Металлы стоящие в ряду напряжений после водорода
Стандартные электродные потенциалы металлов указывают на меру окислительно-восстановительной способности металла и его ионов. Металлы в виде простых веществ – восстановители, ионы металлов – окислители.
Чем наиболее отрицателен электродный потенциал, тем выше способность металла посылать ионы в раствор и тем сильнее проявляет себя металл как восстановитель (например, Li, Na, K). И наоборот, чем наиболее положителен потенциал металлического электрода, тем большей окислительной способностью обладают его ионы.
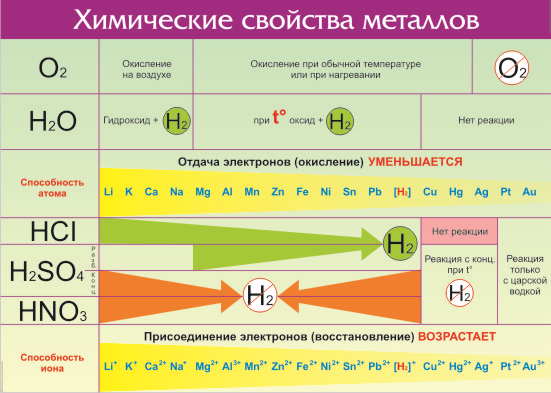
Активные металлы начала ряда, а также щелочные и щелочноземельные вытесняют водород из воды, Например,
Металлы, расположенные между магнием и кадмием, обычно не вытесняют водород из воды. На поверхности этих металлов образуются оксидные пленки, обладающие защитным действием.
Все металлы, стоящие в ряду стандартных электродных потенциалов до водорода, вытесняют его из растворов кислот с концентрацией (активностью) ионов водорода 1 моль/л. Например,
Если электродный потенциал металла имеет положительный знак, то металл является окислителем по отношению к водороду и не вытесняет его из растворов кислот с концентрацией ионов водорода 1 моль/л.
Металлы способны вытеснять друг друга из растворов солей. Направление реакции определяется при этом их взаимным положением в ряду напряжений. Например,
Чем дальше расположены друг от друга в ряду напряжений два данных металла, тем наибольшую ЭДС будет иметь составленный из них гальванический элемент.
Уравнение Нернста
Потенциал металлического электрода зависит от природы металла, концентрации (активности) ионов металла в растворе, температуры.
Если условия отличаются от стандартных, например, если концентрация ионов металла в растворе не равна 1 моль/л, то электродный потенциал металла не является стандартным и его либо определяют экспериментально, либо вычисляют.
При экспериментальном определении составляется гальванический элемент, одним из электродов которого является измеряемый, а вторым – стандартный водородный электрод (рис 8.2):
(катод) Pt, H2/2H + || Me n+ /Me (анод),
и определяется его электродвижущая сила как разность равновесных потенциалов катода и анода (ЭДС=│Ек−Еа│). Так как потенциал стандартного водородного электрода равен нулю (Е o =0,00 В), то ЭДС элемента будет равна потенциалу измеряемого электрода.
Для вычисления электродного потенциала в нестандартных условиях применяют уравнение Нернста:
Так как металл – твердое вещество и вступает в реакцию только с поверхности, его концентрация постоянна и не должна входит в уравнение. Поэтому для вычисления электродных потенциалов металла уравнение Нернста приобретает более простой вид:
где Е о – стандартный электродный потенциал, В; R – газовая постоянная, равная 8,314 Вт-с/моль∙К; Т − температура, К; n − число электронов, участвующих в окислительно-восстановительном процессе; F –число Фарадея, равное 96500 Кл/моль; – активность ионов металла,моль/л.
При подстановке числовых значений R, F и стандартной температуры Т = 298 К и при переходе к десятичным логарифмам, уравнение Нернста принимает еще более простой вид:
Уравнение Нернста для разбавленных растворов, в которых активности мало отличаются от концентраций ( [Me n + ]), имеет вид:
Электрохимический ряд активности металлов
Электрохимический ряд активности (ряд напряжений, ряд стандартных электродных потенциалов) металлов — последовательность, в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов φ 0 , отвечающих полуреакции восстановления катиона металла Me n+ : Me n+ + nē → Me
Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительные реакциях в водных растворах.
Содержание
История
Последовательность расположения металлов в порядке изменения их химической активности в общих чертах была известна уже алхимикам [1] . Процессы взаимного вытеснения металлов из растворов и их поверхностное осаждение (например, вытеснение серебра и меди из растворов их солей железом) рассматривались как проявление трансмутации элементов.
Поздние алхимики вплотную подошли к пониманию химической стороны взаимного осаждения металлов из их растворов. Так, Ангелус Сала в работе «Anatomia Vitrioli» (1613) пришёл к выводу, что продукты химических реакций состоят из тех же «компонентов», которые содержались в исходных веществах. Впоследствии Роберт Бойль предложил гипотезу о причинах, по которым один металл вытесняет другой из раствора на основе корпускулярных представлений [2] .
В 1793 году Алессандро Вольта, конструируя гальванический элемент («Вольтов столб»), установил относительную активность известных тогда металлов: Zn, Pb, Sn, Fe, Cu, Ag, Au. «Сила» гальванического элемента оказывалась тем больше, чем дальше стояли друг от друга металлы в этом ряду («ряд напряжений»). Однако Вольта не связал этот ряд с химическими свойствами металлов.
В 1798 году Иоганн Вильгельм Риттер указал, что ряд Вольта эквивалентен ряду окисления металлов (т. е. последовательности уменьшения их сродства с кислородом). Таким образом, Риттер высказал гипотезу о возникновении электрического тока вследствие протекания химической реакции [3] .
В эпоху становления классической химии способность элементов вытеснять друг друга из соединений стала важным аспектом понимания реакционной способности. Й. Берцелиус на основе электрохимической теории сродства построил классификацию элементов, разделив их на «металлоиды» (сейчас применяется термин «неметаллы») и «металлы» и поставив между ними водород.
Не отрицая значительных заслуг Бекетова в становлении современных представлений об ряде активности металлов, следует считать ошибочным бытующее в отечественной популярной и учебной литературе представление о нём как единственном создателе этого ряда. [5] [6] .
Многочисленные экспериментальные данные, полученные в конце XIX века, опровергали гипотезу Бекетова. Так, Уильям Одлинг описал множество случаев «обращения активности». Например, медь вытесняет олово из концентрированного подкисленного раствора SnCl2 и свинец — из кислого раствора PbCl2; она же способна к растворению в концентрированной соляной кислоте с выделением водорода. Медь, олово и свинец находятся в ряду правее кадмия, однако могут вытеснять его из кипящего слабо подкисленного раствора CdCl2.
Бурное развитие теоретической и экспериментальной физической химии указывало на иную причину различий химической активности металлов. С развитием современных представлений электрохимии (главным образом в работах Вальтера Нернста) стало ясно, что эта последовательность соответствует «ряду напряжений» – расположению металлов по значению стандартных электродных потенциалов. Таким образом, вместо качественной характеристики — «склонности» металла и его иона к тем или иным реакциям — Нерст ввёл точную количественную величину, характеризующую способность каждого металла переходить в раствор в виде ионов, а также восстанавливаться из ионов до металла на электроде, а соответствующий ряд получил название ряда стандартных электродных потенциалов.
Теоретические основы
Значения электрохимических потенциалов являются функцией многих переменных и поэтому обнаруживают сложную зависимость от положения металлов в периодической системе. Так, окислительный потенциал катионов растёт с увеличением энергии атомизации металла, с увеличением суммарного потенциала ионизации его атомов и с уменьшением энергии гидратации его катионов.
В самом общем виде ясно, что металлы, находящиеся в начале периодов характеризуются низкими значениями электрохимических потенциалов и занимают места в левой части ряда напряжений. При этом чередование (щелочных и щёлочноземельных металлов отражает явление диагонального сходства. Металлы, расположенные ближе к серединам периодов, характеризуются большими значениями потенциалов и занимают места в правой половине ряда. Последовательное увеличение электрохимического потенциала (от −3,395 В у пары Eu 2+ /Eu [источник не указан 228 дней] до +1,691 В у пары Au + /Au) отражает уменьшение восстановительной активности металлов (свойство отдавать электроны) и усиление окислительной способности их катионов (свойство присоединять электроны). Таким образом, самым сильным восстановителем является металлический европий, а самым сильным окислителем — катионы золота Au + .
В ряд напряжений традиционно включается водород, поскольку практическое измерение электрохимических потенциалов металлов производится с использованием стандартного водородного электрода.
Практическое использование ряда напряжений
Ряд напряжений используется на практике для сравнительной оценки химической активности металлов в реакциях с водными растворами солей и кислот и для оценки катодных и анодных процессов при электролизе:
Урок №48. Химические свойства металлов. Ряд активности (электрохимический ряд) металлов
Химические свойства металлов определяются их активностью. Простые вещества – металлы в химических реакциях всегда являются восстановителями . Положение металла в ряду активности характеризует то, насколько активно данный металл способен вступать в химические реакции (т. е. то, насколько сильно у него проявляются восстановительные свойства).
Среди металлов традиционно выделяют несколько групп.
благородные металлы (серебро, золото, платина, иридий);
щелочные металлы – I(A) группа ;
щелочноземельные металлы – II(A) группа , кроме Be, Mg.
Металлы встпают в реакции с простыми веществами – неметаллами (кислород, галогены, сера, азот, фосфор и др.) и сложными веществами (вода, кислоты, растворы солей)
Взаимодействие с простыми веществами-неметаллами
1. Металлы взаимодействуют с кислородом, образуя оксиды:
4Li + O 2 = обыч. усл . = 2Li 2 O
2Mg + O 2 = t, °C = 2MgO
Серебро, золото и платина с кислородом не реагируют
2. Металлы взаимодействуют с галогенами (фтором, хлором, бромом и йодом), образуя галогениды – Ме +n Г -1 n
2Na + Cl 2 = 2NaCl
3. Металлы взаимодействуют с серой, образуя сульфиды.
4. Активные металлы при нагревании реагируют с азотом, фосфором и некоторыми другими неметаллами.
3Na + P = t, °C = Na 3 P
Взаимодействие со сложными веществами
I. Взаимодействие воды с металлами
1). Взаимодействие с самыми активными металлами, находящимися в периодической системе в I(А) и II(А) группах (щелочные и щелочноземельные металлы) и алюминий . В результате образуются основание и газ водород .
Me + H 2 O = Me(OH) n + H 2 (р. замещения)
Внимание! Алюминий и магний ведут себя также:
Магний (в горячей воде):
2) Взаимодействие воды с менее активными металлами, которые расположены в ряду активности от алюминия до водорода.
Металлы средней активности, стоящие в ряду активности до (Н 2 ) – Be, Fe, Pb, Cr, Ni, Mn, Zn – реагируют с образованием оксида металла и водорода
Me + Н 2 О = Ме х О у + Н 2 (р. замещения)
Бериллий с водой образует амфотерный оксид:
Be + H 2 O = t°C = BeO + H 2
Раскалённое железо реагирует с водяным паром, образуя смешанный оксид — железную окалину Fe 3 O 4 и водород:
3) Металлы, стоящие в ряду активности после водорода, не реагируют с водой.
Cu + H 2 O ≠ нет реакции
II. Взаимодействие растворов кислот с металлами
Металлы, стоящие в ряду активности металлов левее водорода, взаимодействуют с растворами кислот ( раствор азотной кислоты – исключение ), образуя соль и водород.
Кислота (раствор) + Me до (Н2) = Соль + H 2 ↑
III. Взаимодействие кислот-окислителей с металлами
Металлы особо реагируют с серной концентрированной и азотной кислотами:
H 2 SO 4 (конц.) + Me = Сульфат + H 2 O + Х
HNO 3 + Me = Нитрат + H 2 O + Х
4Zn + 10HNO 3 (раствор горячий) = t˚C = 4Zn(NO 3 ) 2 + N 2 O + 5H 2 O
4Zn + 10HNO 3 (оч. разб. горячий) = t˚C = 4Zn(NO 3 ) 2 + NH 4 NO 3 + 3H 2 O
IV. С растворами солей менее активных металлов
Ме + Соль = Новый металл + Новая соль
Активность металла в реакциях с кислотами, водными растворами солей и др. можно определить, используя электрохимический ряд, предложенный в 1865 г русским учёным Н. Н. Бекетовым: от калия к золоту восстановительная способность (способность отдавать электроны) уменьшается, все металлы, стоящие в ряду левее водорода, могут вытеснять его из растворов кислот; медь, серебро, ртуть, платина, золото, расположенные правее, не вытесняют водород.
Ряд активности металлов

Химия
Что же из себя представляет ряд активности металлов давайте разбираться. Металлы — группа химических элементов, обладающих сходными свойствами. Среди них — электропроводность, пластичность, температурная зависимость сопротивления. По виду металлы можно отличить по характерному блеску, который так и назвали — металлический. Но химические свойства элементов отличаются в зависимости от строения их молекул и кристаллической решетки. Особенно ярко отличия проявляются по отношению взаимодействия с кислотами и щелочами. Всего на данный момент насчитывается 96 металлов. Общие свойства металлов показаны в таблице:
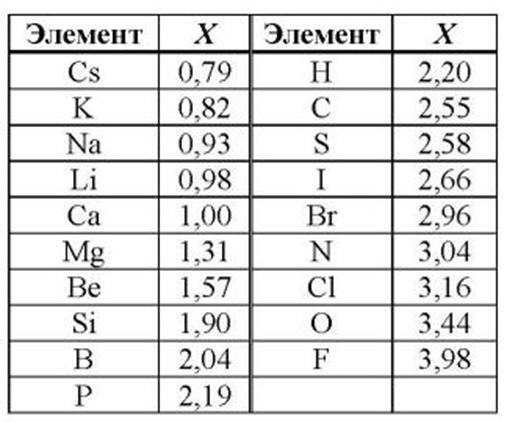
Все металлы в той или иной степени являются восстановителями, то есть, отдают электроны при течении окислительно-восстановительных реакций. Таблица электроотрицательности металлов показывает, какой металл является наиболее активным восстановителем. Если цифра напротив элемента больше 2, то это окислитель с характерными свойствами и выходит из ряда металлов, проявляя типичные свойства неметалла.
Электрохимический ряд активности металлов показывает, какие из металлов более активные, какие менее. Расположение элементов в горизонтальном ряду слева направо показывает направление снижения восстановительной способности и возрастание окислительной.
Восстановительная способность — свойство отдавать электроны в химических реакциях с водными растворами солей и щелочей.
Окислительная способность — свойство присоединять электроны в реакциях с теми же веществами.

Металлы в правой стороне более слабые восстановители, они вытесняются при реакциях с солевыми растворами металлами, расположенными левее. Пример реакции — Zn + Cu 2+ → Zn 2+ + Cu, которая протекает только в одном направлении. Цинк вытесняет медь, реагируя с водным раствором любой соли меди. Цинковая пластинка, при этом, растворяется, а медная восстанавливается.
Такую последовательность элементов еще называют ряд напряженности металлов, или ряд Бекетова. На всех вариантах записи ряда можно заметить, что последовательность металлов разделена знаком водорода (гидрогена), который металлом никак не является. Это своеобразный маркер, показывающий, что стоящие левее металлы вытесняют водород из водных растворов кислот, не обладающих окислительными свойствами. Некоторые металлы, например, литий, кальций, барий и остальные, стоящи до алюминия, вытесняют водород и при реакции с водой.
2Al +3H2SO4 = Al2(SO4)3 + 3H2↑
Fe + 2HCl = FeCl2 + H2↑
Стоящие правее знака водорода металлы с кислотами-неокислителями не взаимодействуют при нормальных условиях.
Шкала активности металлов широко используется для практических целей, например, в гальванике. Если электроды сделаны из разных металлов, то разрушаться будет тот, который стоит левее. Чем больше промежуток между металлами в ряду, тем активнее проходит процесс коррозии.
Например, метод оцинковки позволяет защитить железо именно потому, что цинк находится левее железа в ряду активности. Пока он не разрушится, то ржавчина на железе не появится. При электролизе, расположенные за водородом металлы осаживаются на катоде, а самые активные, занимающее места до алюминия, выделить из солевых растворов в не получится при нормальных температуре и давлении.
Малоактивные металлы, так называемые переходные элементы с электроотрицательностью в пределах 1,5 – 2. Это:
- Ртуть;
- Олово;
- Серебро;
- Никель;
- Рений;
- Медь;
- Марганец и еще несколько элементов.
К металлам средней активности относятся элементы с числом электроотрицательности от 1 до 1,5. В эту группу входят такие известные элементы, как магний, плутоний, неодим, кальций. Остальные элементы обладают высокой химической активностью. Лидирует в этом списке Франций, который практически не встречается в чистом виде. Из более известных можно назвать калий и натрий, которые приходится хранить в керосине, чтобы они не взаимодействовали с водой и воздухом. Если извлечь их из керосина, то металлы практически мгновенно сгорают.
Реакции кальция и натрия с водой при комнатной температуре выглядят так:
2Na + 2H2O = 2NaOH + H2↑
Сa + 2H2O = Сa(OH)2 + H2↑Стоящие в ряду электронапряжения металлов правее элементы тоже взаимодействуют с водой, но реакция протекает при более высокой температуре с образованием оксида и водорода.
3Fe + 4H2O = Fe3O4 + 4H2↑
Если вступает в реакцию металл и неметалл, то электрический ряд напряжений металлов тоже дает возможность заранее узнать, в каком направлении будет протекать реакция. Скорость реакции зависит как от восстановительной активности металла, так и от окислительных свойств неметалла. Стоящие до водорода металлы реагируют с кислородом уже при комнатной температуре, некоторые — достаточно бурно, например, литий и кальций.
4Li + O2 = 2Li2O
2Ca + O2 = 2CaO.
При таком взаимодействии образуются оксиды. Менее активные металлы, например железо, реагируют с кислородом спокойнее, а некоторые, например, золото и серебро, платина не окисляются вовсе, благодаря чему получили определение благородных.
С хлором реагируют практически все активные металлы с выделением теплоты.
2Fe + 3Cl2 = 2FeCl3
Также выделяется теплота при реакции активных металлов с серой, но начинается она при нагревании. После начала реакции нагрев не нужен — образовавшегося тепла достаточно для поддержания реакции.
2Al + 3S = Al2S3
Внимательно изучив ряд металлов, несложно определить тип реакции при контакте с другими элементами в зависимости от места в последовательности. Также легко назвать основные характеристики металла, как химического элемента, и возможность его использования на практике.
Химические свойства металлов
Общие представления о химической устойчивости металлов. Металлы и их сплавы – важнейшие конструкционные материалы. Чтобы иметь представление о химической устойчивости этих материалов, необходимо знать свойства металлов, их поведение в различных средах. Химические свойства металлов объясняются следующими особенностями.
Все металлы – восстановители, что обусловлено строением их атомов. Внешние электроны в атомах металлов находятся на значительном удалении от ядра и связаны с ним сравнительно слабо – атомы металлов характеризуются низкими энергиями ионизации и близким к нулю или отрицательным сродством к электрону. Именно поэтому металлы легко отдают валентные электроны, выступая в качестве восстановителей и превращаясь в положительные ионы и, как правило, не способны присоединять электроны – проявлять окислительные свойства.
Все металлы по восстановительным свойствам разделены на три группы:
1) активные металлы (в «Ряду напряжений» находятся от Li до Al включительно);
2) металлы средней активности (в ряду напряжений находятся от Al до H2);
3) малоактивные металлы (в ряду напряжений стоят после водорода).
Будучи восстановителями, металлы могут взаимодействовать с окислителями. Важнейшим окислителем, входящим в состав воздуха, является кислород. С кислородом взаимодействуют почти все металлы, кроме Ag, Au, Hg и платиновых металлов, причём щелочные и щелочноземельные взаимодействуют очень активно, так что уже при обычной температуре рубидий и цезий самовозгораются:
Хотя процессы взаимодействия других металлов с кислородом протекают менее активно, их окисление всегда термодинамически выгодно, т.к. сопровождается уменьшением свободной энергии Гиббса. Образующиеся при этом оксиды во многих случаях придают химическую устойчивость изделиям из металла.
Термодинамическая возможность реакции металла с тем или иным окислителем определяется условием или ЭДС реакции (Е = jо - jв ) положительна. Сравнение ряда потенциалов окислителей:
| F2/2F | Cl2/2Cl | Br2/2Br | O2/OH | H2O, H/H2 |
| +2,87 | +1,356 | +1,087 | +1,23 (рН=0) | 0,0 (рН=0) |
| +0,82 (рН=7) | -0,41 (рН=7) |
с электродными потенциалами металлов позволяет сделать следующие выводы. Все металлы окисляются фтором и могут окисляться хлором. Большинство металлов (кроме платины и золота) могут окисляться бромом и кислородом в кислой среде. В нейтральной среде кислород не может окислять золото, платиновые металлы, ртуть, серебро. Ионы водорода в кислой среде могут окислять многие металлы, кроме платиновых, ртути, золота, серебра, меди, рения, сурьмы и висмута. Реальная возможность окисления того или иного металла определяется не только термодинамикой, но и кинетикой процесса. Взаимодействие многих металлов с окислителями тормозится пассивными пленками на поверхности металлов.
Взаимодействие металлов с водой. Окислителем в этом случае является катион водорода (ион гидроксония Н3О+), присутствующий в результате равновесной реакции Н2О D Н+ + ОН.
Для того чтобы выяснить, какие металлы окисляются катионами водорода, концентрация которых обусловлена диссоциацией молекул воды, необходимо определить окислительно-востановительный потенциал водородного электрода в воде. При 25 о С и рН = 7 , Е = . ЭДС реакции будет положительна (Е > 0), если < - 0,41В. Значит, все металлы, имеющие стандартный электродный потенциал меньший, чем – 0,41В (в «Ряду напряжений» стоят до кадмия включительно), могут окисляться катионами водорода, т.е. восстанавливать водород из воды.
Чтобы процесс мог протекать до конца, необходимо, чтобы образующиеся гидроксиды Me(OH)n были растворимы в воде. В противном случае, вследствие образования малорастворимых оснований, покрывающих металл, реакция практически прекращается.
2Na + 2H2O ® 2 Na + + H2 + 2OH.
Процесс термодинамически возможен, т.к. < - 0,41B, но из-за образования малорастворимого Zn(OH)2, предохраняющего цинк от воздействия воды, практически не идёт.
Процесс термодинамически не возможен, т.к. > - 0,41B.
Приведённые выше расчёты указывают лишь на возможность осуществления процесса, а не на обязательное его протекание. В действительности существуют ограничения, которые препятствуют реализации такой возможности, а иногда полностью её исключают. Например, пассивацию поверхности металла малорастворимым соединением, в частности основанием, мы уже рассмотрели. На возможность реального осуществления реакции влияет реальное состояние поверхности (наличие оксидных плёнок). Так, в соответствии с электродными потенциалами металлы Be, Mg, Al, Ti и др. должны взаимодействовать с водой (восстанавливать катионы водорода из воды). Однако оксидные поверхностные слои, не растворимые в воде, исключают возможность такого взаимодействия. Нерастворимость TiO2 ни в воде, ни в разбавленных растворах кислот и щелочей обусловливает высокую химическую пассивность титана.
Взаимодействие металлов с растворами щелочей. Только амфотерные металлы Be, Al, Zn, Pb, Sn могут взаимодействовать с растворами щелочей по ионно-молекулярной схеме:
где n, m – степень окисления металла и заряд комплексного иона, соответственно.
В качестве примера рассмотрим взаимодействие бериллия с раствором гидроксида натрия. Схема процесса:
в-ль ок-ль продукт продукт
Схемы полуреакций и ионно-молекулярное уравнение:
1 Be + 4OH– 2eˉ = [Be(OH)4] 2-
Для определения металлов, восстанавливающих водород из щелочных растворов, т.е. для расчёта ЭДС реакции нельзя пользоваться потенциалами окислительно-восстановительных систем , т.к. металл, окисляясь, переходит в значительно более сложный ион – [Me(OH)n] m - . В подобных случаях надо рассматривать потенциал системы [Me(OH)n] m - /Ме.
Кроме того, концентрация [H + ] в щелочном растворе зависит от концентрации щелочи. Например, для 1М раствора NaOH [OH] = 1 моль/л; при 25 0 С [H + ] = = 10 -14 моль/л. Отсюда .
Взаимодействие металлов с растворами кислот.Минеральные кислоты HCl, H3PO4, H2SO4 разбавленная и др., за исключением HNO3 любой концентрации и H2SO4 концентрированной, являются окислителями металлов за счёт катионов водорода.
Для перечисленных кислот взаимодействие с металлами идёт по схеме:
Ме + 2Н + ® Ме n + + H2
Определим ЭДС данной ОВР в общем виде в стандартных условиях:
Чтобы металл мог восстанавливать катионы Н + до Н2 при взаимодействии с перечисленными минеральными кислотами, необходимо, чтобы его стандартный электродный потенциал был меньше нуля вольт и образующаяся соль была растворимой в воде (реакция будет идти до конца; в противном случае поверхность металла запассивируется).
, процесс термодинамически возможен.
1 Zn – 2eˉ = Zn 2+
Zn + 2H + = Zn 2+ + H2
, процесс возможен, но образующаяся в начальный момент малорастворимая соль PbSO4 покрывает металл пассивирующей солевой плёнкой и реакция практически прекращается.
Особенности взаимодействия металлов с растворами азотной кислоты. В азотной кислоте сильным окислителем является нитрат- ион NO, поэтому при её взаимодействии с металлами водород Н2 не выделяется, а протекает восстановление NO. Каким будет продукт восстановления - зависит от концентрации кислоты и активности металла.
Чем активнее металл и чем меньше концентрация кислоты, тем в большей степени восстанавливается азот (понижается его степень окисления). Азотная кислота как сильный окислитель окисляет металлы до высоких степеней окисления, взаимодействует со всеми металлами, стоящими в «Ряду напряжений», по серебро включительно.
В зависимости от концентрации кислоты и активности металла получаются следующие продукты:
Читайте также:
