Металлы по своему строению являются
Определение металлов можно дать с позиций химии, физики и техники.
В химии металлы — это химические элементы, находящиеся в левой части периодической системы элементов Д. И. Менделеева, которые обладают особым механизмом взаимодействия валентных электронов (ионов) с ядром как в самих металлах, так и при вступлении в химические реакции с другими элементами, в том числе с металлами.
Физика характеризует металлы как твердые тела, обладающие цветом, блеском, способностью к плавкости (расплавлению) и затвердеванию (кристаллизации), тепло- и электропроводностью, магнитными и другими свойствами.
В технике металлы — это конструкционные материалы, обладающие высокой обрабатываемостью (ковкостью, штампуемостью, обрабатываемостью резанием, паяемостью, свариваемостью и др.), прочностью, твердостью, ударной вязкостью и рядом других ценных свойств, благодаря которым они находят широкое применение.
Русский ученый М. В. Ломоносов (1711 — 1765), исследуя металлы и неметаллы в своем труде «Первые основания металлургии или рудных дел», дал металлам определение: «Металлом называется светлое тело, которое ковать можно. Таких тел находим только шесть: золото, серебро, медь, олово, железо и свинец». Это определение М. В. Ломоносов дал в 1773 г., когда известны были только шесть металлов.
Из металлов, добываемых из недр земли, получают большую группу конструкционных материалов, применяемых в различных отраслях промышленности. В природе одни металлы встречаются в чистом, самородном виде, другие — в виде оксидов (соединений металла с кислородом), нитридов и сульфидов, из которых состоят различные руды этих металлов.
Самыми распространенными металлами, применяемыми в качестве конструкционных материалов, являются железо, алюминий, медь и сплавы на основе этих металлов.
К металлам относятся более 80 элементов периодической системы Менделеева. Все эти металлы подразделяются на две большие группы: черные металлы и цветные металлы.
Характерными признаками черных металлов являются темно-серый цвет, блеск, высокие плотность и температура плавления, твердость, прочность, вязкость и полиморфизм (аллотропия). По физикохимическим свойствам черные металлы подразделяют на пять групп:
- железистые (железо, кобальт, никель, марганец);
- тугоплавкие (вольфрам, рений, тантал, молибден, ниобий, ванадий, хром, титан и др.);
- урановые — актиниды (уран, торий, плутоний и др.);
- редкоземельные — лантаниды (лантан, церий, иттрий, скандий и др.);
- щелочно-земельные (литий, натрий, калий, кальций и др.).
Из этих пяти групп черных металлов особенно широкое применение в промышленном производстве находят железистые и тугоплавкие металлы.
Железистые металлы, кроме марганца, называют еще ферромагнетиками. Ферромагнетики способны намагничиваться и притягивать металлы своей группы.
К тугоплавким относятся металлы, которые имеют температуру плавления выше температуры плавления железа (1 539 °С): титан — 1 667 °С, ванадий — 1 902 °С, хром — 1 903 °С, молибден — 2 615 °С, ниобий — 2 460 °С, тантал — 2 980 °С, вольфрам — 3 410 °С. Тугоплавкие металлы в основном применяются как легирующие элементы в производстве жаропрочных, жаростойких, теплостойких и специальных сплавов, в том числе твердых сплавов и высоколегированных сталей.
2. Строение металлов
Атомно-кристаллическая структура металлов. Как известно, все вещества состоят из атомов, в том числе и металлы. Каждый металл (химический элемент) может находиться в газообразном, жидком или твердом агрегатных состояниях. Каждое агрегатное состояние будет иметь свои особенности, отличные друг от друга. В газообразном металле расстояние между атомами велико, силы взаимодействия малы и атомы хаотично перемещаются в пространстве; газ стремится к расширению в сторону большего объема. При понижении температуры и давления вещество переходит в жидкое состояние. Свойства жидкого вещества резко отличаются от свойств газообразного. В жидком металле атомы сохраняют лишь так называемый ближний порядок атомов, т. е. в объеме расположено небольшое количество атомов, а не атомы всего объема. При понижении температуры жидкий металл переходит в твердое состояние, которое имеет строгую закономерность расположения атомов.
Если условно провести вертикальные и горизонтальные линии связи через центры атомов, можно увидеть, что у металлов в твердом состоянии атомы расположены в строго определенном порядке и представляют собой множество раз повторяющиеся элементарные геометрические фигуры — параллелепипеды (рис. 1). Наименьшую геометрическую фигуру называют элементарной ячейкой. Элементарные ячейки, расположенные на горизонтальных и вертикальных кристаллографических плоскостях (рис. 2), образуют пространственную кристаллическую решетку.
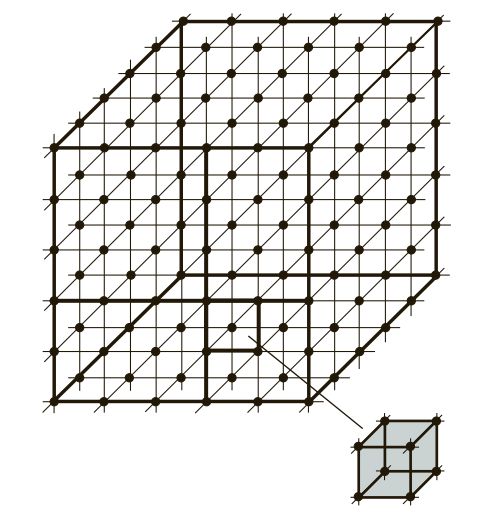
Рис. 1. Схема расположения элементарных геометрических ячеек в атомных решетках металлов и сплавов
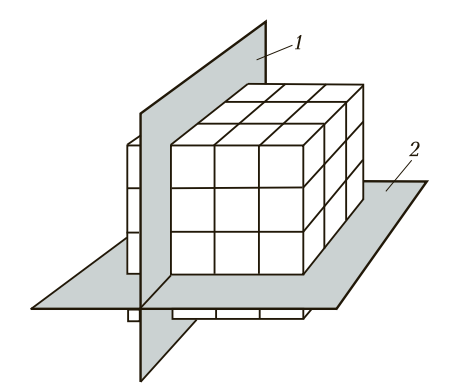
Рис. 2. Расположение кристаллографических плоскостей: 1 и 2 — соответственно горизонтальная и вертикальная кристаллографические плоскости
Элементарные кристаллические решетки характеризуют следующие основные параметры: расстояние между атомами по осям координат (по линиям связи), углы между линиями связи, координационное число — число атомов, находящихся на наиболее близком и равном расстоянии от любого атома в решетке. Форму элементарной ячейки рассматривают по кристаллографическим плоскостям в трех измерениях.
Таким образом, любой металл можно представить не как однородную цельную массу, а как массу, сложенную из множества элементарных ячеек. Блок элементарных атомных кристаллических ячеек образует атомно-кристаллическую ячейку (решетку). Если выделить эту элементарную ячейку, то в зависимости от металла получим следующие типы кристаллических ячеек (рис. 3): куб (К), объемно-центрированный куб (ОЦК), гранецентрированный куб (ГЦК), гексагональная плотноупакованная ячейка (ГПУ), гексагональная простая ячейка (Г) и др.
Простая кубическая ячейка (рис. 3, а) характерна для неметаллов, которые обладают наибольшими плотностью и удельным весом, и имеет восемь атомов, которые расположены в каждой вершине куба.
Объемно-центрированная кубическая ячейка (рис. 3, б ) состоит из восьми атомов, которые расположены по одному атому в каждой вершине куба, и одного, находящегося в центре куба на равных расстояниях от его граней. Эту форму атомной кристаллической ячейки имеют железо модификации Fe-α, ванадий, вольфрам, молибден, тантал и хром, т. е. в основном черные металлы.
Гранецентрированная кубическая ячейка (рис. 3, в) имеет 14 атомов — по одному атому в каждой вершине куба (восемь атомов) и по одному атому в центре каждой грани (шесть атомов). Гранецентрированную кубическую ячейку имеют алюминий, железо модификации Fe-γ, золото, кобальт, медь, никель, платина и серебро, в основном это цветные металлы и часть черных металлов.
Гексагональная плотноупакованная ячейка (рис. 3, г) состоит из 17 атомов. Форма геометрического тела, которую образуют эти атомы, является шестигранной призмой. При этом по шесть атомов расположены в каждой вершине верхнего и нижнего оснований, по одному атому в центре этих оснований и три атома в центре одной их трех граней (через грань). Гексагональную плотноупакованную ячейку имеют бериллий, кадмий, магний, ванадий, тантал.
Простая гексагональная ячейка (рис. 3, д) состоит из 12 атомов, которые расположены в вершинах верхнего и нижнего оснований шестигранной призмы. Такую кристаллическую ячейку имеют ртуть и цинк.
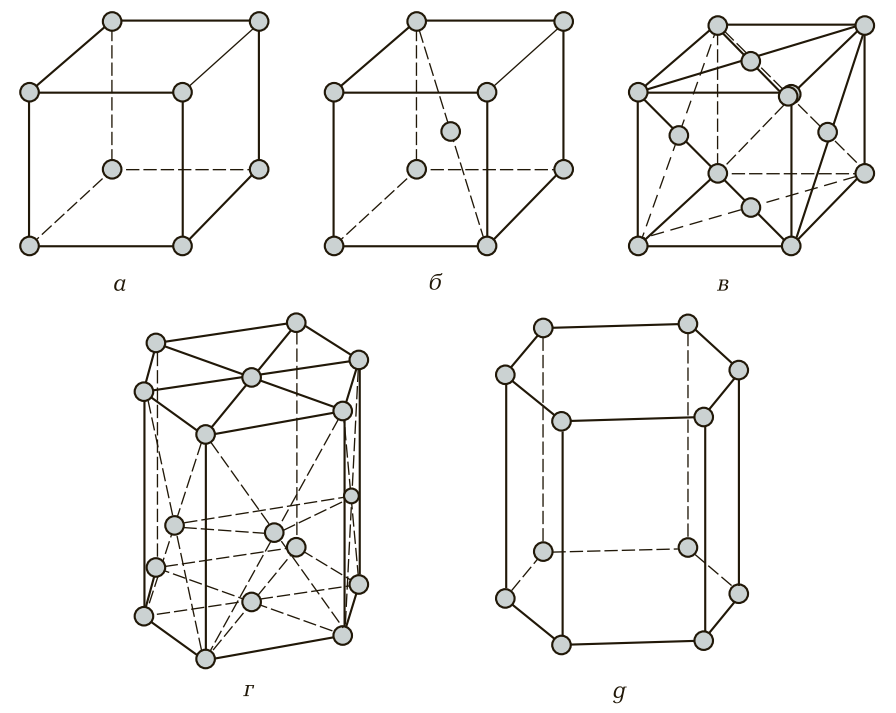
Рис. 3. Геометрические формы элементарных кристаллических ячеек: а — куб; б — объемно-центрированный куб; в — гранецентрированный куб; г — гексагональная плотноупакованная ячейка; д — гексагональная простая ячейка
Связь между атомами в кристаллической решетке и между решетками осуществляется за счет так называемой металлической связи. От прочности этой связи зависят прочность и твердость металлов. Чем выше эта связь, тем бо´льшую прочность и твердость имеют металлы. Механизм связи между атомами в решетке и между решетками имеет сложную физико-химическую природу.
В практике идеальное расположение кристаллических решеток обычно не наблюдается. Кристаллы, образуемые кристаллическими решетками, имеют искаженную геометрическую форму и различную величину.
Анизотропия металлов. Анизотропия (от гр. anisos — неравный и tropos — направление) — неодинаковость физических свойств среды (тела) в различных направлениях. Анизотропия предполагает зависимость свойств металлов от направления по плоскостям атомно-кристаллических решеток. Чем больше в плоскости атомов, тем выше свойства металлов. В горизонтальных плоскостях в любой форме атомно-кристаллических решеток больше, чем в вертикальных плоскостях. Следовательно, прочность металлов, испытанная в горизонтальном направлении, выше, чем в вертикальном. Анизотропия проявляется в процессе обработки конструкционных материалов давлением (проката, волочения, штамповки и других технологических способов получения заготовок и изделий).
На рис. 2 кристаллографические плоскости совпадают с линиями связи, проходящими через атомы металла. Форма элементарной кристаллической ячейки, расстояние между атомами и прочность металлической связи определяют физические, механические и технологические свойства металлов. Если исследуемый металл рассматривать по трем кристаллографическими плоскостям, по линиям связи между атомами, то можно заметить, что свойства по этим трем измерениям будут различны. Число атомов в этих плоскостях неодинаково. Металлическая связь между горизонтально и вертикально расположенными атомами также неодинакова. Это, в свою очередь, приводит к различной прочности металлов в продольном и поперечном направлениях. Например, предел прочности меди в продольном направлении будет в 2 раза больше, чем в поперечном.
Все металлы анизотропны, так как они состоят из кристаллов. Кристаллическое строение металлов обусловливает пластическую деформацию, т. е. изменение внешней формы и размеров под действием нагрузок без разрушения. Способность металлов и сплавов пластически деформироваться положена в основу их обработки давлением (прокатка, волочение, ковка, штамповка и прессование). При обработке давлением, например прокатке (рис. 4, а), происходит перемещение одного слоя атомных решеток по другому по кристаллографическим плоскостям (рис. 4, б).
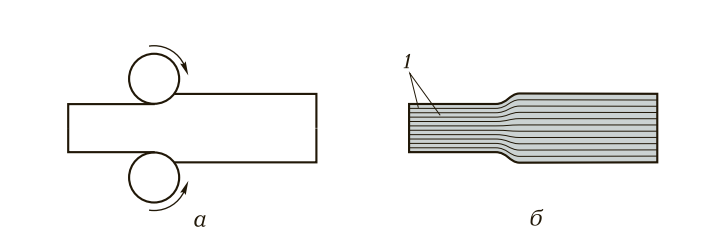
Рис. 4. Схема деформации металлов и сплавов (прокатка): а — деформация; б — скольжение металлов по кристаллографическим плоскостям в процессе деформации; 1 — кристаллографические плоскости
В процессе деформации металла при прокатке происходит не только изменение поперечных и продольных размеров заготовок, но и изменение микроструктуры металла.
Зерна под действием давления прокатных валков искажаются, приобретая продолговатую или пластинчатую форму, а затем преобразуются в волокна. Изменение микроструктуры металла в процессе деформации условно показано на рис. 5.
Процесс кристаллизации. Рассмотрим, как происходит образование кристаллов у чистых металлов. Установлено, что процесс кристаллизации металлов из жидкого состояния в твердое идет в две стадии:
- образование центров кристаллизации;
- рост кристаллов вокруг этих центров (рис. 6).
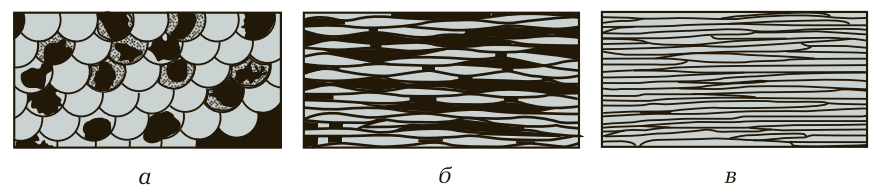
Рис. 5. Изменение микроструктуры металла в процессе деформации: а — микроструктура металла до деформации; б — микроструктура металла после первой операции деформации; в — микроструктура металла после окончательной деформации
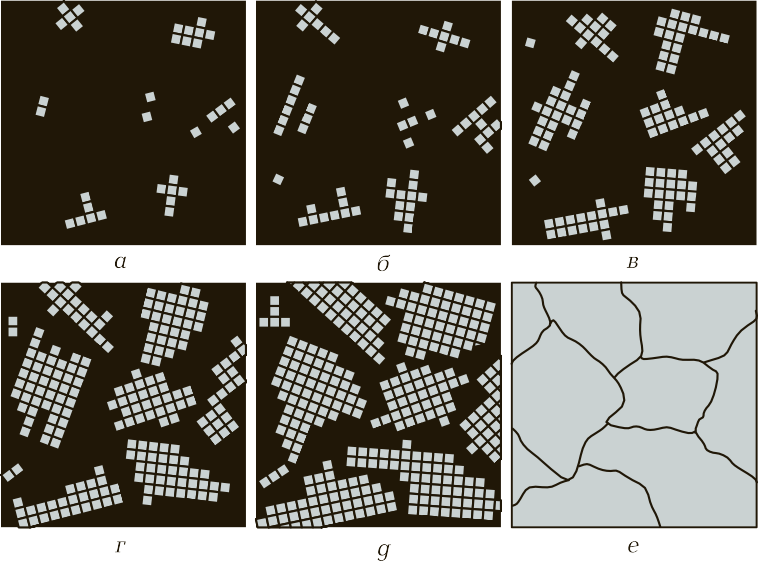
Рис. 6. Процесс кристаллизации металлов и сплавов: а — е — последовательные этапы процесса
Далее вновь появляются новые центры, и происходит рост твердой фазы вокруг первичных и вторичных центров. Процесс происходит до того момента, пока образованные таким образом кристаллы не будут соприкасаться друг с другом и не будет наличия жидкой фазы металла (см. рис. 6, г — е). Когда образование кристалла идет в жидкой фазе (в расплавленном металле), он будет иметь правильную форму, т. е. состоять из определенных геометрических фигур правильной формы. Когда кристаллы начинают соприкасаться друг с другом, а процесс затвердевания еще не закончен, тогда происходят искажения формы зерен. В практике замечено, что когда идет быстрое охлаждение, образуются мелкие зерна — мелкозернистая структура. При медленном охлаждении появление новых центров кристаллизации замедляется, но происходит рост зерна вокруг первичных центров кристаллизации. В этом случае металл будет иметь крупнозернистую структуру.
Процесс образования кристаллов в жидком состоянии и перехода металла в твердое состояние называется первичной кристаллизацией. Величина и форма зерна влияет на механические свойства металлов. Чем зерна мельче и чем правильнее их форма, тем большую твердость и прочность будет иметь металл. Чем зерна больше и чем искаженнее их форма, тем ниже твердость и прочность металла.
Аллотропия металлов. Такие металлы, как железо, кобальт, никель и др., обладают способностью изменять кристаллическую решетку при нагревании в твердом состоянии. Процесс изменения кристаллических решеток в твердом состоянии называется вторичной кристаллизацией, или аллотропией, а состояние вещества (металла) при наличии нескольких кристаллических решеток при изменении параметров (давления, температуры) — аллотропическими модификациями, или полиморфизмом. Такие металлы, как железо, молибден, вольфрам, литий в твердом состоянии при нормальной температуре имеют объемно-центрированную кубическую ячейку; алюминий, медь, серебро в твердом состоянии при нормальной температуре имеют форму гранецентрированной кубической ячейки.
На рис. 7 представлены кривые нагрева и охлаждения металла (на примере марганца). Аллотропные состояния (модификации), имеющие те или иные кубические ячейки, обозначаются греческими буквами. Первоначальное аллотропное состояние при нормальной температуре обозначается буквой α, при дальнейших повышении температуры и перекристаллизации металла — буквами β, γ, δ и т. д. При охлаждении металлов и сплавов процесс аллотропного превращения происходит в обратном порядке, как правило при тех же температурах.
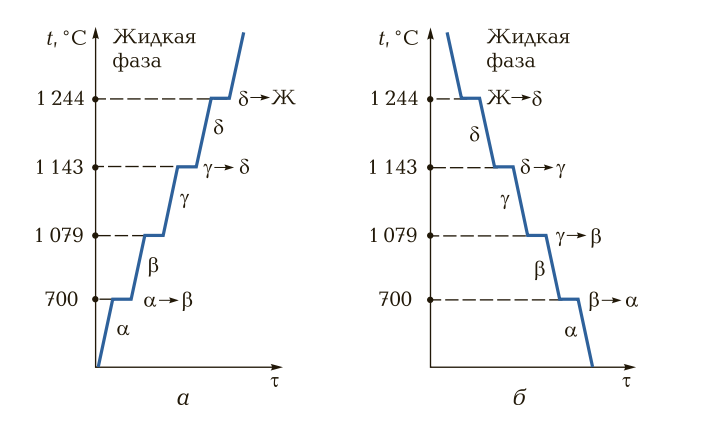
Рис. 7. Кривые нагрева (а) и охлаждения (б) марганца: t — температура; τ — время
Что такое металлы и их строение
Металлы

Без рубрики
Общая характеристика металлов
Как известно, все химические элементы и образуемые ими простые вещества делятся на металлы и неметаллы.
Так как в периодах и группах периодической системы Д.И.Менделеева существуют закономерности в изменении металлических и неметаллических свойств элементов, можно достаточно определенно указать положение элементов-металлов и элементов-неметаллов в периодической системе. Если провести диагональ от бора к астату, то слева от этой диагонали в периодической системе все элементы являются металлами, а справа от нее элементы побочных подгрупп являются металлами, а элементы главных подгрупп – неметаллами. Элементы, расположенные вблизи диагонали (например, Al, Ti, Ga, Ge, Sb, Te, As, Nb), обладают двойственными свойствами: в некоторых своих соединениях ведут себя как металлы, а в некоторых – проявляют свойства неметаллов.
Все s-элементы (кроме Н и Не), d-элементы (все элементы побочных подгрупп) и f-элементы (лантаноиды и актиноиды) являются металлами. Среди р-элементов есть и металлы, и неметаллы, число элементов-металлов увеличивается с увеличением номера периода.

Самородки золота
Атомы большинства металлов на внешнем электронном слое имеют от 1 до 3 электронов. Исключение: атомы германия, олова, свинца на внешнем электронном слое имеют четыре электрона, атомы сурьмы, висмута – пять, атомы полония – шесть. Атомы металлов имеют меньший заряд ядра и больший радиус по сравнению с атомами неметаллов данного периода. Поэтому прочность связи внешних электронов с ядром в атомах металлов небольшая. Атомы металлов легко отдают валентные электроны и превращаются в положительно заряженные ионы.
Простые вещества, которые образуют элементы-металлы, при обычных условиях являются твердыми кристаллическими веществами (кроме ртути). Кристаллическая решетка металлов образуется за счет металлической связи. Имеющиеся между узлами кристаллической решетки свободные электроны могут переносить теплоту и электрический ток, что является причиной главных физических свойств металлов – высокой электро- и теплопроводности.
Физические свойства металлов
- Все металлы – твердые вещества (кроме ртути).
- Для всех металлов характерны металлический блеск и непрозрачность.
- Все металлы – проводники теплоты и электрического тока. Металлы, характеризующиеся высокой электрической проводимостью, обладают и высокой теплопроводностью.
- Важными свойствами металлов являются их пластичность, упругость, прочность. Они способны под давлением изменять свою форму, не разрушаясь.
По степени твердости металлы значительно отличаются друг от друга. Так, калий, натрий – мягкие металлы (их можно резать ножом); хром – самый твердый металл (царапает стекло).
Температуры плавления и плотности металлов также изменяются в широких пределах. Самый легкоплавкий металл – ртуть (tпл.= — 39 ̊ С), самый тугоплавкий – вольфрам (tпл.= 3380 ̊ С). Плотность лития – 0,59 г/см 3 , осмия – 22,48 г/см 3 .
Металлы отличаются своим отношением к магнитным полям и делятся на три группы:
— ферромагнитные металлы способны намагничиваться под действием слабых магнитных полей (железо, кобальт, никель, гадолиний);
— парамагнитные металлы проявляют слабую способность к намагничиванию (алюминий, хром, титан, почти все лантаноиды);
— диамагнитные металлы не притягиваются к магниту, даже слегка отталкиваются от него (олово, медь, висмут).
Химические свойства металлов
Атомы металлов не могут присоединять электроны. Поэтому они во всех химических реакциях являются восстановителями и в соединениях имеют только положительные степени окисления. Восстановительная активность различных металлов неодинакова. В периодах слева направо восстановительная активность металлов уменьшается; в главных подгруппах сверху вниз – увеличивается.
- Взаимодействие с простыми веществами – неметаллами:
а) с галогенами металлы образуют соли – галогениды, например:
б) с кислородом металлы образуют оксиды, например:
Горение железа в кислороде
в) с серой металлы образуют соли – сульфиды, например:
г) с водородом самые активные металлы образуют гидриды, например:
д) с углеродом многие металлы образуют карбиды, например:
- Взаимодействие со сложными веществами:
а) металлы, находящиеся в начале ряда напряжений (от Li до Na), при обычных условиях вытесняют водород из воды и образуют щелочи, например:
б) металлы, расположенные в ряду напряжений до водорода, взаимодействуют с разбавленными кислотами (HCl, H2SO4 и др.), в результате чего образуются соли и выделяется водород, например:
в) металлы взаимодействуют с растворами солей менее активных металлов, в результате чего образуется соль более активного металла, а менее активный металл выделяется в свободном виде, например:
Общие способы получения металлов
Большинство металлов встречаются в природе в виде различных соединений (оксиды, сульфиды, сульфаты, хлориды, карбонаты и др.). Только наименее активные металлы встречаются в природе в свободном виде (самородные металлы) – золото, серебро, платина и др.
Получение металлов из их соединений – это задача металлургии.
Любой металлургический процесс является процессом восстановления ионов металла с помощью различных восстановителей, в результате которого получаются металлы в свободном виде.
В зависимости от способа проведения металлургического процесса различают пирометаллургию, гидрометаллургию и электрометаллургию.
Пирометаллургия – это получение металлов из их соединений при высоких температурах с помощью различных восстановителей: углерода, оксида углерода (II), водорода, металлов (алюминия, магния) и др.
Гидрометаллургия – это получение металлов, которое состоит из двух процессов: 1) природное соединение металла (обычно оксид) растворяется в кислоте, в результате чего получается раствор соли металла; 2) из полученного раствора данный металл вытесняется более активным металлом.
Электрометаллургия – это получение металлов при электролизе растворов или расплавов их соединений. Роль восстановителя в данном процессе играет электрический ток.
Сплавы
Металлы в чистом виде применяют реже, чем их сплавы. Это объясняется тем, что сплавы часто обладают более высокими техническими свойствами, чем чистые металлы. Изготовление сплавов основано на свойстве металлов в расплавленном состоянии взаимно растворяться и смешиваться друг с другом.
По своему составу и строению сплавы бывают различными. Важнейшими из них являются:
- Механическая смесь металлов. Охлажденный расплав представляет собой смесь очень мелких кристаллов отдельных металлов (например, Pb + Sb)
- Твердые растворы. При охлаждении расплава образуются однородные кристаллы. В узлах их кристаллических решеток находятся атомы различных металлов (например, Cu + Ni).
- Интерметаллические соединения. При взаимном растворении металлов их атомы реагируют между собой, образуя химические соединения. В таких соединениях металлы чаще всего не проявляют валентность, характерную для них в соединениях с неметаллами (например, Cu3Zn, Zn3Mg, Ag2Zn5).
В состав сплавов могут входить и неметаллы (углерод, бор и др.)

Бронза
Способность металлов в расплавленном виде не только механически смешиваться, но и образовывать между собой (и атомами неметаллов) различные соединения – одна из главных причин, объясняющая, почему сплавы по физическим свойствам сильно отличаются от свойств составляющих их металлов. Сплав полученный из монокарбида вольфрама и кобальта – «победит» — по твердости сравним с алмазом. В настоящее время в технике применяют большое число различных сплавов, обладающих заранее заданными свойствами. Для их получения используют более 40 химических элементов в разнообразных сочетаниях и количественных соотношениях.
Некоторые широко используемые сплавы
Сталь – сплав железа и углерода, добавки: Mn, Cr, Ni, Si, P, S.
Бронза – сплав меди с оловом, добавки: Zn, Pb, Al, Mn, P, Si.
Латунь – сплав меди с цинком, добавки: Sn, Mn, Al, Pb, Si.
Мельхиор – сплав меди с никелем.
Дюралюминий – сплав алюминия с медью (3-5%), марганцем (1%), магнием (1%).
Металлы по своему строению являются

Металлы (от лат. metallum — шахта, рудник) — группа элементов, в виде простых веществ обладающих характерными металлическими свойствами, такими как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск.
Из 118 химических элементов, открытых на данный момент (из них не все официально признаны), к металлам относят:
- 6 элементов в группе щелочных металлов,
- 6 в группе щёлочноземельных металлов,
- 38 в группе переходных металлов,
- 11 в группе лёгких металлов,
- 7 в группе полуметаллов,
- 14 в группе лантаноиды + лантан,
- 14 в группе актиноиды (физические свойства изучены не у всех элементов) + актиний,
- вне определённых групп бериллий и магний.
В астрофизике термин «металл» может иметь другое значение и обозначать все химические элементы тяжелее гелия
- Металлический блеск (характерен не только для металлов: его имеют и неметаллы иод и углерод в виде графита)
- Хорошая электропроводность
- Возможность лёгкой механической обработки
- Высокая плотность (обычно металлы тяжелее неметаллов)
- Высокая температура плавления (исключения: ртуть, галлий и щелочные металлы)
- Большая теплопроводность
- В реакциях чаще всего являются восстановителями.
Все металлы (кроме ртути и, условно, франция) при нормальных условиях находятся в твёрдом состоянии, однако обладают различной твёрдостью. Ниже приводится твёрдость некоторых металлов по шкале Мооса.
Температуры плавления чистых металлов лежат в диапазоне от −39 °C (ртуть) до 3410 °C (вольфрам). Температура плавления большинства металлов (за исключением щелочных) высока, однако некоторые «нормальные» металлы, например олово и свинец, можно расплавить на обычной электрической или газовой плите.
В зависимости от плотности, металлы делят на лёгкие (плотность 0,53 ÷ 5 г/см³) и тяжёлые (5 ÷ 22,5 г/см³). Самым лёгким металлом является литий (плотность 0.53 г/см³). Самый тяжёлый металл в настоящее время назвать невозможно, так как плотности осмия и иридия — двух самых тяжёлых металлов — почти равны (около 22.6 г/см³ — ровно в два раза выше плотности свинца), а вычислить их точную плотность крайне сложно: для этого нужно полностью очистить металлы, ведь любые примеси снижают их плотность.
Большинство металлов пластичны, то есть металлическую проволоку можно согнуть, и она не сломается. Это происходит из-за смещения слоёв атомов металлов без разрыва связи между ними. Самыми пластичными являются золото, серебро и медь. Из золота можно изготовить фольгу толщиной 0.003 мм, которую используют для золочения изделий. Однако не все металлы пластичны. Проволока из цинка или олова хрустит при сгибании; марганец и висмут при деформации вообще почти не сгибаются, а сразу ломаются. Пластичность зависит и от чистоты металла; так, очень чистый хром весьма пластичен, но, загрязнённый даже незначительными примесями, становится хрупким и более твёрдым. Некоторые металлы такие как золото, серебро, свинец, алюминий, осмий могут срастаться между собой, но на это может уйти десятки лет.
Все металлы хорошо проводят электрический ток; это обусловлено наличием в их кристаллических решётках подвижных электронов, перемещающихся под действием электрического поля. Серебро, медь и алюминий имеют наибольшую электропроводность; по этой причине последние два металла чаще всего используют в качестве материала для проводов. Очень высокую электропроводность имеет также натрий, в экспериментальной аппаратуре известны попытки применения натриевых токопроводов в форме тонкостенных труб из нержавеющей стали, заполненных натрием. Благодаря малому удельному весу натрия, при равном сопротивлении натриевые «провода» получаются значительно легче медных и даже несколько легче алюминиевых.
Высокая теплопроводность металлов также зависит от подвижности свободных электронов. Поэтому ряд теплопроводностей похож на ряд электропроводностей и лучшим проводником тепла, как и электричества, является серебро. Натрий также находит применение как хороший проводник тепла; широко известно, например, применение натрия в клапанах автомобильных двигателей для улучшения их охлаждения.
Цвет у большинства металлов примерно одинаковый — светло-серый с голубоватым оттенком. Золото, медь и цезий соответственно жёлтого, красного и светло-жёлтого цвета.
На внешнем электронном уровне у большинства металлов небольшое количество электронов (1-3), поэтому они в большинстве реакций выступают как восстановители (то есть «отдают» свои электроны)
- С кислородом реагируют все металлы, кроме золота, платины. Реакция с серебром происходит при высоких температурах, но оксид серебра(II) практически не образуется, так как он термически неустойчив. В зависимости от металла на выходе могут оказаться оксиды, пероксиды, надпероксиды:
оксид лития
пероксид натрия
надпероксид калия
- С азотом реагируют только самые активные металлы, при комнатной температуре взаимодействует только литий, образуя нитриды:
- С серой реагируют все металлы, кроме золота и платины:
- С водородом реагируют только самые активные металлы, то есть металлы IA и IIA групп кроме Be. Реакции осуществляются при нагревании, при этом образуются гидриды. В реакциях металл выступает как восстановитель, степень окисления водорода −1:
- С углеродом реагируют только наиболее активные металлы. При этом образуются ацетилениды или метаниды. Ацетилениды при взаимодействии с водой дают ацетилен, метаниды — метан.
Взаимодействие неокисляющих кислот с металлами, стоящими в электрическом ряду активности металлов до водорода
Читайте также:
