Металлы как химические элементы и простые вещества
Цели урока:
Знать: положение металлов в ПСХЭ.
Уметь: характеризовать свойства элементов по положению в ПСХЭ.
Повторить понятия «металлическая связь», «металлическая кристалическая решётка».
Изучить физические свойства металлов и их применение.
1) Электронная формула кальция.
а) 1S 2 2S2 2Р6 3S1
б) 1S 2 2S 2 2Р6 3S 2
в) 1S 2 2S 2 2Р6 3S 2 3S6 4S1
г) 1S 2 2S 2 2Р6 3S 2 3Р6 4S 2
2) Электронную формулу 1S2 2S2 2Р6 3S1 имеет атом:
а) Nа
б) Са
в) Сu
г) Zn
Закономерности в изменении свойств элементов – металлов.
Положение металлов в ПСХЭ
Металлы - это химические элементы, атомы которых отдают электроны внешнего (а иногда предвнешнего) электронного слоя, превращаясь в положительные ионы.
Металлы – восстановители
Ме0 – nе = Меn+.
Характеризуются небольшим числом электронов внешнего слоя (в основном 1 - 3), большим радиусом R атомов,
Особенности электронного строения атомов металлов
Типы кристаллических решеток
кубическая
объемно-центрированная
кубическая
гранецентрированная
кубическая
гексагональная
плотноупакованная
Зависимость физических свойств от строения.
Металлический блеск наиболее выражен у серебра . Его используют в создании зеркал.
Свойство электропроводности ярко выражено у меди
Свойство пластичности наиболее ярко выражено у золота.
Свинец – очень тяжелый металл, его используют как балласт при погружении в воду.
Алюминий –лёгкий металл. Его используют для создания «крылатых» сплавов.
А теплопроводность меди используется при изготовлении посуды
ЗАПОЛНЕНИЕ КРОССВОРДА «МЕТАЛЛЫ»
1. Каким веком в истории человечества сменился каменный век?
2. Добыча какого металла лидирует в настоящее время?
3. Способность проводить электрический ток.
4.Самый пластичный металл.
Важнейшее свойство металлов изменять свою форму при ударе.
Какие, пластичные вещества с характерным блеском, способные проводить тепло и электрический ток.
«Крылатый металл»
8. Благодаря какому свойству металлическая деталь нам всегда кажется холодной?
9. Самый электропроводимый металл?
10. Характерный внешний вид металлов.
Простые вещества – металлы
Определение понятия
Металлы – ковкие, пластичные тягучие вещества, которые имеют металлический блеск, тепло- и электропроводны.
87 элементов Периодической системы Д.М. Менделеева образуют в свободном состоянии простые вещества с металлической связью.
Расположение ионов в кристалле щелочного металла
Свойства металлов:
Пластичность (ковкость) – свойство металлов изменять свою форму при ударе, прокатываться в тонкие листы и вытягиваться в проволоку.
Золото – самый пластичный металл.
Свойства металлов:
2) металлический блеск – способность отражать свет за счёт плотной упаковки ион-атомов, которые занимают 80% от всего объёма кристалла.
Свойства металлов:
3) твердость – свойство материала сопротивляться внедрению в него другого, более твёрдого тела (исключение ртуть).
4)тепло- и электропроводность – из-за наличия свободных электронов.
Свойства некоторых металлов:
Ag Pt – самые блестящие
Ag Cu Au Al – лучшие проводники
Аu – лучший по ковкости и пластичности
Os – самый тяжёлый ( 22.48 г/мл)
Li – самый лёгкий (0.52 г/ мл)
Hg – самый легкоплавкий (Тпл = -38.87 С)
W – cамый тугоплавкий (3370 С)
К- самый мягкий
Cr – самый твёрдый
История
М.В.Ломоносов определял металл «как Светлое тело, которое ковать можно».
АЛХИМИЯ (позднелат. alchimia) донаучное направление в развитии химии.
Способы получения металлов:
Пирометаллургия - восстановление металлов из руд при высоких температурах с помощью восстановителей (углерода, оксида углерода(II), водорода, магния, алюминия).
2. Гидрометаллургия – растворение природного соединения металла с последующим восстановлением его из раствора.
3. Электрометаллургия - способ получения металла с помощью электрического тока (электролиз).
Краткое описание документа:
Презентация по учебной теме «Простые вещества – металлы».
1. Простые вещества – металлы Подготовил: Сергей Огородников
2. Положение металлов в классификации веществ Вещества Простые Металлы Неметаллы Сложные Оксиды Основания Кислоты Соли
3. Определение понятия Металлы – ковкие, пластичные тягучие вещества, которые имеют металлический блеск, тепло- и электропроводны. 87 элементов Периодической системы Д.М. Менделеева образуют в свободном состоянии простые вещества с металлической связью. Расположение ионов в кристалле щелочного металла
4. Свойства металлов: 1) Пластичность (ковкость) – свойство металлов изменять свою форму при ударе, прокатываться в тонкие листы и вытягиваться в проволоку. ЗоЗлоолтоото – самый пластичный металл.
5. Свойства металлов: • 2) металлический блеск – способность отражать свет за счёт плотной упаковки ион-атомов, которые занимают 80% от всего объёма кристалла.
6. Свойства металлов: • 3) твердость – свойство материала сопротивляться внедрению в него другого, более твёрдого тела (исключение ртуть). • 4)тепло- и электропроводность – из-за наличия свободных электронов. Ртуть
7. Свойства некоторых металлов: Ag Pt – самые блестящие Ag Cu Au Al – лучшие проводники Аu – лучший по ковкости и пластичности Os – самый тяжёлый ( 22.48 г/мл) Li – самый лёгкий (0.52 г/ мл) Hg – самый легкоплавкий (Тпл = -38.87 С) W – cамый тугоплавкий (3370 С) К- самый мягкий Cr – самый твёрдый
8. История М.В.Ломоносов определял металл «как Светлое тело, которое ковать можно». АЛХИМИЯ (позднелат. alchimia) донаучное направление в развитии химии.
9. Простые вещества:
10. Способы получения металлов: 1. Пирометаллургия - восстановление металлов из руд при высоких температурах с помощью восстановителей (углерода, оксида углерода(II), водорода, магния, алюминия). 2. Гидрометаллургия – растворение природного соединения металла с последующим восстановлением его из раствора. 3. Электрометаллургия - способ получения металла с помощью электрического тока (электролиз).
Рабочие листы и материалы для учителей и воспитателей
Более 3 000 дидактических материалов для школьного и домашнего обучения
Урок№9. Простые и сложные вещества. Химический элемент. Металлы и неметаллы
В химии кроме терминов “атом” и “молекула” часто употребляется понятие “элемент” .
Химический элемент – это атомы одного и того же вида .
Так, например, атом водорода – это химический элемент водород; атомы кислорода и ртути – соответственно химические элементы кислорода и ртути.
К середине XIX века были открыты 63 химических элемента.
В настоящее время известно 118 химических элементов, т.е. 118 видов атомов.
Простые и сложные вещества
По элементному составу различают простые вещества , состоящие из атомов одного элемента (H 2 , O 2 , Cl 2 , P 4 , Na, Cu, Au), и сложные вещества , состоящие из атомов разных элементов (H 2 O, NH 3 , OF 2 , H 2 SO 4 , MgCl 2 , K 2 SO 4 ).
Простые вещества – вещества, молекулы которых состоят из атомов одного вида (атомов одного химического элемента).
Сложные вещества (или химические соединения) – вещества, молекулы которых состоят из атомов разного вида (атомов различных химических элементов).
Химические элементы образуют около 500 простых веществ, которые условно классифицируют на металлы и неметаллы по их основным физическим свойствам.
Различие понятий «химический элемент» и «простое вещество»
Каждое простое вещество характеризуется определенными физическими и химическими свойствами.
Когда какое-нибудь простое вещество вступает в химическую реакцию и образует новое вещество, то оно при этом утрачивает большинство своих свойств.
Например, железо, соединяясь с серой, теряет металлический блеск, ковкость, магнитные свойства и др., следовательно, в сульфиде железа нет железа, каким мы знаем его в виде простого вещества. Но так как из сульфида железа при помощи химических реакций можно снова получить металлическое железо, то химики говорят, что в состав сульфида железа входит элемент железо, понимая под этим тот материал, из которого состоит металлическое железо.
Подобно железу, и сера находится в сульфиде железа не в виде хрупкого желтого горючего вещества серы, а в виде элемента серы.
Точно так же водород и кислород, входящие в состав воды, содержатся в воде не в виде газообразных водорода и кислорода с их характерными свойствами, а в виде элементов — водорода и кислорода.
Если же эти элементы находятся в «свободном состоянии», т. е. не связаны химически ни с каким другим элементом, то они образуют простые вещества.
Химический элемент можно определить, как вид атомов, характеризующийся определенной совокупностью свойств. При соединении друг с другом атомов одного и того же элемента образуются простые вещества, сочетание же атомов различных элементов дает или смесь простых веществ, или сложное вещество.
Различие между простым веществом и элементом становится особенно ясным, когда мы встречаемся с несколькими простыми веществами, состоящими из одного и того же элемента.
Возьмем, например, кусок фосфора. Это — белое, полупрозрачное вещество, очень ядовитое; на воздухе в темноте фосфор светится и может самовоспламеняться. Фосфор - простое вещество, он не может быть разложен на другие вещества. Однако, если нагреть фосфор без доступа воздуха, то через некоторое время его свойства изменятся: фосфор приобретает красно-фиолетовый цвет, перестает светиться в темноте, делается неядовитым и не самовоспламеняется на воздухе, причем эти новые свойства не исчезают по прекращении нагревания. Таким образом, несомненно происходит превращение одного вещества в другое, но превращение особое: взятое нами вещество не разлагается, и к нему ничего не присоединяется. Это заставляет признать оба вещества, как первоначально взятое, так и полученное после нагревания, лишь различными формами существования одного и того же элемента фосфора в свободном состоянии; первое из них называется белым, а второе — красным фосфором.
Доказательством того, что белый и красный фосфор действительно представляют собой различные формы одного и того же элемента и состоят из одинаковых атомов, служит их отношение к кислороду: при нагревании в кислороде как белый, так и красный фосфор взаимодействуют с ним, образуя одно и то же вещество — фосфорный ангидрид. Следовательно, элемент фосфор в свободном состоянии может существовать в виде различных простых веществ.
Подобно фосфору, и многие другие элементы в свободном состоянии существуют в виде нескольких различных простых веществ.
Аллотропия
Способность одного элемента существовать в виде различных простых веществ, отличающихся по свойствам, называется аллотропией .
Углерод – С – алмаз, графит, карбин, фуллерен.
Кислород – O – кислород (O 2 ), озон (O 3 ).
Сера – S – ромбическая, моноклинная, пластическая.
Фосфор – P – белый, красный, чёрный.
Например, аллотропные формы химического элемента углерода – алмаз и графит – отличаются строение их кристаллов.
Металлы как химические элементы и простые вещества
Положение в периодической системе
1. Типичные металлы – s - элементы: IА - IIА группы (искл.Н)
2. Нетипичные металлы: р-элементы: IIIА гр. (кроме В), IV гр – Ge , Sn , Pb ; V гр.- Sb , Bi ; VI гр.- Po .
3. Переходные металлы: d -элементы – все элементы побочных подгрупп; f - элементы: лантоноиды, актиноиды.
У атомов металлов небольшое количество электронов (ē) на внешнем энергетическом уровне и большие радиусы атомов ( R )
Кристаллическая решетка – металлическая: состоит из чередующихся в пространстве атомов и положительных ионов, внутри-общие электроны– «электронный газ».
Тип химической связи – металлическая.
Металлические (восстановительные) свойства в группе (А п/гр) усиливаются (растет R атома , и электроны легче отрываются), в периоде – ослабляются (растет заряд ядра, электроны внешнего уровня сильнее удерживаются).
Восстановительные свойства уменьшаются (активность металлов уменьшается)
Li, Cs,Rb,K, Ba, Ca, Na, Mg, Al, Mn, Cr, Zn, Fe, Cd, Co, Sn, Ni, Pb, H2, Cu, Ag, Hg, Pt, Au
Физические свойства
Наличие свободных электронов обуславливает:
- Металлический блеск (непрозрачность)-ē отражают световые лучи, большинство металлов в порошкообразном состоянии теряют свой блеск, за исключением алюминия и магния.
- Цвет Большинство металлов светло-серого цвета (Исключение: золото - желтое, медь- красная, цезий - светло-желтый)
- Электропроводность (свободные ē приобретают направленное движение) Лучшие проводники электричества: Cu , Ag , далее Au , Al , Fe. С повышением температуры – электропроводность понижается, т.к. усиливаются колебания атомов, электронам трудно перемещаться.
- Теплопроводность
- Пластичность
- Плотность ( Самый легкий - Li , самые тяжелые - Os и Ir)
- Температура плавления ( самый легкоплавкий - Hg −39 °C , самый тугоплавкий – W 3410 °C )
- Твердость (щелочные металлы можно резать ножом, самый твердый – Cr) Большинство металлов твердые, за исключением ртути и ,условно, франция.
Получение
· Пирометаллургия- получение из руд при высоких температурах при взаимодействии с хорошими восстановителями (H2, CO,C и др.)
Выделяют два этапа: 1) Обжиг металлсодержащей руды; 2) Получение чистого металла
· Металлотермия- восстановление металлами (алюминотермия, кальцийтермия, магнийтермия и т.д.):
· Гидрометаллургия- соединения металлов переводят в раствор и восстанавливают:
· Электрометаллургия – электролиз растворов и расплавов:
Запомнить: Алюминий получают из оксида (глинозема, бокситов и т.д.) в расплаве криолита Na 3 AlF 6
Запомнить: Металлы никогда не вытесняют из Н N О3(к) H 2 SO 4(к) водород; они пассивируют Al , Cr , Fe
в) Взаимодействие с солями ( более активные металлы вытесняют менее активные из растворов их солей )
CuCl 2 + Fe = FeCl 2 + Cu;
- но если металл взаимодействует с водой, то
CuCl 2 +2К +2 H 2 O = 2К Cl + Cu (ОН)2↓+ Н2↑; т.к.: 1) 2К + 2 H 2 O = 2КОН+ Н2
2) CuCl 2 +2КОН= Cu (ОН)2↓+ 2К Cl
г) Взаимодействуют с оксидами металлов и неметаллов:
е)Другое:
Между собой образуют интерметаллические соединения, сплавы: Na 2 Sb
С органическими веществами ( со спиртами, фенолами, карбоновыми кислотами и др. )
Простые и сложные вещества

Из этой статьи вы узнаете, какие вещества называются простыми, а какие сложными, в чем их различия и особенности строения.
О чем эта статья:
Прежде чем переходить к понятиям простых и сложных веществ и к их строению, давайте вспомним, что такое химический элемент.
Химический элемент — это группа атомов с одинаковым зарядом ядра, который обусловливает его (элемента) химические свойства.
В зависимости от того, как соединяются друг с другом химические элементы, выделяют два типа веществ: простые и сложные.
Что такое простые вещества
Простые вещества — это вещества, образованные атомами только одного типа химического элемента. Например: H2, Na, P, Al.
Простые вещества делятся на два типа: металлы и неметаллы.
Металлы
Имеют общие между собой физические свойства. Обладают металлическим блеском, высокой тепло- и электропроводностью, твердые (за исключением ртути), пластичные и ковкие.
К простым веществам — металлам относятся: Na, Ca, Fe и т. д.
Почти все металлы имеют немолекулярное строение, т. е. состоят из атомов или ионов.
Неметаллы
Среди неметаллов выделить общие физические свойства практически невозможно. Они могут находиться в разных агрегатных состояниях, обладать различным цветом и т. д.
К простым веществам — неметаллам относятся: P, C, F2 и т. д.
Большинство неметаллов имеют молекулярное строение, т. е. состоят из молекул. При этом молекулы могут быть:
одноатомные: He, Si, Ar и другие;
двухатомные: F2, O2, H2, N2, Cl2, Br2, I2. Эти простые вещества всегда пишутся с индексом 2, их необходимо запомнить;
трехатомные — например, молекула озона O3;
и другие многоатомные.
Некоторые неметаллы имеют немолекулярное (атомное) строение: красный фосфор, кремний, алмаз и графит.
Металлы и неметаллы сильно отличаются друг от друга физическими и химическими свойствами.
При этом запоминать, к какому типу относится то или иное вещество, не нужно, достаточно посмотреть в таблицу Менделеева:
Проведите диагональ от 5-го до 85-го номера химических элементов.
Все химические элементы, находящиеся ниже и левее проведенной диагонали, образуют простые вещества — металлы (кроме водорода).
Выше диагонали химические элементы, находящиеся в главных подгруппах, образуют простые вещества — неметаллы, а в побочных — металлы.
Например, фосфор (порядковый номер — 15) расположен в таблице Менделеева выше диагонали и в главной подгруппе V группы. Значит, простое вещество фосфор — неметалл.
В большинстве случаев названия химического элемента и простого вещества совпадают. Поэтому необходимо научиться различать характеристики простого вещества и химического элемента.
Характеристика химического элемента
Характеристика простого вещества
Расположение в периодической системе (атомный номер, номер группы или периода)
Относительная атомная масса
Строение атома (число электронов, протонов или нейтронов, количество заполненных энергетических уровней)
Распространенность в природе
Содержание в соединении (например, в растительных белках или аминокислотах)
Значения электроотрицательности, сродства к электрону, энергии ионизации
Как правило, когда мы характеризуем простое вещество, то говорим о его физических или химических свойствах:
Влияние на живой организм
Температуры кипения и плавления
Взаимодействие с другими веществами
Содержание в каких-либо смесях веществ (например, газов)
Аллотропия
Аллотропия — это возможность образования химическим элементом нескольких простых веществ, которые отличаются друг от друга строением и свойствами.
Образующиеся простые вещества называют аллотропными модификациями.
Аллотропия характерна для следующих химических элементов:
углерод (алмаз, графит, графен, углеродные нанотрубки, фуллерен и другие);
фосфор (красный, белый и черный);
кислород (кислород и озон);
кремний (аморфный и кристаллический);
Рассмотрим две аллотропные модификации углерода:


The image 1 is a derivative of "Crystal" by manfredxy on Envato Elements.
The image 2 is a derivative of "Rough Graphite rock" by vvoennyy on Envato Elements.
Алмаз — бесцветное прозрачное вещество. Является одним из самых твердых веществ. Не проводит электрический ток.
Графит представляет собой вещество серо-черного цвета, обладает металлическим блеском. Имеет высокую тепло- и электропроводность.
Что такое сложные вещества
Сложные вещества — это вещества, образованные атомами нескольких химических элементов.
Например, молекула HNO3 состоит из одного атома водорода, одного атома азота и трех атомов кислорода.
К сложным веществам в химии относятся две большие группы веществ: неорганические и органические.
Неорганические вещества
Неорганические вещества делятся на 4 вида:
Оксиды — вещества, молекулы которых состоят из двух химических элементов, один из которых — кислород в степени окисления −2.
Основания — вещества, молекулы которых состоят из катиона металла и гидроксильной группы (—OH).
Кислоты — вещества, молекулы которых состоят из катиона водорода (H+), способного замещаться атомом металла, и кислотного остатка.
Соли — вещества, состоящие из катиона металла и кислотного остатка.
Кратко о классификации веществ можно узнать из схемы:
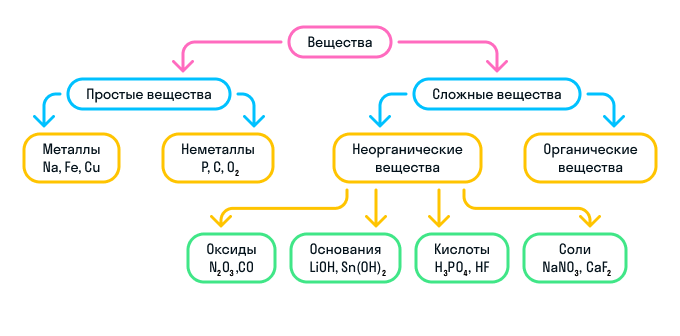
Номенклатура неорганических веществ
Названия простых веществ чаще всего совпадают с названием химического элемента, а для сложных веществ существует два вида номенклатуры: тривиальная и систематическая.
В тривиальной номенклатуре вещества названы в соответствии с их особенностями, например специфическим запахом или окраской.
В систематической номенклатуре название зависит от вида неорганического вещества.
Оксиды
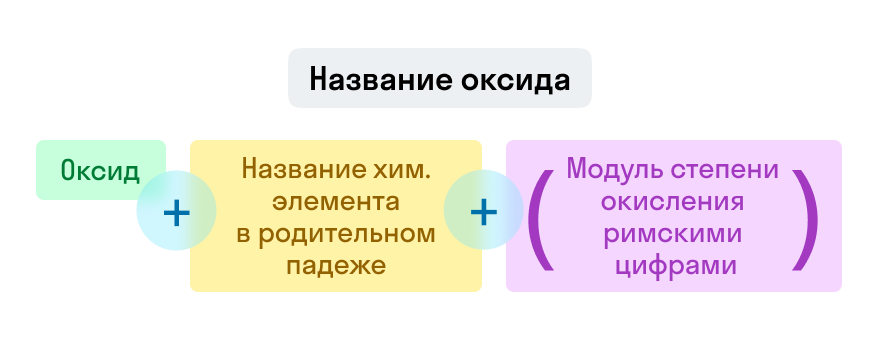
Примеры названий оксидов:
Fe2O3 — оксид железа (III). Читается: феррум два о три;
Na2O — оксид натрия. Читается: натрий два о.
Основания
Примеры названий гидроксидов:
Fe(OH)3 — гидроксид железа (III). Читается: феррум о аш трижды;
NaOH — гидроксид натрия. Читается: натрий о аш.
Соли
Примеры названий солей:
KNO3 — нитрат калия. Читается: калий эн о три;
AlCl3 — хлорид алюминия. Читается: алюминий хлор три.
Кислоты
Названия кислот, кислотных остатков и их формулы необходимо выучить, они приведены в таблице ниже.
Читайте также:
