Металлы из руд с помощью электролиза помогает получить
ХИМИЯ – это область чудес, в ней скрыто счастье человечества,
величайшие завоевания разума будут сделаны
именно в этой области.(М. ГОРЬКИЙ)
Таблица
Менделеева
Универсальная таблица растворимости
Коллекция таблиц к урокам по химии
Общая характеристика и способы получения металлов
Значительная химическая активность металлов (взаимодействие с кислородом воздуха, другими неметаллами, водой, растворами солей, кислотами) приводит к тому, что в земной коре они встречаются главным образом в виде соединений: оксидов, сульфидов, сульфатов, хлоридов, карбонатов и т. д. В свободном виде встречаются металлы, расположенные в ряду напряжений правее водорода (Аg, Нg, Рt,Аu, Сu), хотя гораздо чаще медь и ртуть в природе можно встретить в виде соединений.
Минералы и черные породы, содержащие металлы и их соединения, из которых выделение чистых металлов технически возможно и экономически целесообразно, называют рудами.
Получение металлов из руд — задача металлургии.
Металлургия — это и наука о промышленных способах получения металлов из руд, и отрасль промышленности.
Любой металлургический процесс — это процесс восстановления ионов металла с помощью различных восстановителей. Суть его можно выразить так:
Чтобы реализовать этот процесс, надо учесть активность металла, подобрать восстановитель, рассмотреть технологическую целесообразность, экономические и экологические факторы.

В соответствии с этим существуют следующие способы получения металлов:
Пирометаллургия
Пирометаллургия — восстановление металлов из руд при высоких температурах с помощью углерода, оксида углерода (II), водорода, металлов — алюминия, магния.
Например, олово восстанавливают из касситерита SnО2, а медь — из куприта Cu2O
прокаливанием с углем (коксом):
SnО2+ 2С = Sn + 2СО ↑; Cu2O + С = 2Cu+ СО ↑
Сульфидные руды предварительно подвергают обжигу при доступе воздуха, а затем полученный оксид восстанавливают углем:
2ZnS + 302 = 2ZnО + 2SO2 ↑; ZnО + С = Zn + СО ↑
сфалерит (цинковая обманка)
Из карбонатных руд металлы выделяют также путем прокаливания с углем, т. к. карбонаты при нагревании разлагаются, превращаясь в оксиды, а последние восстанавливаются углем:
FeСO3 = FеО + СO2 ↑ ; FеО + С = Fе + СО ↑
сидерит (шпатовый железняк)
Восстановлением углем можно получить Fе, Сu, Zn, Сd, Ge, Sn, Рb и другие металлы, не образующие прочных карбидов (соединений с углеродом).
В качестве восстановителя можно применять водород или активные металлы:
К достоинствам этого метода относится получение очень чистого металла.
2) TiO2+ 2Мg = Тi + 2МgO (магнийтермия)
Чаще всего в металлотермии используют алюминий, теплота образования оксида
которого очень велика (2А1 + 1,5 O2 = Аl2O3 + 1676 кДж/моль). Электрохимический ряд напряжений металлов нельзя использовать для определения возможности протекания реакций восстановления металлов из их оксидов. Приближенно установить возможность этого процесса можно на основании расчета теплового эффекта реакции (Q), зная значения теплот образования оксидов:
где Q1— теплота образования продукта, Q2 -теплота образования исходного вещества.
Доменный процесс (производство чугуна):
C + O2 = CO2, CO2 + C ↔ 2CO
3Fe2O3 + CO = 2(Fe 2 Fe 3 2)O4+ CO2
(Fe 2 Fe 3 2)O4+ CO= 3FeO + CO2
FeO + CO= Fe + CO2
(чугун содержит до 6,67% углерода в виде зерен графита и цементита Fe3C);

Выплавка стали (0,2-2,06% углерода) проводится в специальных печах (конвертерных, мартеновских, электрических), отличающихся способом обогрева. Продувание воздуха, обогащенного кислородом, приводит к выгоранию из чугуна избыточного углерода, а также серы, фосфора и кремния в виде оксидов. При этом оксиды либо улавливаются в виде отходящих газов (CO2, SO2), либо связываются в легко отделяемый шлак – смесь Ca3(PO4)2 и CaSiO3. Для получения специальных сталей в печь вводят легирующие добавки других металлов.
Гидрометаллургия
Гидрометаллургия — это восстановление металлов из их солей в растворе.
Процесс проходит в два этапа: 1) природное соединение растворяют в подходящем реагенте для получения раствора соли этого металла; 2) из полученного раствора данный металл вытесняют более активным или восстанавливают электролизом. Например, чтобы получить медь из руды, содержащей оксид меди СuО, ее обрабатывают разбавленной серной кислотой:
Затем медь либо извлекают из раствора соли электролизом, либо вытесняют из сульфата железом:
Таким образом, получают серебро, цинк, молибден, золото, уран.
Электрометаллургия
Электрометаллургия — восстановление металлов в процессе электролиза растворов или расплавов их соединений.
Этим методом получают алюминий, щелочные металлы, щелочноземельные металлы. При этом подвергают электролизу расплавы оксидов, гидроксидов или хлоридов.
Химики! ! вопрос "Какими способами можно получить металлы? "
Получение металлов.
- Какой основной химический процесс лежит в основе получения металлов?
Большинство металлов встречаются в природе в составе соединений, в которых металлы находятся в положительной степени окисления, значит для того, чтобы их получить, в виде простого вещества, необходимо провести процесс восстановления.
Но прежде чем восстановить природное соединение металла, необходимо перевести его в форму, доступную для переработки, например, оксидную форму с последующим восстановлением металла. На этом основан пирометаллургический способ. Это восстановление металлов из их руд при высоких температурах с помощью восстановителей неметаллических? кокс, оксид углерода (II), водород; металлических? алюминий, магний, кальций и другие металлы. .
Демонстрационный опыт 1. Получение меди из оксида с помощью водорода.
Cu +2O + H2 = Cu0 + H2O (водородотермия)
Демонстрационный опыт 2. Получение железа из оксида с помощью алюминия.
Fe+32O3 +2Al = 2Fe0 + Al2O3 (алюмотермия)
Для получения железа в промышленности железную руду подвергают магнитному обогащению: 3Fe2 O3 + H2 = 2Fe3 O4 + H2O или 3Fe2O3 + CO = 2Fe3O4 + CO2, а затем в вертикальной печи проходит процесс восстановления:
Fe3O4 + 4H2 = 3Fe + 4H2O
Fe3O4 + 4CO = 3Fe + 4CO2
Просмотр медиалекции . (CD)
Гидрометаллургический способ основан на растворении природного соединения с целью получения раствора соли этого металла и вытеснением данного металла более активным. Например, руда содержит оксид меди и ее растворяют в серной кислоте:
CuO + H2SO4 = CuSO4 + H2O, затем проводят реакцию замещения
CuSO4 + Fe = FeSO4 + Cu.
Демонстрационный опыт 3. Взаимодействие железа с раствором медного купороса.
Таким способом получают серебро, цинк, молибден, золото, ванадий и другие металлы.
Электрометаллургический способ.
Это способы получения металлов с помощью электрического тока (электролиза) . Просмотр фрагмента медиалекции. (CD)
Этим методом получают алюминий, щелочные металлы, щелочноземельные металлы. При этом подвергают электролизу расплавы оксидов, гидроксидов или хлоридов:
NaCl —> Na+ + Cl?
катод Na+ + e > Na0 ¦ 2
анод 2Cl? ?2e > Cl20 ¦ 1
суммарное уравнение: 2NaCl = 2Na + Cl2
Современный рентабельный способ получения алюминия был изобретен американцем Холлом и французом Эру в 1886 году. Он заключается в электролизе раствора оксида алюминия в расплавленном криолите. Расплавленный криолит растворяет Al2O3, как вода растворяет сахар. Электролиз “раствора” оксида алюминия в расплавленном криолите происходит так, как если бы криолит был только растворителем, а оксид алюминия? электролитом.
Al2O3 —> AlAlO3 —> Al3+ + AlO33–
катод Al3+ +3e —> Al 0 ¦ 4
анод 4AlO33– – 12 e —> 2Al2O3 +3O2 ¦ 1
суммарное уравнение: 2Al2O3= 4Al + 3O2 .
Термическое разложение соединений.
Железо взаимодействует с оксидом углерода (II) при повышенном давлении и температуре 100-2000, образуя пентакарбонил: Fe + 5CO = Fe (CO)5
Пентакарбонил железа-жидкость, которую можно легко отделить от примесей перегонкой. При температуре около 2500 карбонил разлагается, образуя порошок железа: Fe (CO)5 = Fe + 5CO.
Если полученный порошок подвергнуть спеканию в вакууме или в атмосфере водорода, то получится металл, содержащий 99,98– 99,999% железа. Еще более глубокой степени очистки железа (до 99,9999%) можно достичь методом зонной плавки.
orion_x Просветленный (31348) 1- Восстановлением из соединений. 2 - Выплавлением из руд и минералов. 3 - Электролизом растворов или расплавов солей. 4 - Путем ядерных реакций.
Металлы из руд с помощью электролиза помогает получить
Природные соединения металлов:
сильвинит КСl ∙ NaCl, каменная соль NaCl;
серный колчедан FeS2, киноварь HgS, цинковая обманка ZnS;
мел, мрамор, известняк СаСО3, магнезит MgCO3,
доломит CaCO3 ∙ MgCO3;
глауберова соль Na2SO4 ∙ 10 H2O, гипс CaSO4 ∙ 2Н2О;
магнитный железняк Fe3O4, красный железняк Fe2O3, бурый железняк Fe2O3 ∙ Н2О.
чилийская селитра NaNO3;
Минералы и горные породы, содержащие металлы и их соединения и пригодные для промышленного получения металлов, называются рудами.
Отрасль промышленности, которая занимается получением металлов из руд, называется металлургией.
Способы получения металлов из руд.
1. Электрометаллургический способ - это способы получения металлов с помощью электрического тока (электролиза). Этим методом получают алюминий, щелочные металлы, щелочноземельные металлы.
При этом подвергают электролизу расплавы оксидов, гидроксидов или хлоридов:
NaCl (расплав) D Na+ + Cl-
катод Na+ + e à Na0 ¦ 2
анод 2Cl - - 2e à Cl20 ¦ 1
суммарное уравнение: 2NaCl (распл.) – (э. ток)à 2Na + Cl2
Современный способ получения алюминия был изобретен в 1886 году. Он заключается в электролизе раствора оксида алюминия в расплавленном криолите. Расплавленный криолит растворяет Al2O3, как вода растворяет сахар.
Al2O3 (расплав) D Al3+ + AlO33–
катод Al3+ +3e à Al 0 ¦ 4
анод 4AlO33– –12 e à 2Al2O3 +3O2 ¦ 1
суммарное уравнение: 2Al2O3(распл.) – (э. ток)à 4Al + 3O2 .
2. Пирометаллургический способ - это восстановление металлов из их руд при высоких температурах с помощью восстановителей: неметаллических : кокс, оксид углерода (II), водород; металлических: алюминий, магний, кальций.
Алюмотермия :
Fe+32O3 +2Al = 2Fe0 + Al2O3
Получают железо, хром.
Восстановление оксидов металлов водородом (водородотермия ):
Cu +2O + H2 –(t)à Cu0 + H2O
Получают малоактивные металлы – медь, вольфрам.
Получение чугуна:
В вертикальной печи кокс окисляется до СО, затем происходит постепенное восстановление железа из руды:
3Fe2O3 + CO –(t)à 2Fe3O4 + CO2 ,
Fe3O4 + 4CO –(t)à 3FeО + 4CO2
FeO + CO –(t)à Fe+ CO2
Восстановление углём (коксом):
ZnO + C –(t)à Zn + CO
Получают цинк, никель.
3. Гидрометаллургический способ основан на растворении природного соединения с целью получения раствора соли этого металла и вытеснением данного металла более активным. Например, руда содержит оксид меди и ее растворяют в серной кислоте: CuO + H2SO4 = CuSO4 + H2O, затем проводят реакцию замещения:
CuSO4 + Fe = FeSO4 + Cu.
Таким способом получают серебро, цинк, молибден, золото, ванадий.
Если для восстановления требуется оксид металла, то в процессе переработки сначала получают оксид:
а) из сульфида – обжигом в кислороде: 2ZnS + 3O2 = 2ZnO + 2SO2
б) из карбоната – разложением: СаСО3 –(t)à СаО + СО2
Чугун и сталь.

Производство железа основано на карботермическом восстановлении оксидных металлсодержащих руд.
1) Сульфидные и другие руды вначале подвергают окислительному обжигу : 4FeS2 + 11O2 = 2Fe2O3 + 8SO2.
2)Восстановление оксидных руд осуществляется в доменных печах, при этом протекают следующие реакции:
3Fe2O3 + CO –(t)àCO2 + 2Fe3O4, Fe3O4 + CO–(t)àCO2 + 3FeO, FeO + CO–(t)àCO2 + Feили FeO + C –(t)àCO + Fe.

Полученное железо насыщено углеродом. 3)Затем происходит «выжигание» углерода в сталеплавильных или конверторных печах с образованием стали.
Практическое применение электролиза
При прохождении через раствор или расплав электролита электрического тока, на электродах происходит выделение растворенных веществ или иных веществ, являющихся продуктами вторичных реакций на электродах. Этот физико-химический процесс и называется электролизом.

Суть электролиза
В создаваемом электродами электрическом поле, ионы в проводящей жидкости приходят в упорядоченное движение. Отрицательный электрод — это катод, положительный — анод.
К аноду устремляются отрицательные ионы, называемые анионами (ионы гидроксильной группы и кислотные остатки), а к катоду — положительные ионы, называемые катионами (ионы водорода, металлов, аммония и т. д.)
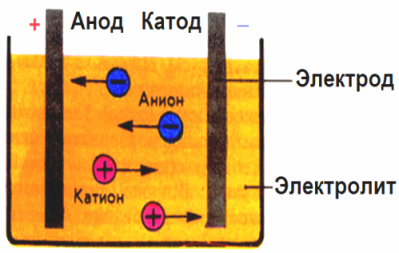
На электродах протекает окислительно-восстановительный процесс: на катоде происходит электрохимическое восстановление частиц (атомов, молекул, катионов), а на аноде — электрохимическое окисление частиц (атомов, молекул, анионов). Реакции диссоциации в электролите — это первичные реакции, а реакции, которые протекают непосредственно на электродах, называются вторичными.
Законы электролиза Фарадея
Разделение реакций электролиза на первичные и вторичные помогло Майклу Фарадею установить законы электролиза:
Первый закон электролиза Фарадея: масса вещества, осаждённого на электроде при электролизе, прямо пропорциональна количеству электричества, переданного на этот электрод. Под количеством электричества имеется в виду электрический заряд, измеряемый, как правило, в кулонах.
Второй закон электролиза Фарадея: для данного количества электричества (электрического заряда) масса химического элемента, осаждённого на электроде, прямо пропорциональна эквивалентной массе элемента. Эквивалентной массой вещества является его молярная масса, делённая на целое число, зависящее от химической реакции, в которой участвует вещество.
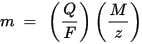
m — масса осаждённого на электроде вещества, Q — полный электрический заряд, прошедший через вещество F = 96 485,33(83) Кл·моль−1 — постоянная Фарадея, M — молярная масса вещества (Например, молярная масса воды H2O = 18 г/моль), z — валентное число ионов вещества (число электронов на один ион).
Заметим, что M/z — это эквивалентная масса осаждённого вещества. Для первого закона Фарадея M, F и z являются константами, так что чем больше величина Q, тем больше будет величина m. Для второго закона Фарадея Q, F и z являются константами, так что чем больше величина M/z (эквивалентная масса), тем больше будет величина m.
Электролиз широко применяется сегодня в промышленности и в технике. Например, именно электролиз служит одним из эффективнейших способов промышленного получения водорода, пероксида водорода, диоксида марганца, алюминия, натрия, магния, кальция и прочих веществ. Применяется электролиз для очистки сточных вод, в гальваностегии, в гальванопластике, наконец — в химических источниках тока. Но обо всем по порядку.
Получение чистых металлов из руд путем электролиза
Благодаря электролизу многие металлы извлекается из руд и подвергается дальнейшей переработке. Так, когда руду или обогащенную руду — концентрат — подвергают обработке реагентами, металл переходит в раствор, затем путем электроэкстракции металл выделяют из раствора. Чистый металл выделяется при этом на катоде. Таким путем получают цинк, медь, кадмий.
Электрорафинированию металлы подвергают для устранения примесей и чтобы перевести содержащиеся примеси в удобную для дальнейшей переработки форму. Металл, подлежащий очистке, отливают в виде пластин, и применяют эти пластины в качестве анодов при электролизе.
Когда ток проходит, металл анода растворяется, переходит в виде катионов в раствор, затем катионы разряжаются на катоде, и образуют осадок чистого металла. Примеси анода не растворяются - выпадают анодным шламом, или переходят в электролит, откуда непрерывно или периодически удаляются.
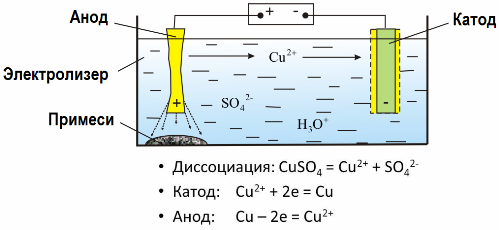
Рассмотрим в качестве примера электрорафинирование меди. Главный компонент раствора - сульфат меди — наиболее распространенная и дешевая соль этого металла. Раствор обладает низкой электрической проводимостью. Для ее увеличения в электролит добавляют серную кислоту.
Кроме того, в раствор вводят небольшие количества добавок, способствующих получению компактного осадка металла. Вообще, электролитическому рафинированию подвергают медь, никель, свинец, олово, серебро, золото.
Очистка сточных вод путем электролиза
Электролиз находит применение в очистке сточных вод (процессы электрокоагуляции, электроэкстракции и электрофлотации). Электрохимический метод очистки — один из наиболее часто применяемых. Для электролиза используют нерастворимые аноды (магнетит, оксид свинца, графит, марганец, которые наносят на титановую основу), или растворимые (алюминий, железо).
Такой метод применяют для выделения из воды токсичных органических и неорганических веществ. К примеру, медные трубы очищают от окалины раствором серной кислоты, и промышленные сточные воды приходится затем очищать путем электролиза с нерастворимым анодом. На катоде выделяется медь, которая снова может использоваться на том же предприятии.
Щелочные сточные воды очищают электролизом от цианистых соединений. С целью ускорения окисления цианидов, повышения электропроводности и экономии электроэнергии, к водам применяют добавку в виде хлорида натрия.
Электролиз проводят с графитовым анодом и стальным катодом. Цианиды разрушаются в ходе электрохимического окисления и хлором, который выделяется на аноде. Результативность такой очистки близка к 100%.
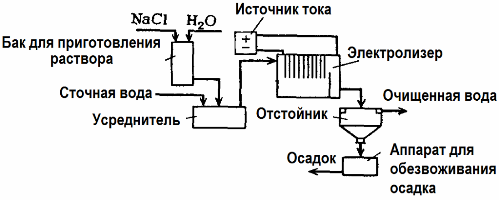
Кроме непосредственно электохимической очистки можно включить в процесс электролиза коагуляцию. Исключив добавки солей, электролиз проводят с растворимыми алюминиевыми или железными анодами. Тогда не только разрушаются загрязнители на аноде, но и растворяется сам анод. Образуются активные дисперсные соединения, которые коагулируют (сгущают) коллоидно-дисперсные загрязнения.
Этот метод эффективен при очистке сточных вод от жиров, нефтепродуктов, красителей, масел, радиоактивных веществ и т. д. Он называется электрокоагуляцией.
Гальваностегия
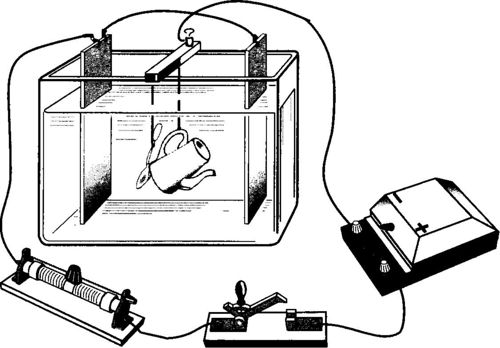
Гальваностегия — это электролитическое нанесение определенных металлов с целью защиты изделий от коррозии и для придания им соответствующего эстетического оформления (покрытие производят хромом, никелем, серебром, золотом, платиной и т. п.). Вещь тщательно очищают, обезжиривают, и используют как катод в электролитической ванне, в которую налит раствор соли того металла, которым необходимо покрыть изделие.
В качестве анода применяют пластину из этого же металла. Как правило применяют пару анодных пластин, а подлежащий гальваностегии предмет располагают между ними.
Гальванопластика
Гальванопластика - осаждение металла на поверхности разных тел для воспроизведения их формы: формы для отливки деталей, скульптур, печатных клише и т.д.

Гальваническое осаждение металла на поверхности предмета возможно лишь тогда, когда поверхность эта или весь предмет являются проводниками электрического тока, поэтому для изготовления моделей или форм желательно использовать металлы. Наиболее подходят для этой цели легкоплавкие металлы: свинец, олово, припои, сплав Вуда.
Эти металлы мягки, легко обрабатываются слесарным инструментом, хорошо гравируются и отливаются. После наращивания гальванического слоя и отделки металл формы выплавляют из готового изделия.
Однако наибольшие возможности для изготовления моделей все же представляют диэлектрические материалы. Чтобы металлизировать такие модели, нужно придать их поверхности электропроводность. Успех или неудача в конечном итоге зависят в основном от качества токопроводящего слоя. Слой этот может быть нанесен одним из трех способов.
Самый распространенный способ — графитирование, он пригоден для моделей из пластилина и других материалов, допускающих растирание графита по поверхности.
Следующий прием — бронзирование, способ хорош для моделей относительно сложной формы, для разных материалов, однако за счет толщины бронзового слоя несколько искажается передача мелких деталей.
И, наконец, серебрение, пригодное во всех случаях, но особенно незаменимое для хрупких моделей с очень сложной формой — растений, насекомых и т. п.
Химические источники тока
Также электролиз является основным процессом, благодаря которому функционируют самые современные химические источники тока, например батарейки и аккумуляторы. Здесь присутствуют два электрода, контактирующие с электролитом.
Между электродами устанавливается разность потенциалов — электродвижущая сила, соответствующая свободной энергии окислительно-восстановительной реакции. Подробнее смотрите здесь: Химические источники электрического тока
Лимонная батарейка (для увеличения нажмите нажмите на картинку)

Подробнее о том, как работает такая батарейка смотрите здесь: Как сделать батарейку из лимона в домашних условиях
Действие химических источников тока основано на протекании при замкнутой внешней цепи пространственно-разделённых процессов: на отрицательном аноде восстановитель окисляется, образующиеся свободные электроны переходят по внешней цепи к положительному катоду, создавая разрядный ток, где они участвуют в реакции восстановления окислителя. Таким образом, поток отрицательно заряженных электронов по внешней цепи идет от анода к катоду, то есть от отрицательного электрода к положительному.
Металлы в природе. Способы получения металлов

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Металлы в природе. Способы получения металлов"
С металлами в свободном состоянии человек знаком с самой глубокой древности. Изначально человеку было известно только 7 металлов, так называемы «металлы древности».

За последние 250 лет открыто и получено в свободном виде 86 новых металлов.
Использовать металлы в свободном виде человек начал в древние века. Первыми металлами из них были золото, серебро, медь. Освоение выплавки железа в больших масштабах сделало огромный переворот в промышленности.

В природе металлы встречаются как в виде простых веществ (в свободном виде), а также в виде соединений. Малоактивные металлы: медь, золото, серебро, платина, палладий и др. в природе могут находиться как в свободном виде, так и в составе соединений. Активные металлы: натрий, калий, кальций, алюминий, магний и др. встречаются в природе только в виде соединений: оксидов, сульфидов, карбонатов и т.д.
Если металл в природных условиях находится в свободном состоянии, то для получения чистого металла нужно только избавиться от соответствующих смесей. Получение металлов из соединений – это задача металлургии.
Большинство металлов находится в природных условиях в виде соединений – руд. Руда – это природное минеральное образование, в котором атомы химических элементов находятся в окисленном состоянии. Для получения металла для этого необходимо провести процесс восстановления:
Для данного процесса используют восстановители, такие как, водород, более активные металлы, углерод (в виде кокса), оксид углерода (II), постоянный электрический ток.
Технологические процессы, лежащие в основе промышленных способов получения металлов из руд, можно разделить на пирометаллургические, гидрометаллургические, электрометаллургические.
Пирометаллургические способы получения металлов основаны на использовании различных восстановителей для получения металлов путем восстановления из руд при высокой температуре.
В гидрометаллургических методах процесс восстановления протекает в водном растворе.
В электрометаллургических процессах восстановителем является постоянный электрический ток.
Водород как восстановитель может использоваться для получения металлов со средней и малой химической активностью: например, меди, вольфрама, молибдена. В данном случае водород восстанавливает металл из его оксида при высокой температуре.
Восстановить металлы из их оксидов можно с помощью более активного металла, поэтому процесс восстановление металлами называется металлотермией. Если в роли восстановителя металла выступает алюминий, то данный процесс называется алюмотермией.

Так, алюминий используется для получения кальция из его оксида, а металлический кальций используют для получения цезия.
Ca + 2СsСl = CaCl2 + 2Cs
Углерод и оксид углерода (II) являются сильными восстановителями.
CuO + CO = Cu + CO2↑

Свободный углерод (в виде кокса) и оксид углерода (II) служат восстановителями при производстве железа в доменном процессе. В общем виде:
Постоянный электрический ток является самым сильным восстановителем. С помощью электрического тока получают многие активные металлы: натрий, калий, кальций и др. При этом процесс идёт не в водном растворе, а в расплаве при повышенной температуре.
Алюминий в промышленных масштабах получают путём электролиза раствора оксида алюминия в расплавленном криолите (Na3AlF6).
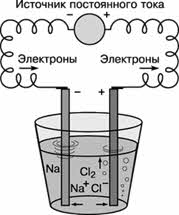
Таким образом, большинство металлов в природе находятся только в виде соединений, в самородном состоянии встречаются золото, медь, палладий и др. Получение металлов из соединений – это задача металлургии. В зависимости от способа получения металлов различают следующие методы: пирометаллургия, электрометаллургия и гидрометаллургия. В пирометаллургическом методе использую восстановители: водород, углерод, оксид углерода (II), более активные металлы.
Читайте также:
