Металлы это p элементы
ЭЛЕМЕНТЫ — (лат. elementa семантич. калька греч. , от ряд, собственно член ряда), термин антич. философии, первоначально «буквы» (алфавита), затем простейшие начала, элементы (ста рослав. транскрипция «стихии»). Уже атомисты (№ 240 Лу.) сравнивали… … Философская энциклопедия
Элементы-индикаторы — элементы, указывающие на наличие м ний и рудных тел. Являются важным поисковым признаком оруденения, когда основные рудообразующие металлы не дают одназначных выводов о ценности геохим. аномалии. Подразделяются на несколько гр.: 1) элементы,… … Геологическая энциклопедия
ЭЛЕМЕНТЫ (КОМПОНЕНТЫ) ПОЛЕЗНЫЕ — составные части полезного ископаемого, представляющие интерес для промышленности. В Э. п. входят элементы главные и второстепенные, включая элементы примеси, элементы спутники и элементы легирующие. Геологический словарь: в 2 х томах. М.: Недра.… … Геологическая энциклопедия
ЭЛЕМЕНТЫ ВТОРОСТЕПЕННЫЕ — присутствующие в руде в низких и чрезвычайно низких содер., но существенно влияющие на промышленную ценность м ния. Обычно не определяют контура рудных залежей. При значительном скоплении Э. в. минимальное бортовое содер. главных полезных… … Геологическая энциклопедия
ЭЛЕМЕНТЫ — ЭЛЕМЕНТЫ (лат. elementa семантическая калька греч. στοιχεία, от στοίχος ряд, собств. член ряда), термин античной философии, первоначально «буквы» (алфавита), затем простейшие начала, элементы (старославянская транскрипция «стихии»). Уже… … Античная философия
Элементы Юнга — Элементы Юнга Юциса Мёрфи (также элементы Юциса Мёрфи) элементы групповой алгебры симметрической группы , определяемые[1] как суммы транспозиций: Элементы попарно коммутируют (более того, элемент коммутирует со всеми… … Википедия
ЭЛЕМЕНТЫ-ПРИМЕСИ — химические элементы, присутствующие в минералах других элементов в виде изоморфных примесей или тонких механических включений; иногда извлекаются в качестве попутных или даже основных (напр., золото из пирита) компонентов. В число элементов… … Большой Энциклопедический словарь
Элементы химические — (a. chemical elements; н. chemische Elemente; ф. elements chimiques; и. elementos quimicos) составные части простых и сложных тел, представляющие собой совокупность атомов c одинаковым зарядом атомных ядер и одинаковым числом электронов в … Геологическая энциклопедия
Элементы-примеси — второстепенные элементы в г. п. и рудах, образующие самостоятельные м лы. Многие из них имеют промышленное значение и путем обогащения могут выделяться в концентраты. См. Элементы второстепенные. Геологический словарь: в 2 х томах. М.: Недра. Под … Геологическая энциклопедия
ЭЛЕМЕНТЫ — № 105 110 сверхтяжёлые искусственно полученные радиоакт. хим. элементы. Элементы с ат. номером 104 110 наз. т р а н с а к т и н о и д н ы м и. Элемент № 105 (нуклид с массовым числом А= 261, T1/2=1,6 с) получен в 1970 в Дубне группой Г. H.… … Физическая энциклопедия
ЭЛЕМЕНТЫ КОРАБЛЯ ТАКТИКО-ТЕХНИЧЕСКИЕ — характеризующие его как боевую единицу следующие: элементы нападения артиллерия, торпеда, мина, глубинные бомбы и т. д.; элементы защиты броня, противоминная защита, противохимическая защита; маневренные элементы скорость хода, поворотливость,… … Морской словарь
P-элементы (химические)
p-элементами называют химические элементы, в атомах которых электрон с наивысшей энергией занимает p-орбиталь.
p-элементами являются:
- в 1-м периоде — нет p-элементов
- во 2-м периоде — B—Ne
- в 3-м периоде — Al—Ar
- в 4-м периоде — Ga—Kr
- в 5-м периоде — In—Xe
- в 6-м периоде — Tl—Rn
К P-элементам относятся непереходные металлы и большинство неметаллов. P-элементы имеют различные свойства, как физические, так и механические. P-неметаллы - это высокореакционные, как правило, вещества, имеющию сильную электроотрицательность, P-металлы - умеренно активные металлы, причём их активность повышается к низу ПСХЭ.
См. также
- -элементы
- -элементы
- -элементы
- -элементы
Wikimedia Foundation . 2010 .
Смотреть что такое "P-элементы (химические)" в других словарях:
Элементы химические — элементы Периодической таблицы элементов Менделеева, в которой каждый элемент это вся совокупность атомов с одинаковым зарядом атомных ядер и одинаковым числом электронов в атомной оболочке. В настоящее время число известных элементов 118 … Начала современного естествознания
ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ — простейшая форма материи, которая может быть идентифицирована химическими методами. Это составные части простых и сложных веществ, представляющие собой совокупность атомов с одинаковым зарядом ядра. Заряд ядра атома определяется числом протонов в … Энциклопедия Кольера
Элементы химические — Периодическая система химических элементов Д. И. Менделеева H … Википедия
Элементы химические — Каждый Э. х. это совокупность Атомов с одинаковым зарядом атомных ядер и одинаковым числом электронов в атомной оболочке. Ядро атомное состоит из протонов, число которых равно атомному номеру (См. Атомный номер) элемента, и нейтронов,… … Большая советская энциклопедия
ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ — совокупности атомов с определенным зарядом ядра Z. Д. И. Менделеев определял Э. х. так: материальные части простых или сложных тел, к рые придают им известную совокупность физ. и хим. св в . Взаимосвязи Э. х. отражает периодическая система… … Химическая энциклопедия
Элементы химические — [chemical elements] составные части всего многообразия простых и сложных веществ. Каждый химический элемент это совокупность атомов с одинаковым зарядом атомных ядер и одинаковым числом электронов в атомной оболочке. Атомное ядро состоит из… … Энциклопедический словарь по металлургии
Элементы химические* — Громадное разнообразие явлений и веществ природы, при её изучении, мысль человеческая всегда стремилась упростить при помощи допущения если не полного единства основных Э. (Демокрит, Эпикур), то, по крайней мере, при помощи небольшого числа Э.,… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Элементы (химические) — Громадное разнообразие явлений и веществ природы, при её изучении, мысль человеческая всегда стремилась упростить при помощи допущения если не полного единства основных Э. (Демокрит, Эпикур), то, по крайней мере, при помощи небольшого числа Э.,… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Химические источники тока — (аббр. ХИТ) устройства, в которых энергия протекающих в них химических реакций непосредственно превращается в электрическую энергию. Содержание 1 История создания 2 Принцип действия … Википедия
p-Элементы
К p-элементов периодической системы относятся элементы с валентным p-подуровнем. Эти элементы расположены в III, IV, V, VI, VII, VIII группах, главных подгруппах периодической системы Д.И.Менделеева. В периоде орбитальные радиусы атомов с увеличением атомного номера уменьшаются, а энергия ионизации в целом растет. В подгруппах элементов с увеличением номера элемента, размеры атомов в общем увеличиваются, а энергия ионизации уменьшается.
p-Элементы III группы К p-элементов III группе относятся бор B, алюминий Al, галлий Ga, индий In и таллий Tl. По характеру этих элементов бор является типичным неметаллом, остальные - металлы. В пределах подгруппы прослеживаются резкий переход от неметаллу к металлам. Свойствами и поведением бор подобный кремния, что является результатом диагональной сродства элементов в периодической системе, согласно которой смещение в периоде вправо вызывает усиление неметаллического характера, а вниз по группе - металлического, поэтому аналогичные по свойствам элементы оказываются расположенными диагонально рядом, например Li и Mg, Ber и Al, B и Si.
Электронное строение валентных подуровней атомов p-элементов III группы в основном состоянии имеет вид ns 2 np 1 . В соединениях бор и трехвалентные алюминий, галлий и индий, кроме того, могут образовывать соединения со степенью окисления +1, а для таллия последний является довольно характерным.
Алюминий является одним из самых распространенных элементов природы, бор - достаточно распространенный, галлий, индий а таллий распространены мало и очень рассеяны, поэтому относятся к редким.
p-Элементы IV группы К p-элементов IV группы относятся углерод C, кремний Si, германий Ge, олово Sn и свинец Pb. Общая электронная конфигурация валентных подуровней атомов p-элементов в основном состоянии ns 2 np 2 . Вследствие наличия 2-х неспаренных p-электронов в соединениях они могут проявлять степень окисления +2, причем эта тенденция усиливается в направлении к свинцу. Атомы могут переходить в возбужденное состояние с образованием четырех валентных электронов, что обусловливает возникновение соединений со степенью окисления +4. Это состояние является характерным для углерода и кремния, способность к выявлению степени окисления +4 ослабляется в направлении к свинцу.
Характер изменения физических свойств элементов и соответствующих простых веществ свидетельствует о закономерное ослабление неметаллических и усиление металлических свойств в ряду C - Si - Ge - Pb.
Углерод и кремний - типичные неметаллы, образующие атомные кристаллические решетки с ковалентной связью. Их простые вещества характеризуются высокими твердостью, температурами плавления и кипения. Для германия эти параметры остаются относительно большими, что вместе с хрупкостью характеризует его как алмазоподобный кристалл с ковалентным типом связи. В то же время в германию уже обнаружено некоторое взнос металлической связи. На это указывает заметное уменьшение ширины запрещенной зоны и росту электропроводности. Для олова полупроводниковые свойства сохраняются лишь до температуры 13,2°С, при дальнейшем нагревании олово переходит в металлический состояние. Свинец - металл, который не проявляет полупроводниковых свойств. Возрастание металлических свойств сопровождается постепенным уменьшением энергии ионизации элементов, их электроотрицательности и усилением восстановительной способности простых веществ.
p-Элементы V группы К p-элементов V группы относятся азот N, фосфор P, мышьяк As, стибий Sb и висмут Bi, при чем азот и фосфор являются типичными элементами, а остальные элементы образуют подгруппу мышьяка. Электронная конфигурация валентных подуровней элементов в основном состоянии ns 2 np 3 .
На последнем энергетическом уровне атомы элементов этой подгруппы имеют по три одноэлектронные орбита ли, которые могут образовывать три ковалентные связи. В то же время в связывании могут принимать участие двухэлектронная орбиталь, а в случае элементов, размещенных после азота, - также свободные nd-орбитали. Так, азот способен образовывать четвертая ковалентная связь по донорно-акцепторным механизмом с использованием своей неподеленной пары электронов. Примером может служить ион аммония NH4 + и его многочисленные производные. Максимально возможная валентность азота в его соединениях равна 4, и каждая пара электронов четырех ковалентных связей занимает одну из четырех орбиталей.
В отличие от азота остальное атомов p-элементов V группы имеют nd-подуровень, вакантные орбитали которого способны участвовать в образовании дополнительных ковалентных связей, за счет чего их ковалентность может расти до 5.
Факторы увеличения радиусов атомов и уменьшение электроотрицательности в ряду N - P - As - Sb - Bi влияют на свойства простых веществ и соединений элементов: постепенно уменьшается стойкость неметаллических форм простых веществ и увеличивается устойчивость металоподобных (азот — типичный неметал с большой электронегативностью, а висмут — типичный металл, электроотрицательности которого лишь 1,70), ослабляются кислотные и усиливаются основные свойства бинарных соединений элементов, их гидроксидов и тому подобное.
p-Элементы VI группы К p-элементов VI группы относятся кислород O, сера S, селен Se, теллур Te и полоний Po. На валентных подуровням атомов p-Элементы VI группы размещено 6 электронов: электронная конфигурация валентных подуровней атомов в основном состоянии ns 2 np 4 .
За счет использования неспаренных электронов элементы в своих соединениях обнаруживают характерную для них валентность 2. Она может расти в случае образования донорно-акцепторных связей, в которых принимают участие двухэлектронные орбитали. Например, в кислых водных растворах существуют ионы гидроксонию H3O + , в которых атом кислорода соединен с тремя атомами водорода ковалентными связями. В отличие от кислорода атомы остальных p-элементов VI группы имеют свободный nd-подуровень, орбитали которого также способны принимать участие в образовании химических связей, в результате чего валентность серы, селена, теллура и полония может возрастать до 6.
Для атомов p-элементов VI группы характерно присоединение электронов для завершения np-подуровня и образования устойчивой электронной конфигурации следующего благородного газа ns 2 np 6 . Это определяет характерный для них степень окисления -2 в соединениях с менее электронегативными элементами.
С переходом к полонию наблюдается характерное для групп p-элементов уменьшение устойчивости высшей степени окисления. Для полония соединения со степенью окисления +6 очень неустойчивы. Это обусловлено сильным ростом энергетической разницы между ns-и np-подуровнями, что затрудняет участие ns-электронов в образовании химических связей.
В ряду O - S - Se - Te - Po возрастают радиусы атомов, что характерно для групп p-элементов, уменьшение энергии их ионизации и электроотрицательности. Ослабление неметаллических свойств элементов проявляется также в уменьшении стойкости неметаллических форм простых веществ и в росте устойчивости металлических. Это приводит к тому, что в отличие от предыдущих элементов подгруппы полоний уже имеет металлическую кристаллическую решетку и относится к металлам.
p-Элементы VII группы - галогены К p-элементов VII группы относятся фтор F, хлор Cl, бром Br, йод I и астату At. Элементы имеют общее название галогены. Электронная конфигурация валентных подуровней атомов p-элементов VII группы соответствует формуле ns 2 np 5 .
На последнем энергетическом уровне атомы элементов имеют по семь электронов, один из которых является неспаренным. Этим объясняется сходство их свойств. Наличие одноэлектронной орбитали определяет характерную для всех элементов валентность 1. Одновременно галогены (кроме фтора) имеют вакантный nd-подуровень, орбитали которого также могут участвовать в образовании химических связей и увеличивать валентность атомов элементов до 7.
Молекулы галогенов двухатомные, неполярные. Все галогены являются неметаллами. В ряду F - Cl - Br - I - At ослабляются признаки неметаличности: фтор — самый типичный элемент-неметала, а астату обнаруживает некоторые свойства элемента-металла.
В пределах своих периодов галогены характеризуются малыми атомными радиусами, что обуславливает их высокие электроотрицательности и сродство к электрону, поэтому для них в сложных веществах самым стойким является степень окисления -1.
p-Элементы VIII группы К p-элементов VIII группы относятся гелий He, неон Ne, аргон Ar, криптон Kr, ксенон Xe и радон Rh, которые составляют главную подгруппу. Атомы этих элементов имеют завершенные внешние электронные слои, поэтому электронная конфигурация валентных подуровней их атомов в основном состоянии имеет вид 1s 2 (Не) и ns 2 np 6 (остальные элементы). Благодаря очень высокой устойчивости электронных конфигураций они в целом характеризуются большими значениями энергий ионизации и химической инертностью, поэтому их называют благородными (инертными) газами. В свободном состоянии они существуют в виде атомов (одноатомных молекул). Атомы гелия (1s 2 ), неона (2s 2 2p 6 ) и аргона (3s 2 3p 6 ) имеют особо устойчивую электронную структуру, поэтому соединения валентного типа для них неизвестны.
Криптон (4s 2 4p 6 ), ксенон (5s 2 5p 6 ) и радон (6s 2 6p 6 ) отличаются от предыдущих благородных газов большими размерами атомов и, соответственно, меньшими энергиями ионизации. Они способны образовывать соединения, которые зачастую имеют низкую стойкость.
p-блок в периодической таблице элементов — электронная оболочка атомов, валентные электроны которых с наивысшей энергией занимают p-орбиталь.
В p-блок входят последние шесть групп главной подгруппы, исключая гелий (который находится в s-блоке). Данный блок содержит все неметаллы (исключая водород и гелий) и полуметаллы, а также некоторые металлы.
P-блок содержит в себе элементы, которые имеют различные свойства, как физические, так и механические. P-неметаллы — это, как правило, высокореакционные вещества, имеющие сильную электроотрицательность, p-металлы — умеренно активные металлы, причём их активность повышается к низу таблицы химических элементов.
- Группы химических элементов
- Периодическая система
Полезное
Смотреть что такое "p-элементы" в других словарях:
Металлы

К металлам относится большая часть элементов периодической системы – 82 химических элементов. Какими свойствами они обладают, и чем отличаются от неметаллов?
Общая характеристика
Металлами называют группу элементов, в виде простых веществ, которые обладают металлическими свойствами (пластичность, ковкость, блеск, электронная проводимость и т. д.)
Основное отличие элементов-металлов – они обладают только восстановительными свойствами, а в реакциях могут только окисляться. В соединениях они могут иметь только положительные степени окисления как в элементарных положительно заряженных ионах, так и в сложных ионах, где они образуют положительные центры.
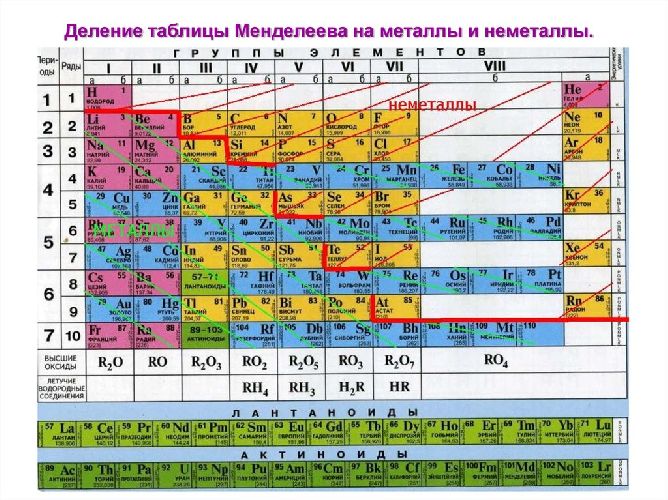
Рис. 1. Список металлов.
Как правило, на внешнем уровне элементов металлов находится небольшое число электронов (1-3), значения электроотрицательности невысокие. К металлам относятся все s-элементы (кроме водорода и гелия), d- и f-элементы, а также p-элементы под чертой бор-астат. Для типичных металлов характерен большой размер атомов, что способствует легкости отдачи валентных электронов. Образующиеся положительные ионы устойчивы, так как имеют завершенную внешнюю электронную оболочку.
Физические и химические свойства
Все металлы, кроме ртути, при нормальных условиях в виде простых веществ находятся в твердом агрегатном состоянии и образуют металлическую кристаллическую решетку.

Рис. 2. Металлы в таблице Д.И. Менделеева.
Таблица «Металлы»
В следующей таблицы представлены группы основных металлов:
| Группа металлов | Металл |
| Щелочные | литий, натрий, калий и т.д. |
| Щелочноземельные | кальций, стронций, барий и т.д. |
| Переходные | уран, титан, железо, платина и т.д. |
| постпереходные | алюминий, свинец, олово и т.д. |
| Тугоплавкие | молибден, вольфрам |
| Цветные | медь, титан, магний и т.д. |
| Благородные | золото, серебро и т.д. |
Металлы пластичны и ковки, особенно если на внешнем электронном уровне атомов по одному электрону: слои атомов перемещаются относительно друг друга без разрушения кристаллической решетки (щелочные металлы, медь, серебро, золото). В атомах непластичных хрупких металлов хрома и марганца – большое число валентных электронов.
Плотность, твердость, температура плавления металлов изменяются в широком диапазоне и зависят от атомной массы, строения атома и геометрии кристаллической решетки. Самый легкий металл – литий (плотность 0,53 г/см 3 ), самый тяжелый – осмий (плотность 22,5 г/см 3 ). Металлы с плотностью больше 5 г/см 3 относят к тяжелым, меньше 5 г/см 3 – к легким металлам.
Самая низкая температура плавления у ртути (-39 градусов по Цельсию), самый тугоплавкий металл – вольфрам (температура плавления 3410 градусов по Цельсию.) Энергия атомизации вольфрама составляет 836 кДж/моль, а температура кипения его 5930 градусов.
Металлы вступают в реакцию как с простыми, так и со сложными веществами. Как типичные восстановители металлы реагируют почти со всеми неметаллами-окислителями (кислород, сера, азот и т. д.):
Также металлы реагируют с такими сложными веществами, как оксиды и гидроксиды, разбавленные растворы кислот, с растворенными в воде щелочами.
В пределах одного и того же периода металлические свойства ослабевают, а неметаллические усиливаются; в пределах одной и той же группы (в главной подгруппе) металлические свойства усиливаются, а неметаллические ослабевают

Рис. 3. Металлы главных подгрупп.
Нахождение металлов и способы их получения
Самый распространенный на земле элемент-металл – алюминий. За ним следуют железо, кальций, натрий.
Некоторые металлы встречаются в природе в самородном состоянии (золото, ртуть, платина), но в основном они находятся в природе в виде оксидов и солей.
Получение металлов происходит с помощью металлургии (получение из руд), пирометаллургии (получение с помощью реакции восстановления при высокой температуре), гидрометаллургии (извлечение из руд в виде растворимых соединений), электрометаллургии (получение металлов электролизом расплавов и растворов их соединений).
Что мы узнали?
Металлы – вещества, которые обладают высокой электро- и теплопроводностью, ковкостью, пластичностью и металлическим блеском. В данной статье по химии 9 класса рассматриваются их физические и химические свойства, формулы класса металлов, а также способы получения.
Читайте также:
