Металлической химической связью образовано вещество
Большинство металлов имеют общие свойства, которые отличны от свойств других простых или сложных веществ. Это такие свойства как:
- повышенные температуры плавления,
- значительные электро- и теплопроводность,
- способность отражать свет и
- способность прокатываться в листы
- характерный металлический блеск.
Эти свойства связаны с существованием в металлах металлической связи:
Металлическая связь — это связь между положительно заряженными ионами и атомами металлов и свободно движущимися по кристаллу электронами.
Образование металлической связи
Простое вещество — металл существует в виде кристалла, имеющим металлическую кристаллическую решетку, в узлах которой находятся атомы или ионы металлов.
Валентные атомные орбитали каждого атома металла в кристалле перекрываются сразу с орбиталями нескольких близлежащих соседей, и число этих атомных орбиталей чрезвычайно велико. Поэтому число возникающих молекулярных орбиталей тоже велико.
Мы уже знаем, что число валентных электронов атомов металлов небольшое, к тому же они достаточно слабо связаны с собственными ядрами и могут легко отрываться. Поэтому электроны заполняют всю зону взаимодействующих орбиталей образуя металлическую связь. Т.о. в кристаллической решетке металла перемещение электронов происходит свободно.
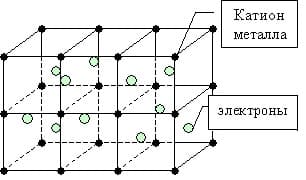
металлическая связь
Такие особенности, как тепло- и электропроводность металлов связано с существованием свободно движущихся электронов в кристаллической решетке.
Особенности металлической связи
Отличие металлической связи от ковалентной
- Несмотря на то, что металлическая связь как и ковалентная связь образована посредством обобществления электронов, однако в металлической связи электроны принадлежат всему множеству ионов/атомов металлов, а в ковалентной только двум атомам неметаллов.
- Важное отличие металлической связи от ковалентной – это то, что здесь не существует направленности связи, т.к. электроны по кристаллу распределены почти равномерно.
- Прочность металлической связи также отличается: ее энергия в 3-4 раза меньше энергии ковалентной связи.
Отличие металлической связи от ионной
В образовании как ионной связи, так и металлической принимают участие ионы — катионы. Однако ионная связь — это связь между катионами и анионами, а в металлической связи анионы отсутствуют, зато имеются электроны, свободно движущиеся между катионами/атомами металлов.
Прочность металлической связи
- Если рассмотреть щелочные металлы, то наиболее активный среди них – цезий, легче всего будет отдавать свои валентные электроны, а труднее всего – рубидий, наименее активный среди щелочных металлов.
Чем легче атом металла переходит в состояние иона, т.е. отдает электроны, тем менее прочна его решетка, вследствие отталкивания положительно заряженных ионов.
В связи с этим металл будет обладать пониженной температурой плавления и становится более мягким.
- Чем больше валентных электронов имеет атом металла, тем более прочна его кристаллическая решетка, и тем выше его температуры кипения и плавления
Ниже приведена зависимость температуры плавления металлов от их положения в периодической таблице и числа валентных электронов.

зависимость температуры плавления металлов от положения в периодической таблице и от числа валентных электронов
Помогите с тестом по химии, я в этой теме ничего не понимаю!
Химическая связь. Типы химической связи: ковалентная (полярная и неполярная), ионная, металлическая
---------------------------------------------------------------------------------------------
1. Верны ли следующие суждения о химической связи?
А. Ионная связь образуются между атомами типичного металла и типичного неметалла
Б. Ковалентная связь образуется между атомами разных неметаллов
1) Верно только А
2) Верно только Б
3) Верны оба суждения
4) Оба суждения неверны
---------------------------------------------------------------------------------------------
2. Соединения с ионной связью образуются в том случае, когда взаимодействуют атомы:
1) Типичного металла и типичного неметалла
2) Элементов с одинаковой электроотрицательностью
3) Элементов с немного различающейся электроотрицательностью
4) Разных металлов
---------------------------------------------------------------------------------------------
3. Формула вещества, образованного ковалентной неполярной химической связью
1) H2, O2, S8
2) CO2, SiCl4, HBr
3) NaCl. Cas. K2O
4) HCl, NaCl, PH3
---------------------------------------------------------------------------------------------
6. Группа формул веществ, каждое из которых образовано ионной связью
1) H2S, NH3, SO3
2) KBr, CH4, NO
3) KCl, BaS, CaO
4) P4, Cl2, H2
---------------------------------------------------------------------------------------------
7. Соединениями с ковалентной неполярной и ионной связью являются соответственно
1) Оксид фосфора (V) и оксида натрия
2) Азот и сульфид натрия
3) Хлорид натрия и хлор
4) Хлорид кальция и хлороводород
---------------------------------------------------------------------------------------------
8. Химическая связь в соединении хлора с элементом, в атоме которого распределение электронов по слоям 2ё, 8ё, 1ё
1) Ковалентная неполярная
2) Ковалентная полярная
3) Ионная
4) Маталлическая
---------------------------------------------------------------------------------------------
9. Химическая связь в соединении кислорода с химическим элементом, в атоме которого распределение электронов по слоям 2ё, 8ё, 6ё
1) Ионная
2) Металлическая
3) Ковалентная неполярная
4) Ковалентная неполярная
---------------------------------------------------------------------------------------------
10. К соединениям с ионной связью относятся вещества, формулы которых
1) Кальций
2) Кислород
3) Азот
4) Бром
5) Вода
6) Метан
---------------------------------------------------------------------------------------------
12. Установите соответствие между названием вещества и видом химической связи в нём
А) Сероводород
Б) Оксид кальция
В) Магний
Г) Азот
1) Металлическая
2) Ковалентная неполярная
3) Ковалентная полярная
4)Ионная
Металлическая химическая связь - характеристика, способы образования и свойства
Металлическая химическая связь характерна для металлов и их сплавов в кристаллическом состоянии. Образуется за счет обобществления валентных электронов. Для этого типа строения вещества не характерно образование направленных структурированных связей.
Следует отличать различные типы связи элементов кристаллов - металлическую, ионную и водородную, свойственную кристаллам льда.
Схема образования металлической связи на примерах
Механизм создания металлической связи предусматривает отрыв частично свободных электронов от атома с образованием катионов с положительным зарядом, формирующих “остов” кристаллической решетки и электронного облака. При этом металлический кристалл не приобретает положительного или отрицательного заряда.
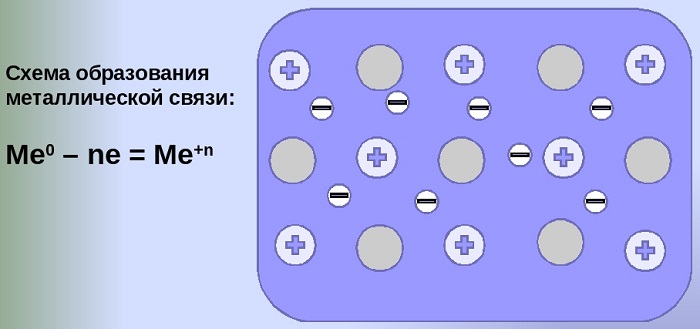
Общий случай формирования связывания металлических атомов в химии, соответствующий данному выше определению:
здесь n - число электронов, участвующих в образовании связи, как правило, от 1 до 3.
В левой части уравнения - атом металла, отдающий электроны, в правой - образовавшийся в результате ион.
Формула показывает, что в кристалле постоянно происходит присоединение и отдача электронов.
Схемы формирования связи на примере атомов различной валентности:
- K - e⁻ ⇆ K;
- Cu - 2e⁻ ⇆ Cu;
- Al - 3e⁻ ⇆ Al.
Отделяющиеся от атома электроны перемещаются на свободные валентные орбитали, которые обобществляются и позволяют всем электронам перемещаться в пределах кристалла. Отделение электронов выгодно атому с точки зрения энергетического баланса, так как позволяет сформировать электронно-стабильную оболочку.
Характерные кристаллические решетки
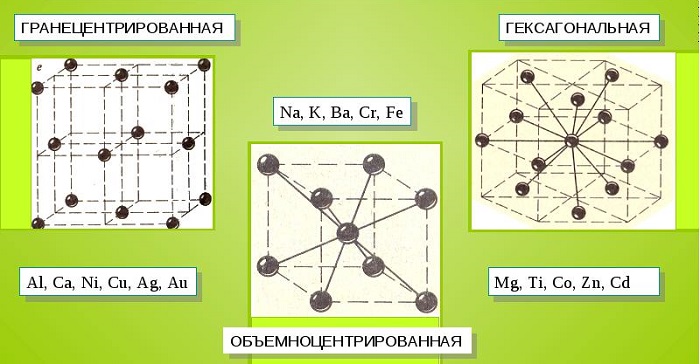
Металлические кристаллы подразделяются на 3 основных типа:
- Объемно-центрированную кубическую решетку, в которой, помимо размещения атомов в четырех вершинах куба, один из них размещается в центре объемной фигуры. Такой тип организации твердого вещества характерен для ряда металлов, включая K, Na и Li, вольфрам, хром, ниобий и др.
- Гранецентрированная кубическая решетка характеризуется расположением атомов в центре граней. Всего в ячейке задействовано 10 атомов, 4 в вершинах и 6 на гранях. Такая решетка встречается у меди, драгметаллов (серебра и золота) и металлов платиновой группы: Pd, Pt.
- Гексагональное строение решетки предполагает размещение атомов в углах и внутри 6-гранной призмы. Ячейка состоит из 15 атомов и свойственна магнию, кальцию, осмию, бериллию и ряду других металлических элементов.
Общими свойствами всех решеток являются высокая симметрия и плотная упаковка составляющих их атомов. Некоторые элементы периодической таблицы формируют уникальную структуру, например, элементарная ячейка In имеет тетрагональное строение.
Для сплавов, являющихся химическими соединениями, также характерно образование кристаллов перечисленных видов, при этом атомы каждого металла занимают определенное место в структуре.
Например, в сплаве никеля и алюминия атомы Al размещаются по углам, а атом Ni - в центре ОЦК ячейки. Свойства сплава и его структура влияют на класс прочности изделия, изготовленного из этого материала.
Физические свойства металлической связи
Физические характеристики металлических кристаллов обусловлены способностью обобществленных электронов свободно перемещаться внутри кристалла.

Характеристики, отличающие подобные вещества:
хорошая электропроводность, благодаря наличию условно свободного электронного облака;
высокая проводимость тепла;
низкая реакционная способность или инертность;
пластичность - большинство металлов можно гнуть и ковать.
Высокий уровень организации вещества обусловливает металлический блеск. Следует иметь в виду, что повышение прочности при пластической деформации и легировании приводит к образованию частично ковалентной связи.
При деформации могут возникать области повышенной прочности и низкими пластическими свойствами, похожие на вещества с ковалентной связью (например, алмаз).
Сходства и отличия металлической химической связи от ионной
Помимо рассматриваемой, металлы могут образовывать другие виды связи, включая простую ионную.
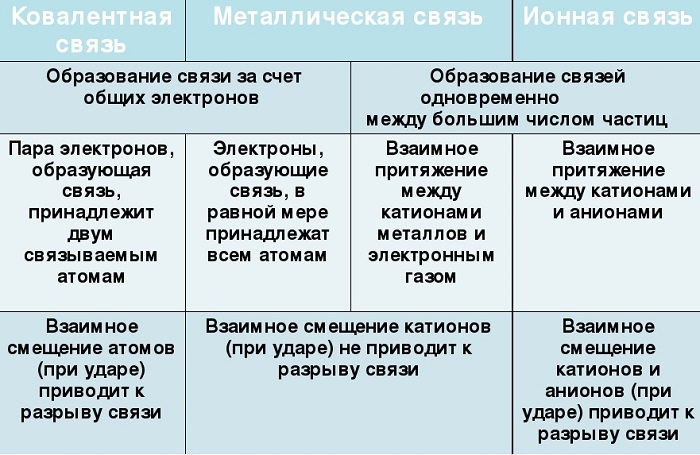
Их общие черты:
участие металлов, при этом металлическая связь формируется исключительно атомами металла, а ионная образуется между металлическим и неметаллическим элементами;
металл высвобождает электроны и становится катионом;
соединения могут существовать в кристаллической форме.
Кристаллы с ионным характером соединения отличают следующие параметры:
- В узлах размещаются как положительно, так и отрицательно заряженные ионы. Каркас металлической решетки формируют исключительно катионы.
- Узлы удерживаются за счет электростатического взаимодействия.
- При низких температурах кристаллические вещества, образованные за счет ионного взаимодействия, проявляют свойства диэлектриков (не проводят ток).
- Переход электронов с атома металла происходит на орбиты атома неметалла.
Характерный пример кристалла с ионной связью - поваренная соль, решетка которой сформирована из ионов Na⁺ и Cl⁻. Такие кристаллические вещества не обладают пластичностью и блеском.
Типы химических связей - структурные особенности молекул
Химическая связь - это взаимодействие между молекулами вещества, которые отвечают за его устойчивость и цвет. Кроме этого, межмолекулярное соединение - это способ взаимодействия между молекулами, имеющими заряд.
- Типы химических связей
- Одноэлектронная химическая связь
- Ковалентное соединение молекул
- Металлическая связь
- Ионное соединение
- Ван-дер-ваальсово соединение молекул
- Двухэлектронная трехцентровая связь
- Кристаллическая решетка
- Полярность (+ или -).
- Прочность (возможность удерживать вокруг себя определенное количество атомов).
- Длина (количество атомов, соединенных в одну цепочку).
Типы химических связей
- Одноэлектронное межмолекулярное соединение.
- Ковалентная связь.
- Металлическая.
- Ионно-водородная.
- Ван-дер-ваальсова.
- Двухэлектронная трехцентровая.
- Одноэлектронная.
- Ковалентная.
- Металлическая.
- Ионная.
Одноэлектронная химическая связь
- Отсутствие перекрытий атомных орбиталей.
- Отсутствие пары для электронов.
- Отсутствие взаимодействия между спинами электронов.

Ковалентное соединение молекул
- Ковалентной полярной.
- Ковалентной неполярной.
Металлическая связь
Металлическая связь между молекулами появляется среди катионов, имеющих положительный заряд, и находятся они в кристаллической решетке, которая, в свою очередь, образуется при помощи движущегося электрона. Данным химическим соединением обладают многочисленные сплавы металлов и сами металлы.
Важно! За счет того, что катионы и электроны валентного типа передвигаются, в незаполненных ими промежутках создается взаимодействие, обладающее электростатическим характеристиками, что и создает металлическое соединение молекул.
Длина ковалентной связи, например, для Ме2 составляет 2,67 ангстрем, для Na - 3,08 ангстрем. В то время как постоянная решетка составляет 3,502 ангстрем для Me и 4,282 для Na.
- Кубической объемно-центрированной. Такую решетку имеют: Pb, K, Na.
- Кубической гранецентрированной. Данной решеткой обладают: Ni, Ag, Rh.
- Гексагональной. Ее имеют: Mg, Cd, Re.

Ионное соединение
Ван-дер-ваальсово соединение молекул
Химические связи данного типа считаются самыми слабыми из всех существующих. Происходит образование данной связи только в том случае, если между собой связываются молекулы, у которых оболочка атома полностью заполнена - N2, Cl2, NH3. Второе название данной связи - слабые межмолекулярные. Они заметно отличаются от других типов связей. Например: для того, чтобы удерживать молекулы хлора в хлоре, необходима сила, которая почти в 10 раз выше, чем необходимая для удержания Cl2. Расстояние между ядрами почти в 2 раза больше, чем у ковалентной связи.

Двухэлектронная трехцентровая связь
Двухэлектронное трехцентровое соединение относится к классу электронно-дефицитных связей. Характеризуется оно тем, что одна пара валентных электронов локализуется в сфере действия сразу трех атомов. Это соединение является наименее изученным, поэтому много сказать о нем невозможно. О том, как образуются связи данного типа, можно прочитать в теории молекулярных орбиталей.
Металлическая химическая связь

Металлическая связь образуется между атомами в кристалле металла, возникающая за счет перекрытия валентных электронов. Так, что же представляет собой этот вид связи, и в каких соединениях она присутствует?
Что такое металлическая связь?
Металлическая химическая связь существует в металлическом кристалле и в жидком расплавленном состоянии. Ее образуют элементы, атомы которых на внешнем уровне имеют мало электронов (1-3) по сравнению с общим числом внешних, энергетически близких орбиталей.

Рис. 1. Схема образования металлической связи.
Валентные электроны из-за небольшой энергии ионизации слабо удерживаются в атоме. Так, у атома натрия на один валентный электрон (3S1) приходится 9 свободных и энергетически близких орбиталей (одна 3s, три 3p и пять 3d).
Из-за малого значения энергии ионизации валентный электрон слабо удерживается и свободно перемещается не только в пределах 9 своих свободных орбиталей, но при плотной упаковке в кристалле и на свободных орбиталях других атомов, осуществляя связь.
Химическая связь сильно делокализована: электроны обобществлены («электронный газ») и перемещаются по всему куску металла, в целом электронейтрального, между положительно заряженными ионами.
Свободное перемещение электронов по кристаллу объясняет ненаправленность и ненасыщенность связи, а также такие физические свойства металлов, как пластичность, блеск, электро- и теплопроводность.
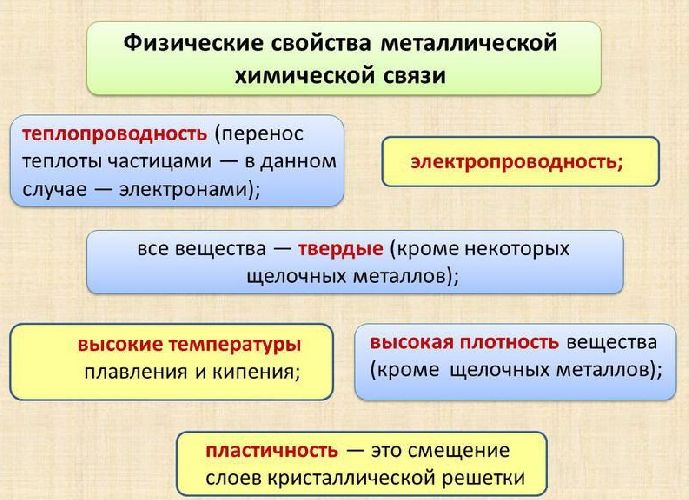
Рис. 2. Свойства металлической химической связи.
Металлы почти всегда образуют высокосимметричные решетки с плотно приближенными друг к другу атомами. Выделяют три вида кристаллических решеток:
- кубическая объемно центрированная. В таком виде решетки атомы располагаются на вершине куба и один атом в центре объема куба. Такую решетку имеют следующие металлы: натрий, литий, барий, калий, свинец и многие другие.
- кубическая гранецентрированная.
- гексагональная. В таком виде решетки атомы располагаются в вершине и центрах шестигранной оснований призмы, а три атома находятся в средней плоскости этой призмы.
Такой тип кристаллической решетки имеют следующие металлы: магний, кадмий, рений, осмий, рутений, бериллий и многие другие.
Что мы узнали?
Металлическая связь близка по природе к ковалентной, но отличается от нее тем, что обобществление электронов при ее образовании осуществляется сразу многими атомами. В данной статье дается определение понятию «металлическая связь», а также приведены примеры металлической химической связи.
Читайте также:
