Металлические свойства у натрия

Натрий (Na, лат. natrium ) — химический элемент первой группы, третьего периода периодической системы Менделеева, с атомным номером 11. Как простое вещество представляет собой мягкий щелочной металл серебристо-белого цвета. На внешнем энергетическом уровне натрий имеет один электрон, который он легко отдаёт, превращаясь в положительно заряженный катион Na + . Единственным стабильным изотопом является 23 Na. В свободном виде не встречается, но может быть получен из различных соединений. Натрий — шестой по распространённости элемент в земной коре: он находится в составе многочисленных минералов, включая полевые шпаты, содалит и «каменную соль» (галит, хлорид натрия).
Содержание
- 1 История и происхождение названия
- 2 Нахождение в природе
- 3 Получение
- 4 Физические свойства
- 5 Химические свойства
- 6 Применение
- 7 Изотопы натрия
- 8 Биологическая роль
- 9 Меры предосторожности

История и происхождение названия
Соединения натрия известны и использовались с давних времён. В древнегреческом переводе Библии — Септуагинте — упоминается слово νίτρον (в латинском переводе — Вульгате — ему соответствует слово nitroet ) как название вещества типа соды или поташа, которое в смеси с маслом служило моющим средством(Иер. 2:22). В Танахе слову νίτρον соответствуют др.-евр. ברית — «мыло» и נתר — «щёлок»(мыльная жидкость). Сода (натрон) встречается в природе в водах натронных озёр в Египте. Природную соду древние египтяне использовали для бальзамирования, отбеливания холста, при варке пищи, изготовлении красок и глазурей. Плиний Старший пишет, что в дельте Нила соду (в ней была достаточная доля примесей) выделяли из речной воды. Она поступала в продажу в виде крупных кусков, из-за примеси угля окрашенных в серый или даже чёрный цвет.
Название «натрий» происходит от латинского слова natrium (ср. др.-греч. νίτρον ), которое было заимствовано из среднеегипетского языка (nṯr), где оно означало среди прочего: «сода», «едкий натр».
Аббревиатура «Na» и слово natrium были впервые использованы академиком, основателем шведского общества врачей Йенсом Якобсом Берцелиусом (Jöns Jakob Berzelius, 1779—1848) для обозначения природных минеральных солей, в состав которых входила сода. Ранее (а также до сих пор в английском, французском и ряде других языков) элемент именовался содий (лат. sodium ) — это название sodium, возможно, восходит к арабскому слову suda, означающему «головная боль», так как сода применялась в то время в качестве лекарства от головной боли.
Металлический натрий впервые был получен английским химиком Хемфри Дэви электролизом расплава гидроксида натрия. Дэви сообщил об этом 19 ноября 1807 года в Бейкеровской лекции (в рукописи лекции Дэви указал, что он открыл калий 6 октября 1807 года, а натрий — через несколько дней после калия).
Нахождение в природе
Кларк натрия в земной коре 25 кг/т. Содержание в морской воде в виде соединений — 10,5 г/л . Металлический натрий встречается как примесь, окрашивающая каменную соль в синий цвет. Данную окраску соль приобретает под действием радиации.
Получение

Промышленное получение натрия по способу Девилля, распространённое в 19 веке. AC — железная трубка со смесью соды, угля и мела; B — холодильник Донни и Мареска; R — приёмник с нефтью
Первым промышленным способом получения натрия была реакция восстановления карбоната натрия углем при нагревании тесной смеси этих веществ в железной ёмкости до 1000 °C (способ Девилля):
Na2CO3 + 2C → 1000oC 2Na + 3CO
Вместо угля могут быть использованы карбид кальция, алюминий, кремний, ферросилиций, силикоалюминий.
С появлением электроэнергетики более практичным стал другой способ получения натрия — электролиз расплава едкого натра или хлорида натрия:
4NaOH → электрический ток 4Na + 2H2O + O2 , 2NaCl → электрический ток 2Na + Cl2 .
В настоящее время электролиз — основной способ получения натрия.
Натрий также можно получить цирконийтермическим методом или термическим разложением азида натрия.
Физические свойства


Качественное определение натрия с помощью пламени — ярко-жёлтый цвет эмиссионного спектра «D-линии натрия», дублет 588,9950 и 589,5924 нм
Натрий — серебристо-белый металл, в тонких слоях с фиолетовым оттенком, пластичен, даже мягок (легко режется ножом), свежий срез натрия блестит. Величины электропроводности и теплопроводности натрия достаточно высоки, плотность равна 0,96842 г/см³ (при 19,7 °C ), температура плавления 97,86 °C , температура кипения 883,15 °C .
Под высоким давлением становится прозрачным и красным, как рубин.
При комнатной температуре натрий образует кристаллы кубической сингонии, пространственная группа I m3m, параметры ячейки a = 0,42820 нм , Z = 2 .
При температуре −268 °С (5 К) натрий переходит в гексагональную фазу, пространственная группа P 63/mmc , параметры ячейки a = 0,3767 нм , c = 0,6154 нм , Z = 2 .
Химические свойства
Щелочной металл на воздухе легко окисляется до оксида натрия. Для защиты от кислорода воздуха металлический натрий хранят под слоем керосина.
При горении на воздухе или в кислороде образуется пероксид натрия:
Кроме того, существует озонид натрия NaO3.
С водой натрий реагирует очень бурно, помещённый в воду кусочек натрия всплывает, из-за выделяющегося тепла плавится, превращаясь в белый шарик, который быстро движется в разных направлениях по поверхности воды, реакция идёт с выделением водорода, который может воспламениться. Уравнение реакции:
Как и все щелочные металлы, натрий является сильным восстановителем и энергично взаимодействуют со многими неметаллами (за исключением азота, йода, углерода, благородных газов):
2Na + Cl2 → 2NaCl 2Na + H2 → 250−400oC,p 2NaH
Натрий более активен, чем литий. С азотом реагирует крайне плохо в тлеющем разряде, образуя очень неустойчивое вещество — нитрид натрия (в противоположность легко образующемуся нитриду лития):
С разбавленными кислотами взаимодействует как обычный металл:
2Na + 2HCl → 2NaCl + H2↑
С концентрированными окисляющими кислотами выделяются продукты восстановления:
Растворяется в жидком аммиаке, образуя синий раствор:
С газообразным аммиаком взаимодействует при нагревании:
С ртутью образует амальгаму натрия, которая используется как более мягкий восстановитель вместо чистого металла. При сплавлении с калием даёт жидкий сплав.
Алкилгалогениды с избытком металла могут давать натрийорганические соединения — высокоактивные соединения, которые обычно самовоспламеняются на воздухе и взрываются с водой. При недостатке металла происходит реакция Вюрца.
Реагирует со спиртами, фенолами, карбоновыми кислотами с образованием солей.
Растворяется в краун-эфирах в присутствии органических растворителей, давая электрид или алкалид (в последнем у натрия необычная степень окисления −1).
Применение
Металлический натрий широко используется как сильный восстановитель в препаративной химии и промышленности, в том числе в металлургии. Используется для осушения органических растворителей, например, эфира. Натрий используется в производстве весьма энергоёмких натриево-серных аккумуляторов. Его также применяют в выпускных клапанах двигателей грузовиков как жидкий теплоотвод. Изредка металлический натрий применяется в качестве материала для электрических проводов, предназначенных для очень больших токов.
В сплаве с калием, а также с рубидием и цезием используется в качестве высокоэффективного теплоносителя. В частности, сплав состава натрий 12 %, калий 47 %, цезий 41 % имеет рекордно низкую температуру плавления −78 °C и был предложен в качестве рабочего тела ионных ракетных двигателей и теплоносителя для атомных энергоустановок.
Жидкометаллический теплоноситель в ядерных реакторах на быстрых нейтронах БН-600 и БН-800.
Натрий также используется в газоразрядных лампах высокого и низкого давления (НЛВД и НЛНД). Лампы НЛВД типа ДНаТ (Дуговая Натриевая Трубчатая) очень широко применяются в уличном освещении. Они дают ярко-жёлтый свет. Срок службы ламп ДНаТ составляет 12—24 тысяч часов. Поэтому газоразрядные лампы типа ДНаТ незаменимы для городского, архитектурного и промышленного освещения. Также существуют лампы ДНаС, ДНаМТ (Дуговая Натриевая Матовая), ДНаЗ (Дуговая Натриевая Зеркальная) и ДНаТБР (Дуговая Натриевая Трубчатая Без Ртути).
Металлический натрий применяется в качественном анализе органического вещества. Сплав натрия и исследуемого вещества нейтрализуют этанолом, добавляют несколько миллилитров дистиллированной воды и делят на 3 части, проба Ж. Лассеня (1843), направлена на определение азота, серы и галогенов (проба Бейльштейна).
Хлорид натрия (NaCl) (поваренная соль) — древнейшее применяемое вкусовое и консервирующее средство.
Азид натрия (NaN3) применяется в качестве азотирующего средства в металлургии и при получении азида свинца.
Цианид натрия (NaCN) применяется при гидрометаллургическом способе выщелачивания золота из горных пород, а также при нитроцементации стали и в гальванотехнике (серебрение, золочение).
Хлорат натрия (NaClO3) применяется для уничтожения нежелательной растительности на железнодорожном полотне.
Изотопы натрия
В настоящее время (2012 г.) известно 20 изотопов с массовыми числами от 18 до 37 и 2 ядерных изомера натрия. Единственный стабильный изотоп 23 Na. У большинства изотопов период полураспада меньше одной минуты, лишь один радиоактивный изотоп — 22 Na — имеет период полураспада больше года. 22 Na претерпевает позитронный распад с периодом полураспада 2,6027 года , его используют в качестве источника позитронов и в научных исследованиях. 24 Na, с периодом полураспада по каналу β − -распада 15 часов, используется в медицине для диагностики и для лечения некоторых форм лейкемии.
Биологическая роль
Натрий входит в состав всех живых организмов. В высших организмах натрий находится большей частью в межклеточной жидкости клеток (примерно в 15 раз больше, чем в цитоплазме клетки). Разность концентраций поддерживает встроенный в мембраны клетки натрий-калиевый насос, откачивающий ионы натрия из цитоплазмы в межклеточную жидкость.
Совместно с калием натрий выполняет следующие функции:
- Создание условий для возникновения мембранного потенциала и мышечных сокращений.
- Поддержание осмотической концентрации крови.
- Поддержание кислотно-щелочного баланса.
- Нормализация водного баланса.
- Обеспечение мембранного транспорта.
- Активация многих энзимов.
Рекомендуемая доза натрия составляет для детей от 600 до 1700 миллиграммов. Для взрослых по данным Американской Ассоциации сердечных заболеваний минимальная необходимая доза составляет меньше 500 миллиграммов, рекомендуемая до 1500 миллиграммов в день (за исключением некоторых болезней или профессий, при которых нужно повышенное количество натрия). В виде поваренной соли в 3/4 чайной ложки содержится 1725 миллиграммов натрия. По другим данным здоровым взрослым стоит ограничивать употребление натрия 2300 миллиграммами, а людям с повышенным давлением и рядом других заболеваний 1500 или меньшим количеством.
Натрий содержится практически во всех продуктах в разных количествах, хотя большую его часть организм получает из поваренной соли, в том числе в составе консервов, полуфабрикатов, соусов, колбасных изделий и т.п. В качестве источника натрия служат также такие пищевые добавки как глутамат натрия, пищевая сода (бикарбонат натрия), нитрит натрия, сахаринат натрия и бензоат натрия. Усвоение в основном происходит в желудке и тонкой кишке. Витамин Д улучшает усвоение натрия, однако чрезмерно солёная пища и пища, богатая белками, препятствуют нормальному всасыванию. Количество поступившего с едой натрия показывает содержание натрия в моче. Для богатой натрием пищи характерна ускоренная экскреция.
Дефицит натрия у питающегося сбалансированной пищей человека не встречается, однако некоторые проблемы могут возникнуть при голодании. Временный недостаток может быть вызван использованием мочегонных препаратов, поносом, обильным потением или избыточным употреблением воды.
Симптомами нехватки натрия являются потеря веса, рвота, образование газов в желудочно-кишечном тракте и нарушение усвоения аминокислот и моносахаридов. Продолжительный недостаток вызывает мышечные судороги и невралгию.
Переизбыток натрия вызывает отек ног и лица, повышенное выделение калия с мочой, у некоторых людей повышенное кровяное давление и скопление жидкости. Максимальное количество соли, которое может быть переработано почками, составляет примерно 20—30 граммов, большее количество уже опасно для жизни.
Меры предосторожности
Чистый металлический натрий огнеопасен. На воздухе склонен к самовоспламенению. Особенно опасен контакт с водой и влажными поверхностями, так как натрий очень бурно реагирует с водой, часто со взрывом, образуя едкую щёлочь (NaOH). В лабораториях небольшие количества натрия (примерно до 1 кг) хранят в закрытых стеклянных банках под слоем керосина, лигроина, бензина или вазелинового масла так, чтобы слой жидкости покрывал весь металл. Банка с натрием должна храниться в металлическом несгораемом шкафу (сейфе). Натрий берут пинцетом или щипцами, отрезают скальпелем (натрий пластичен и легко режется ножом) на сухой поверхности (не на столе, а в стеклянной чашке); необходимое количество и остаток тут же возвращают в банку под слой керосина, а отрезанный кусок либо помещают в керосин, либо тут же вводят в реакцию. Прежде чем приступить к работе с натрием, необходимо пройти инструктаж по охране труда. Лица, впервые приступающие к работе с натрием, должны производить эту работу под наблюдением сотрудников, имеющих опыт такой работы. Обычно в лабораторных условиях для реакций используют количества натрия, не превышающие нескольких десятков граммов. Для показательных опытов, например, в школе на уроках химии, следует брать не более одного грамма натрия. После работы с металлическим натрием всю посуду и остатки натрия заливают неразбавленным спиртом и полученный раствор нейтрализуют слабым раствором кислоты. Следует обратить особое внимание на то, чтобы все остатки и обрезки натрия были полностью нейтрализованы до их выбрасывания, так как натрий в мусорном ведре может вызвать пожар, а в канализационном сливе может вызвать взрыв и разрушение трубы. Все работы с натрием, как и вообще с щелочами и щелочными металлами, должны проводиться в очках или защитной маске. Хранить натрий дома и производить с ним какие-либо опыты не рекомендуется.
Воспламенение и даже взрыв металлического натрия при соприкосновении с водой и многими органическими соединениями может причинить серьёзные травмы и ожоги. Попытка взять кусочек металлического натрия голыми руками может привести к его воспламенению (иногда взрыву) из-за влажности кожи и образованию тяжелейших ожогов натрием и образующейся щёлочью. Горение натрия создает аэрозоль оксида, пероксида и гидроксида натрия, обладающий разъедающим действием. Некоторые реакции натрия протекают очень бурно (например, с серой, бромом).
Натрий
Натрий — элемент главной подгруппы первой группы, третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 11. Обозначается символом Na (лат. Natrium). Простое вещество натрий (CAS-номер: 7440-23-5) — мягкий щелочной металл серебристо-белого цвета.
В воде натрий ведет себя почти так же, как литий: реакция идёт с бурным выделением водорода, в растворе образуется гидроксид натрия.

Натрий (а точнее, его соединения) использовался с давних времён. Например, сода (натрон), встречающаяся в природе в водах натронных озёр в Египте. Природную соду древние египтяне использовали для бальзамирования, отбеливания холста, при варке пищи, изготовлении красок и глазурей. Плиний Старший пишет, что в дельте Нила соду (в ней была достаточная доля примесей) выделяли из речной воды. Она поступала в продажу в виде крупных кусков, из-за примеси угля окрашенных в серый или даже чёрный цвет.
Натрий впервые был получен английским химиком Хемфри Дэви в 1807 году электролизом твердого NaOH.
Название «натрий» (natrium) происходит от арабского натрун по-гречески — nitron и первоначально оно относилось к природной соде. Сам элемент ранее именовался содием Sodium.
Первым способом получения натрия стала реакция восстановления карбоната натрия углем при нагревании тесной смеси этих веществ в железной ёмкости до 1000°C:
Затем появился другой способ получения натрия — электролиз расплава едкого натра или хлорида натрия.

Качественное определение натрия с помощью пламени — ярко-жёлтый цвет эмиссионного спектра «D-линии натрия», дублет 588,9950 и 589,5924 нм.
Натрий — серебристо-белый металл, в тонких слоях с фиолетовым оттенком, пластичен, даже мягок (легко режется ножом), свежий срез натрия блестит. Величины электропроводности и теплопроводности натрия достаточно высоки, плотность равна 0,96842 г/см³ (при 19,7° С), температура плавления 97,86° С, температура кипения 883,15° С.
Щелочной металл, на воздухе легко окисляется. Для защиты от кислорода воздуха металлический натрий хранят под слоем керосина. Натрий менее активный чем литий, поэтому с азотом реагирует только при нагревании:
При большом избытке кислорода образуется пероксид натрия
Металлический натрий широко используется в препаративной химии и промышленности как сильный восстановитель, в том числе в металлургии. Натрий используется в производстве весьма энергоёмких натриево-серных аккумуляторов. Его также применяют в выпускных клапанах грузовиков как теплоотвод. Изредка металлический натрий применяется в качестве материала для электрических проводов, предназначенных для очень больших токов.
Натрий также используется в газоразрядных лампах высокого и низкого давления (НЛВД и НЛНД). Лампы НЛВД типа ДНаТ (Дуговая Натриевая Трубчатая) очень широко применяются в уличном освещении. Они дают ярко-жёлтый свет. Срок службы ламп ДНаТ составляет 12-24 тысяч часов. Поэтому газоразрядные лампы типа ДНаТ незаменимы для городского, архитектурного и промышленного освещения. Также существуют лампы ДНаС, ДНаМТ (Дуговая Натриевая Матовая), ДНаЗ (Дуговая Натриевая Зеркальная) и ДНаТБР (Дуговая Натриевая Трубчатая Без Ртути).
Металлический натрий применяется в качественном анализе органического вещества. Сплав натрия и исследуемого вещества нейтрализуют этанолом, добавляют несколько миллилитров дистиллированной воды и делят на 3 части, проба Ж. Лассеня (1843), направлена на определение азота, серы и галогенов (проба Бейльштейна)
— Хлорид натрия (поваренная соль) — древнейшее применяемое вкусовое и консервирующее средство.
— Азид натрия (Na3N) применяется в качестве азотирующего средства в металлургии и при получении азида свинца.
— Цианид натрия (NaCN) применяется при гидрометаллургическом способе выщелачивания золота из горных пород, а также при нитроцементации стали и в гальванотехнике (серебрение, золочение).
— Хлорат натрия (NaClO3) применяется для уничтожения нежелательной растительности на железнодорожном полотне.
В организме натрий находится большей частью снаружи клеток (примерно в 15 раз больше чем в цитоплазме). Это разницу поддерживает натрий-калиевый насос, который откачивает попавший внутрь клетки натрий.
Совместно с калием натрий выполняет следующие функции:
Создание условий для возникновения мембранного потенциала и мышечных сокращений.
Поддержание осмотической концентрации крови.
Поддержание кислотно-щелочного баланса.
Нормализация водного баланса.
Обеспечение мембранного транспорта.
Активация многих энзимов.
Рекомендуемая доза натрия составляет для детей от 600 до 1700 миллиграмм, для взрослых от 1200 до 2300 миллиграмм. В виде поваренной соли это составляет от 3 до 6 грамм в день.
Натрий содержится практически во всех продуктах, хотя большую его часть организм получает из поваренной соли. Усвоение в основном происходит в желудке и тонкой кишке. Витамин Д улучшает усвоение натрия, однако, чрезмерно соленая пища и пища богатая белками препятствуют нормальному всасыванию. Количество поступившего с едой натрия показывает содержание натрия в моче. Для богатой натрием пищи характерна ускоренная экскреция.
Дефицит натрия у питающегося сбалансированой пищей человека не встречается, однако, некоторые проблемы могут возникнуть при вегетарианских диетах. Временный дефицит может быть вызвано использованием мочегонных, поносом, обильным потением или избыточным употреблением воды. Симптомами нехватки натрия являются потеря веса, рвота, образование газов в желудочно-кишечном тракте, и нарушение усвоения аминокислот и моносахаридов. Продолжительный дефицит вызывает мышечные судороги и невралгию.
Переизбыток натрия вызывает отек ног и лица, а так же повышеное выделение калия с мочой. Максимальное количество соли, которое может быть переработано почками составляет примерно 20-30 грамм, большее количество уже опасно для жизни.
Соединения натрия
Натрий, Natrium, Na (11)
Название натрий — sodium, natrium происходит от древнего слова, распространенного в Египте, у древних греков (vixpov) и римлян. Оно встречается у Плиния (Nitron), у других древних авторов и соответствует древнееврейскому нетер (neter). В древнем Египте натроном, или нитроном, называли вообще щелочь, получаемую не только из природных содовых озер, но и из золы растений. Ее употребляли для мытья, изготовления глазурей, при мумификации трупов. В средние века название нитрон (nitron, natron, nataron), а также борах (baurach), относилось и к селитре (Nitrum). Арабские алхимики называли щелочи alkali. С открытием пороха в Европе селитру (Sal Petrae) стали строго отличать от щелочей, и в XVII в. уже различали нелетучие, или фиксированные щелочи, и летучую щелочь (Alkali volatile). Вместе с тем было установлено различие между растительной (Alkali fixum vegetabile — поташ) и минеральной щелочью (Alkali fixum minerale — сода).
В конце XVIII в. Клапрот ввел для минеральной щелочи название натрон (Natron), или натр и для растительной — кали (Kali), Лавуазье не поместил щелочи в «Таблицу простых тел», указав в примечании к ней, что это, вероятно, сложные вещества, которые когда-нибудь будут разложены. Действительно, в 1807 г. Дэви путем электролиза слегка увлажненных твердых щелочей получил свободные металлы — калий и натрий, назвав их потассий (Potassium) и содий (Sodium). В следующем году Гильберт, издатель известных «Анналов физики», предложил именовать новые металлы калием и натронием (Natronium); Берцелиус сократил последнее название до «натрий» (Natrium). В начале XIX в. в России натрий называли содием (Двигубский, 182i; Соловьев, 1824); Страхов предлагал название содь (1825). Соли натрия назывались, например, сернокислая сода, гидрохлоровая сода и одновременно уксусный натр (Двигубский, 1828). Гесс, по примеру Берцелиуса, ввел название натрий.
Периодическая система химических элементов Менделеева
Классификация хим. элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона/
198095, г.Санкт-Петербург, ул.Швецова, д.23, лит.Б, пом.7-Н, схема проезда
Характеристика ХЭ на основании его положения в ПС Д. И. Менделеева

Видеоурок начинается воспоминанием ученика Васи, который должен сделать домашнее задание по химии, а для этого ему нужно охарактеризовать два химических элемента: натрий и фосфор по плану, который они изучали в 8 классе. В видеофрагменте подробно расписан план характеристики химического элемента на основании положения его в Периодической системе, приведены конкретные примеры и подробное описание элементов натрия и фосфора.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Характеристика ХЭ на основании его положения в ПС Д. И. Менделеева"
Характеристика химического элемента на основании его положения в Периодической системе Д.И. Менделеева.
Химические элементы в Периодической системе – это герои, и им, как и любым героям, нужно давать определенные характеристики. За основу их характеристики нужно брать Периодическую систему химических элементов Д.И. Менделеева.
Описывать химический элемент нужно будет по 7 пунктам:
1. указать Положение элемента в Периодической системе Д.И. Менделеева и строение его атома
2. характер простого вещества, т.е. металлом или неметаллом является этот химический элемент
3. сравнить свойства простого вещества со свойствами простых веществ, образованных соседними по подгруппе элементами
4. сравнить свойства простого вещества со свойствами простых веществ, образованных соседними по периоду элементами
5. определить состав высшего оксида и его характер (основный, кислотный, амфотерный)
6. состав высшего гидроксида, его характер (кислородсодержащая кислота, основание, амфотерный гидроксид)
7. для неметаллов ещё указать состав летучего водородного соединения.
Но для этого, придется вспомнить основные закономерности изменения свойств атомов, простых веществ и соединений, образованных химическими элементами главных подгрупп.
Для атомов химических элементов в группах сверху вниз
· увеличивается заряд ядра атомов, который численно равен порядковому номеру элемента
· радиус атомов тоже увеличивается, т.к. увеличивается число энергетических уровней, а число энергетических уровней определяется номером периода
· при этом число электронов остается неизменным, электроны все дальше и дальше отдаляются от ядра, поэтому их становится легче отдать и восстановительные свойства усиливаются
· окислительные – ослабевают.
· высшая степень окисления остается неизменной и равна номеру группы
· низшая степень окисления тоже не изменяется и равна № группы – 8.
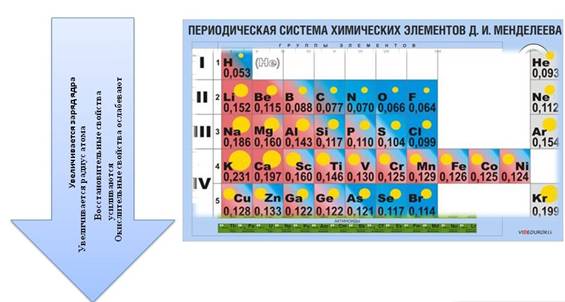
В периодах слева направо:
· заряд ядра увеличивается
· радиус уменьшается, т.к. увеличивается число электронов на внешнем уровне, которое определяется по номеру группы и электроны крепче связаны с ядром
· число энергетических уровней остается неизменным
· восстановительные свойства ослабевают
· усиливаются окислительные свойства.
· Высшая степень окисления изменяется от +1 до +8: в первой группе ‒ +1, во второй ‒ +2, в третьей ‒ +3, в четвертой ‒ +4, в пятой ‒ +5
· низшая степень окисления изменяется от -4 до -1: в четвертой группе она равна -4, в пятой -3, в шестой -2, а в седьмой -1.
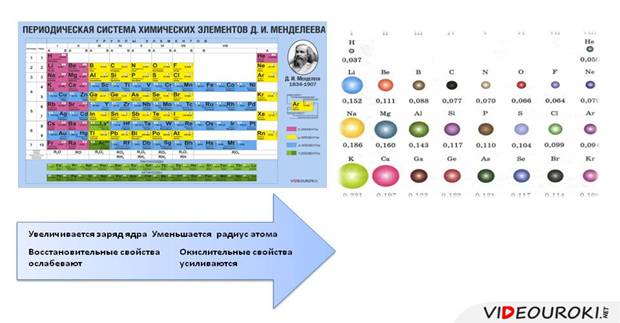

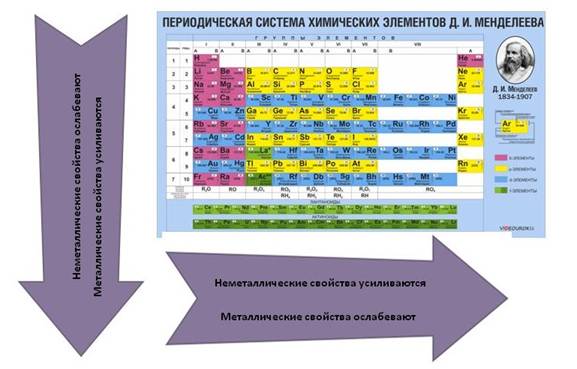
Что касается простых веществ, то металлические свойства в группах сверху вниз усиливаются, а в периодах слева направо ослабевают. Неметаллические свойства, наоборот, в группах сверху вниз ослабевают, а в периодах слева направо усиливаются.
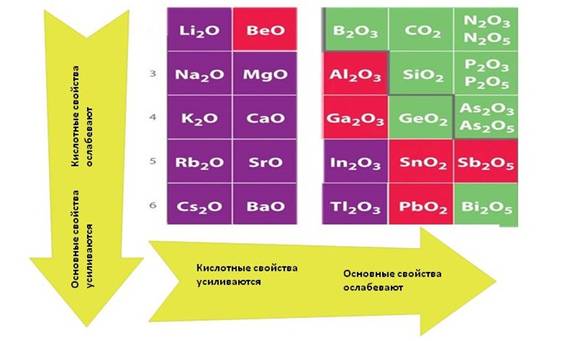
Для соединений химических элементов характерно то, что в группах сверху вниз усиливаются основные свойства, а кислотные ослабевают. Например, в I группе, основные свойства оксида калия (K2O)выражены сильнее, чем у оксида лития (Li2O), а в IV группе у оксида кремния (IV) (SiO2)– кислотные свойства выражены сильнее, чем у оксида свинца (IV) (PbO2). В периодах слева направо усиливаются кислотные свойства, а ослабевают основные. Например, у оксида магния (MgO) основные свойства выражены сильнее, чем у оксида алюминия (Al2O3), у оксида углерода (IV) (CO2) – кислотные свойства выражены сильнее, чем у оксида бора (B2O3).
Нам пришлось много вспомнить из курса химии 8 класса, но зато теперь мы может охарактеризовать металл натрий по всем признакам.
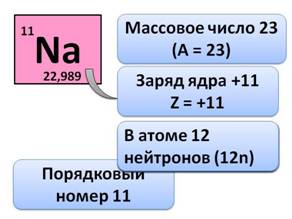
· Порядковый номер натрия (Na), т.е. клетка, в которой он стоит – 11
· Массовое число – 23

· Значит, заряд его ядра равен +11, Z = +11 (заряд ядра атома равен порядковому номеру элемента, числу протонов и числу электронов). Поэтому в атоме 11 электронов (11 ē), а число нейтронов определяется по формуле N = A – Z, т.е. 23 – 11 = 12, значит в атоме 12 нейтронов (12n).
· Натрий находится в 3-ем периоде, у него 3 энергетических уровня, на которых располагаются все его электроны. На первом уровне 2 электрона (это максимально), на втором – 8, на третьем – 1 электрон.
Т.к. у натрия 1 электрон на внешнем уровне, то этот элемент относится к металлам. В реакциях он будет отдавать 1 электрон, проявляя восстановительные свойства, и получать степень окисления +1.
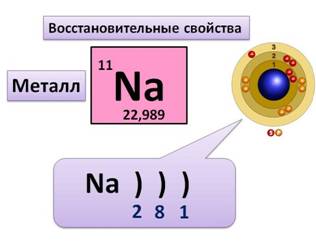
Охарактеризуем натрий как простое вещество. Натрий – это металл, для него характерна металлическая химическая связь и металлическая кристаллическая решетка. Как и для любого металла для него характерны такие физические свойства, как металлический блеск, пластичность, тепло и – электропроводность.

Сравним свойства натрия со свойствами его соседей по группе: металлические свойства натрия выражены сильнее, чем у лития, но слабее, чем у калия, т.к. в группе сверху вниз увеличивается радиус атома и электроны больше отдаляются от ядра и их становится легче оторвать.
Сравним свойства натрия со свойствами его соседей по периоду: металлические свойства натрия выражены сильнее, чем у магния, т.к. в периодах, слева направо радиус атомов уменьшается, а число электронов на внешнем уровне увеличивается, электроны крепче связаны с ядром, поэтому их становится тяжелее оторвать, чем присоединить.
Составим формулу оксида натрия, и определить его характер.
Т.к. натрий – металл I A группы, то ему соответствует оксид натрия – Na2O, значит, это основный оксид и он проявляет все свойства, характерные для этих оксидов: он реагирует с кислотами и кислотными оксидами, с водой с образованием щёлочи.

Гидроксид натрия – это NaOH, он является щёлочью – растворимым в воде основанием. Для него будут характерны следующие свойства: реакции с кислотами и кислотными оксидами, реакции с солями.

Натрий – металл, но он не образует летучих водородных соединений.
Охарактеризуем фосфор.
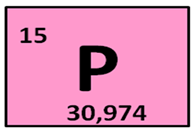
Фосфор находится в клетке номер 15, т.е. порядковый номер его – 15. Заряд ядра его атома будет +15. Число протонов, как и число электронов равно 15: (р = 15, ē = 15). Массовое число фосфора – 31, поэтому число нейтронов будет равно 16, т.к. если мы от массового числа отнимем число протонов, то будет 16 (31 – 15 = 16).

Фосфор находится в 3 периоде, значит, у него 3 энергетических уровня, на первом уровне – 2 электрона, на втором – 8, а на третьем будет пять: (2ē, 8ē, 5ē). На внешнем энергетическом уровне у фосфора 5 электронов.
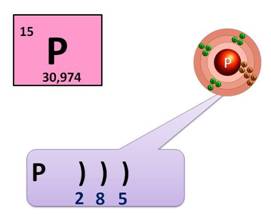
Фосфор – это неметалл, он может быть как окислителем, так и восстановителем. Как окислитель, он может присоединить 3 электрона до завершения внешнего уровня, получая при этом степень окисления -3 (Р 0 + 3 ē → Р -3 ), а как восстановитель, он может отдать 3 или 5 электронов и получить степень окисления +3 или +5 (Р 0 - 3 ē → Р +3 , Р 0 - 5 ē → Р +5 ).
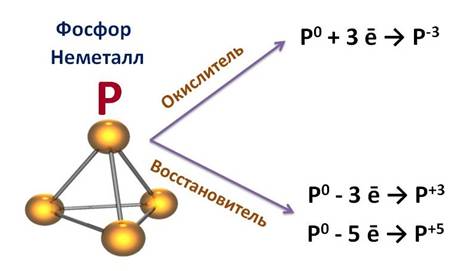
Фосфор – неметалл. Для него характерно явление аллотропии, как и для серы. Т.е. он может образовывать несколько простых веществ, отличающихся своими свойствами. Например, белый фосфор имеет белый цвет и молекулярную кристаллическую решетку, молекула имеет вид тетраэдра, а красный фосфор представляет собой полимер, черный фосфор является полупроводником и имеет металлический блеск.
Сравнить свойства фосфора и его соседей. Неметаллические свойства фосфора выражены сильнее, чем у мышьяка, но слабее, чем у азота, т.к. радиус у азота меньше, чем у фосфора. По сравнению с соседями по периоду, свойства фосфора выражены сильнее, чем у кремния, но слабее, чем у серы.
Составим формулу оксида и гидроксида фосфора.
Высший оксид фосфора – P2O5. Это кислотный оксид, который проявляет свойства, характерные для этих оксидов: он реагирует с основными оксидами, основаниями и водой с образованием соответствующей кислоты.

Высший гидроксид фосфора – это фосфорная кислота, или ортофосфорная – H3PO4, она проявляет свойства, характерные для всех кислот: реагирует с металлами, основаниями и основными оксидами, с солями.

Фосфор – неметалл, поэтому имеет летучее водородное соединение – РН3 – фосфин.
НАТРИЙ — соль жизни
Соединения металлов натрия-калия контролируют солевой баланс в наших организмах. Нарушения этого баланса опасно для жизни. В составе крови соединения этих металлов создают своеобразный электролит, необходимый для работы любой клетки организма.
От Библии до наших дней
История героя статьи тянется с библейских времен. Именно в Библии упомянуто вещество, которым пользовались для мытья, отбеливания хлопковых тканей. В переводе слово νίτρον (нитрон) означает мыло или щелок.

Природной содой или щелоком из золы многие века люди пользовались для домашних нужд.
Свойства натрия

Натрий (natrium) относится к щелочным металлам, в таблице Менделеева имеет атомный № 11.
- Легко режется ножом.
- Чистый натрий имеет белый серебристый цвет; на воздухе быстро покрывается слоем оксида Na2O.
- Структура кристаллической решетки объемноцентрированная, кубическая.
- Natrium легче воды; если бросить кусочек в воду, он будет плавать на ее поверхности.
Металл настолько активный, что хранят его в минеральном масле или в керосине, без доступа воздуха.
- Натрий реагирует с разбавленными кислотами, как рядовой металл.
- В реакции с концентрированными кислотами образуются продукты восстановления.
- Бурная реакция с водой идет с выделением водорода, поэтому металл загорается или взрывается.
- Как все щелочные металлы, активно реагирует со многими неметаллами.
Известен один стабильный изотоп — 23-Na.
| Свойства атома | |
|---|---|
| Название, символ, номер | На́трий / Natrium (Na), 11 |
| Атомная масса (молярная масса) | 22,98976928 ± 0,00000002 а.е.м.[1] а. е. м. (г/моль) |
| Электронная конфигурация | [Ne] 3s1, 1s22s22p63s1 |
| Радиус атома | 190 пм |
| Химические свойства | |
| Ковалентный радиус | 154 пм |
| Радиус иона | 97 (+1e) пм |
| Электроотрицательность | 0,93 (шкала Полинга) |
| Электродный потенциал | -2,71 В |
| Степени окисления | −1 (в алкалидах)[2]; 0; +1 (наиболее частая) |
| Энергия ионизации (первый электрон) | 495,6(5,14) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 0,971 г/см³ |
| Температура плавления | 370,96 К; 97,81 °C |
| Температура кипения | 1156,1 К; 882,95 °C |
| Уд. теплота плавления | 2,64 кДж/моль |
| Уд. теплота испарения | 97,9 кДж/моль |
| Молярная теплоёмкость | 28,23[3] Дж/(K·моль) |
| Молярный объём | 23,7 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая объёмноцентрированная |
| Параметры решётки | 4,2820 Å |
| Температура Дебая | 150 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 142,0 Вт/(м·К) |
| Номер CAS | 7440-23-5 |
Познавательно: у космонавтов в коже накапливается связанный белками Na. Тело так реагирует на чуждые условия существования. Почему соединение выводится из клеток — ученые пока не поняли.
Минералы, месторождения
В природе встречаются минералы:
- мирабилит (глауберова соль);
- галит (каменная соль);
- бура (формула Na2В4О7 • 10Н2О);
- криолит.

Месторождений металлического натрия на планете нет. В любом месте (даже в пустынях) найдется вода, с которой металл мгновенно прореагирует.
Добыча и переработка
Для производства натрия ведется добыча минералов во многих странах:

Промышленное получение натрия по способу Девилля, распространённое в 19 веке. AC — железная трубка со смесью соды, угля и мела; B — холодильник Донни и Мареска; R — приёмник с нефтью
Основной способ промышленного получения натрия — электролиз NaOH или NaCl.
Возможно получение с помощью термического разложения NaN3.

Качественное определение натрия с помощью пламени — ярко-жёлтый цвет эмиссионного спектра «D-линии натрия», спектральный дублет 588,9950 и 589,5924 нм
Плюсы и минусы
Достоинства соединений натрия не перечислить. Самое главное — без него невозможна биологическая жизнь на планете.
К недостаткам можно отнести дороговизну натриевых реакторов (необходимость промежуточного контора, усиленные системы безопасности). Реакторы на БН дороже, чем ВВЭР (водо-водяные).
Натрий вокруг нас
Применение металла и его соединений чрезвычайно широко:
- Металлический Na работает теплоносителем в реакторах на быстрых нейтронах (БН) и в ионных ракетных двигателях.

Познавательно: поваренной солью (NaCl) пользуются все жители планеты (даже животные с удовольствием приходят на солончаки полакомиться солью.
Купить металл
Цена металлического Natrium за килограмм у разных производителей колеблется от 900 до 1500 руб/кг.

Мне 42 года и я специалист в области минералогии. Здесь на сайте я делюсь информацией про камни и их свойства — задавайте вопросы и пишите комментарии!
Читайте также:

