Металлическая связь химия 11 класс
Учение о химической связи составляет основу всей теоретической химии.
| Под химической связью понимают такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы. |
Различают три типа химических связей: ионную, ковалентную, металлическую.
Ионная химическая связь
Как вы знаете, наиболее устойчивой является такая электронная конфигурация атомов, при которой на внешнем электронном уровне, подобно атомам благородных газов, будет находиться 8 электронов (или для первого энергетического уровня — 2). При химических взаимодействиях атомы стремятся приобрести именно такую устойчивую электронную конфигурацию и часто достигают этого или в результате присоединения валентных электронов от других атомов (процесса восстановления), или в результате отдачи своих валентных электронов (процесса окисления). Атомы, присоединившие «чужие» электроны, превращаются в отрицательные ионы, или анионы. Атомы, отдавшие свои электроны, превращаются в положительные ионы, или катионы. Понятно, что между анионами и катионами возникают силы электростатического притяжения, которые и удерживают их друг около друга, осуществляя тем самым ионную химическую связь.
Так как катионы образуют в основном атомы металлов, а анионы — атомы неметаллов, логично сделать вывод, что этот тип связи характерен для соединений типичных металлов (элементы главных подгрупп I и II групп, кроме магния Mg и бериллия Be) с типичными неметаллами (элементы главной подгруппы VII группы). Классическим примером является образование галогенидов щелочных металлов (фторидов, хлоридов и др.). Рассмотрим схему образования ионной связи в хлориде натрия:
Два разноименно заряженных иона, связанные силами притяжения, не теряют способности взаимодействовать с другими противоположно заряженными ионами, вследствие чего образуются соединения с ионной кристаллической решеткой. В ионном соединении ионы представлены как бы в виде электрических зарядов со сферической симметрией электрического поля, одинаково убывающего с увеличением расстояния от центра заряда (иона) в любом направлении (рис. 9). Поэтому взаимодействие ионов не зависит от направления, т. е. ионная связь, в отличие от ковалентной, будет ненаправленной.

Рис. 9.
Кристаллическая решетка хлорида натрия, состоящая из противоположно заряженных ионов натрия и хлорид-ионов
Ионные соединения представляют собой твердые, прочные, тугоплавкие вещества с высокой температурой плавления. Растворы и расплавы большинства ионных соединений — электролиты.
Ионный тип связи характерен для гидроксидов типичных металлов и многих солей кислородсодержащих кислот.
Ионная связь существует также в солях аммония, где нет атомов металлов (их роль играет катион аммония NH + 4) — NH4Cl, (NH4)2SO4, и в солях, образованных органическими основаниями — аминами (например, в хлориде метиламмония — [CH3NH3] + C1 - и т. д.).
Однако при образовании ионной связи не происходит идеального (полного) перехода электронов. Ионная связь является крайним случаем ковалентной полярной связи.
Урок по химии на тему "Металлическая химическая связь" (11класс)
Тема урока: “Металлическая химическая связь. Особенности строение атомов металлов. Металлическая химическая связь и металлическая кристаллическая решётка. Свойства веществ с этим типом связи “.
Цель: Расширить и закрепить знания учащихся о природе металлической химической связи.
Образовательные: научить объяснять механизм образования металлической химической связи и строение металлической кристаллической решётки, характеризовать свойства веществ с данным видом химической связи; дать представление о причинах единства всех типов химической связи.
Воспитательные: воспитывать чувство ответственности, положительное отношение к предмету химии
Развивающие: развивать умения анализировать, сравнивать, обобщать, делать выводы.
Тип урока: урок проверки и закрепления полученных знаний.
Оборудование: персональный компьютер.
1. Организационный момент(1-2мин)
2. Проверка домашнего задания(7-10мин)
Тест в Googl форме:
1. Пара элементов, между которыми образуется
ковалентная полярная связь
2. Формула соединения
с ковалентной связью
с ионной связью
a) NaCl; б) НСl; в) ВаО
3. Химическая связь
4. Ковалентная связь
5. Верным является утверждение?
σ-связь возникает в результате бокового перекрывания орбиталей
π-связь возникает в результате бокового перекрывания орбиталей
6. Даны схемы перекрывания орбиталей:
Выбрать верные ответы:
а) σ-связь; б) π-связь; в) σ- и π-связи
7. Кристаллическую решетку
в) оксид углерода
г) сульфид натрия
б) хлорид натрия
г) оксид кремния
Ответы на вопросы теста:
3. Физ. минутка(гимнастика для глаз).
4. Изучение нового материала(10-12мин).
Учитель организует частично поисковую беседу.Учащийся отвечает на вопросы, работает со схемой строения кристалла металла.
Вспомните общие физические свойства металлов?
С чем связано наличие этих свойств у металлов?
Свойства веществ обусловлены строением их атомов, а от свойств зависит применение веществ.Строение-свойства-применение.
Вспомните строение атомов металлов?
Металлы активно используются в повседневной жизни и в промышленности.Учащийся приводит примеры(свойство-где используется,например ,электропроводность-для изготовления проводов)
Все металлы объединяют свойства общего характера, такие как сравнительно высокая t° плавления, способность к отражению света, высокая тепло- и электропроводность, пластичность. Эти особенности обусловлены существованием в металлах особого вида химической связи — металлической.
Металлическая связь — связь между положительно заряженными ионами металла в кристалле (атомы-ионы), осуществляемая за счет притяжения электронов, свободно перемещающихся в кристалле.
Схема строения кристалла металла

Атомы металлов в соответствии со строением на внешнем энергетическом уровне имеют от 1 до 3 электронов, реже — 4, они слабо связаны с ядром атома, т. к. радиус атомов металлов сравнительно большой. Электроны могут легко отрываться от атомов, в результате чего в кристаллической решетке появляются свободные электроны и атомы-ионы.
В кристаллической решетке существует большая свобода перемещения электронов: одни атомы будут терять электроны, образующиеся ионы могут принимать электроны из «электронного газа».
Свободные электроны общие для большинства ионов металлов кристалла. Этим металлическая связь отличается от ковалентной, где электронная пара общая только для двух атомов. В случае металлической связи электроны равномерно распределены по кристаллу. Этим объясняется пластичность метириалов, т.е. возможность смещения ионов и атомов в любом направлении без нарушения связи. Энергия металлической связи в 3—4 раза меньше энергии ковалентной связи.
В газообразном состоянии (в виде пара) атомы металла связаны также непрочными ковалентными связями. Сравним энергию связи в Н2 - 432 кДж/моль; Li2 - 104; Na2 - 71,1; К2 — 49,6.
В кристалле металла связи намного прочнее, чем в состоянии пара: Li — 159; Na —106.
Металлическая связь совмещает в себе ковалентную связь — есть обобществленные электроны и ионную связь — наблюдается взаимопритяжение обобществленных электронов и ионов-атомов.
5. Закрепление(2-3мин)
Ученик выполняет задание самостоятельно.
Задание: Найдите лишнее:
а) CuCl2, Al, MgS
б) Ca, CO2, Fe
6. Домашнее задание(1-2мин).
Параграф 6, стр 50-54,стр 55 №4,6
7. Подведение итогов урока, рефлексия(1-2мин).
Учитель подводит итоги урока, предлагает ученику оценить самого себя и проанализировать ошибки.С помощью смайликов в скайпе провести рефлексию урока.
Металлическая связь химия 11 класс
Ключевые слова конспекта: Металлическая химическая связь: ион-атомы и электронный газ. Физические свойства металлов и их применение на основе этих свойств. Чёрные и цветные металлы. Сплавы.
Подавляющее число химических элементов периодической системы Д. И. Менделеева относятся к металлам:
- все s-элементы, кроме водорода и гелия;
- все d-элементы;
- p-элементы IIIА-группы, кроме бора;
- некоторые p-элементы IVA- (олово и свинец) и VA- (сурьма и висмут) групп, а также p-элемент VIIА-группы — полоний.
Анализ положения металлов в периодической системе и учёт особенностей строения их атомов позволяет сделать следующие выводы: атомы этих элементов содержат небольшое число электронов на внешнем слое (1—3), имеют сравнительно большой радиус атома и много свободных орбиталей, которые могут легко перекрываться. Поэтому валентные электроны свободно перемещаются от одних атомов, превращая их в ионы, к другим, связывая их.
В простых веществах-металлах осуществляется бесконечный процесс превращения атомов в ионы и обратно, который можно отразить с помощью схемы:Эти же процессы происходят и в металлических сплавах.
Металлическая связь определяет и особое кристаллическое строение металлов и сплавов — металлическую кристаллическую решётку, в узлах которой расположены ион–атомы. Обобществлённые подвижные электроны не принадлежат какому–то определённому атому и способны перемещаться по всему объёму металла. В отсутствие в нём электрического поля эти электроны хаотически движутся и сталкиваются, чаще всего с ионами кристаллической решётки. В 1900 г. немецкий физик Пауль Друде предложил называть совокупность этих электронов электронным газом. Этот электронный газ прочно соединяет, как бы склеивает ионный остов металла. При механических нагрузках или нагреве газ не допускает разрыва металлической решётки, связывая положительные ионы. Поэтому при обработке металлов изменение их формы происходит без разрушения кристаллической решётки, так как её слои легко скользят один по другому.
Металлы электропроводны, потому что под действием электрического поля валентные электроны начинают направленное движение — возникает электрический ток. Металлы — это проводники первого рода, в отличие от растворов электролитов, которые относятся к проводникам второго рода.
Мы вряд ли представляем себе жизнь без электричества, которое поступает в каждый дом, в каждую квартиру по сети электрических проводов своеобразной кровеносной системе современной технической цивилизации. Лучше всего проводят электрический ток серебро, медь, золото, алюминий. Серебро и золото — дорогие металлы. Медь также недешёвый металл. Поэтому кабели линий электропередачи (ЛЭП) делают главным образом из алюминия.
Кстати, прочная опора линии электропередачи тоже металлическая. Прочность — одно из основных свойств большинства металлов, позволяющее использовать их в качестве конструкционных материалов. Один из наиболее прочных и в то же время лёгких металлов — титан. Этот металл и сплавы на его основе — незаменимые конструкционные материалы в самолётостроении и космической технике.
Все металлы теплопроводны. Это свойство, как и нетоксичность некоторых металлов, лежит в основе их применения для производства кухонной посуды: кастрюль, сковородок, противней. Батареи центрального отопления должны быстро нагреваться поступающей в них водой и эффективно отдавать теплоту окружающему воздуху, поэтому их тоже изготавливают из металла.
Самыми теплопроводными металлами являются те, которые хорошо проводят электрический ток: серебро, медь, золото, алюминий.
Металлы обладают металлическим блеском. Блестят они потому, что отражают лучи света, а не пропускают их, как стекло, и не поглощают, как сажа. Окраска большинства металлов серебристо–белая, так как они в равной степени отражают все лучи видимой части спектра. Золото и медь частично поглощают коротковолновое излучение, поэтому обладают окраской от жёлтой до красно–коричневой. Самые блестящие металлы — ртуть, палладий, серебро и алюминий, поэтому отражатели прожекторов, автомобильных фар и фонарей покрывают тонким слоем палладия, алюминия или хрома. Почти все измельчённые в порошок металлы, кроме магния и алюминия, теряют блеск и превращаются в серые или чёрные порошки.
Пластичность металлов в сочетании с блеском делают их незаменимым материалом для художников. Самым пластичным по праву считается золото. Из одного грамма этого металла можно вытянуть нить длиной 2 км или раскатать фольгу толщиной 0,00008 мм. Такой тонкий листочек даже в руки взять невозможно: он сразу прилипнет к коже. Это свойство находит своё применение: тонкими золотыми листочками покрывают купола церквей, скульптуры, деревянную резьбу.
Современная техника и промышленность нуждаются в металлических материалах с самыми разнообразными и трудно сочетаемыми свойствами, которых нет у чистых металлов. На помощь технологам приходят сплавы.
Например, из железосодержащих руд выплавляют чугун — сплав железа с углеродом, в котором массовая доля углерода составляет от 2 до 4%. Чугун — хрупкий материал, изделия из которого получают не ковкой, а литьём, как из пластмасс. Из чугуна изготавливают различные массивные конструкции: корпуса станков, турбин, детали двигателей, ограждения. Настоящее произведение искусства — ограды мостов и решётки парков Санкт–Петербурга.
Если из чугуна удалить излишек углерода и довести его содержание до 1—2%, получится сталь. В отличие от чугуна, она пластична, ковка, имеет гладкую блестящую поверхность. Сталь можно прокатать в тонкий лист или железнодорожный рельс, вытянуть в проволоку, согнуть уголком.
Для придания стали специфических свойств в неё добавляют другие металлы — так называемые легирующие добавки. Используя их, выплавляют сотни разных сортов стали. Нержавеющая сталь содержит хром и никель. В жаропрочную сталь добавляют вольфрам. Молибден придаёт стали твёрдость. Алюминий добавляют в сталь, идущую на изготовление кузовов автомобилей.
Сплав меди с оловом, бронза, обладает хорошими литейными свойствами. Из неё отливают не только колокола и художественные изделия, но и подшипники, вентили, клапаны и детали машин.
Сплав меди с цинком называют латунью. Она прочнее меди, устойчива к атмосферной коррозии. Из латуни изготавливают трубки, шестерни, армейские знаки отличия, химическое оборудование.
Нарядные столовые приборы, посуду, недорогие украшения изготавливают из мельхиора — сплава меди с никелем. Несмотря на то, что никеля в этом сплаве всего 20%, мельхиор лишён медного цвета и по внешнему виду напоминает серебро.
Сплав алюминия с медью, магнием и марганцем называют дуралюмин (дюраль) и используют в самолёто-, судо- и машиностроении.
Конспект урока по химии «Металлическая химическая связь». В учебных целях использованы цитаты из пособия «Химия. 11 класс : учеб, для общеобразоват. организаций : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение». Выберите дальнейшее действие:
§ 6.2. Металлическая связь
Такая химическая связь ненаправленная, ненасыщенная, характеризуется небольшим числом валентных электронов и большим числом свободных орбиталей, что характерно для атомов металлов.
Схема образования металлической связи (М — металл):
Наличием металлической связи обусловлены физические свойства металлов и сплавов: твердость, электрическая проводимость и теплопроводность, ковкость, пластичность, металлический блеск. Вещества с металлической связью имеют металлическую кристаллическую решетку.
Межмолекулярные взаимодействия
Одним из видов межмолекулярных взаимодействий, которые обусловливают притяжение молекул друг к другу в твердом и жидком состояниях, является водородная связь.
Механизм образования водородной связи имеет частично электростатический, частично донорно-акцепторный характер. Примеры межмолекулярной водородной связи:

При наличии такой химической связи даже низкомолекулярные вещества могут быть при обычных условиях жидкостями (этиловый спирт, вода) или легко сжижающимися газами (аммиак, фтороводород).
В биополимерах — белках (вторичная структура) имеется внутримолекулярная водородная связь между карбонильным кислородом и водородом аминогруппы:
Молекулы полинуклеотидов — ДНК представляют собой двойные спирали, в которых две цепи нуклеотидов связаны друг с другом водородными связями. При этом действует принцип комплементарности, т. е. эти связи образуются между определенными парами, состоящими из пуринового и пиримидинового оснований: против аде-нинового нуклеотида (А) располагается тиминовый (Т), а против гуанинового (Г) — цитозиновый (Ц).
Вещества с водородной связью имеют молекулярные кристаллические решетки.
Помимо водородной связи существуют другие силы межмолекулярного взаимодействия, называемые силами Ван-дер-Ваальса (в честь голландского физика). В основе их лежит электростатическое взаимодействие диполей, но в различных веществах механизм возникновения диполей различен.
Если вещества состоят из полярных молекул (НСl, Н2O, СН3ОН, С2Н5Сl), то молекулярные диполи притягиваются друг к другу противоположно заряженными частями.
Этот вид взаимодействия называют ориентационным.
В смесях веществ, состоящих из полярных и неполярных молекул, под влиянием полярной молекулы в неполярной молекуле возникает (индуцируется) диполь. Постоянный диполь и индуцированный диполь притягиваются друг к другу.

Такой вид взаимодействия называют индукционным.
Наконец, в любых молекулах (полярных и неполярных) непрерывно изменяется взаимное положение электронов и ядер, что вызывает появление мгновенных диполей, между которыми также действуют силы притяжения. Эти взаимодействия называют дисперсионными.
Ван-дер-ваальсовы силы недостаточны для образования молекул, но способствуют образованию жидкостей и кристаллов при низких температурах. Они имеются в веществах с атомными, ионными и металлическими кристаллическими решетками, но в этих случаях их вклад в общую энергию связи несущественен.
Металлическая химическая связь

Металлическая связь образуется между атомами в кристалле металла, возникающая за счет перекрытия валентных электронов. Так, что же представляет собой этот вид связи, и в каких соединениях она присутствует?
Что такое металлическая связь?
Металлическая химическая связь существует в металлическом кристалле и в жидком расплавленном состоянии. Ее образуют элементы, атомы которых на внешнем уровне имеют мало электронов (1-3) по сравнению с общим числом внешних, энергетически близких орбиталей.

Рис. 1. Схема образования металлической связи.
Валентные электроны из-за небольшой энергии ионизации слабо удерживаются в атоме. Так, у атома натрия на один валентный электрон (3S1) приходится 9 свободных и энергетически близких орбиталей (одна 3s, три 3p и пять 3d).
Из-за малого значения энергии ионизации валентный электрон слабо удерживается и свободно перемещается не только в пределах 9 своих свободных орбиталей, но при плотной упаковке в кристалле и на свободных орбиталях других атомов, осуществляя связь.
Химическая связь сильно делокализована: электроны обобществлены («электронный газ») и перемещаются по всему куску металла, в целом электронейтрального, между положительно заряженными ионами.
Свободное перемещение электронов по кристаллу объясняет ненаправленность и ненасыщенность связи, а также такие физические свойства металлов, как пластичность, блеск, электро- и теплопроводность.
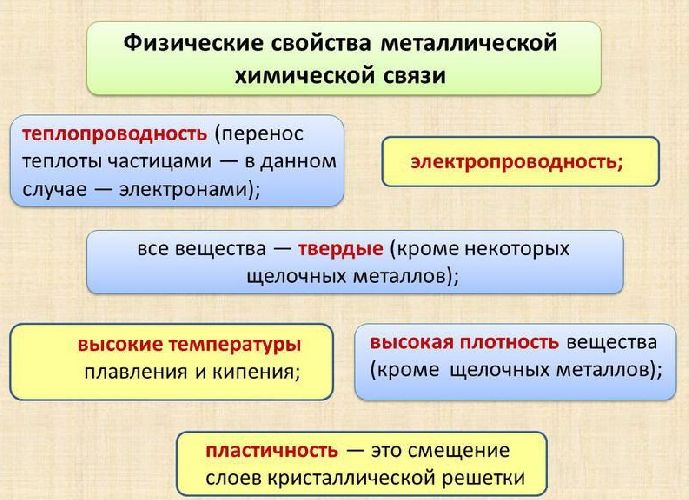
Рис. 2. Свойства металлической химической связи.
Характерные кристаллические решетки
Металлы почти всегда образуют высокосимметричные решетки с плотно приближенными друг к другу атомами. Выделяют три вида кристаллических решеток:
- кубическая объемно центрированная. В таком виде решетки атомы располагаются на вершине куба и один атом в центре объема куба. Такую решетку имеют следующие металлы: натрий, литий, барий, калий, свинец и многие другие.
- кубическая гранецентрированная.
- гексагональная. В таком виде решетки атомы располагаются в вершине и центрах шестигранной оснований призмы, а три атома находятся в средней плоскости этой призмы.
Такой тип кристаллической решетки имеют следующие металлы: магний, кадмий, рений, осмий, рутений, бериллий и многие другие.
Что мы узнали?
Металлическая связь близка по природе к ковалентной, но отличается от нее тем, что обобществление электронов при ее образовании осуществляется сразу многими атомами. В данной статье дается определение понятию «металлическая связь», а также приведены примеры металлической химической связи.
Читайте также:
