Металлами являются все s элементы
МЕТАЛЛЫ — это вещества, обладающие высокой электропроводностью и теплопроводностью, ковкостью, пластичностью и металлическим блеском. Эти характерные свойства металла обусловлены наличием свободно перемещающихся электронов в его кристаллической решетке. Из известных в настоящее время 107 химических элементов 85 относятся к металлам.
Деление всех химических элементов периодической системы Д. И. Менделеева на металлы и неметаллы является условным. Если в периодической таблице провести диагональ через бор и астат, то в главных подгруппах, расположенных справа от диагонали, будут неметаллы, а в главных подгруппах слева от диагонали, побочных подгруппах и в восьмой группе (кроме инертных газов) — металлы. Причем элементы рядом с разделительной линией являются так называемыми металлоидами, т. е. веществами с промежуточными свойствами (металлов и неметаллов) . К ним относятся: бор В, кремний Si, германий Gе, мышьяк Аs, сурьма Sb, теллур Те, полоний Ро.
В соответствии с местом, занимаемым в периодической системе, различают переходные (элементы побочных подгрупп) и непереходные металлы (элементы главных подгрупп) . Металлы главных подгрупп характеризуются тем, что в их атомах происходит последовательное заполнение электронных s- и р-подуровней. В атомах металлов побочных подгрупп происходит достраивание d- и f-подуровней.
Неметаллы - Это химические элементы, которые образуют в свободном виде простые вещества, не обладающие физическими свойствами металлов.
Из известных химических элементов только 22 являются неметаллами. Если провести условную диагональ в переодической системе от берилия к астату, неметаллы окажутся над ней т. е. они находятся в правом верхнем углу.
Атомы неметаллов ( по сравнению с атомами металлов) содержат большее число электронов на внешнем энергетическом уровне, по этому простые вещества - неметаллы обладают, как правило, окислительно - восстановительной деятельностью (кроме фтора и кислорода, которые являются окислителями)
Неметаллы различны по своему агрегатному состоянию. Многие из них газы (кислород, азот, гелий, водород, неон, ксенон, криптон и т. д.). Твердые вещества (фосфор, фтор, йод, бор и т. д.). Бром является жидкостью.
Для неметаллов характерно явление аллотропии. многие из них существуют в виде аллотропных видоизменений, например - фосфор, углерод, кислород, сера и т. д.
Неметаллы имеют различные типы кристаллической решетки - атомную (бор, кремний, углерод в виде алмаза) и молекулярную (йод, белый фосфор, сера кристаллическая)
Физические свойства неметаллов зависят от типа решетки. Вещества с молекулярной решеткой - летучие, легкоплавкие, непрочные, с незначительной растворимостью в воде.
Кароче, там есть такая таблица металлов (такая полосочка, начинаеться Литем (кажись) а заканчиваеться чем-то тяжёлым) .
Основным признаком что эллемент - металл, являеться слабая связь электронов последнего уровня с ядром, они (металлы) могут эти электроны отдавать.
С этим связна причина их электропроводности.
проще говоря, металлы, это те элементы, которые на внешнем электронном уровне имеют 1-3 электрона, т. е. при взаимодействии с другими элементами, , они легко отдают эти электроны. Это 1, 2, 3 группа (гл. подг) перидической системы
А неметаллы, это те элементы, которые имеют почти завершенный электронный уровень, которым не хватает до завершения 1-3 электрона. Это 5,6,7 группа
p-Элементы
К p-элементов периодической системы относятся элементы с валентным p-подуровнем. Эти элементы расположены в III, IV, V, VI, VII, VIII группах, главных подгруппах периодической системы Д.И.Менделеева. В периоде орбитальные радиусы атомов с увеличением атомного номера уменьшаются, а энергия ионизации в целом растет. В подгруппах элементов с увеличением номера элемента, размеры атомов в общем увеличиваются, а энергия ионизации уменьшается.
p-Элементы III группы К p-элементов III группе относятся бор B, алюминий Al, галлий Ga, индий In и таллий Tl. По характеру этих элементов бор является типичным неметаллом, остальные - металлы. В пределах подгруппы прослеживаются резкий переход от неметаллу к металлам. Свойствами и поведением бор подобный кремния, что является результатом диагональной сродства элементов в периодической системе, согласно которой смещение в периоде вправо вызывает усиление неметаллического характера, а вниз по группе - металлического, поэтому аналогичные по свойствам элементы оказываются расположенными диагонально рядом, например Li и Mg, Ber и Al, B и Si.
Электронное строение валентных подуровней атомов p-элементов III группы в основном состоянии имеет вид ns 2 np 1 . В соединениях бор и трехвалентные алюминий, галлий и индий, кроме того, могут образовывать соединения со степенью окисления +1, а для таллия последний является довольно характерным.
Алюминий является одним из самых распространенных элементов природы, бор - достаточно распространенный, галлий, индий а таллий распространены мало и очень рассеяны, поэтому относятся к редким.
p-Элементы IV группы К p-элементов IV группы относятся углерод C, кремний Si, германий Ge, олово Sn и свинец Pb. Общая электронная конфигурация валентных подуровней атомов p-элементов в основном состоянии ns 2 np 2 . Вследствие наличия 2-х неспаренных p-электронов в соединениях они могут проявлять степень окисления +2, причем эта тенденция усиливается в направлении к свинцу. Атомы могут переходить в возбужденное состояние с образованием четырех валентных электронов, что обусловливает возникновение соединений со степенью окисления +4. Это состояние является характерным для углерода и кремния, способность к выявлению степени окисления +4 ослабляется в направлении к свинцу.
Характер изменения физических свойств элементов и соответствующих простых веществ свидетельствует о закономерное ослабление неметаллических и усиление металлических свойств в ряду C - Si - Ge - Pb.
Углерод и кремний - типичные неметаллы, образующие атомные кристаллические решетки с ковалентной связью. Их простые вещества характеризуются высокими твердостью, температурами плавления и кипения. Для германия эти параметры остаются относительно большими, что вместе с хрупкостью характеризует его как алмазоподобный кристалл с ковалентным типом связи. В то же время в германию уже обнаружено некоторое взнос металлической связи. На это указывает заметное уменьшение ширины запрещенной зоны и росту электропроводности. Для олова полупроводниковые свойства сохраняются лишь до температуры 13,2°С, при дальнейшем нагревании олово переходит в металлический состояние. Свинец - металл, который не проявляет полупроводниковых свойств. Возрастание металлических свойств сопровождается постепенным уменьшением энергии ионизации элементов, их электроотрицательности и усилением восстановительной способности простых веществ.
p-Элементы V группы К p-элементов V группы относятся азот N, фосфор P, мышьяк As, стибий Sb и висмут Bi, при чем азот и фосфор являются типичными элементами, а остальные элементы образуют подгруппу мышьяка. Электронная конфигурация валентных подуровней элементов в основном состоянии ns 2 np 3 .
На последнем энергетическом уровне атомы элементов этой подгруппы имеют по три одноэлектронные орбита ли, которые могут образовывать три ковалентные связи. В то же время в связывании могут принимать участие двухэлектронная орбиталь, а в случае элементов, размещенных после азота, - также свободные nd-орбитали. Так, азот способен образовывать четвертая ковалентная связь по донорно-акцепторным механизмом с использованием своей неподеленной пары электронов. Примером может служить ион аммония NH4 + и его многочисленные производные. Максимально возможная валентность азота в его соединениях равна 4, и каждая пара электронов четырех ковалентных связей занимает одну из четырех орбиталей.
В отличие от азота остальное атомов p-элементов V группы имеют nd-подуровень, вакантные орбитали которого способны участвовать в образовании дополнительных ковалентных связей, за счет чего их ковалентность может расти до 5.
Факторы увеличения радиусов атомов и уменьшение электроотрицательности в ряду N - P - As - Sb - Bi влияют на свойства простых веществ и соединений элементов: постепенно уменьшается стойкость неметаллических форм простых веществ и увеличивается устойчивость металоподобных (азот — типичный неметал с большой электронегативностью, а висмут — типичный металл, электроотрицательности которого лишь 1,70), ослабляются кислотные и усиливаются основные свойства бинарных соединений элементов, их гидроксидов и тому подобное.
p-Элементы VI группы К p-элементов VI группы относятся кислород O, сера S, селен Se, теллур Te и полоний Po. На валентных подуровням атомов p-Элементы VI группы размещено 6 электронов: электронная конфигурация валентных подуровней атомов в основном состоянии ns 2 np 4 .
За счет использования неспаренных электронов элементы в своих соединениях обнаруживают характерную для них валентность 2. Она может расти в случае образования донорно-акцепторных связей, в которых принимают участие двухэлектронные орбитали. Например, в кислых водных растворах существуют ионы гидроксонию H3O + , в которых атом кислорода соединен с тремя атомами водорода ковалентными связями. В отличие от кислорода атомы остальных p-элементов VI группы имеют свободный nd-подуровень, орбитали которого также способны принимать участие в образовании химических связей, в результате чего валентность серы, селена, теллура и полония может возрастать до 6.
Для атомов p-элементов VI группы характерно присоединение электронов для завершения np-подуровня и образования устойчивой электронной конфигурации следующего благородного газа ns 2 np 6 . Это определяет характерный для них степень окисления -2 в соединениях с менее электронегативными элементами.
С переходом к полонию наблюдается характерное для групп p-элементов уменьшение устойчивости высшей степени окисления. Для полония соединения со степенью окисления +6 очень неустойчивы. Это обусловлено сильным ростом энергетической разницы между ns-и np-подуровнями, что затрудняет участие ns-электронов в образовании химических связей.
В ряду O - S - Se - Te - Po возрастают радиусы атомов, что характерно для групп p-элементов, уменьшение энергии их ионизации и электроотрицательности. Ослабление неметаллических свойств элементов проявляется также в уменьшении стойкости неметаллических форм простых веществ и в росте устойчивости металлических. Это приводит к тому, что в отличие от предыдущих элементов подгруппы полоний уже имеет металлическую кристаллическую решетку и относится к металлам.
p-Элементы VII группы - галогены К p-элементов VII группы относятся фтор F, хлор Cl, бром Br, йод I и астату At. Элементы имеют общее название галогены. Электронная конфигурация валентных подуровней атомов p-элементов VII группы соответствует формуле ns 2 np 5 .
На последнем энергетическом уровне атомы элементов имеют по семь электронов, один из которых является неспаренным. Этим объясняется сходство их свойств. Наличие одноэлектронной орбитали определяет характерную для всех элементов валентность 1. Одновременно галогены (кроме фтора) имеют вакантный nd-подуровень, орбитали которого также могут участвовать в образовании химических связей и увеличивать валентность атомов элементов до 7.
Молекулы галогенов двухатомные, неполярные. Все галогены являются неметаллами. В ряду F - Cl - Br - I - At ослабляются признаки неметаличности: фтор — самый типичный элемент-неметала, а астату обнаруживает некоторые свойства элемента-металла.
В пределах своих периодов галогены характеризуются малыми атомными радиусами, что обуславливает их высокие электроотрицательности и сродство к электрону, поэтому для них в сложных веществах самым стойким является степень окисления -1.
p-Элементы VIII группы К p-элементов VIII группы относятся гелий He, неон Ne, аргон Ar, криптон Kr, ксенон Xe и радон Rh, которые составляют главную подгруппу. Атомы этих элементов имеют завершенные внешние электронные слои, поэтому электронная конфигурация валентных подуровней их атомов в основном состоянии имеет вид 1s 2 (Не) и ns 2 np 6 (остальные элементы). Благодаря очень высокой устойчивости электронных конфигураций они в целом характеризуются большими значениями энергий ионизации и химической инертностью, поэтому их называют благородными (инертными) газами. В свободном состоянии они существуют в виде атомов (одноатомных молекул). Атомы гелия (1s 2 ), неона (2s 2 2p 6 ) и аргона (3s 2 3p 6 ) имеют особо устойчивую электронную структуру, поэтому соединения валентного типа для них неизвестны.
Криптон (4s 2 4p 6 ), ксенон (5s 2 5p 6 ) и радон (6s 2 6p 6 ) отличаются от предыдущих благородных газов большими размерами атомов и, соответственно, меньшими энергиями ионизации. Они способны образовывать соединения, которые зачастую имеют низкую стойкость.
Активные металлы

Металлы, легко вступающие в реакции, называются активными металлами. К ним относятся щелочные, щелочноземельные металлы и алюминий.
Положение в таблице Менделеева
Металлические свойства элементов ослабевают слева направо в периодической таблице Менделеева. Поэтому наиболее активными считаются элементы I и II групп.
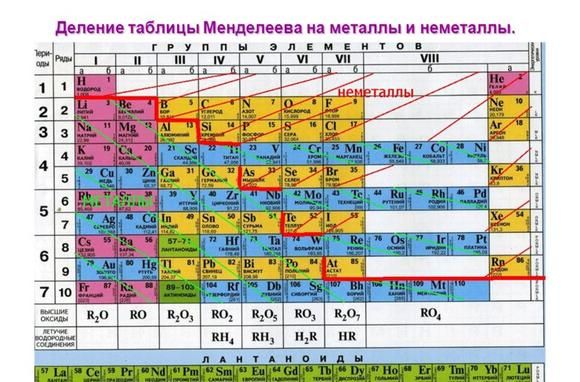
Рис. 1. Активные металлы в таблице Менделеева.
Все металлы являются восстановителями и легко расстаются с электронами на внешнем энергетическом уровне. У активных металлов всего один-два валентных электрона. При этом металлические свойства усиливаются сверху вниз с возрастанием количества энергетических уровней, т.к. чем дальше электрон находится от ядра атома, тем легче ему отделиться.
Наиболее активными считаются щелочные металлы:
- литий;
- натрий;
- калий;
- рубидий;
- цезий;
- франций.
К щелочноземельным металлам относятся:
- бериллий;
- магний;
- кальций;
- стронций;
- барий;
- радий.
Узнать степень активности металла можно по электрохимическому ряду напряжений металлов. Чем левее от водорода расположен элемент, тем более он активен. Металлы, стоящие справа от водорода, малоактивны и могут взаимодействовать только с концентрированными кислотами.

Рис. 2. Электрохимический ряд напряжений металлов.
К списку активных металлов в химии также относят алюминий, расположенный в III группе и стоящий левее водорода. Однако алюминий находится на границе активных и среднеактивных металлов и не реагирует с некоторыми веществами при обычных условиях.
Свойства
Активные металлы отличаются мягкостью (можно разрезать ножом), лёгкостью, невысокой температурой плавления.
Основные химические свойства металлов представлены в таблице.
Реакция
Уравнение
Исключение
Щелочные металлы самовозгораются на воздухе, взаимодействуя с кислородом
Литий реагирует с кислородом только при высокой температуре
Щелочноземельные металлы и алюминий на воздухе образуют оксидные плёнки, а при нагревании самовозгораются
Реагируют с простыми веществами, образуя соли
Алюминий не вступает в реакцию с водородом
Бурно реагируют с водой, образуя щёлочи и водород
Реакция с литием протекает медленно. Алюминий реагирует с водой только после удаления оксидной плёнки
Реагируют с кислотами, образуя соли
Взаимодействуют с растворами солей, сначала реагируя с водой, а затем с солью
Активные металлы легко вступают в реакции, поэтому в природе находятся только в составе смесей – минералов, горных пород.

Рис. 3. Минералы и чистые металлы.
Что мы узнали?
К активным металлам относятся элементы I и II групп – щелочные и щелочноземельные металлы, а также алюминий. Их активность обусловлена строением атома – немногочисленные электроны легко отделяются от внешнего энергетического уровня. Это мягкие лёгкие металлы, быстро вступающие в реакцию с простыми и сложными веществами, образуя оксиды, гидроксиды, соли. Алюминий находится ближе к водороду и для его реакции с веществами требуются дополнительные условия – высокие температуры, разрушение оксидной плёнки.
Металлы

К металлам относится большая часть элементов периодической системы – 82 химических элементов. Какими свойствами они обладают, и чем отличаются от неметаллов?
Общая характеристика
Металлами называют группу элементов, в виде простых веществ, которые обладают металлическими свойствами (пластичность, ковкость, блеск, электронная проводимость и т. д.)
Основное отличие элементов-металлов – они обладают только восстановительными свойствами, а в реакциях могут только окисляться. В соединениях они могут иметь только положительные степени окисления как в элементарных положительно заряженных ионах, так и в сложных ионах, где они образуют положительные центры.
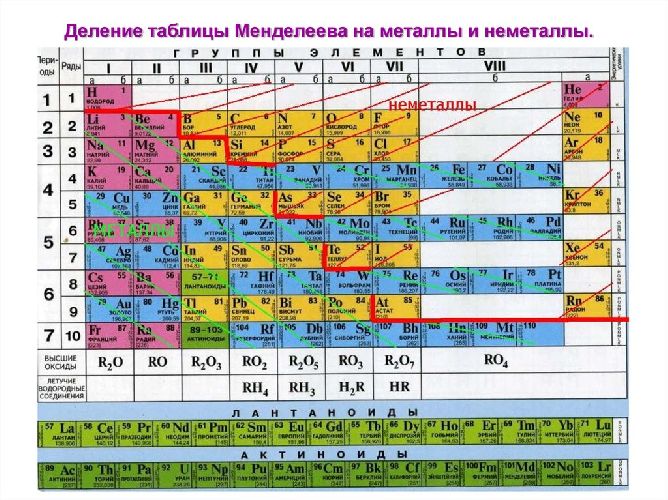
Рис. 1. Список металлов.
Как правило, на внешнем уровне элементов металлов находится небольшое число электронов (1-3), значения электроотрицательности невысокие. К металлам относятся все s-элементы (кроме водорода и гелия), d- и f-элементы, а также p-элементы под чертой бор-астат. Для типичных металлов характерен большой размер атомов, что способствует легкости отдачи валентных электронов. Образующиеся положительные ионы устойчивы, так как имеют завершенную внешнюю электронную оболочку.
Физические и химические свойства
Все металлы, кроме ртути, при нормальных условиях в виде простых веществ находятся в твердом агрегатном состоянии и образуют металлическую кристаллическую решетку.

Рис. 2. Металлы в таблице Д.И. Менделеева.
Таблица «Металлы»
В следующей таблицы представлены группы основных металлов:
| Группа металлов | Металл |
| Щелочные | литий, натрий, калий и т.д. |
| Щелочноземельные | кальций, стронций, барий и т.д. |
| Переходные | уран, титан, железо, платина и т.д. |
| постпереходные | алюминий, свинец, олово и т.д. |
| Тугоплавкие | молибден, вольфрам |
| Цветные | медь, титан, магний и т.д. |
| Благородные | золото, серебро и т.д. |
Металлы пластичны и ковки, особенно если на внешнем электронном уровне атомов по одному электрону: слои атомов перемещаются относительно друг друга без разрушения кристаллической решетки (щелочные металлы, медь, серебро, золото). В атомах непластичных хрупких металлов хрома и марганца – большое число валентных электронов.
Плотность, твердость, температура плавления металлов изменяются в широком диапазоне и зависят от атомной массы, строения атома и геометрии кристаллической решетки. Самый легкий металл – литий (плотность 0,53 г/см 3 ), самый тяжелый – осмий (плотность 22,5 г/см 3 ). Металлы с плотностью больше 5 г/см 3 относят к тяжелым, меньше 5 г/см 3 – к легким металлам.
Самая низкая температура плавления у ртути (-39 градусов по Цельсию), самый тугоплавкий металл – вольфрам (температура плавления 3410 градусов по Цельсию.) Энергия атомизации вольфрама составляет 836 кДж/моль, а температура кипения его 5930 градусов.
Металлы вступают в реакцию как с простыми, так и со сложными веществами. Как типичные восстановители металлы реагируют почти со всеми неметаллами-окислителями (кислород, сера, азот и т. д.):
Также металлы реагируют с такими сложными веществами, как оксиды и гидроксиды, разбавленные растворы кислот, с растворенными в воде щелочами.
В пределах одного и того же периода металлические свойства ослабевают, а неметаллические усиливаются; в пределах одной и той же группы (в главной подгруппе) металлические свойства усиливаются, а неметаллические ослабевают

Рис. 3. Металлы главных подгрупп.
Нахождение металлов и способы их получения
Самый распространенный на земле элемент-металл – алюминий. За ним следуют железо, кальций, натрий.
Некоторые металлы встречаются в природе в самородном состоянии (золото, ртуть, платина), но в основном они находятся в природе в виде оксидов и солей.
Получение металлов происходит с помощью металлургии (получение из руд), пирометаллургии (получение с помощью реакции восстановления при высокой температуре), гидрометаллургии (извлечение из руд в виде растворимых соединений), электрометаллургии (получение металлов электролизом расплавов и растворов их соединений).
Металлы – вещества, которые обладают высокой электро- и теплопроводностью, ковкостью, пластичностью и металлическим блеском. В данной статье по химии 9 класса рассматриваются их физические и химические свойства, формулы класса металлов, а также способы получения.
Химия s-, р-элементов

В этом уроке изучается положение s-, р-элементов в Периодической системе химических элементов Д. И. Менделеева, особенности строения атомов и их свойства.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Химия s-, р-элементов"
Элементы в периодической системе Менделеева делятся на эс, пэ, дэ и эф-элементы. Это разделение осуществляется на основе того, сколько энэргетических уровней имеет электронная оболочка атома и каким уровнем заканчивается заполнение электронной оболочки электронами.
К s-элементам относятся элементы первой А группы – щелочные металлы. Электронная формула щелочных металлов эн-эс-один.
Поэтому для них характерна степень окисления плюс один. Элементы первой А группы обладают сходными свойствами из-за сходного строения электронной оболочки.
Но при увеличении радиуса в группе от лития к францию связь валентного электрона с ядром ослабевает и уменьшается энэргия ионизации. Атомы щелочных металлов легко отдают свой валентный электрон, поэтому они являются сильными восстановителями.
Из-за высокой химической активности щелочные металлы в природе встречаются только в виде соединений. Простые вещества, образованные элементами первой А группы, представляют собой серебристо-белые металлы, которые легко режутся ножом. Все щелочные металлы относятся к лёгким и легкоплавким металлам.
К эс-элементам относятся также элементы второй A группы, из них кальций, стронций, барий называют щелочноземельными металлами. На внешнем энэргетическом уровне у них по два электрона. Из-за своей высокой химической активности они встречаются в природе только в виде соединений. Металлы второй A группы имеют металлический блеск с различными оттенками: от серого до серебристого, температура плавления их выше, чем у щелочных металлов, плотность их меньше пяти грамм на сантиметр кубический, поэтому их относят к легкоплавким металлам.
К p-элементам относятся 30 элементов от третьей А до восьмой А группы периодической системы; пэ-элементы расположены во втором и третьем малых периодах, а также в четвертом, пятом и шестом больших периодах.
Элементы третьей А-группы имеют один электрон на пэ-орбитали. Начиная с четвёртой А и заканчивая восьмой А группой наблюдается заполнение пэ-подуровня до шести электронов. Общая электронная формула пэ-элементов эн-эс-два-эн-пэ-шесть.
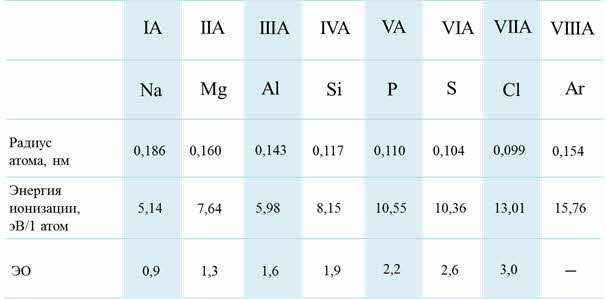
В периодах при увеличении заряда ядра атомные радиусы и ионные радиусы пэ-элементов уменьшаются, энэргия ионизации и сродства к электрону возрастают, электроотрицательность увеличивается, неметаллические свойства элементов усиливаются.
Изменение свойств по периодам
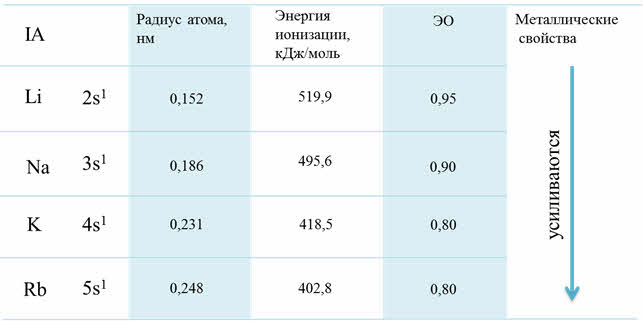
В группах сверху вниз радиусы атомов увеличиваются, энэргия ионизации и сродства к электрону уменьшается, электроотрицательность уменьшается, усиливаются металлические свойства, а неметаллические свойства ослабевают.
Изменение свойств по группам
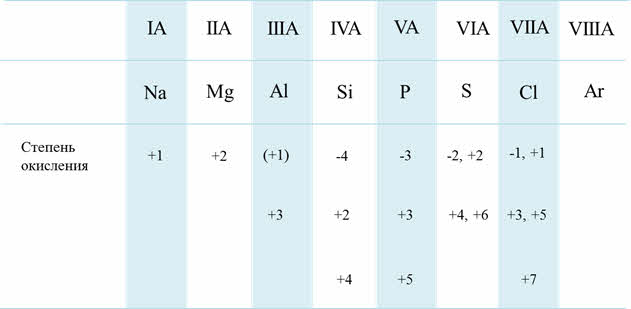
Кроме этого, по периоду с увеличением порядкового номера возрастает высшая степень окисления, а также возможность степеней окисления. Например, у кремния возможны такие степени окисления, как минус четыре, плюс два, плюс четыре; а у хлора – минус один, плюс один, плюс три, плюс пять, плюс семь.
Изменение СО по периоду
Если рассмотреть от первой до третьей А группы, то можно увидеть, что в группе сверху вниз увеличиваются металлические свойства, а также возрастает активность металлов. Например, во второй A группе металлические свойства и активность бария выражены гораздо сильнее, чем у магния.
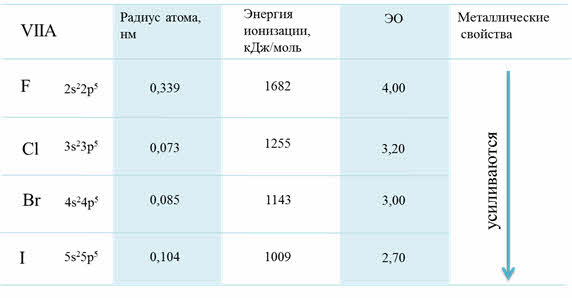
Рассмотрим для примера седьмую A группу – семейство галогенов. В этой группе сверху вниз радиус атома увеличивается, энергия ионизации уменьшается и электроотрицательность также уменьшается.
Возрастание активности металла
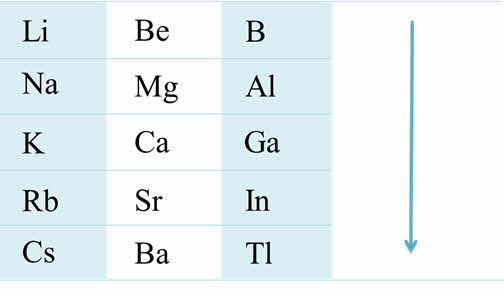
Если рассмотреть группы от четвёртой А до седьмой А, то можно проследить, что в этих группах сверху вниз уменьшается активность неметаллов, уменьшается стабильность соединений в высшей степени окисления, возрастает стабильность соединений в более низкой степени окисления. Например, в пятой A группе висмут проявляет металлические свойства и для него, в отличие от фосфора, наиболее характерна степень окисления плюс три.
Изменение свойств в VIIA группе
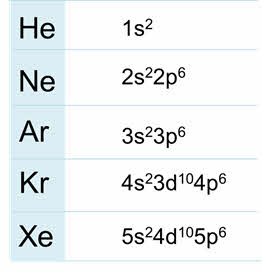
Благородные газы – элементы восьмой A группы. У них завершён внешний энэргетический уровень, причём у гелия два электрона на внешнем уровне, он относится к эс-элементам, а все остальные благородные газы относятся к пэ-элементам.

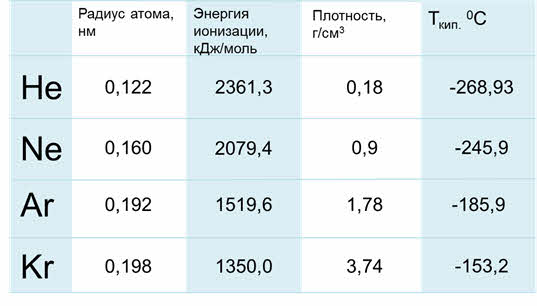
Радиус атомов у благородных газов увеличиваются сверху вниз, энергия ионизации уменьшается, плотность сверху вниз увеличивается, также как температура кипения.
Таким образом, к эс-элементам относятся элементы первой A и второй A группы, к пэ-элементам относятся элементы от третьей до восьмой А группы. Отличительной особенность этих элементов является то, что их валентные электроны расположены на эс- или пэ-подуровне.
По периоду слева направо у них наблюдается уменьшение радиуса атомов, увеличивается энергия ионизации и энергия сродства к электрону, электроотрицательность увеличивается, металлические свойства ослабевают, а усиливаются неметаллические.
В группах сверху вниз наблюдается иная закономерность: радиусы атомов увеличиваются, уменьшается энергия ионизации и энергия сродства к электрону, электроотрицательность уменьшается, металлические свойства усиливаются, а неметаллические ослабевают.
Читайте также:
