Металл tin что это
Олово (латинский – stannum, английский - tin) – биржевой товар из группы цветных металлов. Цену онлайн олова формируют торги на ведущих товарных и фьючерсных биржах мира.
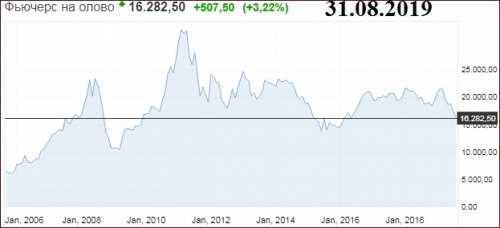
График онлайн олова
Олово торгуется фактическим товаром на товарных биржах и внебиржевых площадках, также доступно к инвестированию через фьючерсы на фьючерсных и универсальных площадках. У олова отсутствует инвестиционная привлекательность сродни драгоценным металлам –золоту, серебру, платины и палладия. Инвестиции в олово не рассматриваются трейдерами альтернативой вложению в акции, облигации, паи ПИФов и прочие ценные бумаги. За оловом на рынок приходят представители крупного производственного бизнеса, которым металл необходим для производства различной продукции.
При этом у трейдеров есть отличная возможность получать профит на операциях с оловом. Для этого биржи предлагают такие финансовые инструменты, как фьючерсы, опционы и CFD. Улавливая трендовые изменения, можно получать прибыль на коротких продажах.
Биржевая единица измерения олова
На биржевых площадках олово продают в долларах США (USD) за тонну или же оплата происходит в валюте страны нахождения биржи, например, в юанях (CNY) на Даляньской товарной бирже и т.д. Олово не классифицируется в пробах, как драгоценные металлы. Но так как покупатель должен заранее понимать, какого качества товар приобретает, биржи выставляют вполне конкретные требования, расписывая в деталях чистоту и прочие свойства олова.
Обычный размер биржевого контракта по олову – 5 тонн.
Цена олова
На стоимость олова влияют такие факторы:
- объемы производства;
- рыночный спрос;
- ситуация на бирже (спекулятивные сделки, влияние новостного фона и др.);
- сроки поставок по фьючерсу (фьючерсные контракты с длительным сроком поставки часто имеют дисконт).
Примечательно, что цена олова быстро восстановилась после глобального кризиса 2008 года. Тогда на пике цена тонны металла доходила до $23,5 тыс., после чего рухнула к $10,5 тыс. Однако уже в 2011 году олово подскочило до $32,4 тыс. Далее цена опустилась, но до середины 2014 года пребывала на уровне пикового значения докризисного 2008 года. На 31.08.2019 года олово торгуется по цене $16,3 тыс. за тонну.
Динамика изменения стоимости олова приведена на графике ниже.
Инвестирование в олово
Трейдерам и инвесторам для инвестирования в олово доступны:
Сфера применения олова
Олово нетоксично, поэтому широко применяется в производстве металлической продукции, использующейся в быту. Также олово применяется для получения сплавов. Самые известные сплавы – бронза и пьютер. Из второго изготавливают посуду, и на эти цели уходит ровно треть всего добываемого металла.
33% всего олова уходит на создание пьютера – сплава, из которого изготавливают металлическую посуду.
Лидеры производства олова по странам
Лидером по добыче олова является Китай, в первой тройке также Индонезия и Перу. В России добыча этого металла значительно уступает лидерам.
ТОП-10 стран-производителей олова (за 2016 год):
- Китай – 125 тыс. тонн.
- Индонезия – 84 тыс. тонн.
- Перу – 23,7 тыс. тонн.
- Боливия – 18 тыс. тонн.
- Бразилия – 13 тыс. тонн.
- Мьянма – 11 тыс. тонн.
- Австралия – 6,1 тыс. тонн.
- Вьетнам – 5,4 тыс. тонн.
- Малайзия – 3,5 тыс. тонн.
- Конго – 3,0 тыс. тонн.
Всего – 296 тыс. тонн.
Компании-лидеры производства олова
ТОП-10 компаний-производителей олова (за 2016 год):
- Yunnan Tin, Китай – 76 тыс. тонн. Акции торгуются на Шэнчьженьской фондовой бирже.
- Malaysia Smelting Corp. Bhd, Малайзия – 26,8 тыс. тонн. Акции на Малайзийской фондовой бирже.
- Timah, Индонезия – 23,76 тыс. тонн. Акции на Индонезийской фондовой бирже.
- Yunnan Chengfeng, Китай – 20,1 тыс. тонн.
- Minsur, Перу – 19,57 тыс. тонн. Акции на Фондовой бирже Лимы.
- Empresa Metalurgica Vinto, Боливия – 13,11 тыс. тонн.
- Thaisarco, Таиланд – 11,09 тыс. тонн.
- Guangxi China Tin, Китай – 10,98 тыс. тонн.
- Metallo-Chimique, Бельгия – 8,54 тыс. тонн.
- Gejiu Zili Metallurgy, Китай – 8,2 тыс. тонн.
Единственной в России специализированной компанией по добыче олова является "Русское олово". Это акционерная компания закрытого типа – трейдеры лишены возможности торговать ее акциями на биржевых площадках.
Крупнейшие экспортеры олова
Ведущим экспортером олова является Мьянма, на долю которой приходится почти 64% всего мирового экспорта. Россия входит в первую десятку, но ее доля минимальна – всего 0,7%.
ТОП-10 экспортеров олова (в долларах США на 2018 год):
- Мьянма - $738,6 млн. (63,9% от всего импорта).
- Австралия - $125,4 млн. (10,9%).
- Конго – $108,8 млн. (9,4%).
- Демократическая республика Конго - $61,2 млн. (5,3%).
- Руанда - $61,1 млн. (5,3%).
- Бразилия - $22,9 млн. (2,0%).
- Россия - $8,4 млн. (0,7%).
- Лаос - $6,9 млн. (0,6%).
- Бурунди - $4,2 млн. (0,4%).
- Португалия - $3,4 млн. (0,3%).
Крупнейшие импортеры олова
Крупнейшими покупателями олова являются Китай и Малайзия. На эти две страны приходится 85% всего экспортного олова.
ТОП-5 импортеров олова:
- Китай – $371 млн. или 48% всего мирового импорта.
- Малайзия – $281 млн. (37%).
- Таиланд – $50,3 млн. (6,5%).
- Сингапур – $19 млн. (2,5%).
- Вьетнам – $13,7 млн. (1,8%).
Крупнейшие биржи по продаже олова и фьючерсов олова, на которых формируется его цена
Олово продают физическим товаром или фьючерсами и другими инструментами (например, бинарными опционами).
Цену формируют ведущие товарные биржи:
- (США) – крупнейшая товарно-сырьевая биржа мира, (Великобритания) – ведущая мировая биржа по цветным и черным металлам, товарная биржа NYMEX (США), (США), , DCE (Китай),
- Multi Commodity Exchange, MCX (Индия).
ТОП бирж РФ торгующих фьючерсами металлов:
CFD на олово
Трейдеры и инвесторы зарабатывают на олове и других металлах с помощью CFD (Contract For Difference), не покупая при этом физический товар. Как это возможно? CFD - покупка не нефти Brent, WTI, природного (NG) или сжиженного (LNG) газа, никеля, меди, алюминия, цинка, свинца и др. CFD - это "контракт на разницу цен". К тому же брокеры предлагают кредитное плечо, благодаря которому можно торговать, не уплачивая полную стоимость лота.

Финансовые регуляторы на фьючерс и CFD олова
Торговать фьючерсами, опционами и CFD цинка разрешается после получения лицензии государственного финансового регулятора. Все маркет-мейкеры, маклеры и биржи должны иметь такое разрешение.
Национальные финансовые регуляторы: FINMA - в Швейцарии, CySEC - на Кипре, FCA - Великобритании, FI - в Швеции, PFSA - в Польше, CNMV в - Испании, ACPR и AMF - во Франции, BaFin - в Германии, FSAEE - в Эстонии, FCMC - в Латвии, MiFID (для всех стран Евросоюза), CSRC - в Китае, SEBI - в Индии, SFC - в Гонконге, MAS - в Сингапуре, FSCL - в Новой Зеландии, IFSC в Белизе, FSC - на Маврикии, FSB - в ЮАР, Botswana IFSC - в Ботсване, ASIC - в Австралии, Банк России, ФСФР - в России, ISA - в Израиле, CMB - в Турции, Dubai FSA - в Дубае, ОАЭ, Tadawul - в Саудовской Аравии, FinCom - в Китае, AFSA - в Казахстане, SET - в Таиланде, НКЦПФР - в Украине, CFTC, NFA, SEC - в США.
А как вы оцениваете перспективы инвестирования в олово: насколько, по вашему мнению, привлекателен рынок? Оставьте, пожалуйста, свой отзыв в комментариях и поделитесь статьей в соцсетях.
С уважением, wiki Masterforex-V - курсы бесплатного (школьного) и профессионального обученияMasterforex-V для работы на форексе, фондовых, фьючерсных, товарных и криптовалютных биржах.
Нитрид титана
Нитрид титана - бинарное химическое соединение титана с азотом. Представляет собой фазу внедрения с широкой областью гомогенности, которая составляет от 14,8 до 22,6 масс. % азота, что можно обозначить брутто-формулами от TiN0,60 до TiN1,0 соответственно [1] .
Содержание
Физические свойства
Нитрид титана представляет собой порошок желто-коричневого цвета, а в компактном состоянии приобретает золотистую окраску. Имеет кубическую гранецентрированную решётку типа NaCl, пространственная группа Fm3m, с периодом а = 0,4235 нм.
- 40 мкОм∙см 9,35∙10 −6 1/K (25-1100 °C)
- Микротвердость 2050 кг/мм 2 25600 кг/мм 2 [2]
Получение
Нитрид титана можно получить одним из следующих способов [1] [3] .
- Непосредственным насыщением титана азотом:
- Взаимодействием тетрахлорида титана со смесью азота и водорода:
- Разложением аминохлоридов титана:
- Восстановлением оксида титанауглеродом в среде азота:
- Синтезом в плазме:
- :
Химические свойства
Нитрид титана устойчив к окислению на воздухе до 700—800 °C, при этих же температурах сгорает в токе кислорода:
При нагреве до 1200 °C в среде водорода или в смеси азота и водорода нитрид титана является инертным веществом.
Нитрид титана стехиометрического состава проявляет стойкость к CO, но медленно реагирует с CO2 по реакции:
Реагирует на холоде с фтором:
Хлор не взаимодействует с нитридом титана до 270 °C, но реагирует с ним при температурах от 300 °C до 400 °C:
При температуре 1300 °C хлороводород взаимодействует с TiN с образованием газообразных хлоридов титана и азота с водородом.
Взаимодействует с дицианом образуя карбонитрид титана [3] :
При комнатной температуре, по отношению к серной, соляной, фосфорной, хлорной кислотам, а также к смесям хлорной и соляной, щавелевой и серной кислот, нитрид титана является стойким соединением. Кипящие кислоты (соляная, серная и хлорная) слабо взаимодействуют с TiN. На холоде малоустойчив против растворов гидроксида натрия. Взаимодействует с азотной кислотой, а в присутствии сильных окислителей растворяется плавиковой кислотой.
Нитрид титана является стойким к действию расплавов олова, висмута, свинца, кадмия и цинка. При высокой температуре сильно разъедается окислами железа (Fe2O3), марганца (MnO), кремния (SiO2) и стеклом [1] .
Применение


Применяется как жаропрочный материал, в частности из него делают тигли для бескислородной плавки металлов. В металлургии это соединение встречается в виде относительно крупных (единицы и десятки микрон) неметаллических включений в сталях, легированных титаном. Такие включения имеют, как правило, форму квадратов и прямоугольников, их легко идентифицировать методом металлографического анализа. Такие крупные частицы нитрида титана, образующиеся из расплава, приводят к ухудшению качества литого металла. Нитрид титана используется для создания износостойких покрытий (в частности, для зубных протезов жёлтого «под золото» цвета), используется в микроэлектронике в качестве диффузионного барьера совместно с медной металлизацией и др.
Нитрид титана применяется ещё и как износостойкое и декоративное покрытие. Изделия, покрытые им, по внешнему виду не отличаются от золота и могут иметь различные оттенки, в зависимости от соотношения металла и азота в соединении. Нанесение нитрида титана производится в специальных камерах термодиффузионным методом. При высокой температуре титан и азот реагируют вблизи поверхности покрываемого изделия и диффундируют в саму структуру металла.
Титан (элемент)
Тита́н (лат. Titanium ; обозначается символом Ti) — элемент побочной подгруппы четвёртой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 22. Простое вещество титан (CAS-номер: 7440-32-6) — лёгкий металл серебристо-белого цвета. Существует в двух кристаллических модификациях: α-Ti с гексагональной плотноупакованной решёткой, β-Ti с кубической объёмно-центрированной упаковкой, температура полиморфного превращения α↔β 883 °C [1] . Температура плавления 1660±20 °C [2] .
История
Открытие TiO2 сделали практически одновременно и независимо друг от друга англичанин У. Грегор и немецкий химик М. Г. Клапрот. У. Грегор, исследуя состав магнитного железистого песка (Крид, Корнуолл, Англия, 1791), выделил новую «землю» (оксид) неизвестного металла, которую назвал менакеновой. В 1795 г. немецкий химик Клапрот открыл в минерале рутиле новый элемент и назвал его титаном. Спустя два года Клапрот установил, что рутил и менакеновая земля — оксиды одного и того же элемента, за которым и осталось название «титан», предложенное Клапротом. Через 10 лет открытие титана состоялось в третий раз. Французский учёный Л. Воклен обнаружил титан в анатазе и доказал, что рутил и анатаз — идентичные оксиды титана.
Первый образец металлического титана получил в 1825 году Й. Я. Берцелиус. Из-за высокой химической активности титана и сложности его очистки чистый образец Ti получили голландцы А. ван Аркел и И. де Бур в 1925 году термическим разложением паров иодида титана TiI4.
Происхождение названия
Металл получил своё название в честь титанов, персонажей древнегреческой мифологии, детей Геи. Название элементу дал Мартин Клапрот в соответствии со своими взглядами на химическую номенклатуру в противовес французской химической школе, где элемент старались называть по его химическим свойствам. Поскольку немецкий исследователь сам отметил невозможность определения свойств нового элемента только по его оксиду, он подобрал для него имя из мифологии, по аналогии с открытым им ранее ураном.
Однако согласно другой версии, публиковавшейся [источник не указан 312 дней] в журнале «Техника-Молодежи» в конце 1980-х, новооткрытый металл обязан своим именем не могучим титанам из древнегреческих мифов, а Титании — королеве фей в германской мифологии (жена Оберона в шекспировском «Сне в летнюю ночь»). Такое название связано с необычайной «лёгкостью» (малой плотностью) металла.
Нахождение в природе
Титан находится на 10-м месте по распространённости в природе. Содержание в земной коре 0,57 % по массе, в морской воде 0,001 мг/л [3] . В ультраосновных породах 300 г/т, в основных — 9 кг/т, в кислых 2,3 кг/т, в глинах и сланцах 4,5 кг/т. В земной коре титан почти всегда четырёхвалентен и присутствует только в кислородных соединениях. В свободном виде не встречается. Титан в условиях выветривания и осаждения имеет геохимическое сродство с Al2O3. Он концентрируется в бокситах коры выветривания и в морских глинистых осадках. Перенос титана осуществляется в виде механических обломков минералов и в виде коллоидов. До 30 % TiO2 по весу накапливается в некоторых глинах. Минералы титана устойчивы к выветриванию и образуют крупные концентрации в россыпях. Известно более 100 минералов, содержащих титан. Важнейшие из них: рутил TiO2, ильменит FeTiO3, титаномагнетит FeTiO3 + Fe3O4, перовскит CaTiO3, титанит CaTiSiO5. Различают коренные руды титана — ильменит-титаномагнетитовые и россыпные — рутил-ильменит-цирконовые.
Месторождения
Месторождения титана находятся на территории ЮАР, России, Украины, Китая, Японии, Австралии, Индии, Цейлона, Бразилии, Южной Кореи, Казахстана [4] .
Запасы и добыча
На 2002 год, 90 % добываемого титана использовалось на производство диоксида титана TiO2. Мировое производство диоксида титана составляло 4,5 млн т. в год. Подтверждённые запасы диоксида титана (без России) составляют около 800 млн т. На 2006 год, по оценке Геологической службы США, в пересчёте на диоксид титана и без учёта России, запасы ильменитовых руд составляют 603—673 млн т., а рутиловых — 49.7—52.7 млн т [5] . Таким образом, при нынешних темпах добычи мировых разведанных запасов титана (без учёта России) хватит более, чем на 150 лет.
Россия обладает вторыми в мире, после Китая, запасами титана. Минерально-сырьевую базу титана России составляют 20 месторождений (из них 11 коренных и 9 россыпных), достаточно равномерно рассредоточенных по территории страны. Самое крупное из разведанных месторождений (Ярегское) находится в 25 км от города Ухта (Республика Коми). Запасы месторождения оцениваются в 2 миллиарда тонн руды со средним содержанием диоксида титана около 10 % [6] .
Крупнейший в мире производитель титана — российская компания «ВСМПО-АВИСМА» [7] .
Брусок кристаллического титана (чистота 99,995 %, вес ≈283 г, длина ≈14 см, диаметр ≈25 мм), изготовленный на заводе «Уралредмет» иодидным методом ван Аркеля и де Бура
Как правило, исходным материалом для производства титана и его соединений служит диоксид титана со сравнительно небольшим количеством примесей. В частности, это может быть рутиловый концентрат, получаемый при обогащении титановых руд. Однако запасы рутила в мире весьма ограничены, и чаще применяют так называемый синтетический рутил или титановый шлак, получаемые при переработке ильменитовых концентратов. Для получения титанового шлака ильменитовый концентрат восстанавливают в электродуговой печи, при этом железо отделяется в металлическую фазу (чугун), а не восстановленные оксиды титана и примесей образуют шлаковую фазу. Богатый шлак перерабатывают хлоридным или сернокислотным способом.
Концентрат титановых руд подвергают сернокислотной или пирометаллургической переработке. Продукт сернокислотной обработки — порошок диоксида титана TiO2. Пирометаллургическим методом руду спекают с коксом и обрабатывают хлором, получая пары тетрахлорида титана TiCl4:
Образующиеся пары TiCl4 при 850 °C восстанавливают магнием:
Полученную титановую «губку» переплавляют и очищают. Рафинируют титан иодидным способом или электролизом, выделяя Ti из TiCl4. Для получения титановых слитков применяют дуговую, электроннолучевую или плазменную переработку.
Титан — легкий серебристо-белый металл. Существует в двух кристаллических модификациях: α-Ti с гексагональной плотноупакованной решёткой (a=2,951 Å; с=4,679 Å [8] ; z=2; пространственная группа C6mmc), β-Ti с кубической объёмноцентрированной упаковкой (a=3,269 Å; z=2; пространственная группа Im3m), температура перехода α↔β 883 °C, ΔH перехода 3,8 кДж/моль. Точка плавления 1660±20 °C, точка кипения 3260 °C, плотность α-Ti и β-Ti соответственно равна 4,505 (20 °C) и 4,32 (900 °C) г/см³ [1] , атомная плотность 5,71·10 22 ат/см³ [источник не указан 1191 день] . Пластичен, сваривается в инертной атмосфере. Удельное сопротивление 0,42 мкОм·м при 20 °C
Имеет высокую вязкость, при механической обработке склонен к налипанию на режущий инструмент, и поэтому требуется нанесение специальных покрытий на инструмент, различных смазок.
При обычной температуре покрывается защитной пассивирующей плёнкой оксида TiO2, благодаря этому коррозионностоек в большинстве сред (кроме щелочной).
Титановая пыль имеет свойство взрываться. Температура вспышки 400 °C. Титановая стружка пожароопасна.
Устойчив к коррозии благодаря оксидной плёнке, но при измельчении в порошок, а также в тонкой стружке или проволоке титан пирофорен [9] .
Титан устойчив к разбавленным растворам многих кислот и щелочей (кроме HF, H3PO4 и концентрированной H2SO4).
Легко реагирует даже со слабыми кислотами в присутствии комплексообразователей, например, с плавиковой кислотой HF он взаимодействует благодаря образованию комплексного аниона [TiF6] 2− .
При нагревании на воздухе до 1200 °C Ti загорается с образованием оксидных фаз переменного состава TiOx. Из растворов солей титана осаждается гидроксид TiO(OH)2·xH2O, осторожным прокаливанием которого получают оксид TiO2. Гидроксид TiO(OH)2·xH2O и диоксид TiO2 амфотерны.
TiO2 взаимодействует с серной кислотой при длительном кипячении. При сплавлении с содой Na2CO3 или поташом K2CO3 оксид TiO2 образует титанаты:
При нагревании Ti взаимодействует с галогенами. Тетрахлорид титана TiCl4 при обычных условиях — бесцветная жидкость, сильно дымящая на воздухе, что объясняется гидролизом TiCl4 содержащимися в воздухе парами воды и образованием мельчайших капелек HCl и взвеси гидроксида титана.
Восстановлением TiCl4 водородом, алюминием, кремнием, другими сильными восстановителями, получен трихлорид и дихлорид титана TiCl3 и TiCl2 — твёрдые вещества, обладающие сильными восстановительными свойствами. Ti взаимодействует с Br2 и I2.
При нагревании Ti поглощает H2 с образованием соединения переменного состава TiHх (x=1,3 — 2). При нагревании эти гидриды разлагаются с выделением H2. Титан образует сплавы со многими металлами.
Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена.
Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники.
Эта отметка установлена 7 декабря 2012.
Покрытие нитрид титана.
Покрытие нитрид титана (покрытие «под золото») широко востребовано во многих сферах жизнедеятельности. Популярным направлением дизайна является использование декоративных покрытий. Идеальный вариант, если такое оформление сочетает высокие эстетические и защитные качества. Уникальное покрытие нитридом титана украсит любой объект и улучшит его потребительские характеристики. Доказанный факт: покрытие становится крепче на открытом воздухе, а его цвет получает большую отчётливость.


Нитрид титана – это популярный современный материал желтоватого цвета, применяемый для декоративного нанесения на различные изделия из нержавейки марки AISI 304, устойчивый к воздействию сильных кислот – серной и соляной. Также возможно нанесения покрытия на ABS пластик и другие материалы. Предварительно их покрывают специальным материалом (например, никелевым или хромовым подслоем).
Цвет и оттенки покрытия зависят от материалов катодов, состава воздушно-газовой смеси, степени разрежения (состояния вакуума) в камере, разности потенциалов между заготовкой и испарителем, частоты и силы ионных токов, применяемых для очистки и подготовки поверхностей.

Лучшим материалом для нанесения покрытия нитрид титана является — нержавеющая сталь AISI 304. Немаловажным фактором удобства работы с нержавейкой этой марки является простота полировки.
Перед вакуумным напылением мы проводим плазменную полировку нержавеющей стали.
На своём производстве мы используем катодно-дуговое осаждение (метод КИБ) – на сегодняшний день, это самый передовой и качественный метод нанесения покрытия нитрид титана.
Выбирая компанию по покрытию нитридом титана, обратите внимание на технологию его нанесения. Цены на покрытие нитридом титана у разных компаний варьируются. Здесь экономия может дорого обойтись. Мы предлагаем вам по-настоящему высокое качество по доступной цене.
Область применения покрытия Нитрид Титана.
Церковная тематика — покрытие куполов храмов, кресты, шары, церковная утварь.

Реклама, промоушн. Для привлечения внимания используют «золотые» металлические объемные буквы, передвижные конструкции, вывески, таблички.
Дизайн интерьеров. Нитридно-титановую обработку применяют для украшения кабин лифтов и дверей в холлах, элементов декора, ниш, арок, скульптурных групп, изделий из декоративного камня, стекла и металла.
Мебельное производство. Нанесение покрытия TiN используют для оформления золотых и медных диванных конструкций, оснований кроватей, тумб, столов и подстолий, опор и ножек, шкафов-купе, фурнитуры.
Строительство. Ионно плазменное покрытие наносится на лестничные конструкции, перила, поручни.
Производство сантехники, аксессуаров для ванной. Напыление «под золото» нитрид титана – популярный вариант покрытия смесителей, вешалок и полочек, полотенцесушителей.
Промышленность. Нитридная оболочка обладает хорошими защитными свойствами, обеспечивает стойкость к коррозионным воздействиям, влиянию неблагоприятных факторов окружающей среды, укрепляет кристаллическую решетку металла. Незаменимое покрытие нитрид титана многократно упрочняет режущий инструмент.
Медицина. Титановое напыление используется в производстве зубных протезов, вставок, накладок и коронок. Такие изделия долговечнее и дешевле золотых изделий для протезирования.
Свойства покрытия нитрид титана.
Высокие эстетические качества. Если подобраны правильные параметры напыления, вещи с титановым напылением по цвету и блеску покрытия очень похожи на изделия из натурального золота.


Конкурентная цена. Стоимость прочной оболочки на порядок дешевле такого же по толщине золотого напыления, при том, что срок службы нитрида титана в несколько раз дольше.
Длительный срок службы. Покрытие TiN не тускнеет и не отслаивается со временем.
Экологичность. Материал абсолютно безвреден для людей.
Устойчивость к воздействию кислотных и щелочных сред. Нитрид титана невосприимчив к атмосферным явлениям, серной, соляной кислотам, фосфатам и хлору.
Прочность, хорошая сопротивляемость механическим повреждениям. Материал обладает высокой прочностью, его применяют даже при обработке режущего инструмента.
Широкий температурный диапазон использования. Соединение устойчиво до 700-800 °C.
Методы и технология нанесения покрытия нитрид титана.
Нанесение нитрида титана при помощи вакуума основывается на формировании направленного потока частиц этого элемента на поверхность и их последующей конденсации с образованием плёнки.
Поведение любой частицы напыляемого материала в момент контакта с поверхностью находится в прямой зависимости от её энергии, химических свойств детали и температуры поверхности. Чтобы покрыть нитридом титана заготовку, необходимо создать оптимальные условия для максимальной конденсации частиц на поверхности.
Существует несколько видов напыления:
- конденсация с ионной бомбардировкой (КИБ);
- атомная ионизация и распыление (АИР);
- газофазовое осаждение;
- магнетронное нанесение;
- термодиффузионное насыщение;
- электронно-лучевое испарение.
Самым качественным считается катодно-дуговое осаждение (метод КИБ). Он обеспечивает прочную адгезию (схватываемость с основанием) защитного покрытия благодаря внедрению атомов титана в кристаллические структуры материалов нижнего слоя. Толщина напыления около 3―5 мкм.
Олово

Олово — пластичный, ковкий и легкоплавкий блестящий металл серебристо-белого цвета. Используется в основном как безопасное, нетоксичное, коррозионностойкое покрытие в чистом виде или в сплавах с другими металлами. Главные промышленные применения олова – в белой жести (луженое железо) для изготовления тары, в припоях для электроники, в домовых трубопроводах, в подшипниковых сплавах и в покрытиях из олова и его сплавов.Элемент состоит из 10 изотопов с массовыми числами 112, 114-120, 122, 124; последний слабо радиоактивен; изотоп 120 Sn наиболее распространен (около 33%).
СТРУКТУРА
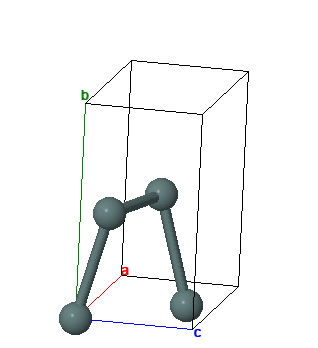
Олово имеет две аллотропные модификации: a-Sn (серое олово) с гранецентрированной кубической кристаллической решеткой и b-Sn (обычное белое олово) с объемноцентрированной тетрагональной кристаллической решеткой. Фазовый переход b -> a ускоряется при низких температурах (-30° С) и в присутствии зародышей кристаллов серого олова; известны случаи, когда оловянные изделия на морозе рассыпались в серый порошок (“оловянная чума”), но это превращение даже при очень низких температурах резко тормозится наличием мельчайших примесей и поэтому редко встречается, представляя скорее научный, чем практический интерес.
СВОЙСТВА

Плотность b-Sn 7,29 г/см 3 , плотность a-Sn 5.85 г/см 3 ,. Температура плавления 231,9°C, температура кипения 2270°C.
Температурный коэффициент линейного расширения 23·10 -6 (0-100 °С); удельная теплоемкость (0°С) 0,225 кдж/(кг·К), то есть 0,0536 кал/(г·°С); теплопроводность (0°С) 65,8 вт/(м·К.), то есть 0,157 кал/(см·сек·°С); удельное электрическое сопротивление (20 °С) 0,115·10 -6 ом·м, то есть 11,5·10 -6 ом·см. Серое олово является диамагнетиком, а белое – парамагнетиком.
Предел прочности при растяжении 16,6 Мн/м 2 (1,7 кгс/мм 2 ); относительное удлинение 80-90%; твердость по Бринеллю 38,3-41,2 Мн/м 2 (3,9-4,2 кгс/мм 2 ). При изгибании прутков олова слышен характерный хруст от взаимного трения кристаллитов.
Чистое олово обладает низкой механической прочностью при комнатной температуре (можно согнуть оловянную палочку, при этом слышится характерный треск, обусловленный трением отдельных кристаллов друг о друга) и поэтому редко используется.

Олово — редкий рассеянный элемент, по распространенности в земной коре олово занимает 47-е место. Кларковое содержание олова в земной коре составляет, по разным данным, от 2·10 −4 до 8·10 −3 % по массе. Основной минерал олова — касситерит (оловянный камень) SnO2, содержащий до 78,8 % олова. Гораздо реже в природе встречается станнин (оловянный колчедан) — Cu2FeSnS4 (27,5 % Sn). Мировые месторождения олова находятся в основном в Китае и Юго-Восточной Азии — Индонезии, Малайзии и Таиланде. Также есть крупные месторождения в Южной Америке (Боливии, Перу, Бразилии) и Австралии.
В России запасы оловянных руд расположены в Чукотском автономном округе (Пыркакайские штокверки; рудник/посёлок Валькумей, Иультин — разработка месторождений закрыта в начале 1990-х годов), в Приморском крае (Кавалеровский район), в Хабаровском крае (Солнечный район, Верхнебуреинский район (Правоурмийское месторождение)), в Якутии (месторождение Депутатское) и других районах.
В процессе производства рудоносная порода (касситерит) подвергается дроблению до размеров частиц в среднем ~ 10 мм, в промышленных мельницах, после чего касситерит за счет своей относительно высокой плотности и массы отделяется от пустой породы вибрационно-гравитационным методом на обогатительных столах. В дополнение применяется флотационный метод обогащения/очистки руды. Таким образом удается повысить содержание олова в руде до 40-70 %. Далее проводят обжиг концентрата в кислороде для удаления примесей серы и мышьяка. Полученный концентрат оловянной руды выплавляется в печах. В процессе выплавки восстанавливается до свободного состояния посредством применения в восстановлении древесного угля, слои которого укладываются поочередно со слоями руды, или алюминием (цинком) в электропечах: SnO2 + C = Sn + CO2. Особо чистое олово полупроводниковой чистоты готовят электрохимическим рафинированием или методом зонной плавки.
ПРОИСХОЖДЕНИЕ

Основная форма нахождения олова в горных породах и минералах — рассеянная (или эндокриптная). Однако олово образует и минеральные формы, и в этом виде часто встречается не только как акцессорий в кислых магматических породах, но и образует промышленные концентрации преимущественно в окисной (касситерит SnO2) и сульфидной (станнин) формах.
В общем можно выделить следующие формы нахождения олова в природе:
- Рассеянная форма: конкретная форма нахождения олова в этом виде неизвестна. Здесь можно говорить об изоморфно рассеянной форме нахождения олова вследствие наличия изоморфизма с рядом элементов (Ta, Nb, W — с образованием типично кислородных соединений; V, Cr, Ti, Mn, Sc — с образованием кислородных и сульфидных соединений). Если концентрации олова не превышают некоторых критических значений, то оно изоморфно может замещать названные элементы. Механизмы изоморфизма различны.
- Минеральная форма: олово установлено в минералах-концентраторах. Как правило, это минералы, в которых присутствует железо Fe +2 : биотиты, гранаты, пироксены, магнетиты, турмалины и т. д. Эта связь обусловлена изоморфизмом, например, по схеме Sn +4 + Fe +2 → 2Fe +3 . В оловоносных скарнах высокие концентрации олова установлены в гранатах (до 5,8 вес.%) (особенно в андрадитах), эпидотах (до 2,84 вес.%) и т. д.
На сульфидных месторождениях олово входит как изоморфный элемент в сфалериты (Силинское месторождение, Россия, Приморье), халькопириты (Дубровское месторождение, Россия, Приморье), пириты. Высокие концентрации олова выявлены в пирротине грейзенов Смирновского месторождения (Россия, Приморье). Считается, что из-за ограниченного изоморфизма происходит распад твёрдых растворов с микровыделениями Cu2 +1 Fe +2 SnS4 или тиллита PbSnS2 и других минералов.

Олово используется в основном как безопасное, нетоксичное, коррозионностойкое покрытие в чистом виде или в сплавах с другими металлами. Главные промышленные применения олова — в белой жести (лужёное железо) для изготовления тары пищевых продуктов, в припоях для электроники, в домовых трубопроводах, в подшипниковых сплавах и в покрытиях из олова и его сплавов. Важнейший сплав олова — бронза (с медью). Другой известный сплав — пьютер — используется для изготовления посуды. Для этих целей расходуется около 33 % всего добываемого олова. До 60 % производимого олова используется в виде сплавов с медью, медью и цинком, медью и сурьмой (подшипниковый сплав, или баббит), с цинком (упаковочная фольга) и в виде оловянно-свинцовых и оловянно-цинковых припоев. В последнее время возрождается интерес к использованию металла, поскольку он наиболее «экологичен» среди тяжёлых цветных металлов. Используется для создания сверхпроводящих проводов на основе интерметаллического соединения Nb3Sn.
Дисульфид олова SnS2 применяют в составе красок, имитирующих позолоту («поталь»).
Искусственные радиоактивные ядерные изомеры олова 117m Sn и 119m Sn — источники гамма-излучения, являются мёссбауэровскими изотопами и применяются в гамма-резонансной спектроскопии.
Интерметаллические соединения олова и циркония обладают высокими температурами плавления (до 2000 °C) и стойкостью к окислению при нагревании на воздухе и имеют ряд областей применения.
Олово является важнейшим легирующим компонентом при получении конструкционных сплавов титана.
Двуокись олова — очень эффективный абразивный материал, применяемый при «доводке» поверхности оптического стекла.
Смесь солей олова — «жёлтая композиция» — ранее использовалась как краситель для шерсти.
Олово применяется также в химических источниках тока в качестве анодного материала, например: марганцево-оловянный элемент, окисно-ртутно-оловянный элемент. Перспективно использование олова в свинцово-оловянном аккумуляторе; так, например, при равном напряжении, по сравнению со свинцовым аккумулятором свинцово-оловянный аккумулятор обладает в 2,5 раза большей емкостью и в 5 раз большей энергоплотностью на единицу объёма, внутреннее сопротивление его значительно ниже.
Исследуются изолированные двумерные слои олова (станен), созданные по аналогии с графеном.
Читайте также:

