Металл светящийся в темноте
С фосфором связано множество увлекательных историй на мистические темы. Большинство из них вращаются вокруг таких явлений как светящиеся столбы на кладбищах и летающие шары на болотах. В научных кругах известен анекдот о том, как Семен Исаакович Вольфкович, советский ученый, исследовал фосфор без защитного костюма, а после в темноте его одежда излучала голубой свет. Во время вечерних прогулок горожане часто принимали ученого за призрак. Поговаривают, что оттуда и пошла байка о монахе, который светился.
Но история открытия этого элемента еще интереснее. В 1669 году немецкий алхимик, по имени Хеннинг Бранд, проводил опыты в поисках формулы золота. Для этого он брал человеческую мочу, Бранд считал, что ее цвет обусловлен наличием драгоценного металла в жидкости. Ученый отстаивал, дистиллировал жидкость, а после, при определенных условиях, соединял полученное сырье с углем и песком. Однако вместо золота, ученый получил субстанцию, которая излучала холодное свечение.
В этой статье мы откроем тебе самые интересные и неожиданные подробности о фосфоре. Будет интересно!
Белый фосфор
В чистом виде является очень опасным веществом. Он токсичен и взрывоопасен при условии взаимодействия с кислородом, именно поэтому его хранят исключительно под водой. При окислении происходит большой выброс энергии и поэтому вещество начинает излучать свечение. Это как раз тот случай, когда энергия является световой. Ранее белый фосфор использовался в изготовлении оружия, однако сегодня цивилизованные страны отказались от этого вещества по причине высокого и неконтролируемого поражающего свойства.
Красный фосфор
Спустя 200 лет после того, как немецкий алхимик случайно открыл фосфор, австрийским ученым была найдена формула новой разновидности вещества. Антон Шреттер выявил, что если фосфор подвергнуть влиянию высоких температур, то получится совершенно новый вид, его назвали красным фосфором, а исходную форму назвали белым. Красный фосфор не так токсичен, как белый и не светится в темноте. Его используют в промышленности, к примеру, в производстве спичек. Хранят его в герметичной таре, так как при длительном взаимодействии с кислородом он вновь принимает свойства белого.
Черный фосфор
Фосфор черный являет собой черное вещество, жирное и по консистенции схожее с графитом. И его получают из белого, однако, в отличие от красного фосфора, черный получают при воздействии высокого давления и температуры 200 градусов Цельсия одновременно. Свойствами этого вещества является высокая способность проводить электрический ток.
Фосфор — основа всего живого
Ученые, наконец, нашли разгадку зарождения организмов, обладающих ДНК. Выяснилось, что фосфор является основой в строении ДНК. Этот химический элемент содержится в каждом живом организме планеты. Известно, что в организме человека содержится примерно 750 грамм фосфора, основная его часть приходится на зубы и кости человека. Выходит, что благодаря фосфору на земле зародилась жизнь!
Пришелец из космоса
На сегодняшний день те соединения фосфора, которые существуют в природе, практически не растворяются в воде. Каждый из нас знает, что зарождение жизни на земле произошло именно в воде. Мнение ученых сходится к тому, что на тот момент, когда происходил процесс зарождения жизни на земле, фосфора, который был, растворим в воде, на планете хватало в изобилии. А «прибыл» он к нам на планету с помощью метеоритов, бомбардировки которых также оказались судьбоносными для нас. Далее растворимые виды фосфора образовывались уже менее интенсивно по причине геотермальных изменений в сейсмически активных зонах.
Источник жизни
Исследования ученых привели к выводу: фосфор образуется при рождении новой звезды. Меньшими объемами он образуется в процессе формирования новых звезд, когда происходят глобальные термоядерные реакции.
Добыча фосфора
После случайного открытия фосфора Хеннингом Брандом его продолжали получать из человеческой мочи, со временем его стали получать из костей мертвых животных. Однако в современном мире добыча фосфора происходит из минералов апатитов.
Фосфорная кислота
Основная часть добытого фосфора используется в производстве фосфорной кислоты, которая в большей степени идет на производство удобрений. Однако и в других сферах она так же востребована. Растворы из фосфорной кислоты применяют в изготовлении пищевых добавок, усилителей вкуса, бытовой химии, устойчивых к возгоранию лакокрасочных изделий и пропиток, которыми обрабатывают древесину.
Долгожданные микробы-спасители
Экологическая ситуация значительно ухудшается с производством белого фосфора. Это вещество склонно к самовозгоранию и очень токсично. Уже сегодня ученые решили проблему загрязнения природы. Обезвреживание будет проводиться специальными микробами, поскольку окисляясь, вещество перестает быть токсичным, а наоборот, приносит пользу живым организмам. На данный момент ученые продолжают свои исследования в данном направлении и уже скоро будут выведены новые штаммы, которые обязательно дадут нужный результат.
Радиация и свечение: разбираем мифы
В массовой культуре существует стереотип о том, что радиоактивные вещества и процессы, связанные с радиоактивным излучением, всегда должны сопровождаться «спецэффектами» в виде зловещего призрачного голубоватого или зеленоватого свечения. Типа такого:



Попытаемся же разобраться, может ли радиация вызывать свечение, и в каких случаях.
Самый каноничный пример, когда нечто действительно светится из-за радиоактивного излучения – так называемое излучение Вавилова-Черенкова. Оно возникает в жидкостях и газах, когда через них проходят быстро движущиеся заряженные частицы.
«Быстро» - это значит быстрее скорости света в данной среде (подчеркнём – именно в данной среде; в воде, например, скорость света составляет примерно 75 % от его скорости в вакууме). Понятно, что для того, чтобы разогнать частицу до таких скоростей, нужна приличная энергия. Поэтому пронаблюдать такое свечение в обычных или даже не совсем обычных (типа радиационной аварии) условиях у вас не получится. Наблюдается оно, к примеру, в слое воды, в который погружены топливные сборки работающего атомного реактора: например, как тут.

Подчеркнём: речь идёт о работающем реактора, в котором идёт самоподдерживающаяся цепная реакция. Ни в Чернобыле, ни в Фукусиме после аварии и за пределами реактора ничего такого наблюдаться не могло и не наблюдалось. После взрыва ядерной бомбы даже в самом-самом эпицентре тоже ничего не светится.
Некоторые радиоактивные вещества могут светиться и сами по себе – например, плутоний-238 высокой очистки может светиться слабым красноватым светом. Но это не какое-то специфическое радиоактивное свечение, а обычное излучение нагретого тела – также светится гвоздь, если вы накалите его в огне. А вот за нагрев слитка плутония отвечает процесс естественного радиоактивного распада ядер его атомов, который в плутонии идёт крайне активно.

Тёплый ламповый плутоний
N.B. Далеко не всякий плутоний светится. Например:

А вот уран, самый широко используемый радиактивный элемент, так делать не умеет: даже обогащённый уран, в котором существенно увеличена доля наиболее активного изотопа, урана-235, распадается недостаточно активно для того, чтобы существенно нагреваться в естественной среде. Вообще даже чистый уран-235 не очень опасен: его можно даже держать в руках.

Таблетки из обогащённого урана для АЭС
Правда, лучше всё-таки надеть перчатки: но не из-за радиоактивности, а из-за того, что, как и все тяжёлые металлы, уран весьма токсичен, и при попадании в организм может наделать бед с чисто биохимической точки зрения.
Впрочем, уран тоже может светиться. Точнее, не сам уран, а соединения урана. И не сами по себе, а будучи смешанными с другими веществами.
Классическим примером является так называемое урановое стекло, известное своей необычной желтовато-зелёной окраской. Её стеклу придают именно соединения урана.

Часто можно видеть картинки и видео, на которых урановое стекло светится таинственным зеленоватым светом. Но не спешите радоваться: это не «уран светится в темноте».

Скорее всего, где-то за пределами кадра спрятана ультрафиолетовая лампа, свет которой и сообщает урановому стеклу свечение. Дело в том, что урановое стекло является флуоресцирующим материалом: оно поглощает падающий на него свет и переизлучает его на определённой длине волны.
Именно благодаря флуоресценции, урановое стекло весьма необычно выглядит, к примеру, в ярком солнечном свете, содержащем много ультрафиолета: оно не просто отражает и преломляет свет, как обычное стекло, но «играет» специфическим образом.
Флуоресценция уранового стекла никак не связана с радиоактивностью самого урана: флуоресцентными свойствами обладают и многие нерадиоактивные соединения, например, хинин.

Гидрохлорид хинина в ультрафиолетовом свете выглядит. радиоактивно
Само по себе урановое стекло не светится. Вообще.

И да. Радиоактивность уранового стекла ничтожна. Его можно невозбранно держать дома, например (антиквариатъ, пик популярности изделий из уранового стекла пришёлся на 30-е годы 20 века). Хотя кушать и пить из него регулярно не рекомендуется — но, опять же, не из-за радиоактивности, а из-за химической токсичности урана.
Существует родственное флуоресценции явление – фосфоресценция. Разница между ними состоит в том, что при флуоресценции переизлучение происходит сразу, а при фосфоресценции – с задержкой. Фосфоресцирующие вещества как бы «аккумулируют» свет, а потом медленно отдают его.
Кстати, собственно фосфор в темноте светится не поэтому: это не фосфоресценция, а хемилюминисценция – свечение, вызванное медленным окислением фосфора кислородом воздуха. Да, вещество, давшее название явлению, к самому явлению не имеет отношения – в физике, да и в жизни вообще, так часто бывает. Америку, знаете ли, тоже назвали не в честь Колумба.
Почему мы заговорили о фосфоресценции? А потому, что она имеет непосредственное отношение к тому явлению, которое и породило обсуждаемый стереотип.
Помните советские часы со светящимися стрелками? Так вот, их свечение – таки да может вызвано радиоактивностью.

В советское время существовал светящийся краситель, он же светосостав постоянного действия, он же светомасса – это смесь сульфида цинка, меди и крошечных количеств радиоактивного вещества, например, радия или тория. В целом, принцип свечения таких составов (радиолюминисценция) схож с флуоресценцией, разница лишь в том, что источником энергии для свечения является не свет, а излучаемое радиоактивным материалом альфа-излучение.
Так что – да, такие красители действительно светятся из-за радиации, но – нет, светится не само радиоактивное вещество, а флуоресцирующая краска, люминофор. Не было бы её – не было бы и свечения.
Кстати, некоторые многие современные люминофоры нередко содержат стронций – вещество, известное в основном благодаря своим радиоактивным изотопам стронций-82 и стронций-90. Однако в природном стронции их ничтожное количество: в основном естественный стронций состоит из стабильных стронция-86, 87 и 88 и почти неактивен.

Светится без всякой радиации
И да. Чистый радий тоже не светится. Свечение, которое наблюдали супруги Кюри, и которое и дало название элементу, было обусловлено взаимодействием атомов радия с атомами бария, которые входили в состав изучаемых супругами Кюри молекул.
Кстати, в отличие от того же уранового стекла, радиевые часы могут таки доставить вам неприятности. Их не рекомендуется, к примеру, разбирать, снимать с них стекло и так далее. Скопившаяся в таких часах пыль может быть изрядно радиоактивной: глотать или вдыхать её убедительно не рекомендуется.
Подводя итоги, можно сказать следующее. Да, радиация может вызывать свечение, причём сразу несколькими способами. Однако наличие такого свечения не является ни характерным, ни специфическим признаком радиации: лишь меньшая часть светящихся в темноте веществ радиоактивна, и лишь иногда процессы радиоактивного распада сопровождаются видимым глазу свечением.
Залез в аптечку и сделал СВЕТЯЩИЕСЯ КРИСТАЛЛЫ - делаем люминофоры дома .
Заскучал в очередной раз, ну чтож - ДА БУДЕТ ДОМАШНЯЯ ВАРКА. Делаем снова все на гряяяяззз из борной кислоты и подручных веществ из аптечки и кухонного шкафа. Ребята погнали.

И вот например простые кристаллы из борной кислоты и салициловой кислоты!

Для того чтоб сделать люминофор, не плохо бы понять, что это за вещество. Люминофор это такое вещество, которое поглощает энергию и преобразовывает её в световое излучение. В зависимости от фильтра находящегося на поверхности люминофора или его примеси, свечение может быть различного цвета. У люминофора есть несколько видов: радиолюминофоры, электролюминофоры, рентгенолюминофоры, фотолюминофоры, катодолюминофоры. Фотолюминофор - порошок, он наделен способностью светиться в темное время суток под воздействием искусственного или естественного освещения.
Убедительная просьба ознакомиться с предыдущими постами дорогие друзья, сегодня мы рассмотрим общие моменты по получению таких кристалликов.
Делал вот по этим видосам, друзья пожалуйста ознакомьтесь, чтобы быть в теме:
Теперь о некоторых тонкостях, которые нужно знать, чтобы приготовить такие вот кристаллы:


Борные люминофоры состоят собственно из борной кислоты, которая выступает как основа с добавлением различных органических соединений, выступающие как активаторы промежуточных соединений, образующихся при частичном обезвоживании борной кислоты. Эти люминофоры могут быть приготовлены как при сплавлении до 200°С, так и интенсивным высушиванием смеси под вакуумом при 100°С
Эти пункты очень важны для выяснения общих свойств борных люминофоров и представляют следующий перечень:
• Свечение активированной борной кислоты под ультрафиолетовым излучением происходит из-за присутствия следов органического материала.
• Люминофор мог быть приготовлен с использованием самой борной кислоты, частично обезвоженной борной кислоты, так же, используя полностью обезвоженную её форму в качестве борного ангидрида - B2O3.
• Самые лучшие и успешные результаты получены с использованием частично обезвоженными борными промежуточными соединениями, которые возникают при обезвоживании борной кислоты.
• Люминофор быстро теряет свою способность к люминесценции, как при воздействии влаги находящейся в воздухе, так и при сильном обезвоживании - люминесценция у борного ангидрида намного более слабая, чем у частично обезвоженных продуктов борной кислоты.
• Интенсивность люминесценции сильно уменьшается под воздействием кислорода на борные люминофоры.
• В качестве активирующих свечение веществ могут применяться многие органические препараты и соединения.
• Тесное взаимодействие между активатором и основой не только возможно, но также вероятно в случае синтеза, который исключает обезвоживание борной кислоты путём нагрева.
• Не распавшаяся органическая молекула (активатор) единственная причина люминесценции и также единственный центр вызывающий световой эффект, а борная кислота предоставляет необходимые физические условия, наряду как в борном ангидриде в качестве активатора по большей части выступает элементарный углерод.
• Борный люминофор имеет структуру схожую с твёрдыми растворами.
• Многие борные люминофоры обладают флюоресценцией, фосфоресценцией и некоторые термолюминесценцией с заменой полос излучения.
• Большинство борных люминофоров имеют полосы возбуждения и полосы излучения в спектре, от двух до четырёх.
• Свойства борных люминофоров отличаются по нескольким параметрам от люминофоров, активированных примесями металлов, и механизмы люминесценции также резко отличаются.
• Примеси металлов как активаторов борной кислоты или борных промежуточных соединений не являются доминирующими над органическими активирующими соединениями. Флюоресценция и фосфоресценция при добавке солей металлов возникает не по причине активации металла, а по причине взаимодействия кислотного остатка соли металла с борной кислотой или её промежуточными соединениями при частичном обезвоживании, а так же распада кислотного остатка соли металла на другие стабильные составляющие при температуре приготовления. (Пример тому - внесение в борную кислоту ацетатов металлов или формиатов).
• Излучающие центры длительной фосфоресценции и короткой флюоресценции имеют между собой различия.
• Структуры фосфоресцирующих центров борного ангидрида отличаются от люминофоров борной кислоты и от сульфидных люминофоров металлов второй группы.
• Подавляющее большинство борных люминофоров имеют отдельные полосы поглощения (возбуждения), как в видимой части спектра, таких, как фиолетовой и синей, а так же большинство из них имеют оптимум поглощения в ультрафиолетовой части спектра – ближнего (А), среднего (В) и чуть реже, дальнего (С) ультрафиолета.
• Некоторые корреляции и порой существенные изменения присутствуют между составом активаторов, их вносимого количества, цвета излучения и интенсивности фосфоресценции, а так же между цветом и интенсивностью излучения фосфоресценции и флуоресценции, у одного и того же люминофора.
• Имеет место изменение цвета флуоресценции и фосфоресценции при возбуждении различными источниками излучений у одного и того же борного люминофора.
• Имеются различия между цветом флюоресценции и фосфоресценции при возбуждении одного и того же люминофора одним и тем же источником возбуждения.
• Время послесвечения в темноте не особо длительное, у самых успешных образцов фосфоресценция не превышает двух минут. Самое большое уменьшение интенсивности фосфоресценции, наблюдается в течение первых тридцати секунд после прекращения возбуждения.
• Цвет флюоресценции активирующего соединения в состоянии чистого вещества-реактива или растворённого в органическом растворителе, отличается от цвета флюоресценции люминофора на борной кислоте, приготовленного с ним же, и их излучения фиксируются в различных частях спектра.
• Активирующее органическое вещество не обязательно должно обладать флюоресценцией само по себе и флуоресцентное вещество не всегда приводит к активации борной кислоты. Таким образом, нет никакой связи между флуоресцентной способностью активатора и его способностью активировать свечение. Есть некоторые исключения, например соединение - флуоресцеин. Это общее заключение целиком согласуется с работами Томашека.
В качестве активаторов для борной кислоты могут быть применены углеводороды, гетероциклические соединения, оксисоединения, карбоновые кислоты, сульфокислоты и особенно флуоресцеин, который исследовался в борнокислотных соединениях наиболее часто. Увеличение боковой алифатической цепи действует угнетающим образом. Многие окрашенные вещества, исключая флуоресцеин, не активируют борную кислоту. Так же введение галоидов и нитрогруппы ухудшает или даже совсем уничтожает фосфоресценцию. Аминогруппы и имидогруппы, связанные не циклически, то же ухудшают эффект. Вводимые ацетаты, формиаты и прочие органические кислотные остатки дают позитивный, но часто не наилучший эффект. Введение сульфатов дает незначительный эффект. Действующие концентрации активаторов достаточно низки, но оптимумы значительно отличаются.
Наилучшие активаторы – флуоресцеин, α-оксинафтойная кислота и терефталевая кислота. Теперь, немного подробнее о некоторых активаторах и свойствах их борных люминофоров.


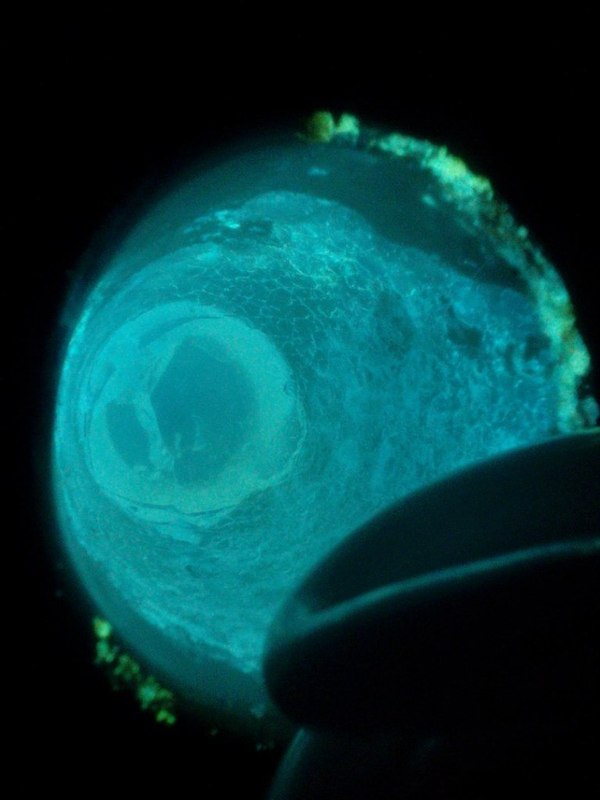

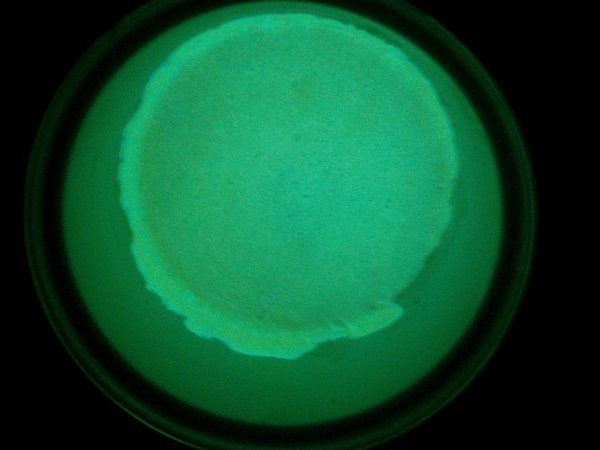
Ну и конечно же МЕГА КРИСТАЛЛ. В кастрюле на углях аккуратно расплавил борную кислоту и всыпал активатор - ФЛУОРЕСЦЕИН. Все, люминофор готов, масса кристалла 500 гр.

Полосы фосфоресценции при борной кислоте представляют собой полосы разделённые и имеющие много максимумов, но более размытые, чем, например, в затвердевшем жидком воздухе или этиловом спирте, где линейчатость спектра выступает резко. При этом, чем резче полоса и ближе по своему строению к линейчатому спектру, тем меньше влияние температуры, но как правило, борные люминофоры имеют весьма низкий температурный предел верхнего уничтожения флюоресценции и при повышенных температурах и изменение температуры в пределах нормальных условий не влияет на послесвечение. Обычно уже при +160°С все борные люминофоры не светят. Исключением являются лишь люминофоры с флуоресцеином и нафталевым ангидридом.
Все эти люминофоры не обладают ни одним видом вынужденного затухания. Как указывалось выше, борные люминофоры возбуждаются лишь видимым светом и УФ. Оптимум в основном приходится на ближний и средний спектр ультрафиолетового спектра. Ни от катодных, ни от рентгеновских, а так же от излучения радиоактивных элементов эти люминофоры не светят. Даже вещества, подобные дигидроколлидин-дикарбоноводиэтиловому эфиру, хорошо возбуждающемуся от радиоактивных излучений, будучи введён в борную кислоту, дают люминофоры, прекрасно возбуждающиеся на свету, но совершенно не реагирующие на препараты радия. То же относится к пентадецилпаратоликетону, хорошо реагирующий на катодное излучение.

ДОПОЛНИТЕЛЬНУЮ ИНФУ ПО ЛЮМИНОФОРОМ МОЖНО ПОСМОТРЕТЬ ТУТ:
21 мая - День Химика.
50 лет назад Химический факультет МГУ начал проводить День Химика под знаком элементов таблицы Менделеева.
Ежегодно День Химика собирает вместе студентов, аспирантов, преподавателей и сотрудников, а также выпускников МГУ и гостей из других вузов России и ближнего зарубежья.
Традиционно заглавный элемент определяется порядковым номером Дня Химика. Сурьма, будучи пятьдесят первой, стала отправной точкой для Дня Химика-51.
День Химика 2016 - это повод отдохнуть, встретиться с друзьями, погрузиться в атмосферу родного факультета! Спортивные состязания, весёлые конкурсы, непредсказуемый аукцион, традиционное Представление на ступеньках, незабываемая Ночь Химика, а также множество других важных и интересных событий - вот что ждёт вас 21-го мая!

Всем удачи друзья, надеюсь вам полезна статья по получению таких кристалликов)
Какие вещества светятся в темноте?

Предметы и вещества, которые умеют сами по себе светиться в темноте, всегда удивляют и притягивают внимание. Ведь это так удивительно, что им не требуется никакого внешнего источника питания, чтобы быть видимыми в кромешной тьме. Помните, как глядя в детстве на фосфорные часы, каждый мечтал получить такие же в подарок? Не обязательно фосфорные, конечно, можно и с другим веществом – главное, чтобы светились. Даже не обязательно, чтобы это были часы – главное чтобы эта вещь светилась сама по себе каждую ночь. Теперь нам будет легче разобраться, какие светящиеся вещества и предметы стоит уносить к себе в дом, а от каких лучше держаться подальше: ведь мы подготовили целый список веществ и предметов, которые светятся в темноте. Одни из них издают флуоресцентное свечение сами по себе, другие – под воздействием черных ламп.
Это интересно: черные лампы – это вовсе не лампы, покрашенные в черный цвет, а лампа, работающая в длинноволновой часть ультрафиолетового диапазона. Наши глаза плохо воспринимают электромагнитные волны данного диапазона, поэтому свет черной лампы для нас почти невидим.
Радий. Это радиоактивный элемент, который по мере распада излучает бледно-синее свечение. Радий использовался для создания светящихся красок, которые, как правило, бывают зеленого цвета. Первооткрывателем радия считается Мария Кюри. Изначально радий считался полезным элементом, и активно использовался в промышленном производстве: добавлялся в краски и продукты питания. Остается лишь посочувствовать постоянным потребителям этих товаров: радий обладает огромной токсичностью и имеет свойства накапливаться в организме, разрушая костную ткань.
Плутоний. Не все радиоактивные элементы светятся сами по себе. Плутоний, например, издает свечение, только когда взаимодействует с кислородом в воздухе. Он дает темно-красный свет, похожий на горящий уголек. Основное свое применение плутоний нашел в ядерном оружии и в качестве топлива на АЭС. Кстати, за все время испытаний ядерных бомб в атмосферу попало около 5 тонн плутония, который постепенно рассеялся по всему миру.
Фосфор. Всем известный фосфор, как и плутоний, реагирует с кислородом и только после этого дает свечение жутко-зеленого света. Хотя фосфор светится, он не является радиоактивным.
Радон. Накачав этот газ в комнату, вы его даже не увидите. Но стоит только включить кондиционер на минимальную температуру и немного подождать, как воздух вокруг начнет светиться. Сначала он станет желтым, а при еще большем охлаждении – оранжево-красным. Но наблюдать эту красоту всё-таки лучше на расстоянии – радон является радиоактивным газом, который, попадая в организм человека, способствует развитию рака легких.
Актиний. Актиний – чрезвычайно редкий элемент. По подсчетам специалистом, всего в коре нашей планеты находится около 2600 тонн актиния. Если всё-таки умудриться собрать достаточное количество актиния, то можно невооруженным глазом увидеть, что в темноте он издает нежно-голубое свечение.
Тритий. Этот радиоактивный элемент является изотопом водорода. Тритий можно встретить в часах с подсветкой, оружейных прицелах, а так же в качестве генератора энергии для автономных датчиков. Некоторые фирмы даже выпускают тритиевые брелки, которые светятся в темноте. Но здесь есть маленькая хитрость – сам тритий не светится, а испускает электроны, которые попадают на специальное вещество, атомы которого при возбуждении начинают светиться. Такое вещество называется люминофором. По такому принципу работает, например, брелок на картинке ниже.
Но как же быть с радиоактивностью? Неужели тритиевые брелки покупают только самоубийцы? Вовсе нет – энергия выделяемых тритием электронов настолько мала, что без проблем задерживается защитным стеклом и знакомым нам люминофором.
Предметы и существа.
Светиться могут не только редко встречающиеся и недоступные обычному человеку химические элементы, но и вполне обыденные вещи и существа.
Грибы. На сегодняшний день науке известно около 70 видов светящихся в темноте грибов, но, наверняка, в природе существует ещё немало неоткрытых видов. Некоторые из них светятся едва заметно, другие же заметны с нескольких десятков метров. Происходит это благодаря биолюминесценции – способности живых организмов светиться при помощи протекающих внутри химических реакций.
Старые пни. Не случайно старые пни в данном списке идут сразу же после грибов, потому что в их свечении виноваты именно грибы. Трухлявые пни и гнилушки являются отличным домом для многих видов грибов, среди которых нет-нет, да и попадутся светящиеся грибы. Через некоторое время они оккупируют весь пень, создавая в темноте совершенно невероятную иллюзию.
Светляки. С обычным ничем не примечательным в дневное время суток жучком с наступлением ночи происходят удивительные перемены – кончик его тела вдруг начинает испускать зеленый свет, который образуется благодаря окислению вещества люциферина.

Разве можно себе представить, что ночью этот жучок светится необычным зеленым светом?
Медузы. Казалось бы, что общего между светляками и медузами? Первые живут на поверхности в травке, а вторые обитают в океанах на глубине нескольких километров под чудовищным давлением. Оказывается, и те, и другие умеют светиться в темноте благодаря всё тому же веществу – люциферину.
Это интересно: способностью к свечению обладают многие морские обитатели. Например, планктон, который собирается в огромные светящиеся стаи. По ночам такие светящиеся облака видны даже из космоса!
Белая бумага. Если вы совсем отчаялись найти хоть что-нибудь светящееся, можете открыть письменный стол и взять оттуда простой лист белый бумаги. Не пытайтесь рассмотреть его в темноте – ничего не увидите. Но в этом случае нам на помощь придет черная лампа. В состав белого листка входят отбеливающие агенты, которые при воздействии ультрафиолетом начинают светиться ярко-синим цветом.
Читайте также:
