Металл расплавляющийся в руке
Галлий – невероятный металл, который разбивается, как стекло, плавится в руке человека, атакует другие металлы, но не токсичен для людей и действует как инопланетная форма жизни при воздействии серной кислоты и раствора дихромата. Звучит слишком удивительно, чтобы быть правдой, но галлий – это абсолютно реальный химический элемент, который содержится в некоторых гаджетах, которые мы используем каждый день.
Но, что, пожалуй, еще интереснее, ученые проводят массу безумных экспериментов с галлием. Благодаря своим странным свойствам и поведению галлий может творить довольно странные вещи в лаборатории. На видео выше показано, что происходит, когда галлий «атакует» алюминий.
Популярный эксперимент с «бьющимся сердцем галлия» показывает, что галлий может действовать как живое существо, будучи погруженным в серную кислоту и раствор дихромата. Изменяя поверхностное натяжение галлия, ученые могут сделать металл похожим на органическое бьющееся сердце, что показано на видео выше.
Жидкая ложка из галлия – это забавная демонстрация, в которой хорошо используется температура плавления галлия 30 градусов по Цельсию. Ложка галлия перемешивает горячую воду и тут же тает в лужу на дне кружки, что вы можете наблюдать на видео ниже.


@Mircenall, тебя тут постов лишают)
Ну вот что за изверги такие видео делают. Включил первый видос и сразу подумал, что очередные нашуники погибли, а тут просто звук только на один канал идет
В первом видео такая реакция за какое время проходит? Непонятно. Может оно год стояло так.
Почему звук только слева?
Блин, круто звучит, как ругательство "дихромат калия")
Дык про галлий миллиард постов было. Автор, вот честно - чего конкретно нового про него вы внесли? Тип я понимаю это было бы более менее как статья. Пояснение с и физической точки зрения почему так происходит, а не то что все уже знают.
Вывод: галлий нельзя перевозить в алюминиевой лодке
А если скушать его?
Одно из лучших вступлений для книги

ТЕРМОДИНАМИКА И И СТАТИСТИЧЕСКАЯ МЕХАНИКА
— Людвиг Больцман, потративший много сил на изучение статистической механики, покончил с собой в 1906 году. Такая же судьба постигла в 1933 году Пауля Эренфеста, продолжившего его труды.
Теперь настал наш черёд заняться статистической механикой. Наверное, будет разумно подойти к этому предмету с некоторой осторожностью.

Научное открытие

Всё ради получения прибыли


Общий объём всей воды и всей атмосферы нашей планеты

К последним новостям мира науки
Один из крупнейших научных издательских домов Elsevier начал отправлять рецензентам анкеты с вопросами о. гендерной и расовой принадлежности.
Делается это, по словам редакции «для поддержки инклюзивности науки». В частности, инклюзивность решили внезапно поддержать в таких журналах, как Chemical engineering journal и Journal of Alloys and Compounds (само собой, никоим образом не связанных с исследованиями гендерных и расовых вопросов)


Кроме того, забавно видеть от научного издательства постановку вопроса «Каким бы расовым термином вы бы себя определили?»
И далее идёт перечисление «рас»:
Азиаты или жители Океании
Черные
Испанцы или латиноамериканцы
Коренные народы (североамериканские индейцы, южноамериканские индейцы и т.п.)
Ближневосточные или североафриканские жители
Белые
Собственное описание
Толерантность, инклюзивность и всё такое — это, конечно, хорошо, однако расоведение (раздел антропологии, изучающий человеческие расы) выделяет всего четыре расы человека (европеоидная, монголоидная, негроидная, австралоидная) и десятки малых антропологических типов. В списке же намешаны расы, народы, языковые группы и даже возможность самоопределить себя в отдельную расу.
Извините, другой науки у нас для вас нет 🌚
Мечехвосты

Правда ли, что употребление соли вредно?

Один из самых популярных мифов о питании гласит, что соль — это белая смерть, она вредна для здоровья. Мы решили проверить, правда ли это.
(Специально для любителей расширения сознания — речь идет про поваренную соль, которая хлорид натрия)
(Самое важное для ЛЛ: утверждение, что соль вредна, абсолютно некорректно. При этом к проблемам со здоровьем может привести как ее дефицит, так и избыток в суточном рационе)
Информацию о том, насколько соль опасна для нашего организма, можно найти на сайтах медицинских учреждений, например больниц. Об этом пишут СМИ, даже специалисты ООН бьют тревогу. Рассуждения о том, стоит ли полностью отказываться от соли, можно найти на порталах о диетологии и здоровом образе жизни. Стереотип о том, что соль — это яд, настолько распространён, что его можно встретить даже в кино.
1. Дефицит соли
Соль на 97% состоит из хлорида натрия и служит одним из основных источников этих элементов для нашего организма. Натрий — электролит, который играет важную роль в поддержании водно-солевого баланса (логично), а также обеспечивает передачу нервных импульсов.
Сама по себе нехватка натрия в крови — уже достаточно серьёзное заболевание, гипонатриемия. Оно может привести к тяжёлым неврологическим и психическим нарушениям, судорогам, коме и даже смерти. Ещё одна опасность низкого содержания натрия в организме — обезвоживание, которое тоже может привести к тяжёлым последствиям для здоровья. И обезвоживание, и гипонатриемия особенно опасны для людей старшего возраста. Натрий выводится из нашего организма естественным образом с мочой и потом. Именно поэтому спортсмены после тяжёлых тренировок могут ощутить нехватку натрия, один из её симптомов — мышечные спазмы.
В 2016 году специалисты Кокрановской библиотеки изучили результаты различных исследований о взаимосвязи потребления соли, давления и холестерина и выяснили, что диета с пониженным содержанием соли способствует некоторому повышению холестерина и триглицеридов в крови. А это, в свою очередь, может привести к заболеваниям сердца. Кроме того, пищевую соль часто обогащают железом, йодом и фолиевой кислотой, поэтому её употребление может восполнить и нехватку этих веществ в организме.
Американская кардиологическая ассоциация рекомендует потреблять в день 1,5 г натрия — это примерно 3/4 чайных ложки соли. Однако, согласно проведенным ими исследованиям, средний американец съедает примерно полторы, превышая норму в два раза. То же самое обнаружили и диетологи Австралии.
2. Негативные последствия избытка соли
Многочисленные исследования врачей показали, что переедание соли способствует развитию гипертонии, что, в свою очередь, может привести к инфарктам и инсультам. В 2020 году учёные заявили, что увеличение ежедневного употребления натрия всего на 1 г приводит к повышению риска смерти от сердечно-сосудистых заболеваний на 6%. Кровяное давление влияет и на здоровье почек, поэтому сильно солёная пища может отрицательно сказаться и на них.
Впрочем, на этот счёт учёные пока не смогли прийти к единому мнению. Некоторые из них считают, что доказательств влияния потребления соли на кровяное давление недостаточно. В любом случае паниковать и полностью отказываться от соли не стоит: доказано, что употребление в пределах одной-двух чайных ложек точно не способствует повышению давления.
Кроме того, обзор 2014 года показал, что сокращение количества соли в рационе на 2 г способствует снижению систолического артериального давления всего на 3,82 мм ртутного столба. При средних значениях в 125–144 мм ртутного столба такое снижение представляется не особенно значимым.
Между делом учёные выяснили, что одни люди более чувствительны к соли, чем другие. Вероятно, именно им стоит более пристально следить за соблюдением нормы потребления натрия. Но зато и сокращение соли в рационе для них будет более эффективным, чем для тех, кто не так чувствителен. В группу риска, по мнению учёных, входят пожилые люди, гипертоники, афроамериканцы, люди с хроническими заболеваниями почек, те, у кого был низкий вес при рождении.
3. Соль и рак желудка
Некоторые исследования связывают диеты с повышенным содержанием соли с риском развития рака желудка. Так, одно из исследований, проведённых в Японии, с участием более чем 40 000 человек показало, что этот риск выше аж на 30% у тех, кто предпочитает сильно солёную пищу.
При этом учёные пока не пришли к единому мнению, как конкретно соль может вызвать рак. По одной из версий, она способствует размножению бактерий, провоцирующих язвенную болезнь, которая может перерасти в рак. По другой — диета с высоким содержанием соли может вызвать клеточные мутации, которые в конечном счёте и приводят к раку.
4. Остеопороз
Ещё одна опасность избыточного потребления соли — остеопороз. Организм выводит излишки натрия через мочу, а вместе с ней выводится и кальций. Соответственно, чем больше соли необходимо вывести организму, тем больше он вымоет и кальция, что может стать причиной костных нарушений.
5. Контроль количества потребляемой соли
Ограничивать соль в рационе действительно есть смысл, поскольку следить за ее количеством не так просто, особенно если вы употребляете готовые продукты, например соусы. Соль содержится практически во всех продуктах питания, но оценить её количество не всегда можно на глаз.
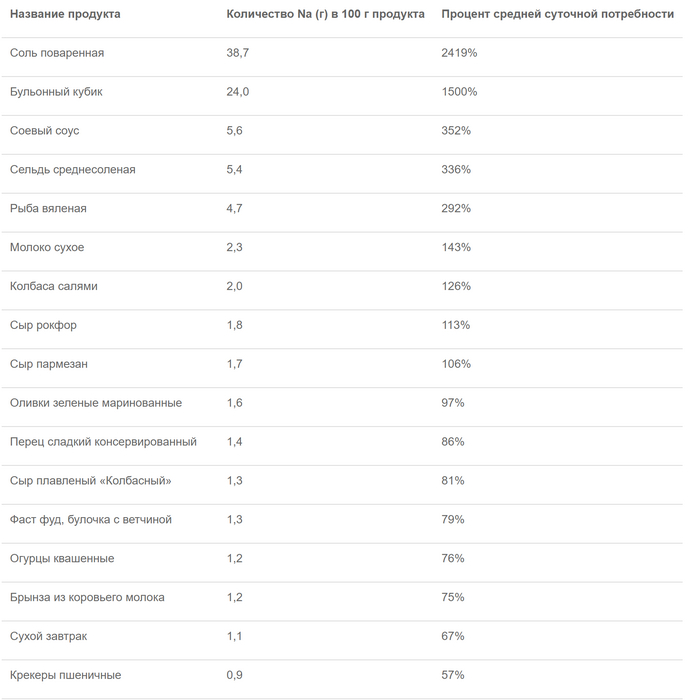
Роспотребнадзор приводит таблицу содержания соли в различных продуктах. По их данным, в 100 г среднесолёной сельди содержится 336% дневной нормы натрия, в 100 г пармезана — 106%, а в таком же количестве оливок — 97%. Таким образом, чтобы не превысить норму, вам не только нужно выбрать в день что-то одно, но и совсем не употреблять соль в других продуктах, что практически невозможно.
Таким образом, избыточное потребление соли может быть опасно для здоровья, хотя учёные до сих пор не смогли прийти к единому мнению на этот счёт. Тем не менее полностью отказываться от неё нельзя, поскольку она — источник натрия, который необходим организму для нормальной жизнедеятельности, а его нехватка может привести к печальным последствиям для здоровья.
Поэтому, как и со многими другими продуктами, с солью всё хорошо в меру, однако утверждать, что её употребление в любых количествах приближает смерть, — несправедливо.

Наш вердикт: полуправда (проверяемый факт или утверждение представляет собой смесь правды и лжи примерно в равных пропорциях)
Ещё нас можно читать в Телеграме, в Фейсбуке и в Вконтакте
В сообществах отсутствуют спам, реклама и пропаганда чего-либо (за исключением здравого смысла).
Аудиоверсии проверок в виде подкастов c «Коммерсантъ FM» доступны в Simplecast, «Яндекс.Подкасты», Apple Podcasts, «ЛитРес», Soundstream и Google.Подкасты.
12 физ. и хим. характеристик металла, что плавится в руках
Металл который плавится в руке: понятие легкоплавкости + характеристика галлия + разбор термодинамических свойств химического элемента + физические/химические свойства металла + его область применения.

Многие из нас видели в интернете фото металла, который плавится в руке. Единственный химический элемент в природе, который может безопасно для здоровья человека, провернуть подобный трюк – галлий.
В сегодняшней статье мы разберем отличительные свойства группы легкоплавких металлов + предоставим характеристику элемента, тающего в руках его владельца.
Понятие легкоплавких металлов/сплавов
Легкоплавкость – понятие растяжимое, особенно это актуально для промышленности. В химии легкоплавкими считаются элементы группы металлов + их сплавы, температура плавления которых ниже порога в 1000 градусов Цельсия.

Если температура плавления металла превышает 1 500 градусов Цельсия – его принято выделять в группу тугоплавких. Диаграмма выше четко дает понять, куда какой металл следует относить.
Обратите внимание: минимальная температура плавления у ртути — 39 градусов. Именно благодаря такому физическому свойству, мы можем наблюдать химический элемент в постоянно жидком состоянии.
Теперь пройдемся по легкоплавким сплавам. В своем большинстве – это сплавы эвтектического типа, пиковая температура плавления которых не превышает 232 градусов по Цельсию. В основе производства легкоплавких сплавов лежат легкоплавкие металлы – олово, висмут, таллий, галлий и другие.

Ученым удалось добиться -78 градусов в качестве минимальной температуры плавления для советского сплава, который состоит на 12% из натрия, 47% калия и 41% цезия. Недостаток сплава — реакция с водой. Ближайший конкурент – амальгама. Токсичный сплав из ртути с таллием, сохраняющий жидкое состояние до температуры -61 градус по Цельсию.
Область применения легкоплавких металлов/сплавов:
- энергетическая промышленность и машиностроение. Основное направление – создание тепловых носителей с жидкометаллического типа;
- литьевая промышленность;
- как основа для датчиков температуры, что актуально в системах пожарной безопасности;
- как основа для разработки термометров;
- как ремонтный материал в вакуумных технологиях;
- припои, предохранители и прочие мелочи в микроэлектронике;
- медицинское направление. То же протезирование;
- как металлическая смазка.
Низкая температура плавления является базовых свойством, которое требуется от легкоплавких металлов и сплавов. Вторичные параметры, которые берутся во внимание в различных областях использования – плотность, прочность на разрыв и инертность в химическом плане.
Галлий: металл, который плавится в руках
Поистине, занимательный химический элемент, который имеется в любом школьном кабинете химии. Благодаря демонстрационной наглядности, галлий считается лучшим вариантом донесения до умов учащихся тепловых свойств химических элементов.

Gallium (Ga) – металл, который плавится в руках при достижении температуры в 29.8 градуса по Цельсию . Учитывая стандартные 36.6 в организме человека, чтобы получить желаемый эффект, достаточно кусочек галлия положить на ладошку и наблюдать как тот медленно по ней растекается в разные стороны.
1) Общая информация по элементу
В периодической системе химических элементов галлий находится на 31 позиции. Его латинское обозначение – «Ga». Металл принадлежит к группе легких металлов, куда также входит алюминий, индий, олово, таллий, свинец и висмут.

Внешне, галлий представляет собой мягкий или хрупкий металл (в зависимости от температуры), имеющий белый + серебристый оттенки. Иногда можно заметить синеватые отблески на поверхности чистого вещества.

Великий Менделеев заранее знал о данном химическом элементе. Впервые он просчитал некоторые свойства галлия еще в 1871 году. Изначальное название, присвоенное химиком, звучало как «экаалюминий».
К предугаданным свойствам галлия Менделеевым относились:
- оксидный тип;
- варианты связи с хлором;
- медленная растворимость при соприкасании с щелочами/кислотами;
- галлий не будет реагировать с кислородом;
- возможность легкоплавкого металла образовывать основные соли;
- химический элемент будет открыт при использовании спектроскопии.
Непосредственное выделение металла в чистом виде пришлось на француза Буабодраном. Открытие приходится на 1875 год. Из-за малого долевого содержания галлия в руде (менее 0.2%), пришлось потратить пару месяцев на получение минимального запаса чистого вещества для полноценного исследования его физических/химических свойств.
| Физика галлия | Химия галлия |
|---|---|
| Наличие нескольких модификаций полиморфного типа. | Низкая химическая активность замедляет протекание химических реакций металла в твердом состоянии. |
| При нормальных условиях кристаллическая решетка имеет орторомбическую структуру. При повышении давления наблюдается образование 2 структур полиморфного типа с кубической и тетрагональной решетками. | На воздухе галлий покрывается оксидной пленкой, которая предохраняет его от дальнейших реакций окисления. |
| Плотность галлия – 5.9 грамма на сантиметр кубический, а в жидком состоянии плотность увеличивается до 6.1 грамма на сантиметр кубический. | В контакте с горячей водой, он вытесняет из нее водород, в результате чего образуется гидроксид галлия. |
| Сопротивление электричеству у галлия в твердом и жидком состояниях одинаковы и равны 0.5 на 10-8 Ом*см при температурном режиме в 0 градусов по Цельсию. | Вступает в реакцию с паром (выше 340 градусов) и образует метагаллиевую кислоту. |
| Вязкость галлия колеблется в зависимости от температурного режима. При температуре в 100 градусов – 1.6 сантипуаз, а при 1000 градусов С – 0.6 сантипуаз. | Может взаимодействовать с кислотами минерального типа – происходит выделение Н и образование солевых веществ. |
| Поверхностное натяжение составляет 0.74 ньютона на метр, а отражательный коэффициент от 71% до 76% при разной длине волн. | Галлий инертен по отношению к водороду, азоту, углероду и кремнию. |
В земной коре металл, который плавится в руках, встречается довольно часто. На 1 тонну земли приходится 19 грамм чистого вещества. В химическом аспекте, галлий – элемент рассеянного типа, располагающий двойной природой по геохимии. Хотя кларки вещества и большие, из-за его сильной склонности к изоморфизму, больших скоплений чистого галлия в природе не найти.

К основным минералам, где сравнительно высокое содержание галлия в чистом виде относят сфалерит (до 0.1%), биотит (до 0.1%) и натролит (до 0.1%). В остальных 10+ минералах, которые также применяются для добычи галлия, долевое содержание чистого вещества менее 0.1%. В морской воде галлий также присутствует, но его содержание крайне мало – всего 30 на 10-6 миллиграммов на литр жидкости.
2) Почему галлий – это металл, который плавится в руке?
Обратимся к тепловым свойствам металла, и полностью разберем их при различных уровнях, хотя ответ на вопрос очевиден уже из базового понятия, температуры плавления, которая приравнивается к 29 градусам по Цельсию.
Термодинамические свойства чистого галлия:
- металл переходит из твердого в жидкое состояние при достижении температуры в 29.8 С или 302 градуса Кельвина;
- металл закипает при достижении температуры в 2 448 градусов Кельвина;
- удельная теплота плавления чистого галлия составляет 5600 Джоулей на моль;
- удельная теплота по испарению составляет 270 000 джоулей на моль;
- молярная теплоемкость составляет 26 джоулей, деленных на Кельвины, перемноженные на моли.
Главными поставщиками галлия на мировой рынок являются государства из Юго-Запада Африки, Российская Федерация и большинство стран СНГ. Галлий – металл, который не только плавится в руке, но и вещество, способное менять плотность при смене температурного режима на основании данного свойства можно провести интересный опыт.

Эксперимент: переводим галлий в жидкое состояние, а далее загоняем его в маленький стеклянный пузырек. По мере охлаждения емкости, металл станет постепенно превращаться в твердую субстанцию. Постепенно образующиеся кристаллы начнут расширяться, за счет чего колба рано или поздно треснет.
Во избежание повреждений со стороны зрителей, демонстрация должна проходить в изолированном пространстве с защитной перегородкой. Если слишком резко переохладить колбу, осколки могут разлететься в разные стороны в радиусе нескольких десятков метров.
Обзор свойств и характеристик плавящегося в руке металла, галлия:
3) Получение галлия + области применения металла в промышленности/быту
В основе добычи чистого вещества лежит галлит – редкий минерал, который является смесью галлия и сульфида меди. Наиболее часто он встречается в совокупности с такими минералами как сфалерит и германит. Странный факт, но в залежах каменных углей иногда реально найти галлит в размере 1.5% от всего объема добычи, что делает такие месторождения крайне важными стратегическими запасами для промышленного производства галлия.
Основные методы получения металлического галлия – это переработка боксита, нефелина и некоторые типы полиметаллических руд/угля.
Алгоритм извлечения галлия из руд:
- Электролиз с участием щелочных жидкостей, которые в свою очередь являются промежуточным продуктом с переработки бокситов в глинозем технического применения.
- Получение концентрированных растворов по методу спекания или через процесс Байера. В первом случае получаем до 70 миллиграмм на литр, а во втором до 160 миллиграмм на литр концентрата.
- Дальнейшая очистка галлия путем карбонизации.
- Обогащенный осадок отправляют в емкость с известью, вследствие чего получаем раствор.
- При помощи электролиза раствора получаем черновой вариант металла.
- Черновой галлий прогоняют через водяной напор.
- Смесь фильтруют при помощи пористых пластинок и греют в вакууме, из-за чего из чернового металла удаляются примеси летучего типа.
- В зависимости от степени чистоты конечного продукта, используют химический, электрохимический, либо физический методы разложения.
Эталонный вариант чистки может предоставить галлий с чистотой в 99.9%. В данном случае используется метод электрохимического рафинирования и восстановление с помощью очищенного водорода.

В промышленном плане у галлия нет широкого распространения. Металл сравнительно дорогой для металлургии + его физические/химические свойства редко где могут пригодиться для массового использования.
Где применяется галлий:
- в соединениях с натрием металл применяют при создании лазеров полупроводникового типа с ультрафиолетовым и синим диапазонами;
- как присадка к германию/кремнию;
- как отражающий элемент для зеркал среднего качества. В чистом виде материал способен отражать порядка 89% света. Достоинства подобных изделий обусловливаются способностью металл к пропуску ультрафиолетовых лучей;
- как компонент в смазочных материалах. Клеи с добавкой жидкого галлия весьма популярны и сегодня;
- как замена ртути в кварцевых термометрах;
- оксид галлия – это стратегически важный объект в производстве лазерных материалов.
Иногда галлий применяют как компонент для светящихся красок, а соли на основе металла являются катализаторами в аналитической химии, медицине и органическом синтезе. Чтобы купить 1 килограмма металла, который плавится в руках, потребуется выложить от 250 до 400 американских долларов в зависимости от степени чистоты химического элемента.
Галлий - металл, который плавится в руке
если достать галлия, можно в маркетах устраивать веселье - по крупинке оставлять на алюминиевых баночках с пивом-колой. а если банки большие, типа бочек - то вообще будет весело! галлий растворяет алюминий и происходит бадабум! все в коле-пиве, весело и сладко!
а плавать в нем можно?=)
А где его можно приобрести? о.о
А что будет если магнит поднести?
фигня это, вот цыганий это реальня тема!
а если его пустить по вене , то метал будет у тебя в крови , ффффак йееаа \m/
Напомнило видос. Мб тот чел с Ga баловался?
что с голосом? он хорошенько пыхнул перед съемкой?)
просто было в тексте
очень красиво очень красиво очень красиво очень красиво очень красиво
Если он используется в мобильных телефонах. Получается что в жару, в нем все расплавиться?
Перепутал галий с ртутью :D
гхААлий, метхААллааа, тхелефооооне. Интонация как у гомосека

Реакция галлия и алюминия с прекрасной концовкой

Галлий в гифках
Температура плавления галлия всего 29,8°C - он легко плавится от тепла рук

В отличие от ртути, жидкий галлий хорошо смачивает поверхность и оставляет следы (однако совершенно не токсичен)

Галлиевые капельки в воде из-за высокого поверхностного натяжения не сразу слипаются

Если в жидкий галлий поместить твердый кусочек, то через некоторое время вырастет красивый кристалл

Галлий, как типичный металл реагирует с кислотами, образуя бесцветные растворимые соли

Жидкий галлий способен сплавляться с некоторым металлами (например с алюминием). По итогу деталь, содержащая галлий становится чрезвычайно хрупкой

Жидкий галлий при контакте с алюминием ведет себя подобно ртути - образуется кашеподобная амальгама

Алюминий в амальгаме будет взаимодействовать с водой, поскольку галлий препятствует образованию защитной оксидной пленки

Опыт "Сердце" (галлиевая капля заряжается при контакте с раствором электролита (дихромат калия + серная кислота), вследствие чего уменьшается её поверхностное натяжение и она, слегка сплющиваясь под действием силы тяжести, начинает совершать колебания. Аналогичное происходит и с каплей ртути)
Интересный, плавящийся в руках металл Галлий.


Галлий не существует, это всё "Матрица"!
Про биение галлия аки сердца

Моя ртуть. 45г.
Полезная инфа! В свете последних событий
Война, в общем, это гнилое дело. Но есть свои правила.
Данная информация возможно мало применима в нынешних реалиалих ведения "спецопераций". Какие-то пункты возможно уже устарели и не уневрсальны.
Но в целом будет интересно и полезно.
1. Если вы проводите зачистку ,то как в анекдоте: в комнату заходите вдвоем — сначала граната, потом вы.
2. Подойдя даже к открытым дверям любого офиса — не входи. Жопой чувствуешь, что там может быть враг, не экономь гранаты, выдергивай чеку и закатывай первую. После взрыва через 5 секунд, не выдергивая чеки, закатывай в помещение вторую и сходу за ней -вскакивай. Кто уцелеет от первой, при виде второй, упадет на пол, и закроет голову руками — возьмешь живым.
3. Стоя перед дверью и ожидая своих товарищей, собирающихся для штурма, придержите дверь, чтобы ее было не открыть. Иначе в коридоре увидите или гранату или ствол.
4. Гранату закатывать по полу. Не кидать.
5. Не бегать перед стволом товарища. Вы перекрываете ему возможность стрелять.
6. Любая закрытая дверь НЕПРИКОСНОВЕНННА, так как может быть заминирована.
7. Ящики не открывать, электронику не включать. Ничего не трогать. Все может быть заминировано. Это важно. Вплоть до того, что нельзя открывать холодильник, даже если очень хочется кушать, и поднимать крышку унитаза, поправлять кривовисящие картины на стенах.
8. Не трогать трупы, столы и другие предметы (все можно заминировать).
9. При первом выстреле — не «маячить», сразу падать.
10. Не держать палец на крючке (часто погибают товарищи).
11. Не брать патроны с открытых цинков, захваченных у боевиков, они могут вместо пороха в патроны зарядить тротил (разорвет автомат, оторвет голову).
12. Гранаты носить в специальных мешках, открытыми не держать (были зацепы).
13. Не надо с РПГ стрелять по людям, бесполезно (рассчитан только на бронетехнику).
14. Рожки изолентой не перематывай (в бою перекосит патрон — откинешь сразу оба).
15. На АК предохранитель имеет три положения. Собственно, блокировка, автоматический огонь и одиночный. Если вы в панике резко снимете с предохранителя, то наверняка опустите его до упора и поставите, тем самым, в режим одиночного огня. Это сделано, что бы обезумевший от ужаса боец не просадил магазин за секунду и не остался без патронов.
Помните об этом.
16. Предохранитель на АК достаточно мерзко лязгает. Если вам нужно снять его тихо, то оттяните его и плавно переведите в нужный режим огня (это почти всегда одиночный огонь).
17. Перед выходом попрыгайте на месте. Проверьте, что на вас ничего не лязгает и не бренчит.
Антабки на оружии лучше заранее перемотать изолентой или бинтом. Патрон в патронник, и на предохранитель.
18. Изучите таблицы стрельбы на свое оружие. Пуля летит НЕ ПРЯМО. У нее баллистическая траектория с превышениями и понижениями. Поэтому грамотное определение расстояния до цели и знание таблицы стрельбы — это хорошая возможность попадать быстро, а значит уменьшить время, пока стреляют по вам.
19. Ветер влияет на траекторию полета пули. Изучите влияние ветра на ваше оружие ЗАРАНЕЕ, а не походу и на глазок.
20. Если вам представилась возможность выбирать оружие — берите такое же (такой же калибр) как и большинство ваших товарищей. На себе много патронов не унести, а кончаются они быстро, особенно в городе, так что если с вами смогут поделиться — это большой плюс. Если вашего товарища убили, не побрезгуйте восполнить свой боекомплект (предварительно получив разрешение от командира).
21. Если вы уходите в «автономку», то вы несете на себе 360 патронов (это 12 магазинов и еще столько же, но в пачках просто кидаете в рюкзак. Сильно сэкономите в весе).
22. Помните, что магазины, расположенные на груди и животе — это дополнительная бронезащита.
23. Большинство смертей и ранений происходят от осколков. Обычный ватник вполне способен защитить вас от мелких осколков. Повесив поверх еще и разгрузку с магазинами, вы можете считать себя относительно защищенным. Не забудьте поднять ворот.
24. Бронежилет — это очень хорошо. Любой. Даже самый бэушный.
25. Если вам в броник попала пуля — это еще не значит, что он вас спас. Так как энергия пули, остановленная элементом брони, способна нанести вам чудовищную заброневую травму.
Ребра ломает почти всегда. А возможен и разрыв органов. Так что если в вас нет дырки — это еще не повод радоваться. Бывает, что дырка была бы предпочтительнее.
26. Не трогайте гранатометы. Стрелять из них сложно. Оставьте это более опытным товарищам.
27. Проведя несколько дней на свежем воздухе, курильщика можно засечь за 70-100 метров. Бросайте курить.
28. Если вам что-то послышалось — останавливаете группу и «даете тишину». Слушайте внимательно. Даже если вы будите тормозить группу каждые пять минут, только редкие идиоты будут на вас ругаться.
29. Вы никогда, остановившись, не продолжаете стоять. Нужно встать на колено или лечь. Это очень выматывает, но это вопрос выживания всей группы. Если кто-то ленится садиться — заставьте его.
30. Пальца на спусковом крючке быть не должно, даже если оружие на предохранителе.
31. На маршах, кладете автомат на руки и складываете их на груди крестом. Так легче нести. При этом большой палец провой руки всегда готов снять с предохранителя, а вскинуть оружие достаточно быстро.
32. Ремень (автоматный) всегда на шее. Иначе, если попадете в засаду, будет подрыв мины и вы полетите в одну сторону, а ваше оружие в другую, и вы из легкого 300 превращаетесь в 200.
33. На посту не спать. Если заснете, пристрелить вас захотят не только враги. За это, как и за потерю оружия, расстреливали официально. Сейчас расстреливают неофициально.
34. Пописать можно стоя на коленях, не превращаясь в стоячую ростовую мишень. Туалет, это серьёзно. Если есть специально подготовленная площадка никаких проблем. Если на марше - срать ходят только втроем, один сидит, двое смотрят вокруг на 180 градусов, многих находили валяющимися в собственном дерьме).
35. Чихать в себя.
36. Кто медленно бегает — быстро умирает.
37. Эффективность гранат переоценена. Бывали случаи, когда гранаты взорвалась в небольшой комнате, а внутри были только легкие контузии.
38. Чеку зубами вырвать нельзя. Только пальцами.
39. В стенах могут быть проломы завешанные тряпками или коврами. Так враг может быстро перебегать из парадной в парадную. Помните это. То, что вы находитесь в крайней квартире, не значит, что из соседней к вам нельзя войти через стену.
40. На окна можно вешать сетки от старых советских кроватей. Они хорошо останавливают ВОГи.
41. Вы можете слышать мяуканье, например из-за двери стенного шкафа. Мне очень жаль, но животное обречено. Скорее всего, его там заперли вместе с гранатой. Открывать нельзя. Это очень сложный момент, всегда, в таких сложных ситуациях хочется оставаться человеком,
но…
42. Если вам нужно стрелять из помещения на улицу, то не надо подползать к подоконнику или стоять сбоку от окна. Уйдите вглубь помещения, встаньте на табуретку, закрывшись стеной или т.п. И не включайте свет, нельзя, не подсвечивайте себя (я уже не го ворю о ВУ).
43. Осколки кирпича или бетона, выбитые огнем, имеют свойства лететь на вас. При попадании по глазам… ну вы поняли.
44. Долго стрелять не меняя позицию — плохая идея.
45. Пригибайтесь.
46. Не надо «вычислять снайперов». Не ваша работа, да и знаний вам не хватит. Воюйте дальше, не обращая внимания.
47. Будьте готовы морально «отработать» гражданских, которые засветили вас (если перспектива не радует, то двигайтесь осторожней)
48. На АК-74 (экземпляр с хорошей кучностью боя), можно прикрутить прицел ПСО от СВД. На дистанциях 500-600 метров у АК-74 и СВД очень близко сопряжены траектории, прицел встанет идеально. Будете стрелять и переносить огонь, из-за калибра, гораздо быстрее, чем с СВД. Да и тем, кто решит поискать снайпера, вы будете неинтересны.
49. Современные гранаты РГО и РГН взрываются в ПЕРВУЮ ОЧЕРЕДЬ от удара У них ударный взрыватель стоит, а взрыв через промежуток — это срабатывает сам ликвидатор (на тот случай, если граната упала в рыхлый снег)
50. Никто, даже саперы, не занимаются снятием мин и ВУ. Они тупо подрывают их тротиловой шашкой. Не надо умничать и начинать снимать ВУ.
51. На растяжки нормальные воины ставят секреты, чтобы было не снять по-простому. Так что «перерезать нитку» — плохая идея. Просто пройдите мимо. Это не ваше дело, для этого есть старшие товарищи.
52. При ранениях бывают венозные и артериальные кровотечения. «Лечатся» они по- разному. Но тут важно другое. В горячке боя времени нет. С венозным кровотечением товарищ будет умирать несколько часов, а с артериальным буквально 10-20 секунд, а дальше потеря сознания и начинается гипоксия. Так что, чтобы не париться, быстро накладываете
артериальный жгут поверх раны (сейчас интерны начнут возмущаться, но такова жизнь, это не гражданка, приходится нарушать) и возвращаетесь в бой. У вашего товарища будет полчаса-час на то, чтобы разобраться самому, ну или это сделаете вы, когда освободитесь.
53. Жгут всегда под рукой! Не в сумке, не в рюкзаке — или намотан на приклад, или в разгрузке под рукой.
54. С собой всегда ДВА жгута! Один вы можете отдать раненому товарищу и через минуту получить пулю в бедренную артерию.
55. Есть такое понятие как «подавление огнем». Активно поливая врага, зачастую, можно сковать его действия, даже не попадая и не нанося урона живой силе. Особенно вам помогут трассера.
56. Помните, трассера, помимо того, что очень сильно засырают ствол, они еще и выдают вашу позицию. Так что не злоупотребляйте ими. Да и прицельный огонь ими вести сложно.
57. Оружие нужно чистить каждый день. Особенно нежно в районе дульного тормоза. Если там будет канавка или ямка, то кучность боя сильно упадет.
58. Последние три патрона в магазине лучше забить трассерами. Чтобы пустой магазин не стал для вас неожиданностью. Более того, если вы оставите один патрон в стволе, то вам останется только подстегнуть новый магазин, то есть скорость перезарядки возрастет.
59. Следите за ногами, не ленитесь их мыть. Натрете — и вы уже не воин.
60. Если видите, что по кому-то можно стрелять, это еще не повод стрелять. Если вас не заметили, узнайте у командира, можно ли ввязываться в бой.
61. Если вы кого-то заметили, но вас еще не увидели, не надо резко прыгать в сторону.
Периферическое зрение засечет вас мгновенно. Мягко и плавно, не торопясь, сядьте и спокойно займите позицию. Это будет гораздо менее заметно.
62. Помните, досылая патрон в патронник, затвор нужно отпускать резко, чтоб лязгнул. Иначе «зажует».
СПИСОК СНАРЯЖЕНИЯ ДЛЯ ВОЙНЫ- НЕ ДЛЯ ТУРПОХОДА:
СНАРЯЖЕНИЕ И ЭКИПИРОВКА
1. 2 рюкзака. Один обозный, второй штурмовой 25 л (штурмовой с быстрым сбросом).
2. Наколенники жесткие. И если возможно налокотники (при первых выстрелах в бою боец падает на колени, может разбить чашечки).
3. Туристический коврик (каремат)
4. Разгрузка
5. Бронежилет
6. Активные наушники
7. Баллистический очки
8. Бронешлем. или, в худшем варианте каска
9. Фляга или гидратор
10. Кусачки для ногтей (через две недели отрастают, ножом не обрежешь, ломаются когда вставляешь рожок в автомат, сильная боль).
11. Компас
12. Паракорд (легкий нейлоновый трос) 20 метров
13. Вилка ложка
14. Грим. Зеркальце.
15. Набор ниток и иголок. Спички. Тальк
16. Стрелковые перчатки
17. Скотч прозрачный (привязать гранату при растяжке к дереву, порвался берц – обмотал и побежал дальше).
18. Фонарь. Нож. Часы со стрелками
19. Армейская рация Бинокль Дальномер
20. Средство от насекомых (не вонючее)
21. Мусорные мешки для воды. К низу мешка привязываешь камушек, пробиваешь дырку, расправляешь мешок на ветках, внутрь бросаешь ветки, из-за перепада температур получается конденсат, подставляешь емкость под мешок, за сутки от 200 до 300 грамм воды из конденсата.
22. 1 кг сала мешается со 150гр чеснока, перец соль по вкусу, перекручивается на мясорубку. Шприцом без иглы заталкивается в тюбик от зубной пасты или в другую емкость. Хранится до пол у года в жаре. Очень калорийно (можно применять не останавливая марш-бросок).
1. Берцы: чтобы не пропускали воду и были легкие (обр. рыбьим жиром или салом)
2. Носки шерстяные, высокие, 5 пар (выводят пот, не дают натереть ноги).
3. Прокладки женские, большие (в берцы, впитывают пот).
4. Плотные штаны и куртка
5. Термобелье. Несколько маек, только хлопок
6. Маскхалат (и летний и зимний)
7. Флисовая куртка (вместо свитера, она легче, вес очень важен)
8. Зимние сапоги (советую «Хаски с.080» — дешево и сердито)
9. Панама из брезента, что бы хоть чуть-чуть держала влагу
10. Арафатка. Смоченным платком обвязывается шея (на много легче, на шее есть много важных точек).
1. Берете то, что нужно лично вам, под ваши персональные болячки. Плюс:
2. 3 артериальных новых жгута (старые при растяжке рассыпаются), 2-3 ИПП, много бинтов, рулон эластичного бинта (он зафиксирует все, что угодно, может заменить жгут)
3. Бактерицидный пластырь, лучше водостойкий; Пластырь рулонный, лучше на тканевой основе. Дезинфицирующее средство (недорого раствор хлоргексидина), хорошо бы гель пантестин (раны, ожоги)
4. Жаропонижающее, обезболивающие – аспирин, парацетомол, КЕТОРОЛ (промедол вряд ли достанете)
5. Элементарные капли в нос и для глаз
6. Аллергия, укусы комров – 1% гидрокортизоновая мазь
7. антибиотики широкого спектра действия (амоксицилин, амиксиклав, ципрофлоксацин)
8. Активированный уголь. Чем больше тем лучше (приходиться пить воду из реки где плавают трупы, да и просто под нагрузками живот начинает ерундой страдать). Кстати, белый уголь можно применять в порошке как кровеостанавливающее. Он же применим как антисептик, как энтеросорбент, как искусственная почка и т д . Прошел испытания в Афганистане, в Спитаке и Винницком мед инст. При его применении нет нагнивания ран (применяется в гнойной хирургии). При ожогах. На раны в сухом виде. Внутрь только разведенный водой.
9. При большой потере жидкости — регидрон.
10. Кровоостанавливающее — этамзилат, дицинон (в ампулах).
11. Ножницы, кусачки.
12. Шовный материал, иголка + нить, для зашивания ран (в аптеке)
13. Противошоковый набор. (кеторол, димедрол, преднизалон, кардиомин, адреналин) что есть что:
кеторол — обезболит (вряд ли на гражданке вы найдете промидол)
димедрол+преднизолон (колоть оба, но в разных шприцах, снимут любую аллергическую реакцию на укусы, яд. токсины), кардиомин — поддержит работу сердца при резком падении давления при укусах или ранениях, адреналин — это если совсем все плохо, анафилактический шок+остановка сердца или нитевидный пульс)
Те, кто прошел Афган, меня поймут. А вы, молодые, поймите этот опыт отдают вам люди, прошедшие не одну войну и оставившие там много друзей. Поэтому заучи это как «ОТЧЕ НАШ».
Если этот листок поможет тебе остаться живым, то я не напрасно его писал.
Твой друг.
Легкоплавкие металлы – список, особенности и значение для человека
Однозначности в классификации этой группы металлов у специалистов нет. Их главное свойство содержится в названии – легкоплавкие металлы.

Что представляет собой
Как понятно из названия, легкоплавким считается металл с малой температурой плавления.
В номенклатуре, принятой Международным союзом теоретической и прикладной химии (ИЮПАК), термин «легкоплавкие металлы» отсутствует.
У специалистов единства тоже нет. Одни выставляют «порог плавления» в 500°С. Для других легкоплавким металлом является металл, расплавляющийся при менее 600°С.
Перечень
В соответствии с основной классификацией (температура плавления не более 500°С), к списку легкоплавов причислены следующие элементы:
| Название | Температура плавления (°С) |
| Цинк | 419 |
| Палладий | 327 |
| Свинец | 327 |
| Кадмий | 321 |
| Таллий | 303 |
| Висмут | 271 |
| Полоний | 254 |
| Олово | 232 |
| Индий | 157 |
| Натрий | 98 |
| Калий | 63 |
| Рубидий | 39 |
| Галлий | 30 |
| Цезий | 28 |
| Ртуть | – 39 |
Ртуть – самый легкоплавкий металл. Она единственная из группы плавится на морозе.
Галлий называют металлом, тающим в руках (нормальная температура тела человека выше точки плавления вещества почти на семь градусов).
Классификация
Легкоплавы подразделяются на две группы:
- Тяжелые легкоплавкие металлы – кадмий, кобальт, свинец, ртуть. легкоплавкие металлы – кадмий, олово, галлий, индий, таллий, полоний, висмут.
К драгоценным элементам причислен палладий.

Палладий
Легкие элементы полоний и висмут радиоактивны .

Висмут
Олово, таллий, свинец, цезий – мягкие легкоплавы.

Свинец
Самый мягкий легкоплавкий металл – цезий (0,2 по шкале твердости Мооса).
Где и как применяются
Для всех сфер применения решающее преимущество данной группы – низкая температура плавления.
Особенности использования
На основании этого свойства легкоплавких металлов определены способы использования:
- Мягкие легкоплавы – материал пайки микросхем. Пайка обычным припоем исключена, поскольку создает перегрев, который их расплавит.
- Гораздо чаще используются сплавы. Они легкоплавки, но плотные, прочные на разрыв, химически инертны.
- Самые востребованные соединения: свинцовые, оловянные, кадмиевые, цинковые, ртутные. А также с висмутом, таллием, индием, галлием как базисным компонентом.
Легкоплавкие сплавы – это конгломерат металлов с температурой плавления не выше «оловянной» (232°С). Нижний предел – минус 61°C. На таком холоде плавится амальгама таллия.
Области применения
Сферы применения материала: энергетика, машиностроение, электро-, радиотехника, химпром:
- Основа жидких теплоносителей, смазка.
- Выплавка моделей сложной конфигурации.
- Пожарный сегмент: термодатчики, клапаны тушения огня, другая аппаратура раннего оповещения о возгораниях.
- Основа термометров разных видов и предназначения.
- Верхний слой, предохранители, термодатчики микроэлектроники.
- Медицина. Материал протезов, фиксатор при переломах.
Это также проводники, антикоррозионные покрытия, компонент антифрикционных сплавов.
Используются уникальные свойства отдельных позиций из списка легкоплавов:
- Свинец – материал подшипников, предохранителей, аккумуляторов, оболочка кабеля. Это щит от радиоактивного излучения.
- Олово – защитный слой стали.
- Цинк – компонент латуней, анодное покрытие стальных изделий с высоким КПД.
- Галлий – заменитель ртути, сохраняющий вакуум в аппаратуре.
Легко плавящиеся сплавы образуют также щелочные металлы. На практике такие материалы используются мало из-за чрезмерной химической активности.
Биологическое воздействие
Влияние легкоплавов на организм человека различно:
- Без калия как удобрения растения чахнут, плохо плодоносят. В организме человека работает в дуэте с натрием. Под его контролем жизненно важные процессы.
- Микродозы кадмия содействуют метаболизму. Однако вещество, его растворимые соединения токсичны.
- Висмут токсичен, но безопасен для биологических организмов. Это радиоактивное вещество, поэтому аптечные препараты с ним нужно применять строго по инструкции.
- О токсичности галлия точки зрения противоположны – от малой до высокой степени. Но интоксикация веществом реальна.
- Бесполезные для человека как биологического объекта свинец и ртуть токсичны. Особенно опасна ртуть из разбившегося домашнего градусника.
На особом счету таллий. Мягкое серебристое с сероватой голубизной вещество – сильнейший яд. Его «вывела в свет» как средство получения наследства, решения других проблем Агата Кристи. Описание яда, технологии его применения содержит десяток романов королевы английского детектива.
Читайте также:
