Металл проявляющий переменную степень окисления в соединениях
За лето ребенок растерял знания и нахватал плохих оценок? Не беда! Опытные педагоги помогут вспомнить забытое и лучше понять школьную программу. Переходите на сайт и записывайтесь на бесплатный вводный урок с репетитором.
Вводный урок бесплатно, онлайн, 30 минут
Предварительный просмотр:
Контрольная работа по теме «Металлы»
1 (3 балла). Число электронов на внешнем электронном уровне атома металла главной подгруппы Периодической системы может быть равно:
А. 1. Б. 2. В. 3. Г. Все ответы верны.
2 (3 балла). Электронная формула иона А1 3+ :
A. ls 2 2s 2 2p 6 3s 2 3p 6 . B. ls 2 2s 2 2p 6 3s 2 3p 1
Б. ls 2 2s 2 2p 6 3s 2 3p 6 4s 2 4p 1 . Г. ls 2 2s 2 2p 6
3 (3 балла). Самый тугоплавкий металл:
А. Алюминий. Б. Магний. В. Вольфрам. Г. Свинец.
4 (3 балла). Постоянную степень окисления в соединениях проявляет:
А. Железо. Б. Хром. В. Медь. Г. Натрий.
5 (3 балла). Амфотерный оксид образуется при сгорании в кислороде:
А. Алюминия. В. Кремния.
Б. Кальция. Г. Натрия.
6 (3 балла). Железо взаимодействует с каждым из веществ, формулы которых:
А. НС1, SO 2 , Н 2 O. В. NaOH, Н 3 РO 4 , Вr 2 .
Б. O 2 , Cl 2 , HNO 3(pa36) . Г. СuО, А1С1 3 , O 2 .
7 (3 балла). Формула вещества X в цепочке превращений
А. СаСO 3 . Б. Са(ОН) 2 . В. Ca(NO 3 ) 2 . Г. CaSO 4 .
8 (3 балла). Реактив для распознавания катионов Fe 3+ :
А. Нитрат серебра. Б. Серная кислота. В. Роданид калия. Г. Хлорид бария.
9 (3 балла). Самый пластичный металл:
А. Алюминий. В. Литий.
Б. Золото. Г. Серебро.
10 (3 балла). Металл, проявляющий в соединениях переменную степень окисления:
А. Калий. Б. Хром. В. Цинк. Г. Магний.
Задание 2. Осуществить цепочку превращений:
Ca → CaO → Ca(OH) 2 → Ca(NO 3 ) 2 → Ca 3 (PO 4 ) 2
Задание 3. При растворение цинка в соляной кислоте выделилось 13,44л(н.у) газа. Определите массу прореагировавшего цинка. Определите массу образовавшейся соли.
1 (3 балла). Металл, проявляющий в соединениях переменную степень окисления:
2 (3 балла). Металл, который пассивируется концентрированной серной кислотой:
А. Магний. В. Медь.
Б. Железо. Г. Цинк.
3 (3 балла). Ряд формул веществ, каждое из которых взаимодействует с цинком:
А. НС1, SO 2 , Н 2 O. В. NaOH, Н 3 РO 4 , Вг 2 .
Б. O 2 , NaCl, HNO 3(paзб) . Г. H 2 SO 4 , SO 2 , O 2 .
4 (3 балла). Переход, который нельзя осуществить в одну стадию:
A. Железо→ хлорид железа (III).
Б. Медь→ нитрат меди (II).
B. Натрий→ гидроксид натрия.
Г. Магний→ гидроксид магния.
5 (3 балла). Металл, реагирующий с соляной кислотой при обычных условиях:
А. Алюминий. Б. Серебро. В. Медь. Г. Ртуть.
6 (3 балла). Вещество, взаимодействие которого с магнием отображается сокращенным ионным уравнением Mg° + 2Н + = Mg 2+ + Н 2 0 :
А. Серная кислота. В. Кремниевая кислота.
Б. Вода. Г. Азотная кислота.
7 (3 балла). Число электронов на внешнем электронном уровне атома металла главной подгруппы Периодической системы может быть равно:
8 (3 балла). Электронная формула иона А1 3+ :
9 (3 балла). Самый тугоплавкий металл:
10 (3 балла). Постоянную степень окисления в соединениях проявляет:
Fe → FeCl 3 → Fe(OH) 3 → Fe 2 O 3 → FeO
Задание 3. Кусочек кальция поместили в избыток воды, при этом выделилось 5,6 л(н.у) газа. Определите массу прореагировавшего кальция. Определите массу образовавшегося осадка.
1 (3 балла). Металл, реагирующий с соляной кислотой при обычных условиях:
2 (3 балла). Вещество, взаимодействие которого с магнием отображается сокращенным ионным уравнением Mg° + 2Н + = Mg 2+ + Н 2 0 :
3 (3 балла). Число электронов на внешнем электронном уровне атома металла главной подгруппы Периодической системы может быть равно:
4 (3 балла). Электронная формула иона А1 3+ :
5 (3 балла). Самый тугоплавкий металл:
6 (3 балла). Постоянную степень окисления в соединениях проявляет:
7 (3 балла). Ряд формул веществ, каждое из которых взаимодействует с цинком:
А. НС1, SO 2 , Н 2 O. В. NaOH, Н 3 РO 4 , Вг 2 .
8 (3 балла). Переход, который нельзя осуществить в одну стадию:
9 (3 балла). Металл, реагирующий с соляной кислотой при обычных условиях:
10 (3 балла). Вещество, взаимодействие которого с магнием отображается сокращенным ионным уравнением Mg° + 2Н + = Mg 2+ + Н 2 0 :
Al → Al 2 O 3 → AlCl 3 → Al(OH) 3 → Na 3 AlO 3
Задание 3. Горение натрия на воздухе идет до пероксида натрия. Определить массу пероксида натрия образующегося при горение 2,3 г натрия. Определите объем кислорода который потребуется для сгорания 0,35 моль натрия.
4 (3 балла). Амфотерный оксид образуется при сгорании в кислороде:
5 (3 балла). Железо взаимодействует с каждым из веществ, формулы которых:
6 (3 балла). Формула вещества X в цепочке превращений
Fe → FeCl 2 → Fe(NO 3 ) 2 → Fe(OH) 2 → FeO
Задание 3. Кусочек натрия массой 9,2 г поместили в избыток воды. Определите массу образовавшегося гидроскида натрия. Определите объем выделившегося газа.
По теме: методические разработки, презентации и конспекты

Контрольная работа по природоведению 5 класс; контрольная работа по географии 6 класс "Гидросфера"
Контрольные работы составлены с учётом материалов учебников "Природоведение 5 класс" авторы: Т.С. Сухова, В.И.Строганов и "Землеведение 6 класс" авторы :В.П.Дронов,Л.Е.Савельева.Данные работы ап.
Комплексные числа.Контрольная работа №1 и контрольная работа №2
Контрольная работа №1 и №2 по теме " Комплексные числа" на курсах "Учитель профильной школы".

Методические указания и контрольные задания для домашней контрольной работы по ПМ 04. Управление работами по производству и переработке продукции растениеводства МДК. 04.03Организация малого бизнеса для студентов заочной формы обучения Специальность
Методические указания и контрольные задания для домашней контрольной работы поПМ 04. Управление работами по производству и переработке продукции растениеводства МДК. 04.03Организация малого.
Методические указания и контрольные задания для домашней контрольной работы по ПМ 04. Управление работами по производству и переработке продукции растениеводства МДК.04.02. Учет и анализ хозяйственной деятельности для студентов заочной формы обучения
Методические указания и контрольные задания для домашней контрольной работы по ПМ 04. Управление работами по производству и переработке продукции растениеводстваМДК.04.02. Учет и анализ хо.
Методические указания и контрольные задания для домашней контрольной работы по ПМ 04. Управление работами по производству и переработке продукции животноводства МДК.04.01. Управление структурным подразделением организации для студентов заочной формы
Методические указания и контрольные задания для домашней контрольной работы по ПМ 04. Управление работами по производству и переработке продукции животноводства МДК.04.01. Управление .

Контрольная работа по русскому языку по теме "Наречие" 7 класс, контрольная работа по русскому языку по теме "Частицы" 7 класс
Контрольная работа по теме "Наречие", контрольная работа по теме "Частицы".
Таблица окисления химических элементов

Степень окисления – условная величина, использующаяся для записи окислительно-восстановительных реакций. Для определения степени окисления используется таблица окисления химических элементов.
Значение
Степень окисления основных химических элементов основана на их электроотрицательности. Значение равно числу смещённых в соединениях электронов.
Степень окисления считается положительной, если электроны смещаются от атома, т.е. элемент отдаёт электроны в соединении и является восстановителем. К таким элементам относятся металлы, их степень окисления всегда положительная.
При смещении электрона к атому значение считается отрицательным, а элемент – окислителем. Атом принимает электроны до завершения внешнего энергетического уровня. Окислителями является большинство неметаллов.
Простые вещества, не вступающие в реакцию, всегда имеют нулевую степень окисления.
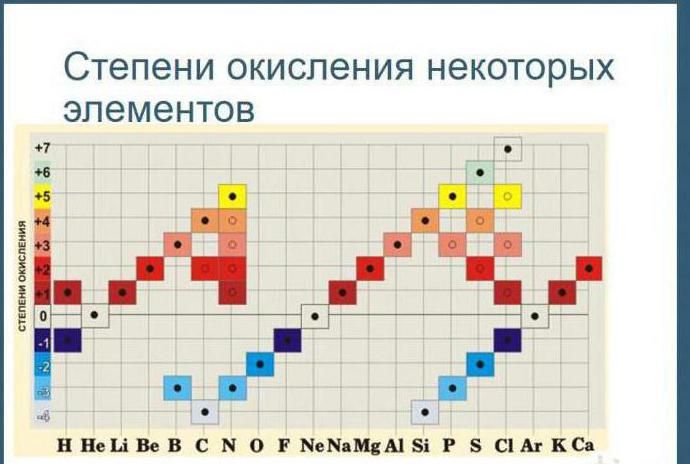
Рис. 1. Таблица степеней окисления.
В соединении положительную степень окисления имеет атом неметалла с меньшей электроотрицательностью.
Определение
Определить максимальную и минимальную степень окисления (сколько электронов может отдавать и принимать атом) можно по периодической таблице Менделеева.
Максимальная степень равна номеру группы, в которой находится элемент, или количеству валентных электронов. Минимальное значение определяется по формуле:
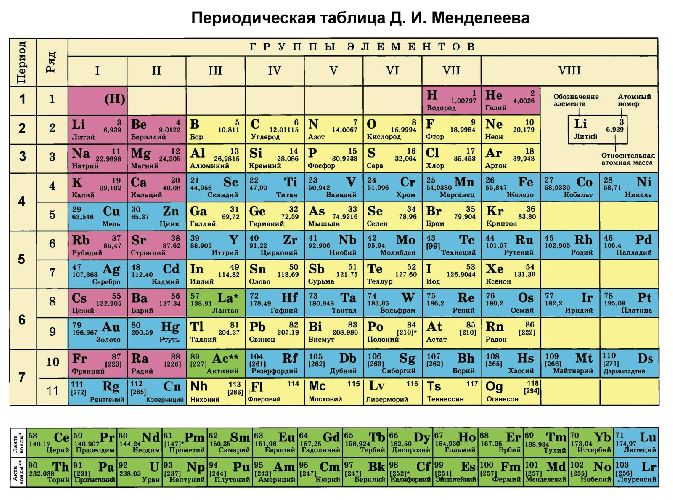
Рис. 2. Таблица Менделеева.
Углерод находится в четвёртой группе, следовательно, его высшая степень окисления +4, а низшая – -4. Максимальная степень окисления серы +6, минимальная – -2. Большинство неметаллов всегда имеет переменную – положительную и отрицательную – степень окисления. Исключением является фтор. Его степень окисления всегда равна -1.
Следует помнить, что к щелочным и щелочноземельным металлам I и II групп соответственно, это правило не применимо. Эти металлы имеют постоянную положительную степень окисления – литий Li +1 , натрий Na +1 , калий K +1 , бериллий Be +2 , магний Mg +2 , кальций Ca +2 , стронций Sr +2 , барий Ba +2 . Остальные металлы могут проявлять разную степень окисления. Исключением является алюминий. Несмотря на нахождение в III группе, его степень окисления всегда +3.

Рис. 3. Щелочные и щелочноземельные металлы.
Из VIII группы высшую степень окисления +8 могут проявлять только рутений и осмий. Находящиеся в I группе золото и медь проявляют степень окисления +3 и +2 соответственно.
Запись
Чтобы правильно записывать степень окисления, следует помнить о нескольких правилах:
- инертные газы не вступают в реакции, поэтому их степень окисления всегда равна нулю;
- в соединениях переменная степень окисления зависит от переменной валентности и взаимодействия с другими элементами;
- водород в соединениях с металлами проявляет отрицательную степень окисления – Ca +2 H2 −1 , Na +1 H −1 ;
- кислород всегда имеет степень окисления -2, кроме фторида кислорода и пероксида – O +2 F2 −1 , H2 +1 O2 −1 .
Что мы узнали?
Степень окисления – условная величина, показывающая, сколько электронов принял или отдал атом элемента в соединении. Величина зависит от количества валентных электронов. Металлы в соединениях всегда имеют положительную степень окисления, т.е. являются восстановителями. Для щелочных и щелочноземельных металлов степень окисления всегда одинаковая. Неметаллы, кроме фтора, могут принимать положительную и отрицательную степень окисления.
Чтобы определить условный заряд атомов в окислительно-восстановительных реакциях, используют таблицу окисления химических элементов. В зависимости от свойств атома элемент может проявлять положительную или отрицательную степень окисления.
Что такое степень окисления
Условный заряд атомов элементов в сложных веществах называется степенью окисления. Значение заряда атомов записывается в окислительно-восстановительных реакциях, чтобы понять, какой элемент является восстановителем, а какой – окислителем.
Степень окисления взаимосвязана с электроотрицательностью, которая показывает возможность атомов принимать или отдавать электроны. Чем выше значение электроотрицательности, тем больше способность атома отнимать электроны в реакциях.

Рис. 1. Ряд электроотрицательности.
Степень окисления может иметь три значения:
- нулевое – атом находится в состоянии покоя (все простые вещества имеют степень окисления 0);
- положительное – атом отдаёт электроны и является восстановителем (все металлы, некоторые неметаллы);
- отрицательное – атом принимает электроны и является окислителем (большинство неметаллов).
Например, степени окисления в реакции натрия с хлором выглядят следующим образом:
В реакции металлов с неметаллами металл всегда является восстановителем, а неметалл – окислителем.
Как определить
Существует таблица, в которой указаны все возможные степени окисления элементов.
Название
Символ
Степень окисления
-3, -2, -1, 0, +1, +2, +3, +4, +5
+2, +3, редко +4 и +6
-1, +1, +5, редко +3, +4
+3, +6, редко +2, +3, +5
+6, редко +2, +3, +4, +5
+3, +4, +6, +8, редко +2
+3, +4, +6, редко +1, +2
+2, +4, +6, редко +1, +3
+3, редко +3, +2, +4, +5
Или использовать на уроках этот вариант таблицы.

Рис. 2. Таблица степеней окисления.
Кроме того, степени окисления химических элементов можно определить по периодической таблице Менделеева:
- высшая степень (максимально положительная) совпадает с номером группы;
- для определения минимального значения степени окисления из номера группы вычитается восемь.
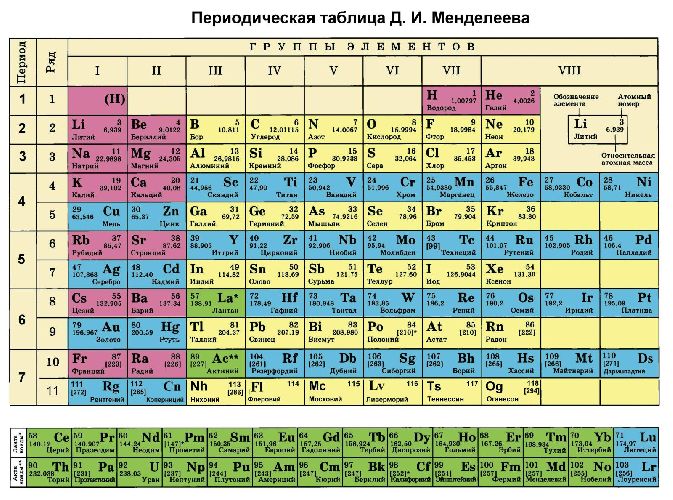
Рис. 3. Таблица Менделеева.
Большинство неметаллов имеют положительную и отрицательную степени окисления. Например, кремний находится в IV группе, значит, его максимальная степень окисления +4, а минимальная -4. В соединениях неметаллов (SO3, CO2, SiC) окислителем является неметалл с отрицательной степенью окисления или с большим значением электроотрицательности. Например, в соединении PCl3 фосфор имеет степень окисления +3, хлор -1. Электроотрицательность фосфора – 2,19, хлора – 3,16.
Второе правило не работает для щелочных и щелочноземельных металлов, которые всегда имеют одну положительную степень окисления, равную номеру группы. Исключения составляют магний и бериллий (+1, +2). Также постоянную степень окисления имеют:
- алюминий (+3);
- цинк (+2);
- кадмий (+2).
Остальные металлы имеют непостоянную степень окисления. В большинстве реакций выступают в качестве восстановителя. В редких случаях могут быть окислителями с отрицательной степенью окисления.
Фтор – самый мощный окислитель. Его степень окисления всегда -1.
Из урока 8 класса узнали о степени окисления. Это условная величина, показывающая, сколько электронов может отдать или принять атом в ходе химической реакции. Значение связано с электроотрицательностью. Окислители принимают электроны и имеют отрицательную степень окисления, восстановители отдают электроны и проявляют положительную степень окисления. Большинство металлов – восстановители с постоянной или переменной степенью окисления. Неметаллы могут проявлять свойства окислителя и восстановителя в зависимости от вещества, с которым реагируют.
Металл проявляющий переменную степень окисления в соединениях
Тип 3 № 7081Из числа указанных в ряду элементов выберите два элемента, которые проявляют низшую степень окисления, равную –4. Запишите в поле ответа номера выбранных элементов.
Для выполнения заданий 1–3 используйте следующий ряд химических элементов:
Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Тип 1 № 7079Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне четыре электрона. Запишите в поле ответа номера выбранных элементов.
На внешнем энергетическом уровне четыре электрона имеют элементы IV группы: углерод и кремний.
Тип 2 № 7080Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде.
Расположите выбранные элементы в порядке возрастания их металлических свойств. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Металлические свойства усиливаются по периоду справа налево: , и .
Источник: Демонстрационная версия ЕГЭ—2017 по химии, Демонстрационная версия ЕГЭ—2018 по химии, Демонстрационная версия ЕГЭ−2019 по химии
Низшую степень окисления, равную –4, проявляют элементы IV группы: кремний и углерод.
Тип 3 № 7150Из числа указанных в ряду элементов выберите два элемента, которые проявляют высшую степень окисления, равную +1. Запишите в поле ответа номера выбранных элементов.
Тип 1 № 7148Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне один электрон. Запишите в поле ответа номера выбранных элементов.
На внешнем уровне один электрон имеют атомы I группы: натрий и калий.
Тип 2 № 7149В одном периоде находятся , , . Металлические свойства усиливаются по периоду справа налево: , и .
Высшую степень окисления, равную +1, проявляют элементы I группы: натрий и калий.
Тип 3 № 7152Из числа указанных в ряду элементов выберите два элемента, которые проявляют низшую степень окисления, равную −2. Запишите в поле ответа номера выбранных элементов.
Тип 1 № 7151Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне пять электронов. Запишите в поле ответа номера выбранных элементов.
На внешнем уровне пять электронов имеют атомы элементов V группы: фосфор и азот.
Тип 2 № 7153Низшую степень окисления, равную −2, проявляют элементы VI группы: сера и кислород.
Тип 3 № 7155Из числа указанных в ряду элементов выберите два элемента, которые проявляют высшую степень окисления, равную +2. Запишите в поле ответа номера выбранных элементов.
Тип 1 № 7154Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне два электрона. Запишите в поле ответа номера выбранных элементов.
На внешнем уровне два электрона имеют атомы элементов II группы: бериллий и магний.
Тип 2 № 7156Расположите выбранные элементы в порядке возрастания их неметаллических свойств. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
В одном периоде находятся , , . Неметаллические свойства усиливаются по периоду слева направо: , и .
Контрольная работа по теме "Металлы" 9 класс
тест по химии (9 класс)
Контрольная работа № 2 по теме «Металлы».
Часть А . Тестовые задания с выбором одного правильного ответа.
- Электронное строение атома кальция:
- 2, 8, 8, 2 2) 2, 8, 2 3) 2, 8, 8 4) 2, 8, 6
- Группа периодической системы химических элементов, в которой все элементы относятся к металлам:
- I 2) II 3) III 4) IV
- Ряд химических элементов, расположенных в порядке увеличения их атомных радиусов:
- K → Na → Li 2) Al → Na → Mg 3) Li → Na → K 4) Na → Mg → Be
- Валентность 3 в соединениях могут проявлять оба элемента:
- Be и Ga 2) B и C 3) Al и Fe 4) Ag и Al
- Вещество, которое может восстановить медь из её оксида, - это:
- Водород 2) азот 3) соляная кислота 4) оксид углерода (IV)
- Железо взаимодействует с каждым из двух веществ:
- соляная кислота и хлор 3) серная кислота и оксид алюминия
- хлорид лития и гидроксид калия 4) сульфат меди (II) и карбонат кальция
- Оба оксида реагируют с растворами кислот и щелочей:
- CuO и CO 2 2) ZnO и P 2 O 5 3) BeO и Al 2 O 3 4) NO и MgO
- Верны ли следующие суждения о свойствах металлов?
А. С водой при обычных условиях реагируют только щелочные металлы.
Б. Металлы в химических реакциях проявляют только восстановительные свойства.
1) верно только А. 2) верно только Б 3) верны оба 4) неверны оба
- Формула вещества Х в цепочке превращений Fe → X → Fe(OH) 3
- FeO 2) Fe 2 O 3 3) FeCl 3 4) FeCl 2
- Реактивом на ион Ва 2+ является ион:
- Cl - 2) SO 4 2- 3) NO 3 - 4) Br -
- В ряду химических элементов Al → Mg → Na
- увеличиваются радиусы атомов химических элементов;
- увеличивается число электронов на внешнем энергетическом уровне;
- увеличиваются заряды ядер атомов;
- усиливаются восстановительные свойства;
- уменьшается число энергетических уровней
- Установите соответствие между исходными веществами и продуктами реакции.
A. Al, NaOH, H 2 O
Б. Fe и H 2 SO 4
2) Fe 2 (SO 4 ) 3 и H 2
4)Na[Al(OH) 4 ] и H 2
5) Ag и Cu(NO 3 ) 2
Часть С . Задания с развёрнутым ответом.
- Дополните генетический ряд железа. запишите уравнения реакций в соответствии со схемой Fe(ОН) 2 → X → Fe 2 O 3 → FeCl 3 .
- Металлическую пластинку прокалили. Полученное вещество черного цвета разделили на две части. Одна часть при нагревании в токе водорода превратилась в исходный металл розового цвета и воду, а растворение другой части в серной кислоте сопровождалось образованием сине-голубого раствора. Определите неизвестный металл и запишите уравнения реакций.
- Число нейтронов и протонов в изотопе 42 Са соответственно равно:
- 20 и 20 2) 22 и 20 3) 20 и 22 4) 20 и 40
- Атом лития отличается от иона лития:
- радиусом частицы 2) зарядом ядра 3) числом протонов 4) числом электронов
- Металл, проявляющий переменную степень окисления в соединениях:
- алюминий 2) барий 3) железо 4) калий
- Ряд химических элементов, расположенных в порядке усиления металлических свойств:
- Ca → Mg → Be 2) Na → Mg → Al 3) Al → Mg → Be 4) Li → Na → K
- Алюминий взаимодействует с каждым из двух веществ:
- сера, концентрированная азотная кислота 3) соляная кислота, оксид железа (III)
- бром, концентрированная серная кислота 4) оксид углерода (IV), азот
- Металл, который не взаимодействует с соляной кислотой:
- Кальций 2) ртуть 3) цинк 4) железо
- Вещества, взаимодействие которых не сопровождается выделением водорода:
- Cu и H 2 SO 4 2) Al и NaOH 3) Ca и H 2 O 4) NaH и H 2 O
- Верны ли следующие суждения о сплавах?
А. Сплав меди с оловом называется латунью.
Б. В состав нержавеющей стали входят железо, никель, хром.
1) верно только А 2) верно только Б 3) верны оба 4) неверны оба
- Формула вещества Х в цепочке превращений Na → X → Na 2 O:
- NaOH 2) Na 2 O 2 3) NaH 4) NaBr
- Реактивом на ион Fe 3+ является:
- OH - 2) Br - 3) SO 4 2- 4) NO 3 -
Читайте также:
