Металл и концентрированная кислота
IIA группа содержит только металлы – Be (бериллий), Mg (магний), Ca (кальций), Sr (стронций), Ba (барий) и Ra (радий). Химические свойства первого представителя этой группы — бериллия — наиболее сильно отличаются от химических свойств остальных элементов данной группы. Его химические свойства во многом даже более схожи с алюминием, чем с остальными металлами IIA группы (так называемое «диагональное сходство»). Магний же по химическим свойствами тоже заметно отличается от Ca, Sr, Ba и Ra, но все же имеет с ними намного больше сходных химических свойств, чем с бериллием. В связи со значительным сходством химических свойств кальция, стронция, бария и радия их объединяют в одно семейство, называемое щелочноземельными металлами.
Все элементы IIA группы относятся к s-элементам, т.е. содержат все свои валентные электроны на s-подуровне. Таким образом, электронная конфигурация внешнего электронного слоя всех химических элементов данной группы имеет вид ns 2 , где n – номер периода, в котором находится элемент.
Вследствие особенностей электронного строения металлов IIA группы, данные элементы, помимо нуля, способны иметь только одну единственную степень окисления, равную +2. Простые вещества, образованные элементами IIA группы, при участии в любых химических реакциях способны только окисляться, т.е. отдавать электроны:
Ме 0 – 2e — → Ме +2
Кальций, стронций, барий и радий обладают крайне высокой химической активностью. Простые вещества, образованные ими, являются очень сильными восстановителями. Также сильным восстановителем является магний. Восстановительная активность металлов подчиняется общим закономерностям периодического закона Д.И. Менделеева и увеличивается вниз по подгруппе.
Взаимодействие с простыми веществами
с кислородом
Без нагревания бериллий и магний не реагируют ни с кислородом воздуха, ни с чистым кислородом ввиду того, что покрыты тонкими защитными пленками, состоящими соответственно из оксидов BeO и MgO. Их хранение не требует каких-либо особых способов защиты от воздуха и влаги, в отличие от щелочноземельных металлов, которые хранят под слоем инертной по отношению к ним жидкости, чаще всего керосина.
Be, Mg, Ca, Sr при горении в кислороде образуют оксиды состава MeO, а Ba – смесь оксида бария (BaO) и пероксида бария (BaO2):
Следует отметить, что при горении щелочноземельных металлов и магния на воздухе побочно протекает также реакция этих металлов с азотом воздуха, в результате которой, помимо соединений металлов с кислородом, образуются также нитриды c общей формулой Me3N2.
с галогенами
Бериллий реагирует с галогенами только при высоких температурах, а остальные металлы IIA группы — уже при комнатной температуре:
с неметаллами IV–VI групп
Все металлы IIA группы реагируют при нагревании со всеми неметаллами IV–VI групп, но в зависимости от положения металла в группе, а также активности неметаллов требуется различная степень нагрева. Поскольку бериллий является среди всех металлов IIA группы наиболее химически инертным, при проведении его реакций с неметаллами требуется существенно большая температура.
Следует отметить, что при реакции металлов с углеродом могут образовываться карбиды разной природы. Различают карбиды, относящиеся к метанидам и условно считающимися производными метана, в котором все атомы водорода замещены на металл. Они так же, как и метан, содержат углерод в степени окисления -4, и при их гидролизе или взаимодействии с кислотами-неокислителями одним из продуктов является метан. Также существует другой тип карбидов – ацетилениды, которые содержат ион C2 2- , фактически являющийся фрагментом молекулы ацетилена. Карбиды типа ацетиленидов при гидролизе или взаимодействии с кислотами-неокислителями образуют ацетилен как один из продуктов реакции. То, какой тип карбида – метанид или ацетиленид — получится при взаимодействии того или иного металла с углеродом, зависит от размера катиона металла. С ионами металлов, обладающих малым значением радиуса, образуются, как правило, метаниды, с ионами более крупного размера – ацетилениды. В случае металлов второй группы метанид получается при взаимодействии бериллия с углеродом:
Остальные металлы II А группы образуют с углеродом ацетилениды:
С кремнием металлы IIA группы образуют силициды — соединения вида Me2Si, с азотом – нитриды (Me3N2), фосфором – фосфиды (Me3P2):
с водородом
Все щелочноземельные металлы реагируют при нагревании с водородом. Для того чтобы магний прореагировал с водородом, одного нагрева, как в случае со щелочноземельными металлами, недостаточно, требуется, помимо высокой температуры, также и повышенное давление водорода. Бериллий не реагирует с водородом ни при каких условиях.
Взаимодействие со сложными веществами
с водой
Все щелочноземельные металлы активно реагируют с водой с образованием щелочей (растворимых гидроксидов металлов) и водорода. Магний реагирует с водой лишь при кипячении вследствие того, что при нагревании в воде растворяется защитная оксидная пленка MgO. В случае бериллия защитная оксидная пленка очень стойкая: с ним вода не реагирует ни при кипячении, ни даже при температуре красного каления:
c кислотами-неокислителями
Все металлы главной подгруппы II группы реагируют с кислотами-неокислителями, поскольку находятся в ряду активности левее водорода. При этом образуются соль соответствующей кислоты и водород. Примеры реакций:
c кислотами-окислителями
− разбавленной азотной кислотой
С разбавленной азотной кислотой реагируют все металлы IIA группы. При этом продуктами восстановления вместо водорода (как в случае кислот-неокислителей) являются оксиды азота, преимущественно оксид азота (I) (N2O), а в случае сильно разбавленной азотной кислоты – нитрат аммония (NH4NO3):
− концентрированной азотной кислотой
Концентрированная азотная кислота при обычной (или низкой) температуре пассивирует бериллий, т.е. в реакцию с ним не вступает. При кипячении реакция возможна и протекает преимущественно в соответствии с уравнением:
Магний и щелочноземельные металлы реагируют с концентрированной азотной кислотой с образованием большого спектра различных продуктов восстановления азота.
− концентрированной серной кислотой
Бериллий пассивируется концентрированной серной кислотой, т.е. не реагирует с ней в обычных условиях, однако реакция протекает при кипячении и приводит к образованию сульфата бериллия, диоксида серы и воды:
Барий также пассивируется концентрированной серной кислотой вследствие образования нерастворимого сульфата бария, но реагирует с ней при нагревании, сульфат бария растворяется при нагревании в концентрированной серной кислоте благодаря его превращению в гидросульфат бария.
Остальные металлы главной IIA группы реагируют с концентрированной серной кислотой при любых условиях, в том числе на холоду. Восстановление серы происходит преимущественно до сероводорода:
с щелочами
Магний и щелочноземельные металлы со щелочами не взаимодействуют, а бериллий легко реагирует как растворами щелочей, так и с безводными щелочами при сплавлении. При этом при осуществлении реакции в водном растворе в реакции участвует также и вода, а продуктами являются тетрагидроксобериллаты щелочных или щелочноземельных металлов и газообразный водород:
При осуществлении реакции с твердой щелочью при сплавлении образуются бериллаты щелочных или щелочноземельных металлов и водород
с оксидами
Щелочноземельные металлы, а также магний могут восстанавливать менее активные металлы и некоторые неметаллы из их оксидов при нагревании, например:
Метод восстановления металлов из их оксидов магнием называют магниетермией.
Металл и концентрированная кислота
ОТНОШЕНИЕ МЕТАЛЛОВ К КИСЛОТАМ
Чаще всего в химической практике используются такие сильные кислоты как серная H 2 SO 4 , соляная HCl и азотная HNO 3 . Далее рассмотрим отношение различных металлов к перечисленным кислотам.
Соляная кислота ( HCl )
Соляная кислота – это техническое название хлороводородной кислоты. Получают ее путем растворения в воде газообразного хлороводорода – HCl . Ввиду невысокой его растворимости в воде, концентрация соляной кислоты при обычных условиях не превышает 38%. Поэтому независимо от концентрации соляной кислоты процесс диссоциации ее молекул в водном растворе протекает активно:
Образующиеся в этом процессе ионы водорода H + выполняют роль окислителя, окисляя металлы, расположенные в ряду активности левее водорода. Взаимодействие протекает по схеме:
Me + HCl соль + H 2 ↑
При этом соль представляет собой хлорид металла ( NiCl 2 , CaCl 2 , AlCl 3 ), в котором число хлорид-ионов соответствует степени окисления металла.
Соляная кислота является слабым окислителем, поэтому металлы с переменной валентностью окисляются ей до низших положительных степеней окисления:
Fe 0 → Fe 2+
Co 0 → Co 2+
Ni 0 → Ni 2+
Cr 0 → Cr 2+
Mn 0 → Mn 2+ и др .
2 Al + 6 HCl → 2 AlCl 3 + 3 H 2 ↑
2│ Al 0 – 3 e - → Al 3+ - окисление
3│2 H + + 2 e - → H 2 – восстановление
Соляная кислота пассивирует свинец ( Pb ). Пассивация свинца обусловлена образованием на его поверхности трудно растворимого в воде хлорида свинца ( II ), который защищает металл от дальнейшего воздействия кислоты:
Pb + 2 HCl → PbCl 2 ↓ + H 2 ↑
Серная кислота ( H 2 SO 4 )
В промышленности получают серную кислоту очень высокой концентрации (до 98%). Следует учитывать различие окислительных свойств разбавленного раствора и концентрированной серной кислоты по отношению к металлам.
Разбавленная серная кислота
В разбавленном водном растворе серной кислоты большинство ее молекул диссоциируют:
Образующиеся ионы Н + выполняют функцию окислителя.
Как и соляная кислота, разбавленный раствор серной кислоты взаимодействует только с металлами активными и средней активности (расположенными в ряду активности до водорода).
Химическая реакция протекает по схеме:
1│2Al 0 – 6e - → 2Al 3+ - окисление
Металлы с переменной валентностью окисляются разбавленным раствором серной кислоты до низших положительных степеней окисления:
Mn 0 → Mn 2+ и др .
Свинец ( Pb ) не растворяется в серной кислоте (если ее концентрация ниже 80%) , так как образующаяся соль PbSO 4 нерастворима и создает на поверхности металла защитную пленку.
Концентрированная серная кислота
В концентрированном растворе серной кислоты (выше 68%) большинство молекул находятся в недиссоциированном состоянии, поэтому функцию окислителя выполняет сера, находящаяся в высшей степени окисления ( S +6 ). Концентрированная H 2 SO 4 окисляет все металлы, стандартный электродный потенциал которых меньше потенциала окислителя – сульфат-иона SO 4 2- (0,36 В). В связи с этим, с концентрированной серной кислотой реагируют и некоторые малоактивные металлы.
Процесс взаимодействия металлов с концентрированной серной кислотой в большинстве случаев протекает по схеме:
Me + H 2 SO 4 (конц.) соль + вода + продукт восстановления H 2 SO 4
Продуктами восстановления серной кислоты могут быть следующие соединения серы:
Практика показала, что при взаимодействии металла с концентрированной серной кислотой выделяется смесь продуктов восстановления, состоящая из H 2 S , S и SO 2. Однако, один из этих продуктов образуется в преобладающем количестве. Природа основного продукта определяется активностью металла: чем выше активность, тем глубже процесс восстановления серы в серной кислоте.
Взаимодействие металлов различной активности с концентрированной серной кислотой можно представить схемой:

Алюминий ( Al ) и железо ( Fe ) не реагируют с холодной концентрированной H 2 SO 4 , покрываясь плотными оксидными пленками, однако при нагревании реакция протекает.
Ag , Au , Ru , Os , Rh , Ir , Pt не реагируют с серной кислотой.
Концентрированная серная кислота является сильным окислителем, поэтому при взаимодействии с ней металлов, обладающих переменной валентностью, последние окисляются до более высоких степеней окисления, чем в случае с разбавленным раствором кислоты:
Fe 0 → Fe 3+ ,
Cr 0 → Cr 3+ ,
Mn 0 → Mn 4+ ,
Sn 0 → Sn 4+
Свинец ( Pb ) окисляется до двухвалентного состояния с образованием растворимого гидросульфата свинца Pb ( HSO 4 )2 .

пятница, 20 февраля 2015 г.
Взаимодействие металлов с кислотами
С разбавленными кислотами, которые проявляют окислительные свойства за счет ионов водорода (разбавленные серная, фосфорная, сернистая, все бескислородные и органические кислоты и др.)

реагируют металлы:
• расположенные в ряду напряжений до водорода (эти металлы способны вытеснять водород из кислоты);
• образующие с этими кислотами растворимые соли (на поверхности этих металлов не образуется защитная солевая
пленка).
В результате реакции образуются растворимые соли и выделяется водород:
2А1 + 6НСI = 2А1С13 + ЗН2↑
М g + Н2 SO 4 = М gS О4 + Н2↑
разб.
С u + Н2 SO 4 → X (так как С u стоит после Н2)
разб.
РЬ + Н2 SO 4 → X (так как РЬ SO 4 нерастворим в воде)
разб.
Некоторые кислоты являются окислителями за счет элемента, образующего кислотный остаток, К ним относятся концентрированная серная, а также азотная кислота любой концентрации. Такие кислоты называют кислотами-окислителями.

Окислительные свойства кислотных остатков и значительно сильнее, чем нона водорода Н, поэтому азотная и концентрированная серная кислоты взаимодействуют практически со всеми металлами, расположенными в ряду напряжений как до водорода, так и после него, кроме золота и платины. Так как окислителями в этих случаях являются ноны кислотных остатков (за счет атомов серы и азота в высших степенях окисления), а не ноны водорода Н, то при взаимодействии азотной, а концентрированной серной кислот с металлами не выделяется водород. Металл под действием данных кислот окисляется до характерной (устойчивой) степени окисления и образует соль, а продукт восстановления кислоты зависит от активности металла и степени разбавления кислоты

Разбавленная и концентрированная серные кислоты ведут себя по-разному. Разбавленная серная кислота ведет себя, как обычная кислота. Активные металлы, стоящие в ряду напряжений левее водорода
вытесняют водород из разбавленной серной кислоты. Мы видим пузырьки водорода при добавлении разбавленной серной кислоты в пробирку с цинком.
Медь стоит в ряду напряжений после водорода – поэтому разбавленная серная кислота не действует на медь. А в концентрированной серной кислоты, цинк и медь, ведут себя таким образом…
Цинк, как активный металл, может образовывать с концентрированной серной кислотой сернистый газ, элементарную серу, и даже сероводород.
Медь - менее активный металл. При взаимодействии с концентрированно серной кислотой восстанавливает ее до сернистого газа.
Следует иметь в виду, что на схемах указаны продукты, содержание которых максимально среди возможных продуктов восстановления кислот.
На основании приведенных схем составим уравнения конкретных реакций — взаимодействия меди и магния с концентрированной серной кислотой:
0 +6 +2 +4
С u + 2Н2 SO 4 = С uSO 4 + SO 2 + 2Н2 O
конц.
0 +6 +2 -2
4М g + 5Н2 SO 4 = 4М gSO 4 + Н2 S + 4Н2 O
конц.
Некоторые металлы ( Fe . АI, С r ) не взаимодействуют с концентрированной серной и азотной кислотами при обычной температуре, так как происходит пассивации металла. Это явление связано с образованием на поверхности металла тонкой, но очень плотной оксидной пленки, которая и защищает металл. По этой причине азотную и концентрированную серную кислоты транспортируют в железных емкостях.
Если металл проявляет переменные степени окисления, то с кислотами, являющимися окислителями за счет ионов Н + , он образует соли, в которых его степень окисления ниже устойчивой, а с кислотами-окислителями — соли, в которых его степень окисления более устойчива:
0 +2
F е+Н2 SO 4 = F е SO 4 +Н2
0 разб. + 3
F е+Н2 SO 4 = F е2( SO4 )3 + 3 SO2 + 6Н2 O
конц
кислот-окислителей
Концентрированная серная кислота – бесцветная тяжелая маслянистая нелетучая жидкость. Не имеет запаха и тянет сказать: «без вкуса», но вкус у нее все же есть, пробовать не советую.
Разбавленная серная кислота ничем особым непримечательна. Свойства как и у других кислот. За исключением того, что она не реагирует со свинцом, так как образующийся сульфат свинца нерастворим. Нерастворимое вещество покрывает кусочек металла и «защищает его от реакции»
А вот концентрированная серная кислота – сильный окислитель (за счет атома серы в высшей степени окисления).
Раз сера – окислитель, то она будет восстанавливаться:
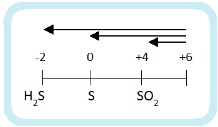
Глубина восстановления серы зависит от активности восстановителя:
- сильные восстановители восстанавливают серную кислоту до H2S,
- слабые — до SO2,
- восстановители средней активности – до S.
На практике образуются несколько продуктов в разных пропорциях. Преобладание того или иного продукта зависит от множества факторов: от вышеупомянутой активности восстановителя, температуры, концентрации кислоты (95%, 90%. 85%, 80%, 75% – это все концентрированная кислота). Но в реалиях школьной программы все схематично и пишем один единственный продукт.
1. Взаимодействие металлов в концентрированной серной кислотой.
Концентрированная серная кислота реагирует с металлами, даже стоящими после водорода. Но кроме платины и золота – эти металлы слишком малоактивны.
Схема этих реакций:

- Активные металлы восстанавливают серную кислоту до H2S:
- Металлы средней активности восстанавливают серную кислоту до S:
- Малоактивные металлы восстанавливают серную кислоту до SO2:
Некоторые металлы (конкретно нужно запомнить — Fe, Al, Cr) при контакте с концентрированной серной кислотой покрываются защитной пленкой – и реакция не идет. Поэтому серную кислоту без всякой опасности перевозят в железных цистернах. Это явление называют пассивацией.
То, что железо, алюминий и хром пассивируются не означает, что реакция невозможна. Просто нужно нагреть – при нагревании от защитной пленки не остаётся и следа:

2. Взаимодействие неметаллов с концентрированной серной кислотой.
Не все неметаллы реагируют с концентрированной серной кислотой: лишь те, что проявляют восстановительные свойства. Поэтому кислород, азот и галогены не вступают в эти реакции.
Мы рассмотрим взаимодействие с фосфором, углеродом, бором, серой. Неметаллы – не такие активные восстановители как типичные металлы – поэтому серная кислота восстанавливается до SO2.
Неметалл окисляется до высшей степени окисления: образуется оксид. Поскольку оксид неметалла – кислотный, то он тут же в момент получения реагирует с водой и образуется кислота:
Угольная кислота не образуется – получается углекислый газ:
Концентрированная серная кислота окисляет серу:

3. Взаимодействие концентрированной серной кислоты с галогенидами.
Галогениды металлов – это соли галогеноводородов (HF, HCl, HBr, HI). Галогеноводороды – летучие кислоты, а HF еще к тому же и слабая.
Поэтому серная кислота их вытесняет из солей:
Соли нужно брать твердые, не раствор. Тогда галогеноводороды будут вытесняться в виде газов.
А к фториду можно и в раствор прилить кислоты, так как фтороводородная кислота – слабая, она вытеснится. Только останется в растворе, вот и вся разница.
С хлоридами и фторидами происходит простая реакция обмена, без изменения степеней окисления.
Галоген окисляется до простого вещества. Сера восстанавливается:

А вот бромиды и иодиды – восстановители. После вытеснения галогеноводорода он тут же окисляется. Поэтому реакции концентрированной серной кислоты с бромидами и иодидами протекают с изменением степеней окисления.
Бромоводород и иодоводород окисляются так же, как и их соли:
Азотная кислота — окислитель.
Производство.
Сырье для производства азотной кислоты – аммиак. Три последовательные реакции окисления:
1. Каталитическое окисление аммиака:
Реакция экзотермическая, необратимая.
2. Окисление NO до NO2:
Реакция экзотермическая, обратимая.
3. Поглощение NO2 водой и одновременно его окисление:
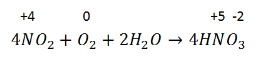
Реакция экзотермическая, обратимая – по этой же схеме азотная кислота разлагается при хранении. Поэтому с течением времени прозрачная изначально азотная кислота буреет. Бурый цвет кислоте придает, образующийся при разложении NO2.
Если растворять NO2 в воде без доступа кислорода, то азот диспропорционирует:
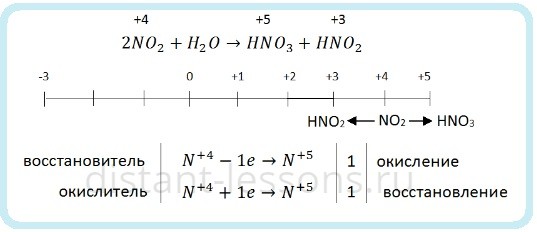
Поэтому оксид азота (IV) NO2 мы относим к кислотным. Хоть у него и нет соответствующей кислоты, при растворении его в воде образуются HNO3 и HNO2.
Азотная кислота – жидкость с резким запахом. Свежая азотная кислота бесцветная. При хранении она разлагается и за счет бурого NO2 приобретает желтоватый цвет.
Важно знать, что азотная кислота летучая, легкокипящая, поэтому и имеет запах. А раз она летучая, то ее можно вытеснить из соли нелетучей кислотой, например, концентрированной серной:
Важно, чтобы нитрат был твердым, а серная кислота концентрированная – меньше воды. Чтобы азотная кислота испарялась, испаряется – значит покидает реакционную смесь, значит реакция идет до конца.
Химические свойства.
Свойства азотной кислоты в целом повторяют свойства концентрированной серной. Но с одной поправкой, в отличие от серной, азотная кислота и концентрированная, и разбавленная проявляет сильные окислительные свойства.
1. Взаимодействие с металлами.
До чего может восстанавливаться азот? Вспомним диаграмму степеней окисления азота:

Получиться может любой из этих продуктов. А на практике – несколько сразу. Мы рассмотрим упрощенный вариант: берем только преобладающий продукт и только два фактора, влияющие на глубину восстановления:
- Активность металла – чем активнее, тем глубже идет восстановление.
- Концентрация кислоты – разбавленная кислота восстанавливается глубже.
Еще больше упрощая берем только четыре продукта: NH4NO3, N2O, NO, NO2.
Наиболее глубокое восстановление дает разбавленная кислота и активный металл – NH4NO3.
Соответственно при взаимодействии концентрированной кислоты и малоактивного металла образуется NO2. Самое неглубокое восстановление.
Теперь нужно определить в каком случае будет N2O, а в каком NO. Фактор активности металла – решающий. С активным металлом и концентрированной кислотой будет N2O. А с малоактивным металлом и разбавленной кислотой образуется NO.
8Na + 10HNO3 конц → 8NaNO3 + N 2 O ↑ + 5H2O

Концентрированная азотная кислота пассивирует Fe, Cr, Al, как и концентрированная серная.
Чтобы провести реакцию нужно нагреть:
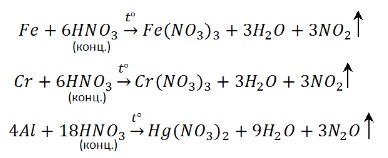
С разбавленной кислотой эти металлы реагируют и без нагревания:
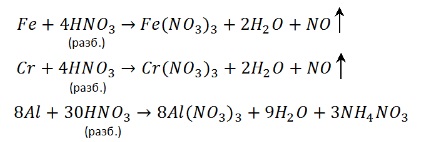
2. Взаимодействие с неметаллами (C, P, B, S).
Неметаллы окисляются до высших кислот. Реагирует и концентрированная, и разбавленная азотная кислота. Неметаллы – не очень хорошие восстановители, поэтому кислота восстанавливается как в реакции с малоактивными металлами (образуются N2O и NO2).

В отличие от серной кислоты, очень концентрированная азотная кислота (безводная) окисляет при нагревании иод до иодноватой кислоты (HIO3):
3. Взаимодействие с галогенидами.
Эти реакции могут запутать, хотя ничего сложного в них нет. Вам нужно просто понять логику каждой из них.
На что следует опираться:
- Реакции могут быть либо окислительно-восстановительными, либо обменными.
- Помним, что фториды (F–) и хлориды (Cl–) – восстановители плохие, если быть точнее, то никакие. А бромиды (Br–) и иодиды (I–) – хорошие восстановители.
- HF – слабая кислота, HCl, HBr, HI – сильные.
Фториды металлов – это соли слабых кислот, поэтому сильная азотная кислота вытесняет фтороводород. И не важно концентрированная или разбавленная – это простая реакция обмена/p>
Фтороводород не реагирует с азотной кислотой. Реакция обмена невозможна и окислительно-восстановительная тоже: фторид – слабый восстановитель.
Хлориды металлов и хлороводород не реагируют с азотной кислотой. Хлорид ион – слабый восстановитель – не возможна ОВР. Хлориды металлов не реагируют, потому что соляная кислота – сильная (предыдущая плавиковая – слабая, если помните).
Бромиды и иодиды вступают с азотной кислотой в окислительно-восстановительное взаимодействие. Сами окисляются до простых веществ. Азотная кислота восстанавливается до NO2 если концентрированная, разбавленная – до NO, то есть так, как будто взаимодействует с малоактивным металлом.
2.6. Характерные химические свойства кислот.
Кислоты можно классифицировать исходя из разных критериев:
1) Наличие атомов кислорода в кислоте
| Кислородсодержащие | Бескислородные |
| H3PO4,HNO3,HNO2,H2SO4,H3PO4,H2CO3,H2CO3, HClO4 все органические кислоты (HCOOH, CH3COOH и т.д.) | HF, HCl, HBr, HI, H2S |
2) Основность кислоты
Основностью кислоты называют число «подвижных» атомов водорода в ее молекуле, способных при диссоциации отщепляться от молекулы кислоты в виде катионов водорода H + , а также замещаться на атомы металла:
3) Летучесть
Кислоты обладают различной способностью улетучиваться из водных растворов.
4) Растворимость
| Растворимые | Нерастворимые |
| HF, HCl, HBr, HI, H2S, H2SO3, H2SO4, HNO3, HNO2, H3PO4, H2CO3, CH3COOH, HCOOH | H2SiO3, высшие карбоновые кислоты |
5) Устойчивость
| Устойчивые | Неустойчивые |
| H2SO4, H3PO4, HCl, HBr, HF | H2CO3, H2SO3 |
6) Способность к диссоциации
хорошо диссоциирующие (сильные)
7) Окисляющие свойства
(проявляют окислительные свойства за счет катионов водорода H + )
(проявляют окислительные свойства за счет кислотообразующего элемента)
практически все кислоты кроме HNO3 и H2SO4 (конц.)
Химические свойства кислот
1. Способность к диссоциации
Кислоты диссоциируют в водных растворах на катионы водорода и кислотные остатки. Как уже было сказано, кислоты делятся на хорошо диссоциирующие (сильные) и малодиссоциирующие (слабые). При записи уравнения диссоциации сильных одноосновных кислот используется либо одна направленная вправо стрелка (), либо знак равенства (=), что показывает фактически необратимость такой диссоциации. Например, уравнение диссоциации сильной соляной кислоты может быть записано двояко:
либо в таком виде: HCl = H + + Cl —
либо в таком: HCl → H + + Cl —
По сути направление стрелки говорит нам о том, что обратный процесс объединения катионов водорода с кислотными остатками (ассоциация) у сильных кислот практически не протекает.
В случае, если мы захотим написать уравнение диссоциации слабой одноосновной кислоты, мы должны использовать в уравнении вместо знака две стрелки . Такой знак отражает обратимость диссоциации слабых кислот — в их случае сильно выражен обратный процесс объединения катионов водорода с кислотными остатками:
Многоосновные кислоты диссоциируют ступенчато, т.е. катионы водорода от их молекул отрываются не одновременно, а по очереди. По этой причине диссоциация таких кислот выражается не одним, а несколькими уравнениями, количество которых равно основности кислоты. Например, диссоциация трехосновной фосфорной кислоты протекает в три ступени с поочередным отрывом катионов H + :
Следует отметить, что каждая следующая ступень диссоциации протекает в меньшей степени, чем предыдущая. То есть, молекулы H3PO4 диссоциируют лучше (в большей степени), чем ионы H2PO4 — , которые, в свою очередь, диссоциируют лучше, чем ионы HPO4 2- . Связано такое явление с увеличением заряда кислотных остатков, вследствие чего возрастает прочность связи между ними и положительными ионами H + .
Из многоосновных кислот исключением является серная кислота. Поскольку данная кислота хорошо диссоциирует по обоим ступеням, допустимо записывать уравнение ее диссоциации в одну стадию:
2. Взаимодействие кислот с металлами
Седьмым пунктом в классификации кислот мы указали их окислительные свойства. Было указано, что кислоты бывают слабыми окислителями и сильными окислителями. Подавляющее большинство кислот (практически все кроме H2SO4(конц.) и HNO3) являются слабыми окислителями, так как могут проявлять свою окисляющую способность только за счет катионов водорода. Такие кислоты могут окислить из металлов только те, которые находятся в ряду активности левее водорода, при этом в качестве продуктов образуется соль соответствующего металла и водород. Например:
Что касается кислот-сильных окислителей, т.е. H2SO4 (конц.) и HNO3, то список металлов, на которые они действуют, намного шире, и в него входят как все металлы до водорода в ряду активности, так и практически все после. То есть концентрированная серная кислота и азотная кислота любой концентрации, например, будут окислять даже такие малоактивные металлы, как медь, ртуть, серебро. Более подробно взаимодействие азотной кислоты и серной концентрированной с металлами, а также некоторыми другими веществами из-за их специфичности будет рассмотрено отдельно в конце данной главы.
3. Взаимодействие кислот с основными и амфотерными оксидами
Кислоты реагируют с основными и амфотерными оксидами. Кремниевая кислота, поскольку является нерастворимой, в реакцию с малоактивными основными оксидами и амфотерными оксидами не вступает:
4. Взаимодействие кислот с основаниями и амфотерными гидроксидами
HCl + NaOH H2O + NaCl
5. Взаимодействие кислот с солями
Данная реакция протекает в случае, если образуется осадок, газ либо существенно более слабая кислота, чем та, которая вступает в реакцию. Например:
HCOONa + HCl HCOOH + NaCl
6. Специфические окислительные свойства азотной и концентрированной серной кислот
Как уже было сказано выше, азотная кислота в любой концентрации, а также серная кислота исключительно в концентрированном состоянии являются очень сильными окислителями. В частности, в отличие от остальных кислот они окисляют не только металлы, которые находятся до водорода в ряду активности, но и практически все металлы после него (кроме платины и золота).
Так, например, они способны окислить медь, серебро и ртуть. Следует однако твердо усвоить тот факт, что ряд металлов (Fe, Cr, Al) несмотря на то, что являются довольно активными (находятся до водорода), тем не менее, не реагируют с концентрированной HNO3 и концентрированной H2SO4 без нагревания по причине явления пассивации — на поверхности таких металлов образуется защитная пленка из твердых продуктов окисления, которая не позволяет молекулами концентрированной серной и концентрированной азотной кислот проникать вглубь металла для протекания реакции. Однако, при сильном нагревании реакция все таки протекает.
В случае взаимодействия с металлами обязательными продуктами всегда являются соль соответствующего метала и используемой кислоты, а также вода. Также всегда выделяется третий продукт, формула которого зависит от многих факторов, в частности, таких, как активность металлов, а также концентрация кислот и температура проведения реакций.
Высокая окислительная способность концентрированной серной и концентрированной азотной кислот позволяет им реагировать не только практическим со всеми металлами ряда активности, но даже со многими твердыми неметаллами, в частности, с фосфором, серой, углеродом. Ниже в таблице наглядно представлены продукты взаимодействия серной и азотной кислот с металлами и неметаллами в зависимости от концентрации:
7. Восстановительные свойства бескислородных кислот
Все бескислородные кислоты (кроме HF) могут проявлять восстановительные свойства за счет химического элемента, входящего в состав аниона, при действии различных окислителей. Так, например, все галогеноводородные кислоты (кроме HF) окисляются диоксидом марганца, перманганатом калия, дихроматом калия. При этом галогенид-ионы окисляются до свободных галогенов:
Среди всех галогеноводородных кислот наибольшей восстановительной активностью обладает иодоводородная кислота. В отличие от других галогеноводородных кислот ее могут окислить даже оксид и соли трехвалентного железа.
Высокой восстановительной активностью обладает также и сероводородная кислота H2S. Ее может окислить даже такой окислитель, как диоксид серы:
Читайте также:
