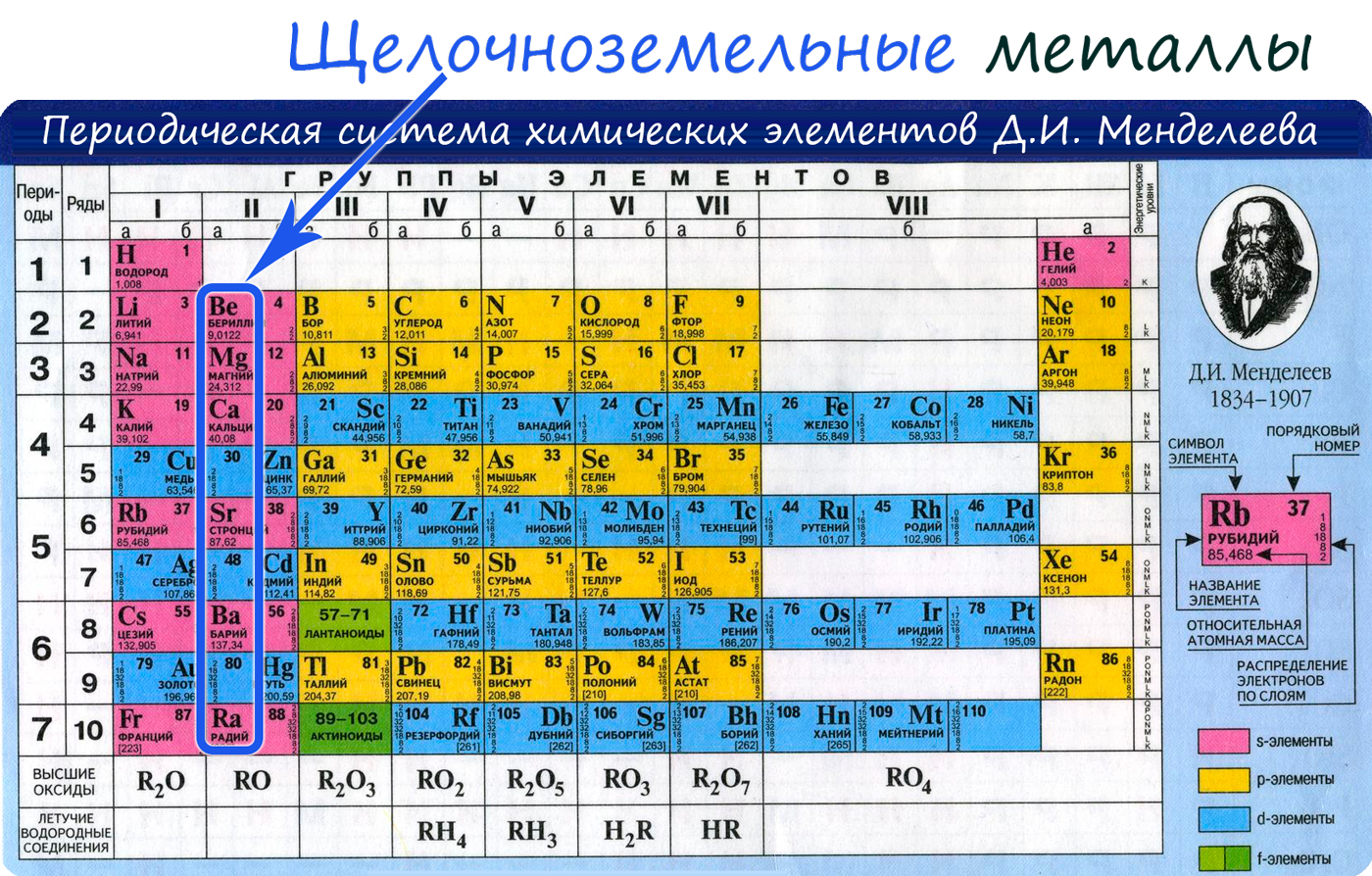
Магний это щелочноземельный металл
К щелочноземельным металлам относят химические элементы: двувалентные металлы, составляющие IIА группу:
Бериллий Be
магний Mg
кальций Ca,
стронций Sr,
барий Ba и
радий Ra.
Хотя бериллий Be по свойствам больше похож на алюминий, а магний Mg проявляет некоторые свойства щелочноземельных металлов, но в целом отличается от них.
Все щелочноземельные металлы — вещества серого цвета и гораздо более твердые, чем щелочные металлы.
Бериллий Be устойчив на воздухе. Магний и кальций (Mg и Ca) устойчивы в сухом воздухе. Стронций Sr и барий Ba хранят под слоем керосина.
Общая характеристка щелочноземельных металлов
От Be к Ra (сверху вниз в периодической таблице) происходит увеличение:
- атомного радиуса,
- металлических, основных, восстановительных свойств,
- реакционной способности.
Уменьшается
- электроотрицательность,
- энергия ионизация,
- сродство к электрону.

Электронные конфигурации у данных элементов схожи, все они содержат 2 электрона на внешнем уровне ns 2 :
Be — 2s 2
Mg —3s 2
Ca — 4s 2
Sr — 5s 2
Ba — 6s 2
Ra — 7s 2
Нахождение в природе щелочноземельных металлов
Как правило, щелочноземельные металлы в природе присутствуют в виде минеральных солей: хлоридов, бромидов, йодидов, карбонатов, нитратов и др.
Основные минералы, в которых присутствуют щелочноземельные металлы:

Способы получения щелочноземельных металлов
Магний
- Магний получают электролизом солей, чаще всего хлоридов: расплавленного карналлита (KCl·MgCl26H2O) или хлорида магния с добавками хлорида натрия при 720–750°С:
- восстановлением прокаленного доломита в электропечах при 1200–1300°С:
2(CaO · MgO) + Si → 2Mg + Ca2SiO4
Кальций
Кальций получают электролизом расплавленного хлорида кальция с добавками фторида кальция:
Барий
Барий получают алюмотермическим способом — восстановление оксида бария алюминием в вакууме при 1200 °C:
Химические свойства щелочноземельных металлов
Качественные реакции
- Окрашивание пламени солями щелочных металлов
Цвет пламени:

Sr — карминово-красный (алый)

Взаимодействие с простыми веществами — неметаллами
С кислородом
С кислородом взаимодействуют при нагревании с образованием оксидов
С галогенами
Щелочноземельные металлы реагируют с галогенами при нагревании с образованием галогенидов .
С водородом
Щелочноземельные металлы реагируют с водородом при нагревании с образованием гидридов:
Бериллий с водородом не взаимодействует.
Магний реагирует только при повышенном давлении:
С серой
Щелочноземельные металлы при нагревании взаимодействуют с серой с образованием сульфидов сульфидов:
Ca + 2C → CaC2 (карбиды)
С азотом
При комнатной температуре с азотом взаимодействует только магний с образованием нитрида:
Остальные щелочноземельные металлы реагируют с азотом при нагревании.
С углеродом
Щелочноземельные металлы реагируют с углеродом с образованием карбидов, преимущественно ацетиленидов:
Бериллий при нагревании с углеродом с образует карбид — метанид:
С фосфором
Щелочноземельные металлы при нагревании взаимодействуют с фосфором с образованием фосфидов:
Взаимодействие со сложными веществами
С водой
Кальций, стронций и барий взаимодействуют с водой при комнатной температуре с образованием щелочи и водорода:
Магний реагирует с водой при кипячении, а бериллий с водой не реагирует.
С кислотами
с концентрированной серной:
с разбавленной и концентрированной азотной:
С водными растворами щелочей
В водных растворах щелочей растворяется только бериллий:
С солями
В расплаве щелочноземельные металлы могут взаимодействовать с некоторыми солями:
Запомните! В растворе щелочноземельные металлы взаимодействуют с водой, а не с солями других металлов.
С оксидами
Щелочноземельные металлы могут восстанавливать из оксидов такие неметаллы как кремний, бор, углерод:
2Ca + SiO2 → 2CaO + Si
Магний сгорает в атмосфере углекислого газа с образованием оксида магния и сажи (С):
Щелочные металлы
К щелочным металлам относят химические элементы: одновалентные металлы, составляющие Ia группу: литий, натрий, калий, рубидий, цезий и франций.
Эти металлы очень активны, быстро окисляются на воздухе и бурно реагируют с водой. Их хранят под слоем керосина из-за их сильной реакционной способности.

Общая характеристика
От Li к Fr (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств, реакционной способности. Уменьшается электроотрицательность, энергия ионизации, сродство к электрону.

- Li - 2s 1
- Na - 3s 1
- K - 4s 1
- Rb - 5s 1
- Cs - 6s 1
- Fr - 7s 1
Природные соединения
- NaCl - галит (каменная соль)
- KCl - сильвин
- NaCl*KCl - сильвинит

Получение
Получить такие активные металлы электролизом водного раствора - невозможно. Для их получения применяют электролиз расплавов при высоких температурах (естественно - безводных):
NaCl → Na + Cl2↑ (электролиз расплава каменной соли)
Химические свойства
Одной из особенностей щелочных металлов является их реакция с кислородом. Литий в такой реакции преимущественно образует оксид, натрий - пероксид, калий, рубидий и цезий - супероксиды.
K + O2 → KO2 (супероксид калия)
Помните, что металлы никогда не принимают отрицательных степеней окисления. Щелочные металлы одновалентны, и проявляют постоянную степень окисления +1 в различных соединениях: гидриды, галогениды (фториды, хлориды, бромиды и йодиды), нитриды, сульфиды и т.д.
Li + H2 → LiH (в гидридах водород -1)
Na + F2 → NaF (в фторидах фтор -1)
Na + S → Na2S (в сульфидах сера -2)
K + N2 → K3N (в нитридах азот -3)
Щелочные металлы бурно взаимодействуют с водой, при этом часто происходит воспламенение, а иногда - взрыв.
Na + H2O → NaOH + H2↑ (воду можно представить в виде HOH - натрий вытесняет водород)
Иногда в задачах может проскользнуть фраза такого плана: ". в ходе реакции выделился металл, окрашивающий пламя горелки в желтый цвет". Тут вы сразу должны догадаться: речь, скорее всего, про натрий.
Щелочные металлы по-разному окрашивают пламя. Литий окрашивает в алый цвет, натрий - в желтый, калий - в фиолетовый, рубидий - синевато-красный, цезий - синий.

Оксиды щелочных металлов
Имеют общую формулу R2O, например: Na2O, K2O.
Получение оксидов щелочных металлов возможно в ходе реакции с кислородом. Для лития все совсем несложно:
В подобных реакциях у натрия и калия получается соответственно пероксид и супероксид, что приводит к затруднениям. Как из пероксида, так и из супероксида, при желании можно получить оксид:
По свойствам эти оксиды являются основными. Они хорошо реагируют c водой, кислотными оксидами и кислотами:
Li2O + H2O → LiOH (осн. оксид + вода = основание - реакция идет, только если основание растворимо)
Na2O + SO2 → Na2SO3 (обратите внимание - мы сохраняем СО серы +4)
Гидроксиды щелочных металлов
Относятся к щелочам - растворимым основаниям. Наиболее известные представители: NaOH - едкий натр, KOH - едкое кали.
Гидроксиды щелочных металлов получаются в ходе электролиза водных растворов их солей, в реакциях обмена, в реакции щелочных металлов и их оксидов с водой:
KCl + H2O → (электролиз!) KOH + H2 + Cl2 (на катоде выделяется водород, на аноде - хлор)

Проявляют основные свойства. Хорошо реагируют с кислотами, кислотными оксидами и солями, если в ходе реакции выпадает осадок, выделяется газ или образуется слабый электролит (вода).
LiOH + H2SO4 → LiHSO4 + H2O (соотношение 1:1, кислота в избытке - получается кислая соль)
2LiOH + H2SO4 → Li2SO4 + 2H2O (соотношение 2:1, основание в избытке - получается средняя соль)
KOH + SO2 → KHSO3 (соотношение 1:1 - получается кислая соль)
2KOH + SO2 → K2SO3 + H2O (соотношение 2:1 - получается средняя соль)
С амфотерными гидроксидами реакции протекают с образованием комплексных солей (в водном растворе) или с образованием окиселов - смешанных оксидов (при высоких температурах - прокаливании).
NaOH + Al(OH)3 → Na[Al(OH)4] (в водном растворе образуются комплексные соли)
NaOH + Al(OH)3 → NaAlO2 + H2O (при прокаливании образуется окисел - смесь двух оксидов: Al2O3 и Na2O, вода испаряется)
Реакции щелочей с галогенами заслуживают особого внимания. Без нагревания они идут по одной схеме, а при нагревании эта схема меняется:
NaOH + Cl2 → NaClO + NaCl + H2O (без нагревания хлор переходит в СО +1 и -1)
NaOH + Cl2 → NaClO3 + NaCl + H2O (с нагреванием хлор переходит в СО +5 и -1)
В реакциях щелочей с йодом образуется исключительно иодат, так как гипоиодит неустойчив даже при комнатной температуре, не говоря о нагревании. С серой реакция протекает схожим образом:
NaOH + I2 → NaIO3 + NaI + H2O (с нагреванием)

NaOH + S → Na2S + Na2SO3 + H2O (сера переходит в СО -2 и +4)
Уникальным является также взаимодействие щелочей с кислотным оксидом NO2, который соответствует сразу двум кислотам - и азотной, и азотистой.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Щелочноземельные металлы
К щелочноземельным металлам относятся металлы IIa группы: бериллий, магний, кальций, стронций, барий и радий. Отличаются легкостью, мягкостью и сильной реакционной способностью.
От Be к Ra (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств, реакционная способность. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
- Be - 2s 2
- Mg - 3s 2
- Ca - 4s 2
- Sr - 5s 2
- Ba - 6s 2
- Ra - 7s 2
- Be - BeO*Al2O3*6SiO2 - берилл
- Mg - MgCO3 - магнезит, MgO*Al2O3 - шпинель, 2MgO*SiO2 - оливин
- Ca - CaCO3 - мел, мрамор, известняк, кальцит, CaSO4*2H2O - гипс, CaF2 - флюорит

Это активные металлы, которые нельзя получить электролизом раствора. С целью их получения применяют электролиз расплавов, алюминотермию и вытеснением их из солей другими более активными металлами.
MgCl2 → (t) Mg + Cl2 (электролиз расплава)
CaO + Al → Al2O3 + Ca (алюминотермия - способ получения металлов путем восстановления их оксидов алюминием)

Все щелочноземельные металлы (кроме бериллия и магния) реагируют с холодной водой с образованием соответствующих гидроксидов. Магний реагирует с водой только при нагревании.
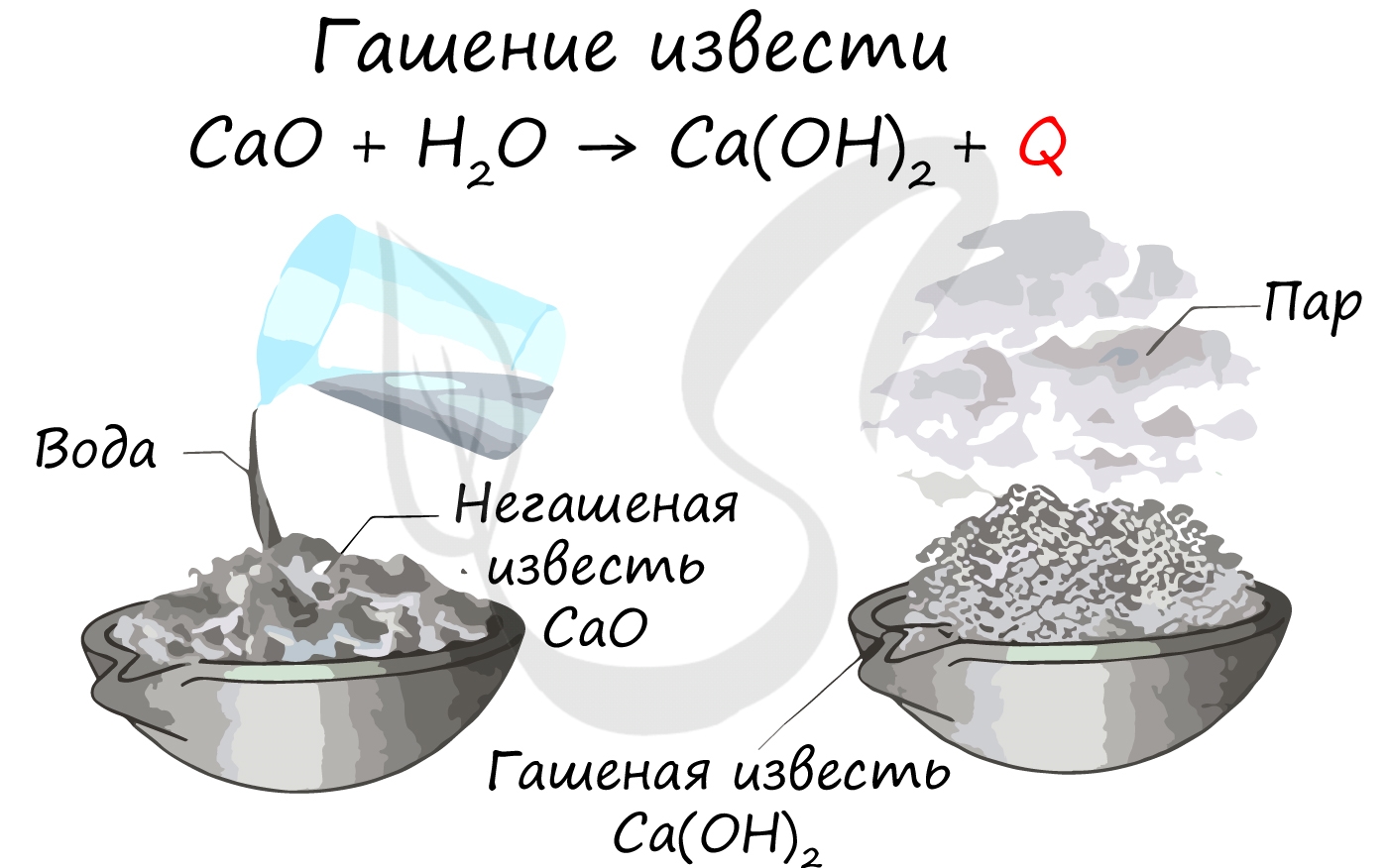
Щелочноземельные металлы - активные металлы, стоящие в ряду активности левее водорода, и, следовательно, способные вытеснить водород из кислот:
Хорошо реагируют с неметаллами: кислородом, образуя оксиды состава RO, с галогенами (F, Cl, Br, I). Степень окисления у щелочноземельных металлов постоянная +2.
Mg + O2 → MgO (оксид магния)
При нагревании реагируют с серой, азотом, водородом и углеродом.
Mg + S → (t) MgS (сульфид магния)
Ca + H2 → (t) CaH2 (гидрид кальция)
Ba + C → (t) BaC2 (карбид бария)

Ba + TiO2 → BaO + Ti (барий, как более активный металл, вытесняет титан)
Оксиды щелочноземельных металлов
Имеют общую формулу RO, например: MgO, CaO, BaO.
Оксиды щелочноземельных металлов можно получить путем разложения карбонатов и нитратов:
Рекомендую взять на вооружение общую схему разложения нитратов:

Проявляют преимущественно основные свойства, все кроме BeO - амфотерного оксида.
- Реакции с кислотами и кислотными оксидами
В нее вступают все, кроме оксида бериллия.
Амфотерные свойства оксида бериллия требуют особого внимания. Этот оксид проявляет двойственные свойства: реагирует с кислотами с образованием солей, и с основаниями с образованием комплексных солей.
BeO + NaOH + H2O → Na2[Be(OH)4] (тетрагидроксобериллат натрия)
Если реакция проходит при высоких температурах (в расплаве) комплексная соль не образуется, так как происходит испарение воды:
BeO + NaOH → Na2BeO2 + H2O (бериллат натрия)

Гидроксиды щелочноземельных металлов
Проявляют основные свойства, за исключением гидроксида бериллия - амфотерного гидроксида.
Получают гидроксиды в реакции соответствующего оксида металла и воды (все кроме Be(OH)2)
Основные свойства большинства гидроксидов располагают к реакциям с кислотами и кислотными оксидами.

Реакции с солями (и не только) идут в том случае, если соль растворимы и по итогам реакции выделяется газ, выпадает осадок или образуется слабый электролит (вода).
Гидроксид бериллия относится к амфотерным: проявляет двойственные свойства, реагируя и с кислотами, и с основаниями.
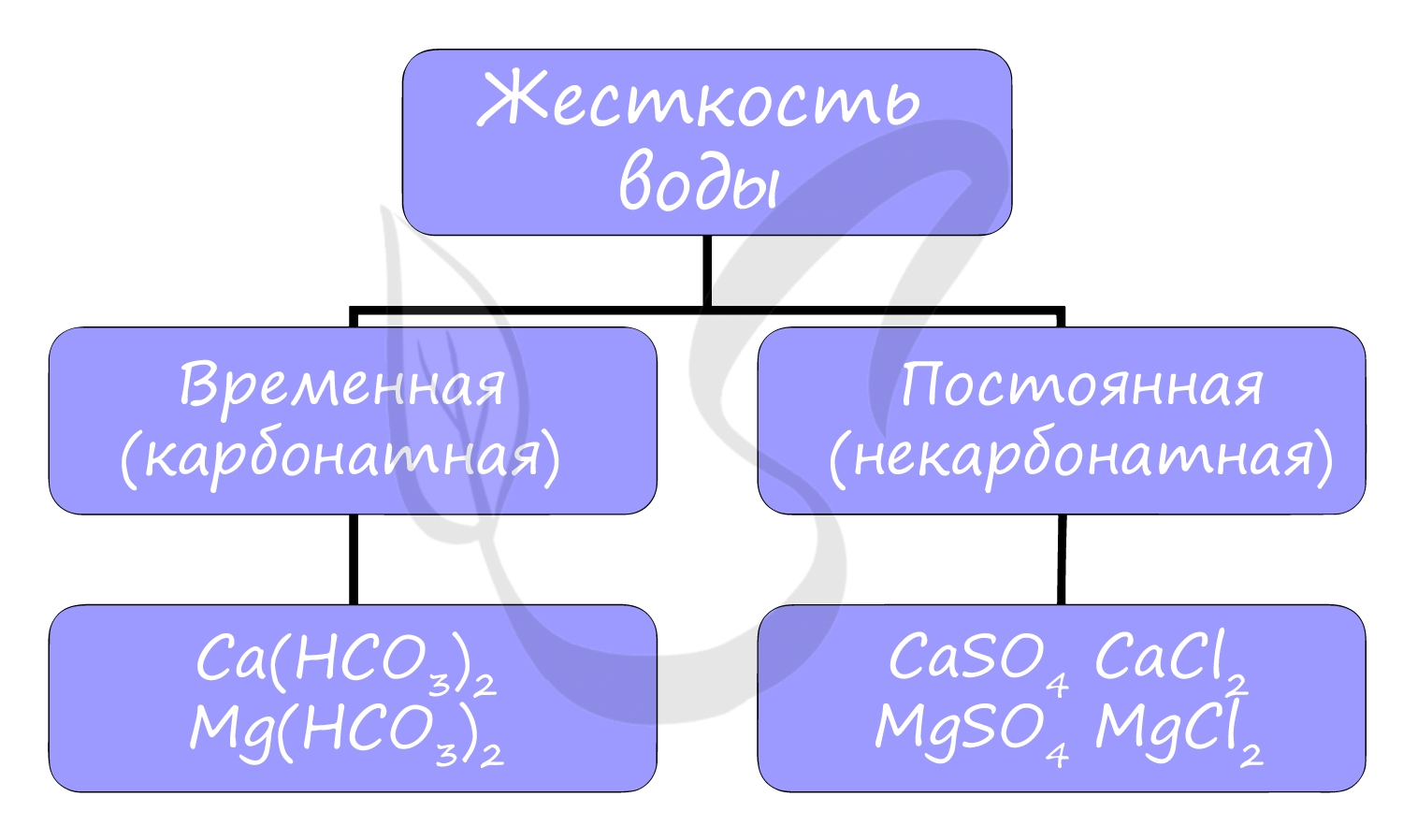
Жесткость воды
Жесткостью воды называют совокупность свойств воды, зависящую от присутствия в ней преимущественно солей кальция и магния: гидрокарбонатов, сульфатов и хлоридов.
Различают временную (карбонатную) и постоянную (некарбонатную) жесткость.
Вероятно, вы часто устраняете жесткость воды у себя дома, осмелюсь предположить - каждый день. Временная жесткость воды устраняется обычным кипячением воды в чайнике, и известь на его стенках - CaCO3 - бесспорное доказательство устранения жесткости:
Также временную жесткость можно устранить, добавив Na2CO3 в воду:
С постоянной жесткостью бороться кипячением бесполезно: сульфаты и хлориды не выпадут в осадок при кипячении. Постоянную жесткость воды устраняют добавлением в воду Na2CO3:
Жесткость воды можно определить с помощью различных тестов. Чрезмерно высокая жесткость воды приводит к быстрому образованию накипи на стенках котлов, труб, чайника.

МАГНИЙ — огненный металл
Тем, что название «магний» существует в мире химии, мы обязаны учебнику «Основания чистой химии» русского химика Гесса. Много русских химиков зубрили науку по этой книге — она была переиздана семь раз.
Пейте минералку
История открытия нашего героя начинается на английском курорте. Там скучающие химики решили исследовать, чем же их лечат. Из минеральной воды (горькой, но регулирующей пищеварение) выделили соль — горькую или английскую. Опыты продолжили, в результате почти одновременно Фарадей и Бюсси получили магний.

Этот металл серебристо-белого цвета можно добыть из почти любого булыжника под ногами, хотя для промышленного применения этот метод навряд ли пригоден.
Каков он, «вспыльчивый металл»

Наш герой — элемент второй группы периодической системы Менделеева. Латинское название Magnesium, атомный номер 12.
Магний теперь относится к щелочноземельным металлам. Однако раньше он таким не считался — его гидроксид не является щелочью, хотя раствор в присутствии фенолфталеина (индикатор) окрашивается в слабо-розовый цвет. Полноценные щелочи с фенолфталеином окрашиваются в густой малиновый цвет.
У чистого магния плотноупакованная гексагональная кристаллическая структура.
Строение атома указывает на принадлежность к металлам. Электронная формула элемента — 1s 2 2s 2 2p 6 3s 2. То есть, на внешнем энергетическом уровне у магния болтается пара электронов, в любой момент готовая «свалить налево» — вступить в реакцию с другим элементом. Кое-кто еще помнит, что свойство металлов на внешнем уровне иметь от 1 до 3 электронов.
И чем же наш герой не металл?
Некоторые характеристики магния:
| Свойство металла | Данные |
| Атомная масса | 24,304 г/моль |
| Степени окисления | 0; +2 |
| Плотность | 1,74 г/см3 |
| Температура плавления | 650оС |
| Теплопроводность | (300 K) 156 Вт/(м·К) |
| Температура кипения | 1090 оС |
| Ковалентный радиус | 136 пм |
|---|---|
| Радиус иона | 66 (+2e) пм |
| Электроотрицательность | 1,31 (шкала Полинга) |
| Электродный потенциал | −2,37 В |
| Степени окисления | 0; +2 |
| Энергия ионизации (первый электрон) | 737,3 (7,64) кДж/моль (эВ) |
Химия магниевых реакций
Вспомним школьные годы. Немного химии во время карантина не повредит.
Итак, химические свойства нашего героя:
- К щелочам огненный металл равнодушен (сами такие, к щелочноземельным металлам относимся). В реакции со щелочами не вступает.
- Зато во взаимодействие с кислотами вступает охотно, даже бурно, с выделением водорода.
- На воздухе магний реагирует с кислородом воздуха, покрывается оксидной пленкой. Эта «одежка» защищает металл от дальнейшего окисления. Но влажная атмосфера разрушает нашего «горячего» героя. Потому его и не хранят во влажных помещениях.
Как он горит!
Немного найдется металлов, горящих на воздухе, и наш герой — один из них. Подожгите магниевую стружку, и вспыхнет яркий, жгучий огонь. Еще бы не жгучий, его температура более 3000 градусов. Только не зажигайте магний на песке. Металл прореагирует с диоксидом кремния в песке, и будет гореть веселее. Потому затушить «магниевый» пожар песочком не получится.

Горящий магний можно использовать как факел в темноте. Пара грамм магния — и даже в самую черную ночь все будет видно в радиусе 5-7 метров.
Подожгите металл в луже, и увидите мощную вспышку. Здесь образуется гидроксид магния (Mg(OH)2) и водород, который многократно усилит мощность огня.
Печально: в 1937 году дирижабль «Гинденбург», наполненный водородом, загорелся. Погибла треть пассажиров. Эта трагедия поставила крест на дирижаблях, как виде воздушного транспорта.
Кстати, головная боль пожарных — магний нельзя тушить водой. От этого огонь разгорится еще больше. Углекислотный огнетушитель тоже не вариант, ведь наш необыкновенный герой в присутствии углекислого газа хорошо горит, образуя уголь и оксид магния:
2Мg + CO2 = C + 2MgO
Минералы, месторождения
Наш герой настолько активен в химическом отношении (просто-таки «неразборчив в связях»), что его нахождение в природе в чистом виде практически невозможно.
Природные источники магния — минералы:
- брусит;
- кизерит;
- доломит;
- магнезит;
- бишофит;
- эпсомит;
- карналлит.
Даже из морской воды можно добывать огненный металл. Самосадочные озера (вода в них называется рапой), содержат большое количество минеральных солей, в том числе магния.
Познавательно: таких озер много в Астраханской области. Это Белинские, Зинзилинские, Мочаговские самосадочные озера (список можно продолжить).
Крупнейшая российская группа месторождений — Саткинское — (разведано 14 штук) находится в Челябинской области, рядом с городом Сатка. Тут сосредоточены магнезиальные руды высокой чистоты.
Получение чистого металла
Промышленное получение металла возможно двумя способами:
В первом способе необходимы обезвоженные хлориды магния, натрия, калия. Их смешивают в электролитической ванне, в расплаве происходит восстановления магния.
Чистый металл сливают, добавляя в ванну сырье. В черновом металле содержится до 2% примесей. При необходимости еще не остывший магний рафинируют, доводя чистоту почти до идеальной — 99,999%.
Во втором способе в качестве сырья предпочтительно использовать доломит с добавлением кокса. Возможно использование морской воды. Смесь разогревают до 2100 градусов, пары магния отгоняются и конденсируются.
Польза и вред добавок
Чистый магний ковкий, легкий металл. Только есть у металла свойство — подверженность коррозии. Потому чистый металл используют редко, в отличие от его сплавов. Для сплавов магния очень важны добавки алюминия, циркония, цинка.
Алюминий делает сплав прочнее и удобнее для литейных работ.
Количество лигатуры важно для качеств сплава:
- 3% алюминия придадут наибольшую пластичность;
- 6% лигатуры — даст лучшие прочность и пластичность;
- 9% алюминия подарит сплаву максимальную прочность.
Свойства цинка в сплавах подобны алюминиевым:
- 3% добавка максимально увеличивает пластичность;
- 5% цинка даст гармоничное сочетание пластичности и прочности сплава;
Если в сплаве есть вредные примеси (никель, железо), то лигатура цинка повысит коррозионную стойкость.
Кремний повысит способность к литью, но в присутствии железа уменьшит устойчивость к ржавчине.
Никель и железо примеси вредные, они делают сплав подверженным ржавчине.
Сплавы магния делят на деформируемые (МА) и литейные (МЛ); последние применяются значительно чаще. В сплав МЦИ добавляют медь, железо, цинк, никель. Эта смесь металлов хороша при вибронагрузках.
Магний в нашей жизни
Металл и его сплавы нашли широкое применение в разных сферах жизни.
- Способность металла давать яркий огонь использовали на заре фотографии.
- Легкость металла открыла ему путь в авиацию. Наши ноутбуки, многие фотокамеры содержат магниевые детали — не таскать же тяжелый прибор, если можно сделать легкий.
- В химических источниках тока энергия химических реакций напрямую превращается в электрическую. Чистый металл и его соединения в электрических батареях сообщают им высокие ЭДС и отменные энергетические характеристики.

Анодом в таких батареях служит магний. В качестве катода применяют:
- ; ;
- серу;
- хлористое серебро;
- хлористый свинец в смеси с графитом;
- диоксид марганца с графитом.
Огнеупорные материалы необходимы для футеровки металлургических печей, тиглей.
Дешевым и качественным сырьем для этого могут быть минералы магния:
В военном деле магний «освещает темные места». А проще, из него делают светозвуковые и светошумовые боеприпасы (патроны, гранаты, снаряды). До конца не убьет, но оглушит и дезориентирует.
Применяют в антитеррористических операциях, при освобождении заложников, разгоне противозаконных сборищ (при массовых беспорядках).
Зажигательные бомбы, трассирующие пули, ракеты сигнальные и осветительные — везде используется яркое горение металла.
Препараты магния необходимы в медицине. Недостаток макроэлемента губителен для сердечно-сосудистой системы. Ишемическая болезнь, артериальная гипертония, аритмии — каждая из этих болезней усугубляется дефицитом магния.
Недостаток нескольких граммов металла плохо отражается на наших нервах (депрессии, мигрени, головокружения, тревога, раздражительность).
Важно: у каждого потребность в магнии возрастает при стрессах, физических нагрузках; у спортсменов — при изнурительных тренировках и на соревнованиях.
Специалисты фирмы Тойота разработали аккумуляторную батарею (на основе серно-магниевых элементов). Показатели у аккумулятора завидные. Загвоздка в том, что в батарее происходит саморазряд (катод электрохимически восстанавливается, образуются полисульфидные анионы, переходящие в раствор). Пока эта проблема не будет решена, серно-магниевые аккумуляторы специалистам только снятся.
Магний металлический обладает сильными восстановительными свойствами. Его используют для получения бериллия, ванадия, хрома. Металл используют как лигатуру в сталях и чугуне.
Все шире применяют магнийорганические соединения в химическом синтезе галогенопроизводных, спиртов, углеводородов.
Где еще применяют соединения магния
Бесцветные кристаллы фторида магния используют в специальной оптике (вещество прозрачно в диапазонах от ультрафиолетового до инфракрасного.
Стеарат магния — пищевая добавка Е470. Используют в косметической, пищевой промышленности, в фармации.
Магниевые сплавы применяют в изготовлении отбойных молотков, в атомной и нефтяной промышленности.
Стоимость огненного металла
Цена первичного магния (МГ90):
Лом металла и магнийсодержащих элементов будет стоить от 35 до 50 рублей за килограмм.

Мне 42 года и я специалист в области минералогии. Здесь на сайте я делюсь информацией про камни и их свойства — задавайте вопросы и пишите комментарии!
Магний. Характеристика металла магния – его применения, свойства и цена

Сегодня даже не каждый взрослый вспомнит почему мы можем однозначно ответить на вопрос: магний металл или неметалл? Магний – относят к щелочноземельным металлам! Вспомнить это поможет беглый взгляд на электронную конфигурацию 1s22s22p63s2 нейтрального атома этого вещества. Учитывая специфику металлов иметь от 1 до 3 свободных электронов на внешнем энергетическом уровне, смотрят на этот параметр и для Mg. Не трудно увидеть, что конфигурация содержит 2 свободных электрона.
Общие металлические свойства магния характерны тем же, что проявляют другие вещества, относящие к данному типу. Обычно они тверды, но пластичны (в отличие от хрупких неметаллов). Имеют специфический блеск. Mg имеет склонность тускнеть на воздухе из-за того, что покрывается защитной кислородной пленкой. Порошок магния легко воспламеняется, достаточно поднести зажженную спичку. Цвет магния, горящего – ярко-белый. Одна из причин, почему этот металл первоначально использовался при фотографировании. Mg наносили на специальную ленту и поджигали ее. При горении образуется MgO, также при протекании процесса на воздухе выделяется нитрид магния с выделением большого количества теплоты.

Так выглядит металлический магний
Особенности Mg, как элемента периодической системы
Химические свойства магния во многом лежат где-то между бериллием и кальцием. Прежде всего, это проявляется во взаимодействии с водой. Первый не реагирует с ней вообще, второй же в ней растворяется. Mg слабо взаимодействует с нагретой водой. Но при взаимодействии с водяным паром (от 400 градусов по Цельсию) происходит реакция Mg+ H2O = MgO + H2, в которой металл растворяется при активном выделении водорода.
Видео – химические свойства магния:
Несколько иная реакция происходит с водяным паром: Mg+ 2H2O = Mg(OH)2 +H2. Причем свободный водород в итоге поглощается магнием MgH3. В результате, если плавление металла происходило во влажной среде, по мере его застывания водород практически полностью исчезает.
Свойства магния: взаимодействовать с водой при высоких температурах становится и гореть при присутствии в атмосфере углекислого газа, – затрудняют тушение пожаров с участием Mg. Их нельзя тушить водой. По инструкции используют порошковые огнетушители и песок. Также можно применять оксиды Si, с которыми магний вступает в реакцию, но количество выделяемой теплоты значительно ниже.

На фото: горение магния
Также необходимо отметить, что несмотря на фактическую нерастворимость Mg(OH)2 в воде, раствор фенолфталеина в его присутствии окрашивается в розовый цвет.

Магний в таблице Менделеева
Магний металл устойчив к едким щелочам, соде, керосину, бензину, минеральным маслам. Способность этого элемента отнимать кислород и хлор, используют для восстановления чистых веществ. Например, брома или титана.
Для синтезов разных классов органических соединений используется свойство магния взаимодействовать с галогенами. Обычно это Cl, Br, I, с фтором Mg образует защитную пленку, из-за чего их соединение редко используется для синтеза реактивов Гриньяра. Последние наиболее часто формируются на основе формулы RMgHal, где R – это органический радикал, а Hal – один из перечисленных галогенов.
Какие физические свойства имеет металл магний
Видео: Магний – металл, который горит
Легкость элемента отображает плотность, которая составляет 1,74 г/см3. Меньшую имеют только кальций и щелочные металлы. Физические свойства магния можно коротко описать стандартными энциклопедическими параметрами:
- Т плавления – 651°С;
- Т кипения – 1107°С;
- Теплопроводность – 0,376 кал/(см·с·град) достаточно высока, сравнима с тем, что демонстрируют бериллий и вольфрам;
- Теплоемкость при Т плавления – 0,3 кал/град;
- Удельная теплоемкость увеличивается до Т плавления и уменьшается по ее достижении;
- Усадка при смене состояний (жидкость – твердое тело) – 3,97-4,2%;
- Удельное электросопротивление при комнатной температуре – 0,047 ом·мм2/м.
Этот элемент периодической таблицы Менделеева относят к щелочноземельным металлам. Однако это утверждение не всегда верно, поскольку химические свойства приближают этот элемент к алюминий подобным веществам.

Так выглядит оксид магния
Оксиды MgO относят к белым тугоплавким веществам, их называют жженой магнезией и применяют при изготовлении строительных материалов. Соли магния металла образуются при взаимодействии вещества с кислотами. Наиболее известная из них MgCO3. Используется металлургам для освобождения сплавов от шлаков, называют карбонат магния. Еще одна соль MgSO4 – известна как горькая или английская. Химики ее именуют сульфат магния. Mg и Ca влияют на жесткость воды. Высокая концентрация этих веществ в Н2О не позволяет моющим средствам пениться.

Магниевый сплав МЦр1Н3
Чтобы более детально ответить на то, какие физические свойства имеет магний, необходимо рассматривать изменения его состояний и качеств по мере применения к нему различных тепловых эффектов: нагревание и охлаждение. Так, например, плотность снижается на 6% при Т – 600 0 С, расплавившись и вовсе падает до значения 1.58 г/см3.
Характеристики металла магния сильно отличаются при низких и высоких температурах. Некоторые результаты экспериментов требуют объяснения, часть из них дают вполне предвиденные реакции.
Гексагональная решетка элемента имеет следующие параметры:
При нагревании до 6270С эти расстояния увеличиваются, дойдя до температуры плавления связи решетки разрушаются вовсе.
Если говорить о том, какого цвета магний придется отметить, что в целом серебристо-белый металл, может выглядеть как черный обуглившийся с присущим блеском. В последнем случае речь идет о стружке магния. Поэтому определяя «на глаз» тип материала, все-таки лучше обратиться к химическим экспериментам, если под рукой не имеется спектрального анализатора.
Классическая задача для школьников рассматривает ряд натрий – магний –алюминий, металлические свойства которого ослабевает от первого к последнему элементу.
Взаимодействие с различными кислотами
Для краткости, проще рассмотреть несколько экспериментов. Для них берутся такие виды кислот:
- Соляная.
- Азотная.
- Серная (разбавленная и нет).

В первом случае наблюдается практически мгновенное растворение, сопровождающееся пузырьками белых газов и резким запахом хлора. Емкость, в которой происходила реакция нагревается.
В азотной кислоте кусочек магния не тонет. Бурый газ скапливается над поверхностью жидкости, выделяется тепло. Иногда говорят, что кислота «кипела», окружая кусочки магния.
Третий случай необходимо рассматривать, как два частных. В неразбавленной серной кислоте реакция идет медленно. Если же использовать раствор с небольшим количеством воды, магний также, как с азотной кислотой плавает на поверхности. При этом происходит едва заметная реакция с выделением белых пузырьков газа.
Получение магния и история открытия
Высокая химическая активность препятствует тому, чтобы магний металлический встречался в чистом виде. Источниками материалов для его добычи становятся магниевые руды или соединения солей, содержащихся в водах морей, океанов, а также подземных. Именно асбест, оливин, серпентин, магнезит, доломит, другие минералы известны миру с давних пор. Название вещества имеет те же корни, что и название города в Малой Азии – Магнезия. Только в 1808 году английский химик Г. Дэви методом электролиза получил металлический осадок, который назвал магнием.
Однако это не был чистый металл. Еще 20 лет понадобилось миру ученых, чтобы получить именно Mg в том виде, который представил его в таблице Менделеева. Сделал открытие чистого металла магния французский химик А. Бюсси в 1828 году.

Что такое электролиз
Сам же метод электролиза лег в основу классических способов получения этого элемента в чистом виде. Для производства в основном используют месторождения магний содержащих руд. Наиболее известное гражданам России находится на Урале – Саткинское. Но в Сибири имеется еще ряд месторождений, как и в Индии, Китае, Корее, некоторых странах Европы и Южной Америке.
На производстве для получения металлического магния используют расплав обезвоженных хлоридов: магния, натрия и калия. При применении непрерывного электролиза происходит восстановление по следующей формуле:
MgCl2 (электролиз) = Mg + Cl2.
Возможность реализации процессов, описанных далее, магний металл с ценой за кг остается востребованным. Очищенный металл выбирают из электролизной ванны, вливая на замещение сырье с содержанием магния. Таким способом получают металл практически свободный от примесей. Доля последних составляет не более 0,1%. Если есть необходимость уменьшить этот показатель, еще не застывший металл рафинируют, получая чистоту 99,999% и больше.
Существует еще один способ получения магния – это восстановление оксида MgO с добавлением кокса при высокой температуре. Альтернативно используют доломит, этот метод не требует предварительного отделения кальция. Получаемые в результате реакции оксиды CaO и MgO смешивают с кремнием. На выходе имеют чистейший магний и Ca2SiO4. Для этого метода допустимо использования минералов или морской воды.
Применение магния
Имеет широкий спектр от медицины до самолетостроения. Физические свойства металла магния, а именно его легкость (плотность) делает незаменим этот элемент в сплавах. Чаще это соединения с цинком, цирконием или алюминием. При очевидной легкости таких сплавов наблюдается их прочность.
Еще раз стоит отметить, что активные химические свойства металла магния позволяют использовать в процессах восстановления Ti, U, V, Zr, прочих. Обычно используется способность отбирать кислород или реагирование с фтором. На выходе получают чистые металлы плюс оксиды или фториды Mg.

Использование магния в медицине
У магния металлические свойства выражены по-особенному: он хорошо режется, благодаря чему легко получают стружку этого элемента. Но в чистом виде элемент практически не используют, как конструкционный металл, однако его сплавы – да.
О свойствах последних уже немного сказано. Но надо отметить, что соединения магния с незначительным количеством Al, Zn, Mn, Be, Ti и редкоземельными элементами имеют лучшие механические качества, чем чистый металл Mg. Они более устойчивы к коррозии, прочнее, устойчивее.

Магний используется для производства некоторых деталей самолета
Основные области применения магния в сплавах: это конструкционные материалы в строении самолетов, машин, ЖД транспорта. Еще одно направление – синтез органических веществ, рассмотрен ранее.
Магний неметалл больше известен, как фторид Mg и активно применяется в оптике для производства линз. Последние обладают прозрачностью, пластичностью, прочностью. Материалы более известны, как синтетические монокристаллы. В промышленности иногда используют кремний, а также золотое, серебряное напыление.
В сталелитейном производстве лом магния используют за его свойство притягивать кислород. Он выполняет роль раскислителя. Благодаря чему сплавы легированной стали обладают большей коррозийной устойчивостью. Поэтому магний часто участвует и в цветном литье. Из него изготавливают аноды.

Особым спросом пользуются и другие «неметаллические» соединения магния, например, его сульфат. Известны растворы для инъекций или суспензий, последние пациент может готовить дома самостоятельно. Прием магния снижает риск заболевания гипертонией у курильщиков.
Используют магний и в земледелии, практически все виды почвы, где имеется растительность содержат этот элемент. Также следует отметить участие Mg в фотосинтезе растений.
Магний металлический цена за килограмм
Не все пункты приема принимают магний. У тех, кто принимает существует лишь одна категория этого металла – кусковой лом магния (точнее это даже не магний в чистом виде, а сплавы, в которых он содержится, но в пунктах обозначается, как лом магния), его стоимость (средняя) составляет:
Лом магния кусковой – 38 рублей за килограмм .
В домашнем обиходе лом магния – это различные вешалки, дверные ручки. Лом магния можно встретить в виде старых блоков цилиндров от двигателей, карсасов авто сидений, панелей приборов, картеров сцепления и коробки передач, педалей, а также поддона картера двигателя, крышки головки блока цилиндров, впускного коллектора.

Так выглядит лом магния
Не стоит путать лом магния с ломом ЦАМа.
Широкий спектр применения этого элемента в металлургии, медицине, агропромышленном комплексе делает его интересным, в качестве вторичного сырья.
Однако увидеть объявления с желанием купить магний с ценой за кг лома, приходится довольно редко. Чаще востребованы сплавы и сернокислый порошок Mg. Но это не мешает бирже оценивать магний металл, цена которого зависит от выпуска чистого продукта. Периодически выпуск снижается, тогда таблоиды показывают возрастание стоимости продукта.
В пунктах приема лом магния и цена на него может зависеть от условий, на которых происходит факт купли/продажи – цена может варьироваться незначительно и от его объема.
Интерес к материалу подогревается его высокой огнеупорностью. Благодаря этому свойству Mg участвует в производстве футеровок и тиглей для металлургических печей. Видимо поэтому, объявления: куплю лом магния, не теряют актуальности – см. также лом огнеупоров.
Читайте также:
