Лимонная кислота взаимодействие с металлами
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH - | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | - | - | Н | Н | Н | |
| F - | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | - | Н | Р | Р |
| Cl - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | - | - | - | Н | - | - | Н | - | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | - | Н | ? | Н | Н | ? | М | М | - | Н | ? | ? |
| HSO3 - | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | - | Н | Р | Р |
| HSO4 - | Р | Р | Р | Р | Р | Р | Р | Р | - | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р |
| NO2 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | - | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO - | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р | Р | - | Р | Р | Р | Р | Р | Р | Р | - | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые (
Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую:
Скопируйте эту ссылку, чтобы разместить результат запроса " " на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Внимание, если вы не нашли в базе сайта нужную реакцию, вы можете добавить ее самостоятельно. На данный момент доступна упрощенная авторизация через VK. Здесь вы можете выбрать параметры отображения органических соединений. Эти параметры действуют только для верхнего изображения вещества и не применяются в реакциях.
Корректная работа сайта обеспечена на всех браузерах, кроме Internet Explorer. Если вы пользуетесь Internet Explorer, смените браузер. На сайте есть сноски двух типов: Подсказки - помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация - такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Влияние лимонной кислоты на металлыЛимонная кислота получила свое название, потому что впервые была обнаружена в цитрусовых фруктах, таких как лимоны, апельсины и лаймы. Эта кислота дает этим фруктам их терпкий вкус. Лимонная кислота используется в нескольких методах для очистки металлов.
кредит: Анна Кучерова / iStock / Getty ImagesCitrus. Коррозия металлов
кредит: Джон Фокс / Stockbyte / Getty Images Коррозия металла. Сильные кислоты быстро разъедают металлы. Сильные кислоты реагируют, окисляя металл, превращая чистый элементарный металл в оксид металла. Добавление сильной кислоты к элементарному железу вступит в реакцию с образованием оксидов железа или ржавчины. Добавление сильной кислоты к никелю создает оксид никеля, зеленовато-голубую корку, которая появляется на монетах, оставленных снаружи под дождем. Драгоценные металлы, такие как золото и серебро, противостоят реакциям окисления и требуют сильной кислоты для превращения их в оксидные формы. Удаление ржавчины
кредит: Даниэль Бруннер / iStock / Getty ImagesRust удаление. Удаление ржавчины является одним из применений лимонной кислоты. Поскольку лимонная кислота является более слабой органической кислотой, она быстро не разъедает железо. Безрецептурные растворы лимонной кислоты обычно предлагаются в низких концентрациях, поэтому они более безопасны. Опуская кусок ржавого железа в раствор лимонной кислоты, начинается реакция. Лимонная кислота хелатирует оксид железа, оставляя чистый кусок железа и твердый хелат, который можно легко удалить. Эффекты жесткой воды
кредит: Comstock Images / Stockbyte / Getty ImagesDrain. Очистка стоков, раковин и туалетов также возможна с помощью лимонной кислоты. Жесткая вода содержит другие металлы, такие как кальций и магний. Эти металлы могут вводиться нефильтрованной водопроводной водой, а также другими бытовыми товарами. Загрязнение металла создает оксидные корки, пятна и обесцвечивания. Буферизация кислоты
кредит: ЕленаЕмчук / iStock / Getty Images Лимонный сок. Сандра Заслоу из Службы распространения кооперативов Северной Каролины объясняет использование кислот для удаления нежелательных металлов: лимонный сок содержит лимонную кислоту и может использоваться для очистки металлических отложений на стекле, корки на трубах и пятен ржавчины на фарфоре и металле. Приготовление пасты из лимонного сока и буры нейтрализует кислоту, поэтому смесь можно оставить на металле на несколько минут без травления, а затем пасту можно смыть. Медь и сплавы
Фото: Райан МакВей / Фотодиск / Getty ImagesЦитровая кислота может очищать медь. Лимонная кислота также очищает медь. Коррозия также портит медные сплавы, в том числе бронзу и латунь. Исследовательская лаборатория Texas A & M по консервации объясняет, как чистить медь. Коррозия меди образует несколько сине-зеленых соединений с кислородом и хлором, придавая древним статуям и отливкам зеленоватый оттенок. Например, Статуя Свободы подвергается воздействию брызг морской воды, что придает ей зеленую патину. Сульфид меди также образуется, создавая гораздо менее привлекательную черную корку. Соединения меди удаляют путем погружения потускневшего предмета в лимонную кислоту низкой концентрации, смешанную с тиомочевиной низкой концентрации, что предотвращает травление металла. Лимонная кислота взаимодействие с металлами
Лимонная кислота
Автор работы награжден дипломом победителя III степениТекст работы размещён без изображений и формул. I. Введение 1. Актуальность работы заключается в том, чтобы выяснить: какими свойствами обладает лимонная кислота, ее области применения. Изучить получение лимонной кислоты, как естественным путем, так и в промышленности. 2. Объект исследования: лимонная кислота. 3. Гипотеза: недостаточные знания по отдельным темам могут привести к негативному мнению о данном веществе. 4. Цель исследования: целью моего исследования является: изучение физических свойств лимонной кислоты, способов ее получения и областей применения, особых свойств этого всем знакомого вещества, биологической роли лимонной кислоты. 5. Задачи исследования: Анализ литературных данных и данных сети интернета. Проведение лабораторного опыта по ознакомлению с физическими свойствами лимонной кислоты. Проведение ряда учебно-исследовательских экспериментов. Анализ полученных экспериментальных данных. 6. Методы исследования: Библиографический анализ литературы и материалов сети интернета. Проведение лабораторного опыта. Проведение учебно-исследовательского эксперимента. Анализ полученных результатов эксперимента. 7. Теоретическая значимость исследования заключается в том, что результаты исследования могут быть использованы в нашей школе на уроках химии и биологии и во внеурочной деятельности для более глубокого изучения темы “Лимонная кислота”, для применения знаний на практике. 8. Практическая значимость исследовательской работы состоит в том, что она может быть использована для повышения образовательного уровня школьников при изучении предметов химии и биологии, подготовки к экзаменам.Для использования лимонной кислоты в быту помогут приобретенные знания в области лимонной кислоты. II. Основное содержание 1. Исторические сведения 1.1. Происхождение названия вещества. Первые сведения о лимонной кислоте и ее свойствах. Впервые лимонная кислота была получена из сока недозрелых лимонов шведским аптекарем Шееле (приложение 1) в 1784 г.; он и дал ей название. Состав химических веществ и их формулы во времена Шеелеопределять не могли и поэтому называли новые вещества по тем исходным материалам, из которых их получали, а также по вкусу, по запаху, либо по именам химиков, впервые получивших эти вещества. До 30-х годов ХХ века лимонная кислота вырабатывалась из цитрусовых, в основном в Италии. Позднее эту кислоту стали получать промышленным способом, как путем синтеза, так и из натуральных продуктов. Так в 1933 году в Чехословакии, а в 1935 году в Советском Союзе было создано производство лимонной кислоты методом биохимического синтеза с помощью плесневых грибов Aspergillus niger из сахара. 2. Теоретическое изучение темы «Лимонная кислота, ее свойства, получение, применение» (приложение 2) 2.1. Строение молекулы лимонной кислоты. Формула. Химическое название. Формула лимонной кислоты: 2.2. Физические свойства лимонной кислоты. Твердая, кристалловидная белого цвета Хорошо растворима в воде, растворима в этиловом спирте, малорастворима в диэтиловом эфире Температура плавления 153°C Температура разложения = 175 °C. Молярная масса составляет 192,1 г/моль. Плотность — 1,665 г/см³ 2.3. Химические свойства лимонной кислоты Под действие серной кислоты лимонная кислота как α-гидроксикислота разлагается с образованием ацетондикарбоновой и муравьиной кислот. Взаимодействует с металлами Взаимодействует с основными оксидами Взаимодействует с основаниями Взаимодействует с солями Взаимодействует с аммиаком Подвергается электролитической диссоциации Проявляет общие для всех карбоновых кислот свойства. При нагревании выше 175 °C лимонная кислота переходит в аконитовую кислоту Лимонная кислота переходит в ангидриды итаконовой и цитраконовой кислот (теряется вода и углекислый газ и образование ацетона) В реакциях с сильными окислителями (перманганат калия, бертолетова соль) переходит в акриловую кислоту и этиленоксид. В водном растворе образует хелатные комплексы с ионами кальция, магния, меди, железа и др. 2.4. Получение лимонной кислоты в промышленности. Около 60 лет назад лимонную кислоту выделяли преимущественно из плодов цитрусовых растений. В настоящее время основной путь промышленного производства — биосинтез из сахара или сахаристых веществ (меласса) промышленными штаммами плесневого гриба Aspergillus niger. Поскольку основным сырьем для получения лимонной кислоты является меласса, в которой содержится много железа, то на стадии пред-ферментации его осаждают при помощи желтой кровяной соли -K4[Fe(CN)6]. Известны два способа ферментации Aspergillus niger - поверхностный и глубинный. Первый из них реализуют на предприятиях малой и средней мощности в виде жидкофазной ферментации на жидкой среде (например, в ряде стран Европы и Америки) и в виде твердофазной ферментации (например, в Японии). Ныне Е330 получают новыми способами. Среди них самыми популярными являются: с помощью плесневых грибов; из продуктов получения сахара; 2.5. Нахождение лимонной кислоты в природе. Лимонная кислота в определённой концентрации содержится в большинстве прокариотов и почти во всех эукариотах (преимущественно в митохондриях). В естественном виде лимонную кислоту содержат такие фрукты и ягоды, как: земляника, все цитрусовые, крыжовник, брусника, персики, лимоны в большом количестве (особенно несозревшие), ананасы, барбарис, хвойные, рябина, помидоры, клюква, абрикосы, гранаты, черная смородина, айва, вишня, китайский лимонник, малина, сливы, махорка и другие. (приложения 3, 4, 5) 2.6. Особенные свойства лимонной кислоты и ее солей. Лимонная кислота всегда есть в человеческом организме. Ее производные — соли, выполняют важную роль при формировании костей, помогая регулировать размер кристаллов кальция. В биохимии соли данной кислоты имеют большое значение в качестве промежуточного звена в цикле трикарбоновых кислот, который имеет место при метаболизме у всех аэробных организмов. Обладает лимонная кислота и ценными лечебными свойствами. Она способствует очищению организма от вредных веществ, лишних солей, шлаков, положительно влияет на работу систем пищеварения, улучшает зрение, сжигает углеводы, проявляет ценные противоопухолевые свойства, повышает иммунитет. Лимонная кислота также способствует выведению токсинов через клетки кожи. С другой стороны, сухая лимонная кислота и её концентрированные растворы при попадании в глаза вызывают сильное раздражение, при контакте с кожей возможно слабое раздражение. При употреблении внутрь больших количеств лимонной кислоты возможны: раздражение слизистой оболочки желудка, кашель, боль, кровавая рвота. При вдыхании пыли сухой лимонной кислоты — раздражение дыхательных путей. Высокая концентрация данного вещества, применяемая наружу или внутрь, является причиной серьезных ожогов. Также лимонная кислота является разрушителем зубной эмали, вступая с ней в реакцию из-за нейтрализации кальция. Страдающим желудочно-кишечными заболеваниями не рекомендуется (а в некоторых случаях даже запрещено) употреблять продукты, имеющие в своем составе Е330. Также ограничить их употребление или исключить из своего меню следует лицам с повышенной кислотностью, так как поступление в организм лимонной кислоты вызовет ухудшения состояния здоровья, может стать причиной сильных желудочных болей. 2.7. Применение лимонной кислоты. В кондитерской промышленности лимонная кислота используется как подкислитель и усилитель вкуса. В алкогольные и прохладительные газированные и негазированные напитки лимонная кислота добавляется для придания им ощущения свежести. Кроме того, она является синергистом, т. е. веществом, усиливающим действие антиоксидантов, таких, например, как аскорбиновая кислота. В консервной промышленности лимонная кислота используется как консервант вместо уксуса, который признан канцерогеном и применение которого в большинстве стран в пищевой промышленности резко ограничен. В масложировой промышленности лимонная кислота предохраняет продукцию от разлагающего действия находящихся в них следов тяжелых металлов, путем образования с ними комплексных соединений. Таким путем значительно снижается вероятность прогоркания жиров, маргаринов и животного масла. Применяется в медицине, в том числе в составе средств, улучшающих энергетический обмен (в цикле Кребса). В косметике используется как регулятор кислотности, буфер, хелатирующий агент, для шипучих композиций (ванны). Применение в домашнем хозяйстве : Для продления времени стояния роз в воде, ее нужно обогатить сахаром и лимонной кислотой. Для вазы, в которую помещается пять литров воды нужно взять 1 г лимонной кислоты (1/8 чайной ложки) и стакан сахара, растворить в воде и поместить в этот раствор розы. Раствор для очищения утюга от накипи. Такой способ очистки применим для утюгов с возможностью подачи пара. Чтобы приготовить чистящий раствор, в стакане воды следует растворить столовую ложку лимонной кислоты. Этот раствор залить вместо воды в резервуар для подачи пара, подключить утюг к сети электропитания, установить отметку подачи пара на максимум и нажимая на кнопку подачи пара, постепенно очищать утюг. По окончанию проведения этой процедуры в резервуар для воды наливают чистую воду и повторяют процедуру несколько раз, с целью очистки парообразующих путей от следов лимонной кислоты. Раствор для очищения налет или потемнений на посуде из серебра, а также ювелирных украшениях, любые монеты, кулоны, перстни, браслеты и так далее. Раствор для очищения накипи на дне и стенках чайника. Очистить сантехнику и даже стены ванной комнаты можно при помощи порошка, полученного из Е 330. Желательно, чтобы фракции порошка были мелкими, а достигнуть этого можно, размолов средство в кофемолке (используя средства защиты дыхательных путей) или хотя бы измельчив скалкой на столе. Использовать так само, как и все чистящие порошки — нанеся небольшое количество на губку, постепенно очищать поверхность. Обладая легкими дезинфицирующими свойствами, Е 330 прекрасно подходит для очищения кухонных столов. Протирать стол слабым раствором этого вещества достаточно раз в неделю. Учитывая его свойство устранять неприятные запахи, им можно протирать также внутренние поверхности холодильника и кухонных шкафчиков. 3. Экспериментальная часть «Лимонная кислота и изучение ее свойств» 3.1. Лабораторный опыт «Ознакомление с физическими свойствами лимонной кислоты». Цель выполнения лабораторного опыта: изучить физические свойства лимонной кислоты и определение ph среды. Этапы лабораторного опыта: Убедилась в том, что лимонная кислота имеет белый, кристаллический вид Приготовила раствор лимонной кислоты, убедившись, что она растворима в воде. (приложение 6) С помощью индикаторов определяю рh среду. Индикатор Лакмус изменил цвет на бледно-розовый цвет. Индикатор Метиловый оранжевый изменил цвет на красный. Индикатор Универсальный изменил цвет на оранжевый, и с его помощью определила, что среда раствора кислая, слабая. Ph = 3.0 (приложение 7) 3.2. Учебно-исследовательский эксперимент “Лимонная кислота как разрыхлитель”. Цель эксперимента: доказать, что лимонную кислоту можно использовать в качестве разрыхлителя. Приготовила раствор лимонной кислоты и соды. С6Н8О7 + 3NaHCO3 --> Na3C6H5O7 + 3CO2 + 3H2O (приложение 8) Наблюдала выделение углекислого газа. (приложение 9) Раствор лимонной кислоты и пищевой соды можно использовать в качестве разрыхлителя теста в кулинарии. Разрыхлитель используется для того, чтобы тесто было нежным и приятным. Сода помогает тесту подняться. 3.3. Учебно-исследовательский эксперимент «Выявление биологической роли лимонной кислоты». Название эксперимента и есть цель моей исследовательской работы. Этапы эксперимента и выводы: Приготовила раствор лимонной кислоты. Наношу на две половинки заранее разрезанных яблок этот раствор, а две половинки оставляю непропитанными. (приложение 10) Наблюдаю, что через некоторое время те половинки, которые не были смазаны раствором, темнеют. Потемнение происходит из-за окисления железа, содержащегося в яблоке, кислородом воздуха.(приложение 10) Лимонная кислота замедляет процессы окисления, являясь природным антиоксидантом. Поэтому она играет большую биологическую роль в жизни человека. 3.4. Учебно-исследовательский эксперимент “Осаждение белков молока лимонной кислотой”. Цель эксперимента: проследить процесс осаждения белков молока с помощью лимонной кислоты. В стакан с молоком насыпаю лимонной кислоты. Перемешивая, наблюдаю на трубочке творожистовидный осадок. (приложение 11) Пропускаю через фильтр получившийся раствор. Наблюдаю, что через некоторое время на фильтре остается масса, содержащая казеин и жиры. (приложение 12) На долю глобулина приходится 6-15% от общего содержания белков. В молоке глобулин находится в растворенном состоянии. Глобулин молока укрепляет иммунитет, защищает организм от инфекций. На долю альбумина приходится 2-3% от общего содержания белков в молоке. 3.5. Учебно-исследовательский эксперимент “Удаление пятен ржавчины с тканей с помощью лимонной кислоты”. Приготовила концентрированный раствор лимонной кислоты. Готовым раствором смочила ткань со ржавчиной. Через небольшой промежуток времени наблюдала исчезновение пятна. (приложение 13) Проведя этот эксперимент, я рассмотрела лимонную кислоту как пятновыводитель. Это свойство лимонной кислоты можно применить в быту. 3.6. Выводы по результатам экспериментов. Выполняя эксперименты, я изучила некоторые свойства лимонной кислоты, о которых я и не догадывалась. Я узнала, какую биологическую роль в жизни человека играет лимонная кислота. Узнала и наглядно продемонстрировала осаждение белка молока лимонной кислотой. Лимонная кислота – интересное органическое вещество! III. Заключение и выводы по работе Выполнив такую обширную работу, я выяснила значение лимонной кислоты в жизни человека, изучила физические и химические свойства данной кислоты, изучила способы получения и области применения лимонной кислоты, выяснила влияние лимонной кислоты на здоровье человека – это естественный антиоксидант. Узнала, что лимонная кислота может осаждать белки молока, может использоваться как средство для очищения поверхностей, для приготовления газированных напитков, как разрыхлитель теста совместно с пищевой содой. IV. Источники А. Ликум – «Всё обо всем» популярная энциклопедия для детей, Том 1. Москва, 1993г. П.А. Оржековский, В.Н. Давыдов, Н.А. Титов – «Творчество учащихся на практических занятиях по химии». АРКТИ, Москва, 1999г. П.И. Воскресенский – «Техника лабораторных работ». Химия. Москва. 1973г. С.А. Шапиро, М.А. Шапиро – «Аналитическая химия». Высшая школа. Москва. 1989г. Химия. 10 класс. Углубленый уровень: учебник / О.С.Габриелян, И.Г.Остроумов, С.Ю. Пономарев, - 6-е изд., стереотип. - М.: Дрофа, 2018. - 368: ил. Гальваника и не только для начинающих. Сборная солянка рецептов и советов. Часть 1 — снятие ржавчины
Уксусный компресс. Снятие ржавчины.
Для случаев, когда нет желания и необходимости сохранять родной красочный слой, ржавчину можно удалить при помощи 70-процентной уксусной эссенции (кислоты), которая свободно продается в бакалейных отделах продуктовых магазинов. Стандартная фасовка эссенции — бутылочки емкостью около 200 мл.
Щавелевая кислота
Стоит применять, когда есть замысел и надежда сохранить оригинальное красочное покрытие без последующей окраски. Лимонная кислота
Вымываем грязь, наслоения ржавчины, жировые пятна и всё что можно очистить до загрузки детали в раствор лимонной кислоты.
1.В чистой миске смешайте четверть чашки буры, одну чайную ложку винного камня и достаточное количество перекиси водорода, чтобы получить густую пасту. Для тщательного перемешивания этих трех компонентов, лучше воспользоваться палочкой. Толстым слоем нанести на ржавчину. Держать нетронутым в течение получаса или около того. Затем протереть влажной губкой.
— ингибитор кислотной коррозии. Продается в аптеке. Применяется при обработке разбавленным водным раствором соляной или серной кислоты для защиты чистого металла, не мешает взаимодействию кислоты с оксидом и гидроксидом железа, но тормозит химическую реакцию (в данном случае реакцию растворения металла в кислоте). Безкислотные реактивы для вывода ржавчины. Раствор хлористого цинка.
Берут произвольное количество хлористого цинка (в зависимости от размера изделия) и у него постепенно доливают при перемешивании дистиллированную воду, пока растворится весь порошок, т.е. готовят насыщенный раствор. Обезжиренные детали помещают в раствор на 10-12 часов. После удаления ржавчины их хорошо промывают водой и вытирают сухой тряпкой. Ровные поверхности при этом становятся блестящими. Из кровяной соли
готовят одновременно два раствора, частей за массою:
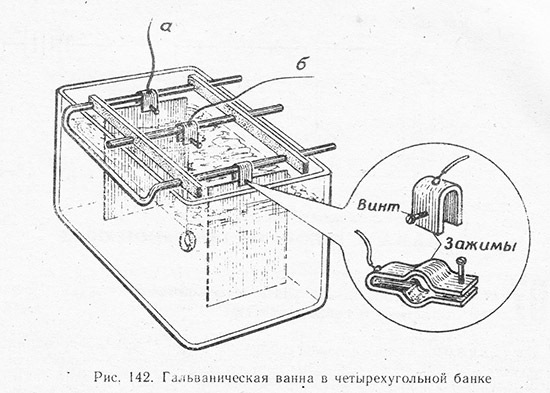
Первое, что вам потребуется, это блок питания. Отрежьте штекер на конце провода блока питания. Разделите конец провода на две части и зачистите их концы от изоляции. Скрутите медный жилки и, если есть возможность, подсоедините их к металлическим зажимам. Например, Вы можете купить микро зажимы типа "крокодил". Внимание! Избегайте контакта содового раствора с бренным телом! Имейте под руками ведро чистой воды, чтобы в случае чего умыться, промыть глаза, ополоснуть руки. Плюс эта сода наносит вред природе, поэтому не выливайте ее в огород. Зато ее не нужно менять для электролиза, раствора хватит очень надолго. Промывка системы охлаждения лимонной кислотой
Всем привет!
Больше промывать не имело смысла на мой взгляд. Читайте также:
|