Кристаллическая решетка металлического проводника состоит из
Все молекулы состоят из мельчайших частиц – атомов. Все открытые на настоящий момент атомы собраны в таблице Менделеева.
Атом – это мельчайшая, химически неделимая частица вещества, сохраняющая его химические свойства. Атомы соединяются между собой химическими связями. Ранее мы уже рассматривали виды химических связей и их свойства. Обязательно изучите теорию по теме: Типы химических связей, перед тем, как изучать эту статью!
Теперь рассмотрим, как могут соединяться частицы в веществе.
В зависимости от расположения частиц друг относительно друга свойства образуемых ими веществ могут очень сильно различаться. Так, если частицы расположены друг от друга далеко (расстояние между частицами намного больше размеров самих частиц), между собой практически не взаимодействуют, перемещаются в пространстве хаотично и непрерывно, то мы имеем дело с газом .
Если частицы расположены близко друг к другу, но хаотично, больше взаимодействуют между собой, совершают интенсивные колебательные движения в одном положении, но могут перескакивать в другое положение, то это модель строения жидкости .
Если же частицы расположены близко к друг другу, но более упорядоченно, и больше взаимодействуют между собой, а двигаются только в пределах одного положения равновесия, практически не перемещаясь в другие положения, то мы имеем дело с твердым веществом .
Большинство известных химических веществ и смесей могут существовать в твердом, жидком и газообразном состояниях. Самый простой пример – это вода. При нормальных условиях она жидкая, при 0 о С она замерзает – переходит из жидкого состояния в твердое, и при 100 о С закипает – переходит в газовую фазу – водяной пар. При этом многие вещества при нормальных условиях – газы, жидкости или твердые. Например, воздух – смесь азота и кислорода – это газ при нормальных условиях. Но при высоком давлении и низкой температуре азот и кислород конденсируются и переходят в жидкую фазу. Жидкий азот активно используют в промышленности. Иногда выделяют плазму, а также жидкие кристаллы, как отдельные фазы.

Очень многие свойства индивидуальных веществ и смесей объясняются взаимным расположением частиц в пространстве друг относительно друга!
Данная статья рассматривает свойства твердых тел, в зависимости от их строения. Основные физические свойства твердых веществ: температура плавления, электропроводность, теплопроводность, механическая прочность, пластичность и др.
Температура плавления – это такая температура, при которой вещество переходит из твердой фазы в жидкую, и наоборот.

Пластичность – это способность вещества деформироваться без разрушения.

Электропроводность – это способность вещества проводить ток.
Ток – это упорядоченное движение заряженных частиц. Таким образом, ток могут проводить только такие вещества, в которых присутствуют подвижные заряженные частицы. По способности проводить ток вещества делят на проводники и диэлектрики. Проводники – это вещества, которые могут проводить ток (т.е. содержат подвижные заряженные частицы). Диэлектрики – это вещества, которые практически не проводят ток.

В твердом веществе частицы вещества могут располагаться хаотично, либо более упорядоченно. Если частицы твердого вещества расположены в пространстве хаотично, вещество называют аморфным . Примеры аморфных веществ – уголь, слюдяное стекло.

Если частицы твердого вещества расположены в пространстве упорядоченно, т.е. образуют повторяющиеся трехмерные геометрические структуры, такое вещество называют кристаллом , а саму структуру – кристаллической решеткой . Большинство известных нам веществ – кристаллы. Сами частицы при этом расположены в узлах кристаллической решетки.
Кристаллические вещества различают, в частности, по типу химической связи между частицами в кристалле – атомные, молекулярные, металлические, ионные; по геометрической форме простейшей ячейки кристаллической решетки – кубическая, гексагональная и др.
В зависимости от типа частиц, образующих кристаллическую решетку , различают атомную, молекулярную, ионную и металлическую кристаллическую структуру .
Атомная кристаллическая решетка

Атомная кристаллическая решетка образуется, когда в узлах кристалла расположены атомы . Атомы соединены между собой прочными ковалентными химическими связями. Соответственно, такая кристаллическая решетка будет очень прочной, разрушить ее непросто. Атомную кристаллическую решетку могут образовывать атомы с высокой валентностью, т.е. с большим числом связей с соседними атомами (4 или больше). Как правило, это неметаллы: простые вещества — кремния, бора, углерода (аллотропные модификации алмаз, графит), и их соединения (бороуглерод, оксид кремния (IV) и др.). Поскольку между неметаллами возникает преимущественно ковалентная химическая связь, свободных электронов (как и других заряженных частиц) в веществах с атомной кристаллической решеткой в большинстве случаев нет. Следовательно, такие вещества, как правило, очень плохо проводят электрический ток, т.е. являются диэлектриками. Это общие закономерности, из которых есть ряд исключений.

Связь между частицами в атомных кристаллах: ковалентная полярная или неполярная.
В узлах кристалла с атомной кристаллической структурой расположены атомы.
Фазовое состояние атомных кристаллов при нормальных условиях: как правило, твердые вещества.
Вещества , образующие в твердом состоянии атомные кристаллы:
- Простые веществас высокой валентностью (расположены в середине таблицы Менделеева): бор, углерод, кремний, и др.
- Сложные вещества, образованные этими неметаллами: кремнезем (оксид кремния, кварцевый песок) SiO2; карбид кремния (карборунд) SiC; карбид бора, нитрид бора и др.
Физические свойства веществ с атомной кристаллической решеткой:
— прочность;
— тугоплавкость (высокая температура плавления);
— низкая электропроводность;
— низкая теплопроводность;
— химическая инертность (неактивные вещества);
— нерастворимость в растворителях.
Молекулярная кристаллическая решетка

Молекулярная кристаллическая решетка – это такая решетка, в узлах которой располагаются молекулы. Удерживают молекулы в кристалле слабые силы межмолекулярного притяжения (силы Ван-дер-Ваальса, водородные связи, или электростатическое притяжение). Соответственно, такую кристаллическую решетку, как правило, довольно легко разрушить. Вещества с молекулярной кристаллической решеткой – легкоплавкие, непрочные. Чем больше сила притяжения между молекулами, тем выше температура плавления вещества. Как правило, температуры плавления веществ с молекулярной кристаллической решеткой не выше 200-300К. Поэтому при нормальных условиях большинство веществ с молекулярной кристаллической решеткой существует в виде газов или жидкостей. Молекулярную кристаллическую решетку, как правило, образуют в твердом виде кислоты, оксиды неметаллов, прочие бинарные соединения неметаллов, простые вещества, образующие устойчивые молекулы (кислород О2, азот N2, вода H2O и др.), органические вещества. Как правило, это вещества с ковалентной полярной (реже неполярной) связью. Т.к. электроны задействованы в химических связях, вещества с молекулярной кристаллической решеткой – диэлектрики, плохо проводят тепло.

Связь между частицами в молекулярных кристаллах: межмолекулярные водородные связи, электростатические или межмолекулярные силы притяжения.
В узлах кристалла с молекулярной кристаллической структурой расположены молекулы.
Фазовое состояние молекулярных кристаллов при нормальных условиях: газы, жидкости и твердые вещества.
Вещества , образующие в твердом состоянии молекулярные кристаллы:
- Простые вещества-неметаллы, образующие маленькие прочные молекулы(O2, N2, H2, S8 и др.);
- Сложные вещества (соединения неметаллов) с ковалентными полярными связями(кроме оксидов кремния и бора, соединений кремния и углерода) — вода H2O, оксид серы SO3 и др.
- Одноатомные инертные газы (гелий, неон, аргон, криптони др.);
- Большинство органических веществ, в которых нет ионных связей — метан CH4, бензол С6Н6 и др.
Физические свойства веществ с молекулярной кристаллической решеткой:
— легкоплавкость (низкая температура плавления):
— высокая сжимаемость;
— молекулярные кристаллы в твердом виде, а также в растворах и расплавах не проводят ток;
— фазовое состояние при нормальных условиях – газы, жидкости, твердые вещества;
— высокая летучесть;
— малая твердость.
Ионная кристаллическая решетка

В случае, если в узлах кристалла находятся заряженные частицы – ионы, мы можем говорить о ионной кристаллической решетке . Как правило, с ионных кристаллах чередуются положительные ионы (катионы) и отрицательные ионы (анионы), поэтому частицы в кристалле удерживаются силами электростатического притяжения . В зависимости от типа кристалла и типа ионов, образующих кристалл, такие вещества могут быть довольно прочными и тугоплавкими. В твердом состоянии подвижных заряженных частиц в ионных кристаллах, как правило, нет. Зато при растворении или расплавлении кристалла ионы высвобождаются и могут двигаться под действием внешнего электрического поля. Т.е. проводят ток только растворы или расплавы ионных кристаллов. Ионная кристаллическая решетка характерна для веществ с ионной химической связью. Примеры таких веществ – поваренная соль NaCl, карбонат кальция – CaCO3 и др. Ионную кристаллическую решетку, как правило, в твердой фазе образуют соли, основания, а также оксиды металлов и бинарные соединения металлов и неметаллов.
Связь между частицами в ионных кристаллах: ионная химическая связь.
В узлах кристалла с ионной решеткой расположены ионы.
Фазовое состояние ионных кристаллов при нормальных условиях: как правило, твердые вещества.
Химические вещества с ионной кристаллической решеткой:
- Соли (органические и неорганические), в том числе соли аммония (например, хлорид аммония NH4Cl);
- Основания;
- Оксиды металлов;
- Бинарные соединения, в составе которых есть металлы и неметаллы.
Физические свойства веществ с ионной кристаллической структурой:
— высокая температура плавления (тугоплавкость);
— растворы и расплавы ионных кристаллов – проводники тока;
— большинство соединений растворимы в полярных растворителях (вода);
— твердое фазовое состояние у большинства соединений при нормальных условиях.
Металлическая кристаллическая решетка

И, наконец, металлы характеризуются особым видом пространственной структуры – металлической кристаллической решеткой, которая обусловлена металлической химической связью . Атомы металлов довольно слабо удерживают валентные электроны. В кристалле, образованном металлом, происходят одновременно следующие процессы: часть атомов отдает электроны и становится положительно заряженными ионами; эти электроны хаотично перемещаются в кристалле; часть электронов притягивается к ионам. Эти процессы происходят одновременно и хаотично. Таким образом, возникают ионы , как при образовании ионной связи, и образуются общие электроны , как при образовании ковалентной связи. Свободные электроны перемещаются хаотично и непрерывно по всему объему кристалла, как газ. Поэтому иногда их называют « электронным газом ». Из-за наличия большого числа подвижных заряженных частиц металлы проводят ток, тепло. Температура плавления металлов сильно варьируется. Металлы также характеризуются своеобразным металлическим блеском, ковкостью, т.е. способностью изменять форму без разрушения при сильном механическом воздействии, т.к. химические связи при этом не разрушаются.

Связь между частицами : металлическая химическая связь.
В узлах кристалла с металлической решеткой расположены ионы металлов и атомы.
Фазовое состояние металлов при обычных условиях: как правило, твердые вещества (исключение — ртуть, жидкость при обычных условиях).
Химические вещества с металлической кристаллической решеткой — простые вещества-металлы.
Физические свойства веществ с металлической кристаллической решеткой:
— высокая тепло- и электропроводность;
— ковкость и пластичность;
— металлический блеск;
— металлы, как правило, нерастворимы в растворителях;
— большинство металлов – твердые вещества при нормальных условиях.
Сравнение свойств веществ с различными кристаллическими решетками
Тип кристаллической решетки (или отсутствие кристаллической решетки) позволяет оценить основные физические свойства вещества. Для примерного сравнения типичных физических свойств соединений с разными кристаллическими решетками очень удобно использовать химические вещества с характерными свойствами. Для молекулярной решетки это, например, углекислый газ, для атомной кристаллической решетки — алмаз, для металлической — медь, и для ионной кристаллической решетки — поваренная соль, хлорид натрия NaCl.
Сводная таблица по структурам простых веществ, образованных химическими элементами из главных подгрупп таблицы Менделеева (элементы побочных подгрупп являются металлами, следовательно, имеют металлическую кристаллическую решетку).
SA. Ток в металлах
В начале XX века была создана классическая электронная теория проводимости металлов (П. Друде, 1900 г., Х.Лоренц, 1904 г.), которая дала простое и наглядное объяснение большинства электрических и тепловых свойств металлов.
Рассмотрим некоторые положения этой теории.
Свободные электроны
Металлический проводник состоит из:
1) положительно заряженных ионов, колеблющихся около положения равновесия, и
2) свободных электронов, способных перемещаться по всему объему проводника.
Таким образом, электрические свойства металлов обусловлены наличием в них свободных электронов с концентрацией порядка 10 28 м –3 , что примерно соответствует концентрации атомов. Эти электроны называются электронами проводимости. Они образуются путем отрыва от атомов металлов их валентных электронов. Такие электроны не принадлежат какому-то определенному атому и способны перемещаться по всему объему тела.
В металле в отсутствие электрического поля электроны проводимости хаотически движутся и сталкиваются, чаще всего с ионами кристаллической решетки (рис. 1). Совокупность этих электронов можно приближенно рассматривать как некий электронный газ, подчиняющийся законам идеального газа. Средняя скорость теплового движения электронов при комнатной температуре составляет примерно 10 5 м/с.
Электрический ток в металлах
Ионы кристаллической решетки металла не принимают участие в создании тока. Их перемещение при прохождении тока означало бы перенос вещества вдоль проводника, что не наблюдается. Например, в опытах Э. Рикке (1901 г.) масса и химический состав проводника не изменялся при прохождении тока в течении года.
Экспериментальное доказательство того, что ток в металлах создается свободными электронами, было дано в опытах Л.И. Мандельштама и Н. Д. Папалекси (1912 г., результаты не были опубликованы), а также Т. Стюарта и Р. Толмена (1916 г.). Они обнаружили, что при резкой остановке быстро вращающейся катушки в проводнике катушки возникает электрический ток, создаваемый отрицательно заряженными частицами — электронами.
- электрический ток в металлах — это направленное движением свободных электронов.
Так как электрический ток в металлах образуют свободные электроны, то проводимость металлических проводников называется электронной проводимостью.
Электрический ток в металлах возникает под действием внешнего электрического поля. На электроны проводимости, находящиеся в этом поле, действует электрическая сила, сообщающая им ускорение, направленное в сторону, противоположную вектору напряженности поля. В результате электроны приобретают некоторую добавочную скорость (ее называют дрейфовой). Эта скорость возрастает до тех пор, пока электрон не столкнется с атомом кристаллической решетки металла. При таких столкновениях электроны теряют свою избыточную кинетическую энергию, передавая ее ионам. Затем электроны снова разгоняются электрическим полем, снова тормозятся ионами и т.д. Средняя скорость дрейфа электронов очень мала, около 10 –4 м/с.
- Скорость распространения тока и скорость дрейфа не одно и то же. Скорость распространения тока равна скорости распространения электрического поля в пространстве, т.е. 3⋅10 8 м/с.
- При столкновении с ионами электроны проводимости передают часть кинетической энергии ионам, что приводит к увеличению энергии движения ионов кристаллической решетки, а, следовательно, и к нагреванию проводника.
Сопротивление металлов
Сопротивление металлов объясняется столкновениями электронов проводимости с ионами кристаллической решетки. При этом, очевидно, чем чаще происходят такие столкновения, т. е. чем меньше среднее время свободного пробега электрона между столкновениями τ, тем больше удельное сопротивление металла.
В свою очередь, время τ зависит от расстояния между ионами решетки, амплитуды их колебаний, характера взаимодействия электронов с ионами и скорости теплового движения электронов. С ростом температуры металла амплитуда колебаний ионов и скорость теплового движения электронов увеличиваются. Возрастает и число дефектов кристаллической решетки. Все это приводит к тому, что при увеличении температуры металла столкновения электронов с ионами будут происходить чаще, т.е. время τ уменьшается, а удельное сопротивление металла увеличивается.
См. так же
Зависимость сопротивления от температуры
Опыт показывает, что при не слишком высоких и не слишком низких температурах зависимости удельного сопротивления от температуры выражается линейной функцией:
\(~\rho = \rho_0 \cdot (1 + \alpha \cdot \Delta t),\)
где Δt = t - t0, t0 = 0 °C, ρ0, ρ — удельные сопротивления вещества проводника соответственно при 0 °С и t °C, α — температурный коэффициент сопротивления, измеряемый в СИ в Кельвинах в минус первой степени (К -1 ) (или °C -1 ).
- Температурный коэффициент сопротивления вещества — это величина, численно равная относительному изменению удельного сопротивления проводника при его нагревании на 1 К:
Для всех металлических проводников α > 0 и слабо изменяется с изменением температуры. Для большинства металлов в интервале температур от 0 ° до 100 °С коэффициент α изменяется от 3,3⋅10 –3 до 6,2⋅10 –3 К –1 (таблица 1). У химически чистых металлов α = 1/273 К -1 .
- Существуют специальные сплавы, сопротивление которых практически не изменяется при нагревании, например, манганин и константан. Их температурные коэффициенты сопротивления очень малы и равны соответственно 1⋅10 –5 К –1 и 5⋅10 –5 К –1 .
Температурный коэффициент сопротивления (при t от 0 °С до 100 °C)
| Вещество | α, 10 –3 °К –1 | Вещество | α, 10 –3 °К –1 |
|---|---|---|---|
| Алюминий | 4,2 | Нихром | 0,1 |
| Вольфрам | 4,8 | Олово | 4,4 |
| Железо | 6,0 | Платина | 3,9 |
| Золото | 4,0 | Ртуть | 1,0 |
| Латунь | 0,1 | Свинец | 3,7 |
| Магний | 3,9 | Серебро | 4,1 |
| Медь | 4,3 | Сталь | 4,0 |
| Никель | 6,5 | Цинк | 4,2 |
Если пренебречь изменением размеров металлического проводника при нагревании, то такую же линейную зависимость от температуры будет иметь и его сопротивление
\(~R_t = R_0 \cdot (1 + \alpha \cdot \Delta t) ,\)
где R0, Rt — сопротивления проводника при 0 °С и t °С.
Зависимость удельного сопротивления металлических проводников ρ от температуры t изображена на рисунке 2.

Зависимость сопротивления металлов от температуры используют в термометрах сопротивления. Обычно в качестве термометрического тела такого термометра берут платиновую проволоку, зависимость сопротивления которой от температуры достаточно изучена. Об изменениях температуры судят по изменению сопротивления проволоки, которое можно измерить. Такие термометры позволяют измерять очень низкие и очень высокие температуры, когда обычные жидкостные термометры непригодны.
Сверхпроводимость
В 1911 г. голландский физик Г. Камерлинг-Оннес, изучая изменение электрического сопротивления ртути при низких температурах, обнаружил, что при температуре около 4 К (т.е. при –269 °С) удельное сопротивление скачком уменьшается (рис. 3) до нуля. Это явление Г. Камерлинг-Оннес назвал сверхпроводимостью.

Г. Камерлинг-Оннес был удостоен Нобелевской премии по физике 1913 г. «за исследования свойств вещества при низких температурах».
В дальнейшем было выяснено, что более 25 химических элементов — металлов при очень низких температурах становятся сверхпроводниками. У каждого из них своя критическая температура перехода в состояние с нулевым сопротивлением. Самое низкое значение ее у вольфрама — 0,012 К, самое высокое у ниобия — 9 К.
Сверхпроводимость наблюдается не только у чистых металлов, но и у многих химических соединений и сплавов. При этом сами элементы, входящие в состав сверхпроводящего соединения, могут и не являться сверхпроводниками. Например, NiBi, Au2Bi, PdTe, PtSb и другие.
До 1986 г. были известны сверхпроводники, обладающие этим свойством при очень низких температурах — ниже –259 °С. В 1986-1987 годах были обнаружены материалы с температурой перехода в сверхпроводящее состояние около –173 °С. Это явление получило название высокотемпературной сверхпроводимости, и для его наблюдения можно использовать вместо жидкого гелия жидкий азот.
Широкому применению сверхпроводимости до недавнего времени препятствовали трудности, связанные с необходимостью охлаждения до сверхнизких температур, для чего использовался жидкий гелий. Тем не менее, несмотря на сложность оборудования, дефицитность и дороговизну гелия, с 60-х годов XX века создаются сверхпроводящие магниты без тепловых потерь в их обмотках, что сделало практически возможным получение сильных магнитных полей в сравнительно больших объемах. Именно такие магниты требуются для создания установок управляемого термоядерного синтеза с магнитным удержанием плазмы, для мощных ускорителей заряженных частиц. Сверхпроводники используются в различных измерительных приборах, прежде всего в приборах для измерения очень слабых магнитных полей с высочайшей точностью.
На основе сверхпроводящих пленок создан ряд быстродействующих логических и запоминающих элементов для счетно-решающих устройств. При космических исследованиях перспективно использование сверхпроводящих соленоидов для радиационной защиты космонавтов, стыковки кораблей, их торможения и ориентации, для плазменных ракетных двигателей.
В настоящее время созданы керамические материалы, обладающие сверхпроводимостью при более высокой температуре — свыше 100 К, то есть при температуре выше температуры кипения азота. Возможность охлаждать сверхпроводники жидким азотом, который имеет на порядок более высокую теплоту парообразования, существенно упрощает и удешевляет все криогенное оборудование, обещает огромный экономический эффект.
- Wikipedia Сверхпроводимость
- Буздин А., Варламов А. Страсти по сверхпроводимости в конце тысячелетия //Квант. — 2000. — № 1. — С. 2-8.
- Мякишев Г.Я. Физика: Электродинамика //§2.6. Сверхпроводимость
Недостатки электронной теории проводимости
Несмотря на то, что электронной теории проводимости металлов объяснила ряд явлений, она имеет и свои недостатки.
- Из теории следовало, что удельное сопротивление должно быть пропорционально корню квадратному из температуры (\(~\rho \sim \sqrt T\)), между тем, согласно опыту, ρ ~ Т.
- Для того чтобы получить значения удельной электрической проводимости металла, полученных из опыта, приходится принимать среднюю длину свободного пробега электронов в сотни раз большей, чем период решетки металла. Иными словами, электрон должен проходит без соударений с ионами решетки сотни атомов.
- Данная теория не смогла объяснить причину сверхпроводимости.
Приведенные выше недостатки указывают на то, что классическая электронная теория, представляя электрон как материальную точку, подчиняющуюся законам классической механики, не учитывала некоторых специфических свойств самого электрона, которые еще не были известны к началу XX века. Эти свойства были установлены позднее при изучении строения атома, и в 1924 г. была создана новая, так называемая квантовая или волновая механика движения электронов.
Из чего состоит кристаллическая решётка металлического проводника?
Из чего состоит кристаллическая решётка металлического проводника?

Происходит ли перенос вещества в цепях, состоящих из металлических проводников?
Происходит ли перенос вещества в цепях, состоящих из металлических проводников?
А) зависит б) не зависит в) зависит если проводник металлический.

Почему в металлическом проводнике отсутствует электрическое поле?
Почему в металлическом проводнике отсутствует электрическое поле?

Как изменится сила тока, если подогреть металлический проводник?
Как изменится сила тока, если подогреть металлический проводник?

Как связано наприжение с силой тока для металлического проводника?
Как связано наприжение с силой тока для металлического проводника.

А)электронов б)положительных и отрицательных ионов в)положительных ионов г)отрицательных ионов.
На рисунке приведены вольтамперные характеристики металлических проводников?
На рисунке приведены вольтамперные характеристики металлических проводников.
Расположите номера проводников в порядке убывания их электрического сопротивления.

Как получить индукционный ток в сплошном металлическом проводнике?
Как получить индукционный ток в сплошном металлическом проводнике?
Помогите?
Очень много баллов даю!
Как скорость упорядоченного движения электронов в металлическом проводнике зависит от напряжения на концах проводника?
Как скорость упорядоченного движения электронов в металлическом проводнике зависит от напряжения на концах проводника?
На 74 градусов. Наверное так.
Площадь верхнего основания конуса не имеет никакого значения. Со стороны нижнего основания на стол действует сила mg, распределённая по площади Sa Единственно, надо площадь перевести в квадратные метры Sa = 4 см² = 4 / 10000 м² = 0, 0004 м² P = mg /..
Поскольку за ПЕРИОД грузик пройдет расстояние, равное четырем амплитудам : L₀ = 4 * 3 = 12 см или 0, 12 м то число колебаний : n = L / L₀ = 0, 36 / 0, 12 = 3 Ответ : 3 колебания.

Q = λ * m = 4 * 330000 = 1320000Дж или 1320 кДж.
Решение Q = m * λ Отсюда находим массу m = Q / λ = 0, 1 кг 100 грамм свинца.

V = 72 км / ч = 20 м / с ; = V² / R = 20² / 500 = 0, 8 м / с² ; N = m(g - ) = 500×(10 - 0, 8) = 4600 Н (4500, если брать g за 9. 8 м / с²).

Правильный ответ это б.
0, 3 * m1 = N * 0, 2 0, 1 * N = 0, 3 * M m1 = 2M M = 1, 2 кг.
Потому что перемещение , cкорость, ускорение - величины векторные и работать с векторами труднее чем с проекциями.

Ответ : Объяснение : Дано : S₁ = S / 4V₁ = 72 км / чS₂ = 3·S / 4V₂ = 15 м / с____________Vcp - ? Весь путь равен S. Время на первой четверти пути : t₁ = S₁ / V₁ = S / (72·4) = S / 288 чВремя на остальной части пути : t₂ = S₂ / V₂ = 3·S / (15·4) = 3..
© 2000-2022. При полном или частичном использовании материалов ссылка обязательна. 16+
Сайт защищён технологией reCAPTCHA, к которой применяются Политика конфиденциальности и Условия использования от Google.
Ответ Б, потому что только между ними действуют электростатические силы.
Как превратить атом в отрицательный ион?
Как превратить атом в отрицательный ион?
Какие носители электрического заряда создают электрический ток в растворах или расплавах электролитов?
Какие носители электрического заряда создают электрический ток в растворах или расплавах электролитов.
1) положительные и отрицательные ионы 2) электроны, положительные и отрицательные ионы 3) электрони и отрицательные ионы 4) электроны.
СРОООООЧНО?
При протекании тока через металлический проводник, какие частицы являются носителями заряда?
Электрический ток в нихромовом проводнике представляет собой направленное движение?
Электрический ток в нихромовом проводнике представляет собой направленное движение.
А)только ионов никеля б)только ионов хрома в)ионов никеля и хрома г)электронов.
А3 : Какие частицы являются носителями тока в металлических проводниках?
А3 : Какие частицы являются носителями тока в металлических проводниках?
Как образуются положительные и отрицательные ионы?
Как образуются положительные и отрицательные ионы.
6. 1 Какой знак заряда у ионов, образующих кристаллическую решетку металла?
6. 1 Какой знак заряда у ионов, образующих кристаллическую решетку металла?
Чем отличается положительный ион от отрицательно иона?
Чем отличается положительный ион от отрицательно иона.
Электроматериаловедение - Строение металлических проводниковых материков
РАЗДЕЛ ПЕРВЫЙ
ПРОВОДНИКОВЫЕ МАТЕРИАЛЫ И ИЗДЕЛИЯ
ГЛАВА Г.
ОСНОВНЫЕ СВОЙСТВА ПРОВОДНИКОВЫХ МАТЕРИАЛОВ
§ 1. Строение металлических проводниковых материалов
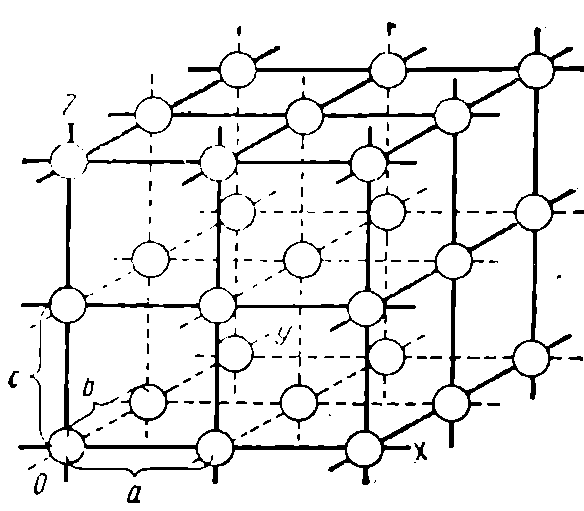
Рис. 1. Кубическая пространственная кристаллическая решетка
Металлические материалы (металлы) относятся к веществам, имеющим кристаллическое строение. Атомы кристаллических материалов располагаются друг относительно друга в строго определенном порядке по прямым линиям. Эти прямые линии, пересекаясь друг с другом, образуют пространственную решетку (рис. 1). В ней атомы занимают места пересечений прямых линий, называемых
Рис. 2. Грань кубического кристалла
узлами кристаллической решетки. По каждому из трех направлений ox, оу, oz атомы располагаются на одинаковом расстоянии. Эти расстояния обозначаются буквами а, b, с и называются параметрами кристаллической решетки. Направления ох, су, oz называются кристаллографическими осями. Углы между кристалло-графическими осями у многих кристаллов прямые, но могут быть и непрямые.
Каждый кристалл представляет собой геометрическую фигуру, ограниченную плоскостями или гранями кристалла. Грани по расположению на них атомов подобны плоским сеткам.
На рис. 2 приведено изображение грани кубического кристалла.
Геометрическую форму кристаллической решетки, а следовательно, и вид кристалла определяют параметры а, b, с (см. рис. 1) и величины углов между кристаллографическими осями.
Рис. 3. Элементарная кристаллическая ячейка объемно-центрированного куба
Рис. 4. Элементарная кристаллическая ячейка гранецентрированного куба
Если параметры а, b, с равны между собой, а углы между ними прямые, то кристаллическая решетка имеет форму куба и называется кубической. Если же параметры а, b, с не равны между собой, а углы между ними остались прямыми, то такую кристаллическую решетку называют призматической. Грани такого кристалла имеют форму прямоугольников.
Кроме кубической и призматической пространственных решеток для кристаллов возможны и другие геометрические фигуры. Основные металлические проводниковые, материалы, применяемые в электротехнических устройствах: медь Cu, железо Fe, алюминий Al, молибден Мо, вольфрам W и др. состоят из кристаллов, имеющих разные кубические решетки. Различают кубическую решетку, в центре которой располагается еще один атом А, и кубическую решетку, в центре каждой из шести граней которой находится еще по атому В. Первую называют объемно-центрированной кубической решеткой (рис. 3), а вторую — гранецентрированной кубической решеткой (рис. 4). Кристаллическую решетку объемно-центрированного куба имеют железо, вольфрам, хром, молибден и некоторые другие металлы, а гранецентрированный куб — медь, алюминий, никель, серебро и другие металлы. Следовательно, металл можно представить как вещество, состоящее из бесконечно большого количества атомов, расположенных в элементарных пространственных решетках. Во всех металлах наблюдаются небольшие отклонения от идеальных решеток — имеются незанятые узлы и некоторые смещения атомов.
Проводниковые материалы могут быть изготовлены из какого- либо одного чистого металла или из сплавов разных металлов. Если сплавляют два металла, то сплав называется двойным, если три — тройным и т. д. При изготовлении сплавов атомы одного металла могут входить в решетку другого, т. е. образовывать совместно с ним одну общую кристаллическую решетку. Такие сплавы называются твердыми растворами. При определенном количественном соотношении и резко отличающихся температурах плавления металлы могут не образовать твердого раствора, а микрокристаллизоваться каждый отдельно в виде самостоятельных зерен. И этом случае сплав будет механической смесью кристаллов исходных металлов. При сплавлении металла с металлом может образоваться и химическое соединение, кристаллическое строение которого будет отличным от строения исходных металлов.
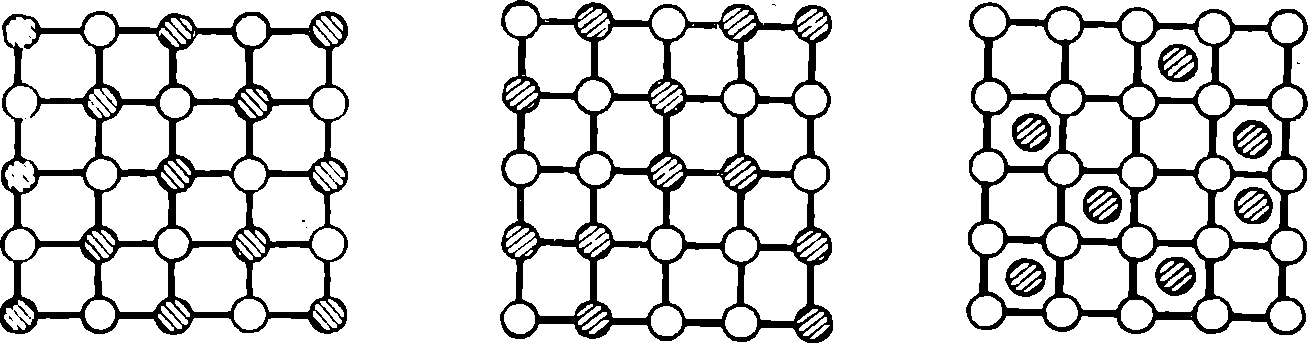
Рис. 7. Распределение атомов в решетке твердого раствора внедрения
Рис. 6. Распределение атомов в решетке твердого раствора неупорядоченного замещения
Рис. 5. Распределение атомов в решетке твердого раствора упорядоченного замещения
Сплавы в виде твердого раствора различаются между собой по тому, как располагаются в кристаллической решетке атомы сплавляемых металлов. Если атомы в общей решетке сплава располагаются с атомами другого, то такой сплав называют твердым раствором упорядоченного замещения. На рис. 5 показана плоская решетка такого сплава двух металлов. Если же атомы двух металлов в общей решетке сплава распределяются в ее узлах беспорядочно, то сплав называют твердым раствором неупорядоченного замещения (рис. 6). Твердый раствор, в котором кристаллическая решетка образуется из атомов одного какого-либо металла, а атомы второго внедряются в промежутки между ними, т. е. между узлами, получил название твердого раствора внедрения. Плоская решетка такого сплава изображена на рис. 7.
Итак, при сплавлении двух разных металлов или металла с неметаллом, например железа с углеродом, образуется новый материал в виде сплава. Сплавы имеют иную, чем исходные металлы, кристаллическую структуру, а следовательно, и иные механические и электрические свойства.
В сплавах при их образовании протекают сложные процессы кристаллизации. Каждый чистый металл имеет определенную температуру плавления, которая при охлаждении этого расплавленного металла является и температурой его кристаллизации. Если температура двух сплавляемых металлов превышает температуры плавления каждого из них, то они растворяются друг в друге. При охлаждении данного расплава кристаллизация начнется при одной температуре, а закончится при другой, более низкой.
t c
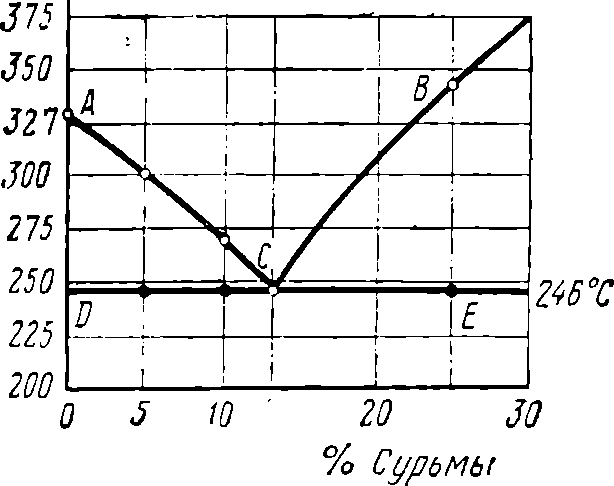
Рис. 8. Диаграмма состояния системы свинец — сурьма
Кристаллизация сплавов имеет температуру начала кристаллизации и температуру ее окончания. Для сплавов, имеющих различное содержание одних и тех же исходных металлов, эти температуры различны. Поэтому на диаграммах, в которых по вертикали наносятся величины температур, а по горизонтали — процентное содержание сплавляемых металлов (рис. 8), получаются две кривые. Линия АСВ, соответствующая температурам начала кристаллизации, получила название линии ликвидуса *, так как она является границей жидкого состояния всего сплава. Выше этой линии сплав находится в жидком состоянии. Линия DCE, соответствующая температурам окончания кристаллизации, называется линией солидуса**, так как она является начальной границей твердого состояния. Ниже этой линии сплав находится в твердом состоянии.
* Ликвидус (лат.) — жидкий, текущий.
**Солидус (лат.) — прочный.
Области диаграммы между двумя линиями (ACD и ВСЕ) содержат как твердый, так и жидкий растворы, т. е. в этих областях температур наблюдается два состояния сплава. Ниже линии солидуса сплав может представлять собой твердый раствор, химическое соединение сплавляемых металлов или их механическую смесь в зависимости от состава сплава и от других факторов. Рассмотренная диаграмма (рис. 8) называется диаграммой состояния сплавов системы свинец — сурьма (Pb — Sb). Эта диаграмма показывает, что начало затвердевания различных по составу сплавов свинца и сурьмы происходит при различных температурах, а окончание затвердевания — при одной определенной температуре (246°С). При содержании в сплаве 13% сурьмы (Sb) и 87% свинца (РЬ) кристаллизация сурьмы и свинца происходит одновременно при 246° С. При этом образуется механическая смесь металлов, называемая эвтектикой *, а сплав этого состава называется эвтектическим. Эвтектический сплав обладает самой низкой температурой плавления, что очень важно для практики.
Диаграммы состояния сплавов других металлов могут иметь другой вид, но и там имеются линии ликвидуса и солидуса.
Читайте также:
