Контрольная работа по теме металлы и их соединения 11 класс
Тесты по химии 11 класс. Тема: "Металлы"
Правильный вариант ответа отмечен знаком +
1. В какой группе находится металл полоний:
2. К четвертой группе относится элемент:
3. Как проходит условная граница между между металлическими и неметаллическими элементами:
4. Металлургический процесс включает в себя:
+ восстановление ионов металла
- окисление ионов неметалла
- восстановление ионов неметалла
5. Пирометаллургией является:
+ процесс получения металлов из их соединений при высокой температуре
- процесс получения неметаллов из их соединений при низкой температуре
- процесс получения неметаллов из их соединений при высокой температуре
6. В пирометаллургии используются:
- как восстановители, так и окислители
7. При алюмотермии используют металл:
8. В гидрометаллургии получают:
+ металлы из растворов их соединений
- неметаллы из растворов их соединений
- воду из растворов их соединений
9. В электрометаллургии используется процесс:
- обработка при предельно высокой температуре
- реакция замещения и соединения
тест 10. При электролизе восстановителем является:
11. Чем определяются физические свойства металлов:
+ типом кристаллической решетки
- количеством протонов, электронов, нейтронов
- расположением в определенной группе или подгруппе
12. Отличием атомов металлов от неметаллов можно назвать:
+ содержат небольшое количество электронов на внешнем уровне, большой радиус и низкая электроотрицательность
- содержат большое количество электронов на внешнем энергетическом уровне, маленький радиус и высокая электроотрицательность
- содержат большое количество электронов на внешнем энергетическом уровне, большой радиус и высокая электроотрицательность
13. Металлической является связь:
+ между ионами металлов
- между ионами неметаллов
- между ионами металла и неметалла
14. Для какого агрегатного состояния не характерна металлическая связь:
- для жидкого состояния
- для твердого состояния
15. Чем обусловлена электропроводность металлов?
+ наличием свободных электронов
- наличием свободных нейтронов
- наличием свободных протонов
16. С повышением температуры электропроводность:
- может как повышаться, так и понижаться
17. Электропроводность увеличивается от:
+ ртути к серебру
- алюминия к цинку
18. Максимальной теплопроводностью обладает:
19. Наиболее пластичным металлом называют:
тест-20. Твердым веществом при нормальных условиях не является:
21. Самым твердым металлом является:
- щелочно – земельные металлы
22. Самым тяжелым металлом является:
23. Самым тугоплавким металлом является:
24. К черным металлам можно отнести:
25. Какие степени окисления имеют металлы:
- как положительные, так и отрицательные
26. Металлы в соединениях проявляют свойства:
- окислительно – восстановительные свойства
27. Какая закономерность уменьшения восстановительных свойств металлов:
+ слева направо, снизу-вверх
- справа налево, сверху вниз
28. На данном изображении представлена:
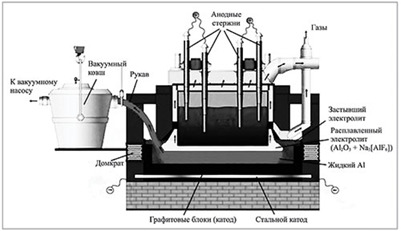
+ схема получения алюминия электролизом
- схема получения железа электролизом
- схема получения гидроксида алюминия электролизом
29. Чем левее находится металл в ряду, тем:
+ больше его восстановительная способность
- меньше его восстановительная способность
- больше его окислительная способность
тест_30. Лантаноиды на внешнем энергетическом уровне содержат по:
31. Сколько примерно имеются металлов в периодической системе Менделеева:
+ более девяти ста
- менее восьми ста
- менее двадцати ста
32. Во сколько раз литий легче осмия:
+ в сорок пять раз
- в шестьдесят раз
- в семьдесят раз
33. Провода высоковольтных изготавливают из:
34. Бронза является сплавом:
- железа и алюминия
- вольфрама и серебра
35. На данном рисунке представлена:
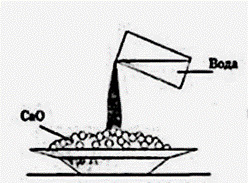
+ реакция гашения извести водой
- реакция соединения калия с хлором
- окисление перманганата калия
36. При взаимодействии с кислородом металлы образуют:
37. При взаимодействии щелочноземельных металлов с водой образуются:
- альдегиды и кетоны
38. Оксидом железа можно назвать:
39. В алюминотермии используется:
тест*40. Взаимодействие металлов с оксидами является реакцией:
Контрольная работа 3 по теме "Металлы" 11 класс
методическая разработка по химии (11 класс)
За лето ребенок растерял знания и нахватал плохих оценок? Не беда! Опытные педагоги помогут вспомнить забытое и лучше понять школьную программу. Переходите на сайт и записывайтесь на бесплатный вводный урок с репетитором.
Вводный урок бесплатно, онлайн, 30 минут
Предварительный просмотр:
Контрольная работа «Металлы»
А1 . Атом наиболее активного металла имеет электронную конфигурацию
1) 1s 2 2s 1 3) 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1
2) 1s 2 2s 2 2p 6 3s 1 4) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 5s 1
А2. Высшую степень окисления хром проявляет в соединении 1) CrCl 2 2) Cr 2 O 3 3) K 2 Cr 2 O 7 4) Cr(OH) 2
А3 . Верны ли следующие суждения о железе?
А. Железо во всех соединениях проявляет степень окисления +2.
Б. Железо в химических реакциях проявляет свойства восстановителя.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
А 4 . Верны ли следующие суждения о концентрированной серной кислоте?
А. Концентрированная серная кислота — сильный окислитель.
Б. При взаимодействии меди с концентрированной серной кислотой выделяется оксид серы(IV).
1) верно только А 3) верны оба суждения
2) верно только Б 4) оба суждения неверны
А5. Гидроксид хрома(III) является
3) амфотерным соединением
А6 . Амфотерным и основным оксидами соответственно являются
1) Na 2 O и CO 2 3) Fe 2 O 3 и Li 2 O
2) Al 2 O 3 и CrO 3 4) Al 2 O 3 и Cr 2 O 3
А7 . Сокращенное ионное уравнение реакции
Cr 3+ + 3OH − = Cr(OH) 3 ↓
1) хрома с водой
2) оксида хрома(III) с водой
3) оксида хрома(III) со щелочью
4) хлорида хрома(III) со щелочью
В1 . Разбавленная серная кислота взаимодействует
1) с оксидом берилия 3) титаном и хромом
2) с хлоридом бария 4) с оксидом железа(III)
5) с гидроксидом хрома(III)
В2 . Установите соответствие между исходными веществами и продуктами их взаимодействия.
1) HNO 3разб + Cu А. Сu(NO 3 ) 2 + NO 2 + H 2 O
2) HNO 3конц + Cu Б. Cu(NO 3 ) 2 + H 2 O
3) HNO 3 +Cr 2 O 3 В. Cr(NO 3 ) 3 + H 2 O
4) HNO 3 + CuO Г. Cu(NO 3 ) 2 + NO + H 2 O
В 3. Определите выход продукта реакции, если при окислении 102,4 г меди избытком концентрированной серной кислоты было получено 230,4 г сульфата меди (2).
В4 . Объем водорода (н. у.), выделяющегося при взаимодействии серной кислоты с 10 г железа, содержащего 5% примеси, равен _______ л.
С1 . Используя метод электронного баланса, составьте уравнение реакции TiCI 4 + . = MgCI 2 + . Определите окислитель и восстановитель.
С2 . Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Fe → FeCl 2 → FeCl 3 → Fe(OH) 3
1) 1 s2 2s 2 2p 6 3s 1 3) 1s 2 2s 2 2p 6 3s 2
2) 1s 2 2s 2 4) 1s 2 2s 2 2p 6 3s 2 3p 1
А2 . Высшую степень окисления титан проявляет в соединении
1) FeTiO 3 3) Ti 2 (SO 4 ) 3
2) TiCI 4 4) TiO 2
А 3. Верны ли следующие суждения о металлах?
А. В пределах одного периода с увеличением порядковых номеров
элементов их металлические свойства усиливаются.
Б. Атомы металлов могут превратиться только в положительно заряженные ионы.
1) верно только А 3) верны оба суждения
2) верно только Б 4) оба суждения неверны
А4 . Верны ли следующие суждения об азотной кислоте?
А. Валентность азота в азотной кислоте равна 4, а степень окисления — +5.
Б. Азотная кислота проявляет свойства окислителя.
А5 . Оксид железа(III) является оксидом
1) несолеобразующим 3) основным
2) кислотным 4) амфотерным
А6 . С соляной кислотой взаимодействует
1) золото 3) алюминий
2) серебро 4) ртуть
А 7 . Сокращенное ионное уравнение реакции
Cu 2+ + 2OH − = Cu(OH) 2 ↓
2) оксида меди(II) с водой
3) оксида меди(II) со щелочью
4) хлорида меди(II) со щелочью
В1 . Концентрированная азотная кислота взаимодействует
1) с кислородом 4) с гидроксидом натрия
2) с медью 5) с гидроксидом алюминия
3) с железом 6) с оксидом магния
1) H 2 SO 4разб + Zn А. ZnSO 4 + H 2 O
2) H 2 SO 4конц + Cu Б. ZnSO 4 + H 2
3) H 2 SO 4 + ZnO В. CuSO 4 + SO 2 + H 2 O
4) H 2 SO 4 + Cu(OH) 2 Г. CuSO 4 + CO 2 + H 2 O
Д. CuSO 4 + H 2 O
В3. Установите соответствие между формулой гидроксида металла и классом, к которому относится этот гидроксид
- Be(OH) 2 А. основание
- Ba(OH) 2 Б. амфотерный гидроксид
- Cr(OH) 2
- Fe(OH) 3
В4. Объем газа (н. у.), который образуется при окислении 30 л метана 30 л кислорода, равен _______ л.
С1 . Используя метод электронного баланса, составьте уравнение реакции Ca + H2O = … + . Определите окислитель и восстановитель.
C → CO 2 → Na 2 CO 3 → CO 2 → CO
Ответы к контрольной работе Металлы Вариант -1
- Со всеми
- 1-г, 2-а, 3-в, 4-б
- Дано : Решение
m (Cu) = 102.4 г Cu + 2H2SO4=CuSO4+SO2+2H2O
m (CuSO4) = 230.4 г 63.5 159.5
выход - ?m (Fe) = 10 г. H2SO4 + Fe = FeSO4 + H2
V (H2) - ?Ti +4 + 4e - = Ti 0 4 1
Mg 0 – 2e - = Mg +2 2 2
2FeCI2 + 3CI2 = 2FeCI3
FeCI3 + H2O = Fe(OH)3 + 3HCI
Fe(OH)3 = Fe2O3 + H2O
Fe2O3+3C = 2Fe + 3CO
Или Fe2O3 +3H2= 2Fe + 3H2O
- 2
- 1-б, 2-в, 3-а, 4-д
- 1-б, 2-а, 3-б, 4-а
- Дано: Решение
V (CH4) = 30 л CH4 + 2O2 = CO2 + 2H2O
V(O2) = 30 л 1.34 2*0.67 22.4
Ca 0 – 2e - = Ca +2 1 - восст
H + +1e - = H 0 2 – ок
CO2 + 2NaOH = Na2CO3 + H2O
CO2 + NaOH (изб)= NaHCO3
Na2CO3 + H2SO4 = Na2SO4 + CO2 + H2O
CO2 (г) + С (тв) = 2СО (г)
Менее 10 баллов «2»
По теме: методические разработки, презентации и конспекты
Контрольная работа для 7 класса по учебнику по УМК Афанасьевой О.В., Михеевой И.В. «Новый курс английского языка для российских школ: 3 год обучения, 7 класс"
Контрольная работа разработана для обучающихся 7-х классов, эта работа проводится после 3-й главы.

Контрольная работа для 7 класса по физике "Механическая работа. Простые механизмы. Энергия".

Контрольная работа для 7 класса по теме "Работа, энергия, мощность, КПД" 8 вариантов.
Контрольная работа для 7 класса на проверку умения решать расчётные задачи по теме "Работа, энергия, мощность, КПД" из 8 вариантов по 5 задач в каждом варианте.
Контрольная работа для 10 класса по теме: Работа. Законы сохранения.
Контрольная работа представлена в двух вариантах различных уровнях сложности ( А1-А4 базовый, А5-А6, В1 повышенный, С1 сложный) с поэлементным анализом работы.

Контрольная работа 11 профильного класса проверочная работа по теории паскаля
Контрольная работа 11 профильного класса проверочная работа по теории паскаля.
Контрольная работа физика 7 класс по теме "Работа и мощность"
Контрольная работа взята из ФГОС УМК О.И.Громцева Контрольные и самостоятельные работы по физике. К учебнику А.В. Перышкина "Физика 7 класс".
Контрольная работа по химии 11 класс
материал по химии (11 класс) на тему
Муниципальное бюджетное общеобразовательное учреждение
«Средняя общеобразовательная школа № 15 п. Березайка»
Бологовского района Тверской области
по теме «Металлы»
Составил: учитель химии
Часть А Тестовые задания с выбором ответа
1. s-Элементу 4-го периода ПСХЭ соответствует электронная формула:
а) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 3 4s 2 в) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 1 4s 2
б) 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 г) 1s 2 2s 2 2p 6 3s 1
2. Электронная формула иона натрия:
а) 1s 2 2s 2 2p 6 3s 2 б) 1s 2 2s 2 2p 6 в) 1s 2 2s 2 2p 6 3s 1 г) 1s 2 2s 2 2p 5
3. Переменную степень окисления в соединениях проявляет:
а) барий б) цинк в) железо г) рубидий
4 . Простое вещество – марганец – может являться:
а) только восстановителем в) только окислителем
б) и окислителем, и восстановителем
5. Схема превращений: Cr +6 →Cr +3 →Cr 0 представляет собой процессы:
а) восстановления в) окисления
б) окисления (1), восстановления (2) г) восстановления(1), окисления(2)
6. Восстановительные свойства в ряду химических элементов: Cs – Rb – K – Ca:
а ) изменяются периодически б) не изменяются в) ослабевают г) усиливаются
7. Формула вещества Х в уравнении реакции: Cu+2H 2 SO 4 =CuSO 4 +X+2H 2 O:
а) H 2 б) SO 2 в) H 2 S г) SO 3
8. Формулы продуктов электролиза раствора бромида калия на инертных электродах:
а) K, H 2 б) KOH, Br 2 , H 2 в)K, Br 2 г) KOH, H 2
9. Магний взаимодействует с каждым веществом группы:
а) водород, сульфат меди (II) (раствор), этатаналь
б) кислород, уксусная кислота, фосфор
в) оксид углерода (IV), оксид кальция, фенол (расплав)
г) глюкоза, этанол, бром
10. Основные свойства гидроксидов усиливаются в ряду:
а) KOH-NaOH-Be(OH) 2 -LiOH в) Be(OH) 2 -LiOH-NaOH-KOH
б) LiOH-Be(OH) 2 -NaOH-KOH г) KOH-NaOH-Be(OH) 2 -LiOH
Часть Б Задания со свободным ответом
11. Составьте формулы высшего оксида и гидроксида элемента, в ядре которого содержится 56 протонов. Назовите эти вещества, укажите их характер.
12. Составьте уравнения реакций следующих превращений: Al → X → AlCl 3 → Al(NO 3 ) 3 → X → KAlO 2
13. Дополните фразу: «В периоде с уменьшением заряда ядра атома от галогена к щелочному металлу радиус атомов …».
14. Сравните число атомов в 32 г меди и 12 г магния.
15. Рассчитайте объем, количество вещества и массу газа, полученного при взаимодействии 3,5 г лития с водой, взятой в избытке.
1. p-Элементу 4-го периода ПСХЭ соответствует электронная формула:
а) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 в) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 1
2. Электронная формула иона магния:
а) 1s 2 2s 2 2p 6 3s 2 б) 1s 2 2s 2 2p 6 в) 1s 2 2s 2 2p 6 г) 1s 2 2s 2 2p 5
а) барий б) хром в) кальций г) магний
4 . Простое вещество – железо – может являться:
5. Схема превращений: Cu +2 →Cu 0 →Cu +2 представляет собой процессы:
б) окисления (1), восстановления (2), г) восстановления(1), окисления(2)
6. Восстановительные свойства в ряду химических элементов: Rb – K –Na –Li:
7. Формула вещества Х в уравнении реакции: 2Fe+6H 2 SO 4 =Fe 2 (SO4) 3 +X+6H 2 O:
8. Формулы продуктов электролиза расплава хлорида натрия на инертных электродах:
а) Na, H 2 б) NaOH, Cl 2 , H 2 в) Na, Cl 2 г) NaOH, H 2
9. Алюминий взаимодействует с каждым веществом группы:
а) водород, сульфат меди (II) (раствор), метаналь
б) кислород, муравьиная кислота, сера
в) оксид углерода (IV), оксид бария, фенол (расплав)
г) глюкоза, этанол, хлор
10. Основные свойства гидроксидов ослабевают в ряду:
а) KOH-NaOH-LiOH-Be(OH) 2 в) Be(OH) 2 -LiOH-NaOH-KOH
11. Составьте формулы высшего оксида и гидроксида элемента, в ядре которого содержится 24 протона. Назовите эти вещества, укажите их характер.
12. Составьте уравнения реакций следующих превращений: Be → X → BeCl 2 → Be(NO 3 ) 2 → X → K 2 BeO 2
13. Дополните фразу: «В периоде с увеличением заряда ядра атома от галогена к щелочному металлу радиус атомов …».
14. Сравните число атомов в 108 г серебра и 20 г кальция.
15. Рассчитайте объем, количество вещества и массу газа, полученного при взаимодействии 12 г магния с водой, взятой в избытке.
контрольная работа по химии 11 класс, по теме:"Предмет органической химии. Предельные углеводороды"
контрольная работа по химии 11 класс, по теме:"Предмет органической химии. Предельные углеводороды".
Контрольная работа по химии : " Классы неорганических веществ"
Контрольная работа по химии: "Классы неорганических веществ".

Тематическое планирование уроков химии, биологии и обществознания. Контрольные работы по химии и биологии.
Календарно - тематическое планирование уроков. Контрольные работы разработаны по вариантам.
Контрольная работа по химии в 9 классе по теме: "Органическая химия"
Данная контрольная работа предназначена для проверки уровня усвоения знаний учащимися за курс «Органическая химия» 9 класс.Задания составлены в форме теста. Тест содержит 16 вопросов с выбором одного .

Контрольная работа по химии для 10 класса (профиль) №1 по темам «Строение и классификация органических соединений», «Химические реакции в органической химии»
Контрольная работа предназначена для обучающихся профильного 10 класса. Включает демоверсию и два варианта заданий. Контрольная работа выявляет уровень знаний по следующим темам:1. Теория химического .

Контрольная работа по химии 9 класс. Тема контрольной работы "Теория электролитической диссоциации".
Контрольная работа по химии 9 класс. Тема контрольной работы "Теория электролитической диссоциации" на два варианта.

Контрольная работа по химии для обучающихся в 9 классе с целью проверки опорных знаний.
Контрольная работа по химии "Металлы"

Контрольная работа в 2-х вариантах состоит из части А (10 заданий), части В (1 задание) и С части (1 задание). Позволит проверить знания учащихся.
Описание разработки
Вариант 1.
Часть А.
При выполнении заданий выберите номер одного правильного ответа.
1. Наиболее сильные восстановительные свойства проявляет.
2. Ряд, в котором элементы расположены в порядке возрастания их атомного радиуса:
3. Электронная конфигурация внешнего электронного слоя…. 2s 2 2p 1 соответствует атому.
4. Соляной кислотой не будет взаимодействовать:
5. Наиболее активно с водой при комнатной температуре будут взаимодействовать оба металла из пары.
6. С растворами кислот будут взаимодействовать оба металла.
7. Самым распространенным металлом в земной коре является:
8. С водой с образованием основания и водорода будет взаимодействовать.
9. Амфотерный оксид образуется при взаимодействии кислорода и.
10. Установите соответствие между правой и левой частями уравнений.
Часть В.
В2. Напишите уравнения реакций, соответствующих превращениям, укажите типы и условия их протекания:
Напишите ионные уравнения реакций в полном и сокращенно-ионном виде.
Часть С.
С1. К 980г 5%-го раствора серной кислоты прилили избыток раствора нитрата бария. Найдите массу выпавшего осадка.
Весь материал - в документе.
Содержимое разработки
Контрольная работа №1
по теме «Металлы».
1.Наиболее сильные восстановительные свойства проявляет
а) K б) Mg в) Li г) Na
2.Ряд, в котором элементы расположены в порядке возрастания их атомного радиуса:
а) B→Be→Li в) K→Na→Li
б) Mg→Ca→Be г) Na→Mg→Al
3.Электронная конфигурация внешнего электронного слоя….2s 2 2p 1 соответствует атому
а) алюминия б) бора в) скандия г) калия
4. Соляной кислотой не будет взаимодействовать:
а) Cu б) Fe в) Al г) Zn
5.Наиболее активно с водой при комнатной температуре будут взаимодействовать оба металла из пары
а) Na и Cu б) Li и Na в) K и Mg г) Cu и Hg
6.С растворами кислот будут взаимодействовать оба металла
а) Li и Ag б) Na и Hg в) K и Mg г) Cu и Hg
7. Самым распространенным металлом в земной коре является:
а) натрий; б) алюминий; в) золото; г) кальций
8. С водой с образованием основания и водорода будет взаимодействовать
а) Са б) Сu в) Zn г) Ag
9. Амфотерный оксид образуется при взаимодействии кислорода и
а) натрия б) меди в) магния г) бериллия
10. Установите соответствие между правой и левой частями уравнений
1. Наиболее сильные восстановительные свойства проявляет
а) К б) Al в) Na г) Zn
2.Ряд, в котором элементы расположены в порядке уменьшения их атомного радиуса:
а) Al→Mg→Na в) Li→Na→K
б) Ca→Ba→Be г) Ca→ Mg→Be
3.Электронная конфигурация внешнего электронного слоя….3s 2 3p 1 соответствует атому
4. С азотной концентрированной кислотой не взаимодействует:
а) медь б) цинк в) кальций г) алюминий.
5. Наиболее активно с водой при комнатной температуре будут взаимодействовать оба металла из пары
а) K и Cu б) Na и K в) Na и Zn г) Cu и Hg
а) K и Cu б) Na и Hg в) K и Zn г) Cu и Hg
7. Самый активный металл первой группы главной подгруппы :
а) цезий б) рубидий в) калий г) натрий
8. С водой с образованием оксида металла и водорода при нагревании будет взаимодействовать
Контрольные работы по химии «Металлы. Неметаллы. Органические вещества»
Пять контрольных работв двух вариантах по учебнику О.С. Габриелян позволят проверить знания учащихся.
Стартовая контрольная работа.
Вариант №1.
1. Напишите электронную и графическую формулу элемента № 17 и формулы его водородного соединения, высшего оксида и соединения с кальцием. Укажите тип связи в этих соединениях.
2. Как изменяются неметаллические свойства элементов в ряду:
- у какого элемента радиус атома наименьший?
- какой элемент имеет наименьшую электроотрицательность?
а) амфотерных гидроксидов,
б) основных оксидов,
4. Осуществите превращения и определите тип каждой реакции:
5. Какова масса и количество вещества оксида магния, который образуется при взаимодействии 2, 4 г магния с кислородом?
Вариант №2.
1. Напишите электронную и графическую формулу элемента № 11 и формулы его высшего оксида и соединения с хлором. Укажите тип связи в этих соединениях.
5. Какова масса и количество вещества диоксида углерода, который образуется при взаимодействии 24 г угля с кислородом?
«Металлы». Контрольная работа №1.
Вариант № 1.
1. Допишите уравнения реакций:
2. Расскажите о положении металлов в Периодической системе химических элементов Д. И. Менделеева.
3. Перечислите способы защиты металлов от коррозии.
На оценку «4 и 5»
4. Напишите уравнения реакций, позволяющие осуществить превращения:
5. Для перехода 4 составьте полное и сокращенное ионное уравнение.
Вариант № 2.
а) Са + S → б) Са + Н2О →
2. Расскажите о природных соединениях кальция. Каково их значение для человека?
3. Расскажите о видах коррозии.
Zn → Zn О → Zn Сl2 → Zn (ОН) 2 → Zn(NО 3 ) 2.
Стартовая контрольная работа
1. Напишите электронную и графическую формулу элемента № 17 и формулы его водородного соединения, высшего оксида и соединения с кальцием. Укажите тип связи в этих соединениях.
2. Как изменяются неметаллические свойства элементов в ряду:
Si → P → S → Cl
3. Даны вещества:
Выпишите формулы: а) амфотерных гидроксидов, б) основных оксидов, в) кислот. г) солей.
4. Осуществите превращения и определите тип каждой реакции:
AgCl ← MgCL2 → Mg → MgO → MgSO4 → Mg(OH)2
5. Какова масса и количество вещества оксида магния, который образуется при взаимодействии 2,4 г магния с кислородом?
1. Напишите электронную и графическую формулу элемента № 11 и формулы его высшего оксида и соединения с хлором. Укажите тип связи в этих соединениях.
C → N → O → F
AgCl ← FeCL2 → Fe → FeO → FeSO4 → Fe(OH)2
5. Какова масса и количество вещества диоксида углерода, который образуется при взаимодействии 24 г угля с кислородом?
«Металлы». Контрольная работа №1
Допишите уравнения реакций:
а) АgNО3 + НСl → б) Fе + Сl2 →
в) Аl(ОН)3 + Н2SО4 → г) Сu + АgNО3 →
Расскажите о положении металлов в Периодической системе химических элементов Д.И. Менделеева.
Перечислите способы защиты металлов от коррозии.
На оценку «4 и 5»
Напишите уравнения реакций, позволяющие осуществить превращения:
Са → Са(ОН)2 → СаСО3 → СаО → СаСl2.
Для перехода 4 составьте полное и сокращенное ионное уравнение.
а) Са + S → б) Са + Н2О →
в) МgСО3 + НСl → г) Li + О2→
Расскажите о природных соединениях кальция. Каково их значение для человека?
Расскажите о видах коррозии.
Zn → Zn О → Zn Сl2 → Zn (ОН)2 → Zn(NО3)2.
5. Для перехода 4 составьте полное и сокращенное ионное уравнение.
Контрольная работа №2 по теме «Неметаллы»
Получение водорода в лаборатории и техника безопасности при работе с ним.
Стекло. История, химический состав, применение.
Напишите уравнения реакций, соответствующие переходам:
4. Определите массу кислорода, затраченного на сжигание 62г фосфора.
5. В трёх пробирках находятся хлорид, сульфат и карбонат натрия. Как распознать каждую из
Читайте также:
