Классификация металлов строение металлов
Определение металлов можно дать с позиций химии, физики и техники.
В химии металлы — это химические элементы, находящиеся в левой части периодической системы элементов Д. И. Менделеева, которые обладают особым механизмом взаимодействия валентных электронов (ионов) с ядром как в самих металлах, так и при вступлении в химические реакции с другими элементами, в том числе с металлами.
Физика характеризует металлы как твердые тела, обладающие цветом, блеском, способностью к плавкости (расплавлению) и затвердеванию (кристаллизации), тепло- и электропроводностью, магнитными и другими свойствами.
В технике металлы — это конструкционные материалы, обладающие высокой обрабатываемостью (ковкостью, штампуемостью, обрабатываемостью резанием, паяемостью, свариваемостью и др.), прочностью, твердостью, ударной вязкостью и рядом других ценных свойств, благодаря которым они находят широкое применение.
Русский ученый М. В. Ломоносов (1711 — 1765), исследуя металлы и неметаллы в своем труде «Первые основания металлургии или рудных дел», дал металлам определение: «Металлом называется светлое тело, которое ковать можно. Таких тел находим только шесть: золото, серебро, медь, олово, железо и свинец». Это определение М. В. Ломоносов дал в 1773 г., когда известны были только шесть металлов.
Из металлов, добываемых из недр земли, получают большую группу конструкционных материалов, применяемых в различных отраслях промышленности. В природе одни металлы встречаются в чистом, самородном виде, другие — в виде оксидов (соединений металла с кислородом), нитридов и сульфидов, из которых состоят различные руды этих металлов.
Самыми распространенными металлами, применяемыми в качестве конструкционных материалов, являются железо, алюминий, медь и сплавы на основе этих металлов.
К металлам относятся более 80 элементов периодической системы Менделеева. Все эти металлы подразделяются на две большие группы: черные металлы и цветные металлы.
Характерными признаками черных металлов являются темно-серый цвет, блеск, высокие плотность и температура плавления, твердость, прочность, вязкость и полиморфизм (аллотропия). По физикохимическим свойствам черные металлы подразделяют на пять групп:
- железистые (железо, кобальт, никель, марганец);
- тугоплавкие (вольфрам, рений, тантал, молибден, ниобий, ванадий, хром, титан и др.);
- урановые — актиниды (уран, торий, плутоний и др.);
- редкоземельные — лантаниды (лантан, церий, иттрий, скандий и др.);
- щелочно-земельные (литий, натрий, калий, кальций и др.).
Из этих пяти групп черных металлов особенно широкое применение в промышленном производстве находят железистые и тугоплавкие металлы.
Железистые металлы, кроме марганца, называют еще ферромагнетиками. Ферромагнетики способны намагничиваться и притягивать металлы своей группы.
К тугоплавким относятся металлы, которые имеют температуру плавления выше температуры плавления железа (1 539 °С): титан — 1 667 °С, ванадий — 1 902 °С, хром — 1 903 °С, молибден — 2 615 °С, ниобий — 2 460 °С, тантал — 2 980 °С, вольфрам — 3 410 °С. Тугоплавкие металлы в основном применяются как легирующие элементы в производстве жаропрочных, жаростойких, теплостойких и специальных сплавов, в том числе твердых сплавов и высоколегированных сталей.
2. Строение металлов
Атомно-кристаллическая структура металлов. Как известно, все вещества состоят из атомов, в том числе и металлы. Каждый металл (химический элемент) может находиться в газообразном, жидком или твердом агрегатных состояниях. Каждое агрегатное состояние будет иметь свои особенности, отличные друг от друга. В газообразном металле расстояние между атомами велико, силы взаимодействия малы и атомы хаотично перемещаются в пространстве; газ стремится к расширению в сторону большего объема. При понижении температуры и давления вещество переходит в жидкое состояние. Свойства жидкого вещества резко отличаются от свойств газообразного. В жидком металле атомы сохраняют лишь так называемый ближний порядок атомов, т. е. в объеме расположено небольшое количество атомов, а не атомы всего объема. При понижении температуры жидкий металл переходит в твердое состояние, которое имеет строгую закономерность расположения атомов.
Если условно провести вертикальные и горизонтальные линии связи через центры атомов, можно увидеть, что у металлов в твердом состоянии атомы расположены в строго определенном порядке и представляют собой множество раз повторяющиеся элементарные геометрические фигуры — параллелепипеды (рис. 1). Наименьшую геометрическую фигуру называют элементарной ячейкой. Элементарные ячейки, расположенные на горизонтальных и вертикальных кристаллографических плоскостях (рис. 2), образуют пространственную кристаллическую решетку.
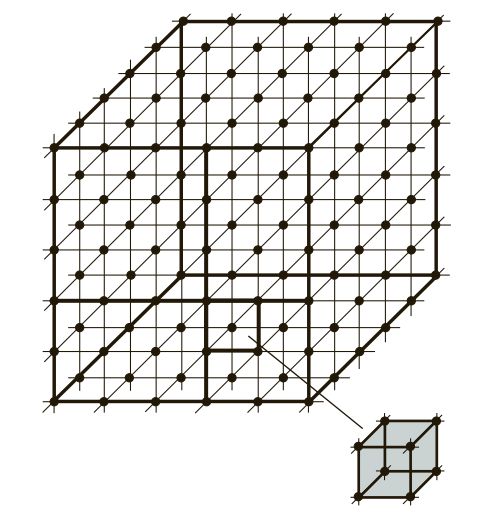
Рис. 1. Схема расположения элементарных геометрических ячеек в атомных решетках металлов и сплавов
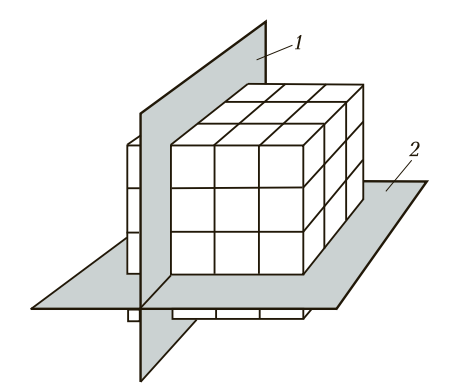
Рис. 2. Расположение кристаллографических плоскостей: 1 и 2 — соответственно горизонтальная и вертикальная кристаллографические плоскости
Элементарные кристаллические решетки характеризуют следующие основные параметры: расстояние между атомами по осям координат (по линиям связи), углы между линиями связи, координационное число — число атомов, находящихся на наиболее близком и равном расстоянии от любого атома в решетке. Форму элементарной ячейки рассматривают по кристаллографическим плоскостям в трех измерениях.
Таким образом, любой металл можно представить не как однородную цельную массу, а как массу, сложенную из множества элементарных ячеек. Блок элементарных атомных кристаллических ячеек образует атомно-кристаллическую ячейку (решетку). Если выделить эту элементарную ячейку, то в зависимости от металла получим следующие типы кристаллических ячеек (рис. 3): куб (К), объемно-центрированный куб (ОЦК), гранецентрированный куб (ГЦК), гексагональная плотноупакованная ячейка (ГПУ), гексагональная простая ячейка (Г) и др.
Простая кубическая ячейка (рис. 3, а) характерна для неметаллов, которые обладают наибольшими плотностью и удельным весом, и имеет восемь атомов, которые расположены в каждой вершине куба.
Объемно-центрированная кубическая ячейка (рис. 3, б ) состоит из восьми атомов, которые расположены по одному атому в каждой вершине куба, и одного, находящегося в центре куба на равных расстояниях от его граней. Эту форму атомной кристаллической ячейки имеют железо модификации Fe-α, ванадий, вольфрам, молибден, тантал и хром, т. е. в основном черные металлы.
Гранецентрированная кубическая ячейка (рис. 3, в) имеет 14 атомов — по одному атому в каждой вершине куба (восемь атомов) и по одному атому в центре каждой грани (шесть атомов). Гранецентрированную кубическую ячейку имеют алюминий, железо модификации Fe-γ, золото, кобальт, медь, никель, платина и серебро, в основном это цветные металлы и часть черных металлов.
Гексагональная плотноупакованная ячейка (рис. 3, г) состоит из 17 атомов. Форма геометрического тела, которую образуют эти атомы, является шестигранной призмой. При этом по шесть атомов расположены в каждой вершине верхнего и нижнего оснований, по одному атому в центре этих оснований и три атома в центре одной их трех граней (через грань). Гексагональную плотноупакованную ячейку имеют бериллий, кадмий, магний, ванадий, тантал.
Простая гексагональная ячейка (рис. 3, д) состоит из 12 атомов, которые расположены в вершинах верхнего и нижнего оснований шестигранной призмы. Такую кристаллическую ячейку имеют ртуть и цинк.
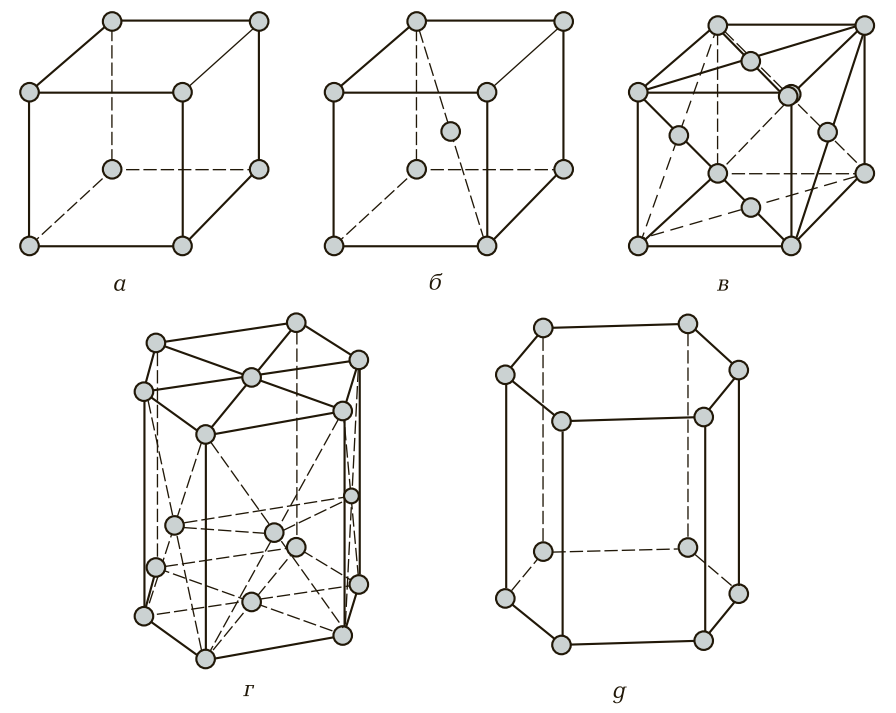
Рис. 3. Геометрические формы элементарных кристаллических ячеек: а — куб; б — объемно-центрированный куб; в — гранецентрированный куб; г — гексагональная плотноупакованная ячейка; д — гексагональная простая ячейка
Связь между атомами в кристаллической решетке и между решетками осуществляется за счет так называемой металлической связи. От прочности этой связи зависят прочность и твердость металлов. Чем выше эта связь, тем бо´льшую прочность и твердость имеют металлы. Механизм связи между атомами в решетке и между решетками имеет сложную физико-химическую природу.
В практике идеальное расположение кристаллических решеток обычно не наблюдается. Кристаллы, образуемые кристаллическими решетками, имеют искаженную геометрическую форму и различную величину.
Анизотропия металлов. Анизотропия (от гр. anisos — неравный и tropos — направление) — неодинаковость физических свойств среды (тела) в различных направлениях. Анизотропия предполагает зависимость свойств металлов от направления по плоскостям атомно-кристаллических решеток. Чем больше в плоскости атомов, тем выше свойства металлов. В горизонтальных плоскостях в любой форме атомно-кристаллических решеток больше, чем в вертикальных плоскостях. Следовательно, прочность металлов, испытанная в горизонтальном направлении, выше, чем в вертикальном. Анизотропия проявляется в процессе обработки конструкционных материалов давлением (проката, волочения, штамповки и других технологических способов получения заготовок и изделий).
На рис. 2 кристаллографические плоскости совпадают с линиями связи, проходящими через атомы металла. Форма элементарной кристаллической ячейки, расстояние между атомами и прочность металлической связи определяют физические, механические и технологические свойства металлов. Если исследуемый металл рассматривать по трем кристаллографическими плоскостям, по линиям связи между атомами, то можно заметить, что свойства по этим трем измерениям будут различны. Число атомов в этих плоскостях неодинаково. Металлическая связь между горизонтально и вертикально расположенными атомами также неодинакова. Это, в свою очередь, приводит к различной прочности металлов в продольном и поперечном направлениях. Например, предел прочности меди в продольном направлении будет в 2 раза больше, чем в поперечном.
Все металлы анизотропны, так как они состоят из кристаллов. Кристаллическое строение металлов обусловливает пластическую деформацию, т. е. изменение внешней формы и размеров под действием нагрузок без разрушения. Способность металлов и сплавов пластически деформироваться положена в основу их обработки давлением (прокатка, волочение, ковка, штамповка и прессование). При обработке давлением, например прокатке (рис. 4, а), происходит перемещение одного слоя атомных решеток по другому по кристаллографическим плоскостям (рис. 4, б).
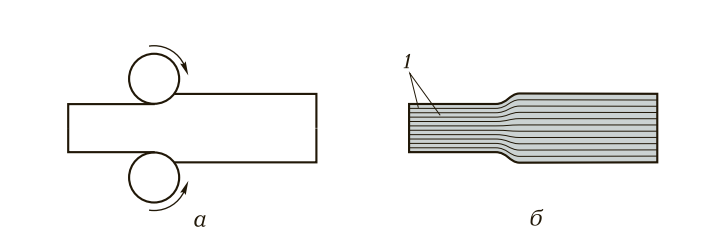
Рис. 4. Схема деформации металлов и сплавов (прокатка): а — деформация; б — скольжение металлов по кристаллографическим плоскостям в процессе деформации; 1 — кристаллографические плоскости
В процессе деформации металла при прокатке происходит не только изменение поперечных и продольных размеров заготовок, но и изменение микроструктуры металла.
Зерна под действием давления прокатных валков искажаются, приобретая продолговатую или пластинчатую форму, а затем преобразуются в волокна. Изменение микроструктуры металла в процессе деформации условно показано на рис. 5.
Процесс кристаллизации. Рассмотрим, как происходит образование кристаллов у чистых металлов. Установлено, что процесс кристаллизации металлов из жидкого состояния в твердое идет в две стадии:
- образование центров кристаллизации;
- рост кристаллов вокруг этих центров (рис. 6).
Рис. 5. Изменение микроструктуры металла в процессе деформации: а — микроструктура металла до деформации; б — микроструктура металла после первой операции деформации; в — микроструктура металла после окончательной деформации
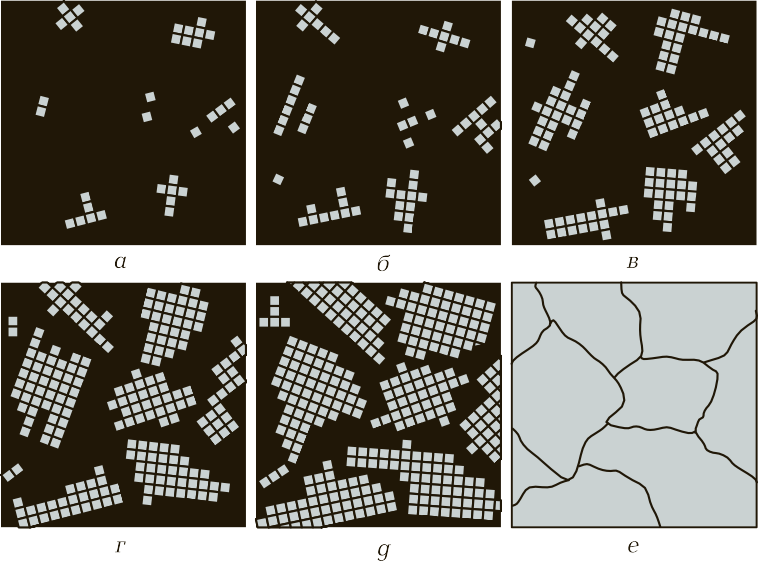
Рис. 6. Процесс кристаллизации металлов и сплавов: а — е — последовательные этапы процесса
Далее вновь появляются новые центры, и происходит рост твердой фазы вокруг первичных и вторичных центров. Процесс происходит до того момента, пока образованные таким образом кристаллы не будут соприкасаться друг с другом и не будет наличия жидкой фазы металла (см. рис. 6, г — е). Когда образование кристалла идет в жидкой фазе (в расплавленном металле), он будет иметь правильную форму, т. е. состоять из определенных геометрических фигур правильной формы. Когда кристаллы начинают соприкасаться друг с другом, а процесс затвердевания еще не закончен, тогда происходят искажения формы зерен. В практике замечено, что когда идет быстрое охлаждение, образуются мелкие зерна — мелкозернистая структура. При медленном охлаждении появление новых центров кристаллизации замедляется, но происходит рост зерна вокруг первичных центров кристаллизации. В этом случае металл будет иметь крупнозернистую структуру.
Процесс образования кристаллов в жидком состоянии и перехода металла в твердое состояние называется первичной кристаллизацией. Величина и форма зерна влияет на механические свойства металлов. Чем зерна мельче и чем правильнее их форма, тем большую твердость и прочность будет иметь металл. Чем зерна больше и чем искаженнее их форма, тем ниже твердость и прочность металла.
Аллотропия металлов. Такие металлы, как железо, кобальт, никель и др., обладают способностью изменять кристаллическую решетку при нагревании в твердом состоянии. Процесс изменения кристаллических решеток в твердом состоянии называется вторичной кристаллизацией, или аллотропией, а состояние вещества (металла) при наличии нескольких кристаллических решеток при изменении параметров (давления, температуры) — аллотропическими модификациями, или полиморфизмом. Такие металлы, как железо, молибден, вольфрам, литий в твердом состоянии при нормальной температуре имеют объемно-центрированную кубическую ячейку; алюминий, медь, серебро в твердом состоянии при нормальной температуре имеют форму гранецентрированной кубической ячейки.
На рис. 7 представлены кривые нагрева и охлаждения металла (на примере марганца). Аллотропные состояния (модификации), имеющие те или иные кубические ячейки, обозначаются греческими буквами. Первоначальное аллотропное состояние при нормальной температуре обозначается буквой α, при дальнейших повышении температуры и перекристаллизации металла — буквами β, γ, δ и т. д. При охлаждении металлов и сплавов процесс аллотропного превращения происходит в обратном порядке, как правило при тех же температурах.
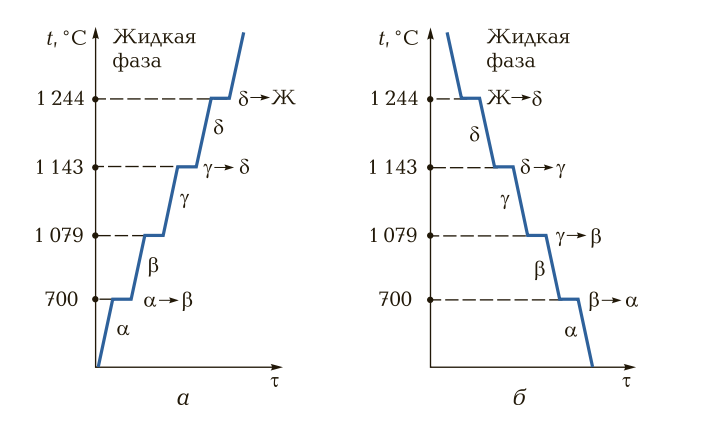
Рис. 7. Кривые нагрева (а) и охлаждения (б) марганца: t — температура; τ — время
Кристаллическая структура металлов. Общая характеристика и классификация металлов
В технике под металлами понимают материалы, обладающие целым комплексом специфических физических, химических, технологических, эксплуатационных и механических свойств.
Физические свойства отражают поведение материалов в различных тепловых, электромагнитных и гравитационных полях. К наиболее характерным физическим свойствам металлов следует отнести металлический блеск, высокую электро- и теплопроводность, способность испускать электроны при нагреве, а также сравнительно высокую плотность большинства металлов.
Химические свойства отражают способность материалов взаимодействовать с другими веществами. С точки зрения химических свойств металлы это химические элементы, расположенные в левой части таблицы Менделеева. Атомы этих элементов содержат на внешней электронной оболочке небольшое число электронов, слабо связанных с ядром. Вступая в химические взаимодействия с неметаллами, атомы металлов легко отдают им свои внешние валентные электроны и становятся положительно заряженными ионами.
Технологические свойства отражают способность материалов подвергаться тому или иному виду обработки. К наиболее характерным технологическим свойствам металлов следует отнести их относительно хорошую деформируемость (в частности, штампуемость и ковкость), а также хорошую свариваемость и возможность получать изделия методом литья.
Эксплуатационные свойства характеризуют поведение материалов в реальных условиях эксплуатации. Среди эксплуатационных свойств металлов можно выделить их неплохую износостойкость.
Механические свойства отражают способность материалов сопротивляться деформации и разрушению под воздействием различного рода нагрузок. К наиболее характерным механическим свойствам металлов относят их достаточно высокую пластичность и вязкость, а также твёрдость и прочность.
Физические и химические свойства металлов наиболее подробно изучаются в рамках дисциплин «Физика» и «Химия». Материаловедение большее внимание уделяет механическим и технологическим свойствам материалов.
Все металлы делят на две большие группы: на чёрные металлы и цветные металлы.
Чёрные металлы отличаются специфическим темно-серым цветом, высокой температурой плавления и относительно высокой твёрдостью. Цветные металлы имеют характерную белую, желтую или красную окраску, и отличаются от чёрных металлов большей пластичностью, меньшей твёрдостью и невысокой температурой плавления.
Чёрные металлы, в свою очередь, подразделяют на 5 групп:
1. Металлы группы железа – Fe, Cо, Ni и Mn.
Fe составляет основу самых распространённых в промышленности сплавов – сталей и чугунов. Остальные металлы этой группы применяются либо в качестве добавок к железоуглеродистым сплавам, либо в качестве основы для соответствующих сплавов (кобальтовых, никелевых и т.п.).
2. Тугоплавкие металлы – Ti, V, Cr, Mo, W и др.
Металлы этой группы имеют температуру плавления выше, чем у железа, т.е. более 1539°С. Их обычно используют в качестве добавок к легированным сталям, либо в качестве основы для специальных сплавов (например, титановых или хромовых). Вольфрам в чистом виде используют для изготовления нитей накала электроламп.
3. Урановые металлы или актиноиды – Ac, Th и т.д. Применяются, как правило, для изготовления сплавов, используемых в атомной энергетике.
4. Редкоземельные металлы или лантаноиды – La, Ce и т.д. Эти металлы обычно встречаются в смешанном виде и имеют близкие свойства. Их используют для изготовления специальных сплавов, обладающих особыми физическими и иными свойствами.
5. Щелочные металлы – Li, Na, K и т.д. Отличаются высокой химической активностью и поэтому в свободном виде не используются.
Цветные металлы подразделяют на 3 группы:
1. Легкие металлы – Al, Mg, Be. Обладают сравнительно низкой плотностью. Al из-за своей высокой электропроводности широко применяется для изготовления электропроводов. Кроме того, Al используют для получения алюминиевых сплавов, широко применяемых в машиностроении.
2. Благородные металлы – Ag, Au, Pt и т.д. в том числе Cu. Данные металлы отличаются высокой пластичностью, электропроводностью и коррозионной стойкостью. Благодаря этим свойствам они широко применяются в микроэлектронике и ювелирном деле. Медь используют также для получения бронз и латуней. Слитки благородных металлов, размещённые в банках, играют роль фактических денег.
3. Легкоплавкие металлы – Sn, Pb, Zn, Hg и т.д. Имеют сравнительно низкую температуру плавления. Температура плавления ртути (Hg) ниже комнатной и поэтому данный металл в обычных условиях является жидким. Sn и Pb используют для изготовления припоев, те сплавов, служащих для соединения деталей методом пайки.
Наиболее распространенным металлом на земном шаре является алюминий (8,8%). На втором месте находится железо (4,65%), которое к тому же является одним из наиболее дешёвых металлов.
2.2 Металлическая межатомная связь и модель «электронного газа»
Вышеназванные характерные свойства металлов, в большинстве своём, могут быть объяснены спецификой межатомного взаимодействия и особенностями структуры металлов. Атомы металлов, находящихся в твёрдом стоянии, связаны между собой особым типом химической связи, которую называют металлической связью. Такая связь устанавливается посредством обобществления всех валентных электронов атомами материала. Валентные электроны, потерявшие связь со своими атомами, оказываются принадлежащими всему металлу в целом и, будучи относительно свободными, образуют в объёме металла так называемый «электронный газ» или точнее «электронную жидкость». Сами же атомы при этом становятся положительно заряженными ионами. Таким образом, на атомарном уровне металлы выглядят как совокупность расположенных в узлах кристаллической решётки положительно заряженных ионов, которые омываются газом относительно свободных электронов или иначе «электронной жидкостью» (рис. 7).
Рис. 7. Модель «электронного газа (жидкости)»
Наличием в объёме металла электронного газа или жидкости объясняются многие свойства металлов. Так, если к металлу приложить разность потенциалов, то под воздействием электрического поля относительно свободные электроны наряду с хаотическим движением приобретут направленное движение в сторону от минуса к плюсу. Другими словами в металле возникнет электрический ток. Поскольку в металлах свободных носителей заряда, т.е. электронов, достаточно много, их электропроводность оказывается очень высокой. Эти же электроны проводимости весьма эффективно могут переносить тепловую энергию от разогретого участка металла к более холодным областям, и этим объясняется высокая теплопроводность металлов. Кроме того, электронная жидкость хорошо отражает фотоны, т.е. частицы света, и тем самым обеспечивает металлам характерный блеск.
При пластическом деформировании металлов наблюдается сдвиг атомных слоёв относительно друг друга и металлическая связь способствует этому процессу. В данном случае электронная жидкость играет роль своеобразного клея, соединяющего атомные слои, и одновременно роль своеобразной смазки, облегчающей процесс скольжения этих слоёв. В результате металлы оказываются достаточно пластичными материалами.
Металлическая связь, в отличие от ковалентной связи, не является строго направленной в пространстве и допускает произвольное число взаимодействующих частиц. В результате атомы металлов, стремясь к более выгодной и устойчивой конфигурации, обладающей меньшей свободной энергией, располагаются в пространстве наиболее компактным образом. Этим, в частности, объясняется относительно высокая плотность большинства металлов. Плотным атомным упаковкам металлов соответствуют следующие типы кристаллических структур:
1. Объёмоцентрированная кубическая структура или ОЦК-структура. Такую структуру описывает ОЦК-решётка, элементарная ячейка которой выглядит следующим образом:
Рис. 8. Элементарная ячейка ОЦК-структуры.
В узлах этой кристаллической решётки располагаются атомы, а точнее ионы, соответствующего металла. Координационное число в данном случае равно 8 (на ближайшем равном расстоянии от любого атома находится 8 аналогичных атомов). Коэффициент компактности равен 0,68. Это означает, что 68% объёма металла занято атомами, а остальную его часть составляют пустоты. Это достаточно плотное расположение атомов. Базис образуют два атома соответствующего металла (один атом, расположенный в центре ОЦК-ячейки, полностью ей принадлежит, и ещё один атом (8 по ⅛) дают узлы, расположенные в вершинах ячейки). ОЦК-структура наблюдается у таких металлов как Cr, Mo, W, V и др.
2. Гранецентрированная кубическая структура или ГЦК-структура. Эту структуру описывает ГЦК-решётка, элементарная ячейка которой выглядит следующим образом:
Рис. 9. Элементарная ячейка ГЦК-структуры.
В узлах решётки также располагаются атомы соответствующих металлов. Координационное число здесь равно 12, а коэффициент компактности имеет значение 0,74. Базис образуют четыре атома металла (каждый атом, расположенный в центре грани принадлежит ячейке только наполовину, а поскольку таких атомов 6, то получается ровно 3; плюс один атом дают вершины ячейки). ГЦК-структура характерна для Al, Cu, Ni, Ag, Au и Pt.
3. Гексагональная плотноупакованная структура или ГПУ-структура. Эту структуру описывает соответствующая ГПУ-решётка. Хотя ГПУ-решётку можно построить и с помощью меньшей по объёму ячейки, в данном случае в качестве элементарной ячейки лучше подойдёт шестигранная призма, которая нагляднее отражает гексагональную симметрию структуры (рис. 10).
Рис. 10. Элементарная ячейка ГПУ-структуры.
Координационное число для такой структуры равно 12 (если за начало отсчёта принять атом, расположенный в центре грани, то на равном ближайшем расстоянии от него находится 6 атомов, плюс по 3 атома сверху и снизу). Коэффициент компактности, как и у ГЦК-структуры, имеет значение 0,74. Это наивысшая степень упаковки атомов. Базис образуют 6 атомов соответствующего металла (3 атома внутри призмы полностью ей принадлежат; атомы в центре верхней и нижней грани принадлежат ячейке только наполовину, а каждый из 12 атомов в вершинах призмы принадлежит рассматриваемой ячейке лишь на 1/6 часть, поскольку находится на пересечении 6 аналогичных ячеек). ГПУ-структура наблюдается у таких металлов как Mg, Zn, Be и др.
Иногда у металлов наблюдается тетрагональная или простая гексагональная структура, но гораздо реже, чем три вышеназванные структуры.
Занятие 1. Электронное строение и классификация металлов
Металлы, или вещества, находящиеся в металлическом состоянии, обладают электронным строением, характеризующимся наличием незаполненных подуровней в валентной зоне. Валентные электроны не связаны с определенными атомами, а принадлежат всему металлическому телу, образуя электронный газ, окружающий каркас из положительно заряженных ионов.
Металлическая связь между атомами ненаправленная. Каждый атом стремится окружить себя как можно большим числом соседних атомов, следствием чегоявляется высокая компактность металлов.
Электроны, образующие электронный газ, называют электронами проводимости, поскольку они легко перемещаются во внешнем электрическом поле, создаваяэлектрический ток.
Незаполненность валентных энергетических зон металлов определяет их высокую электропроводность,теплопроводность, металлический блеск и др. Все металлыимеют положительный температурный коэффициент электрического сопротивления, т. е. при Т→0 К R → 0 (у полупроводников и неметаллов при Т→0 К R→∞).
По ряду характерных признаков металлы делят на две группы: черные и цветные. К черным относят железо и его сплавы (стали, чугуны). Остальные металлы и сплавы на их основе – цветные.
Нередко к металлам железной группы относят Ni, Co и Мn.
Металлы с температурой плавления выше 1800 0 С называют тугоплавкими. К ним принадлежи Тi, Zг. Сг, V, Nb, Mo, Wи др.
Металлы с низкой температурой плавления (Hg, Sn, Bi, Cd, Pb, Zn, Sb и др.) относят к легкоплавким.
К легким относят металлы с низкой плотностью. К ним принадлежат нашедшие широкое техническое применение Mg, Be, Al, Ti.
Металлы (Ag, Au, Os, Ir, Pt, Rh, Pd и др.) составляют группу благородных. Они химически инертны.К благородным металлам часто относят медь, обладающую химической стойкостью в сухой атмосфере.
К редкоземельным металлам (РЗМ) относят металлы группы лантана – лантаноиды(Се, Рг, Nd и др.) и сходные с ними Y и Sc.
Металлы актиноидной (урановой) группы составляют используемые в атомной технике актиноиды (Th, Pa, U и др.).
Li, Na, К и др. (их используют в качестве теплоносителей в быстрых ядерных реакторах с высоко энергетической активной зоной) составляют группу щелочноземельных металлов.
Ряд металлов (Fe, Ni, Co, Gd), в связи с особенностями их электронного строения, обладает ферромагнетизмом –способностью сильно намагничиваться во внешнем магнитном поле. Основные свойства ферромагнетиков определяются доменной структурой их кристаллов. Домен –это область кристалла размером 10 -4 . 10 -6 м, которая при отсутствии внешнего магнитного поля спонтанно (самопроизвольно) намагничена до насыщения. Магнитные моменты отдельных доменов направлены различно, поэтому полный магнитный момент ферромагнетика равен нулю.
Занятие 2. Кристаллическое строение металлови дефекты кристаллических структур
Большинство металлов имеют кристаллическую решетку. Положительно заряженные ионы, образующие каркас металлического тела, совершают непрерывные тепловые колебания около точек, закономерно расположенных в определенных местах пространства. Эти точки являются узлами воображаемой пространственной кристаллической решетки.
Наименьший объем кристалла, при трансляции которого по координатным осями воспроизводится вся кристаллическая решетка, называется элементарной кристаллической ячейкой.Ячейка характеризуется параметрами а, Ь и с – периодами кристаллической решетки (расстояниями между атомами, расположенными на ребрах ячейки, направленных по осям х, у и z соответственно) и углами между координатными осями – a (между осями х и z), β (между у и z), γ (между x и у).
Различают простые и сложные кристаллические решетки. В элементарной ячейке простой решетки атомы (ионы) расположены только в вершинах образующего ячейку многогранника. В сложных – они могут находиться также внутри многогранника или на его гранях.
Металлы имеют сложные кристаллические решетки. В большинстве случаев – это кубическая объемно-центрированная (ОЦК), кубическая гранецентрированная (ГЦК) и гексагональная плотноупакованная (ГПУ).
В элементарной ячейке ОЦК атомы находятся в вершинах куба и внутри него, в точке пересечения пространственных диагоналей. В ячейке ГЦК атомы расположены в вершинах куба и в центре каждой грани. В ячейке ГПУ атомы находятся в вершинах правильной шестигранной призмы, в центре каждого ее основания и, кроме того, три атома заключены внутри призмы.
Размеры элементарной ячейки определяются размерами образующих ее атомов. При этом полагают, что атомы, представляемые в виде жестких шаров, касаются друг друга в направлениях ячейки с наиболее плотным их расположением.
Во многих случаях в разных температурных интервалах один и тот же металл обладает различными кристаллическими решетками. Такое явление носит название полиморфизм или аллотропия.
Важными характеристиками кристаллической решетки являются коэффициент компактности, координационное число, базис.
Коэффициент компактности – это отношение объема принадлежащих кристаллической ячейке атомов к объему всей ячейки. Следует иметь в виду, что в кристаллической решетке часть атомов, составляющих ячейку, относится не только к данной ячейке, но и к ячейкам, находящимся по соседству. Например, атом, расположенный в вершине кубической ячейки (простая кубическая, ОЦК, ГЦК) принадлежит еще семи соседним ячейкам, т.е. данной ячейке принадлежит лишь 1/8 атома.
Коэффициент компактности простой кубической решетки равен 52 %, ОЦК – 68 %, ГЦК – 74 % (столь же компактна решетка ГПУ). Остальное пространство занято порами. В ячейке ГЦК в центре расположена крупная октаэдрическая пора с радиусом, равным 0,41 радиуса атома. В ячейке ОЦК больших пор нет. Поры, расположенные на ребрах ячейки, имеют радиус, равный 0,16 радиуса атома.
Координационное число – это число атомов, находящихся в кристаллической решетке на равном наименьшем расстоянии от данного атома. Каждый атом простой кубической решетки имеет 6 ближайших соседей, расположенных на расстоянии длины ребра куба (на расстоянии периода решетки). Координационное число такой решетки обозначают К6. В ОЦК решетке у каждого атома 8 ближайших соседей и координационное число равно 8 (К8). В ГЦК и ГПУ решетках каждый атом имеет 12 ближайших соседей. Соответственно координационные числа К12 и Г12.
Чем выше координационное число, тем плотнее пространственная кристаллическая решетка материала.
Базис кристаллической решетки – это таблица координат атомов, принадлежащих элементарной ячейке, рассматриваемой в пространственных координатных осях. Базис простой кубической решетки (0,0,0), ОЦК – (0,0,0; 1/2,1/2,1/2), ГЦК – (0,0,0; 1/2,0,1/2; 0,1/2,1/2; 1/2,1/2,0).
Пространственное положение кристаллографических плоскостей (плоскостей, проходящих через определенные группы атомов кристаллической решетки), а также кристаллографических направлений характеризуется кристаллографическими индексами.
Индексы плоскости – это три целых числа, заключенных в круглые скобки и представляющих собой приведенные к целым числам значения обратных величин отрезков, отсекаемых плоскостью на осях х, у, z.За единицы длины принимают параметры решетки а, b, с. Например, плоскость, включающая пространственные диагонали куба, имеет индексы (101). Если плоскость отсекает отрицательные отрезки, то знак минус ставится над соответствующим индексом. Кристаллографические индексы отражают положение не только данной плоскости, но целого семейства плоскостей, ей параллельных.
Индексы направлений – это три числа, заключенных в квадратные скобки и представляющих собой приведенные к целым значениям координаты любой точки направления после его параллельного переноса в начало координат. За единицы принимают параметры кристаллической решетки. Например, направление совпадающее с пространственной диагональю куба, имеет индексы [111]. Если направление имеет отрицательные координаты, то над соответствующим индексом ставится знак минус.
В различных направлениях кристаллической решетки плотность расположения атомов различна, что влечет за собой различие в свойствах кристалла в зависимости от направления, в котором это свойство измерено – анизотропию. В поликристаллических телах в пределах отдельных зерен наблюдается явление анизотропии. Однако, поскольку ориентация кристаллической решетки в различных зернах различна, в целом по куску материала свойства усредняются. Поэтому реальные металлы являются изотропными,т.е. телами с примерно одинаковыми свойствами по всем направлениям. Поскольку их изотропность является не истиной, а усредненной, то их принято называть квазиизотропами. Если каким-либо способом, например давлением, сориентировать кристаллические решетки в зернах одинаково (создать текстуру деформации), то такое поликристаллическое тело станет анизотропным.
Реальные кристаллы всегда содержат дефекты – искажения правильного расположения атомов в пространстве. Различают точечные, линейные, поверхностные и объемные дефекты.
Точечные дефекты по размерам сравнимы с межатомными расстояниями. К ним относятся вакансии (отсутствие атома в узле кристаллической решетки), межузельные или дислоцированные атомы (атом находится в межузельном пространстве кристаллической решетки) и примесные атомы. Среди последних различают атомы замещения (чужеродный атом занимает место в узле кристаллической решетки) и атомы внедрения (чужеродный атом находится в межузельном пространстве решетки).
Линейные дефекты по размерам в двух направлениях сравнимы с межатомными расстояниями, а в третьем простираются на многие тысячи периодов кристаллической решетки. Важнейшими видами линейных несовершенств являются краевые (линейные) и винтовые дислокации.
Образование краевых дислокаций вызвано присутствием в кристаллической решетке неполных кристаллографических плоскостей. Такие полуплоскости, не имеющие продолжения в нижней или верхней частях кристаллической решетки, называются экстраплоскостями. Краевая дислокация представляет собой область упругих искажений, проходящих вдоль края экстраплоскости. Различают положительные и отрицательные дислокации. Положительная дислокация (ее отмечают знаком ┴.) возникает, если экстраплоскость находится в верхней части кристалла, если в нижней – отрицательная (ее отмечают знаком ┬).
Винтовая дислокация – это область упругих искажений кристаллической решетки, проходящая вдоль линии, вокруг которой атомные плоскости изогнуты по винтовой поверхности. В зависимости от направления изгиба различают правые и левые винтовые дислокации.
Дислокации (краевые и винтовые) не могут обрываться внутри кристалла. Они выходят на границы кристалла, прерываются другими дислокациями или образуют дислокационные петли.
Поверхностные дефекты малы только в одном направлении. Они представляют собой упругие искажения кристаллической решетки по границам зерен или их фрагментов (блоков мозаичной структуры). Различают большеугловые (высокоугловые) и малоугловые (низкоугловые) границы.
Большеугловые границы представляют собой области в несколько периодов кристаллической решетки, на протяжении которых решетка одной кристаллографической ориентации переходит в решетку другой ориентации. Такое строение имеют межзеренные границы.
Малоугловые границы представляют собой цепочки дислокаций (дислокационные стенки), отделяющие одну часть кристаллической решетки от другой (один блок мозаичной структуры от другого). Плотность расположения дислокаций зависит от угла между кристаллографическими плоскостями в соседних блоках. Чем угол больше (в пределах до нескольких угловых градусов), тем чаще расположены дислокации.
Объемные дефекты представляют собой искажения решетки, вызванные наличием пор, трещин, раковин и других макронарушений непрерывности кристаллической решетки.
Характеристики разных видов металла
Металлы – обобщенное название химических элементов, объеденных по ряду признаков. В периодической таблице они занимают большую часть, однако до сих пор не существует документа, позволяющего разделить их на классы.
Отличаются металлы в первую очередь своими качественными характеристиками. Какие-то имеют высокую теплопроводимость, другие выдерживают высокие нагрузки на разрыв и растяжение. В зависимости от этих качеств определяется и сфера применения, но металлы в природном виде, даже очищенные, не обладают необходимыми показателями в достаточном виде, поэтому применяется технология сплавов, то есть соединения нескольких элементов в одну молекулярную решетку. Это позволяет существенно улучшить характеристики, и придать сплаву необходимые качества.
Простой пример: возьмем распространенный в промышленности сплав бронзу. Это соединение, где основным элементом выступает медь. В качестве легирующего, то есть улучшающего качество, компонента используется олово. В результате соединения получается новый металл, более твердый и упругий по сравнению с чистой медью, который часто используют для изготовления крепежа.
Основные виды классификации металлов
Существует несколько видов классификации металлов. Начнем с основного типа – деления на две большие группы: черные и цветные. Черные металлы отличает высокая температура плавления, плотность и повышенная твердость. Цветные металлы, в большинстве случаев, плавятся при более низких температурах и обладают повышенной электро и теплопроводимостью.
Такое разделение обусловлено распространением элементов в природе. На добычу черных элементов приходится более 90 процентов от всей массы добываемых металлов, в то время как на цветную группу приходится не более 5-10 процентов. Необходимо отметить, что виды классификации являются условными, и используются в зависимости от назначения конечного продукта, который производят из этих металлов. Так, для изготовления крепежа используется классификация по техническим характеристикам, а для изготовления сложных сплавов химическая и кристаллическая. Рассмотрим эти виды подробнее.
Химическая классификация металлов
.jpg)
Все элементы в периодической таблице делятся на четыре основных группы, маркируемые латинскими буквами:
- S. Отмечены розовым цветом.
- P. Желтые элементы.
- D. Бирюзовый цвет.
- F. Зеленые элементы в таблице.
Каждая группа содержит в себе металлы. Элементы из первых двух категорий (S и P) называют простым видом, а элементы из групп D и F переходным. Также каждая группа делится еще на несколько категорий. В группу S входят щелочные и щелочеземеленые металлы, а в группы D и F платиновые, урановые и редкоземельные. При этом в каждой группе существуют исключения, из чего можно сделать вывод, что деление металлов по химическим группам является условностью, и редко применяется в практических сферах. Такое деление интересно только для научных изысканий, и практически не применимо в промышленности и производстве. Например, изготовление крепежа отталкивается от технических аспектов, и лишь в малой степени от химических.
Классификация металлов по кристаллической решетке
Все элементы имеют, так называемую, кристаллическую решетку. Абстрактная структура, определяющая расположение атомов и электронов, а также их привязку к ядру. В аморфных материалах, таких как стекло, атомы расположены хаотично, и не имеют строгой конструкции. В отличие от металлов, которые в твердом виде обладают строго структурированной решеткой, с четким построением молекулярных элементов. Всего разделяют 4 вида кристаллических решеток, которые проще представить в виде таблицы:
Это наиболее распространенные типы кристаллических решеток, часто встречающиеся у металлов. В общей сложности система классификации насчитывает 14 конфигураций, но у металлов они или встречаются крайне редко, или не встречаются вообще. Также следует отметить, что правильное построение решетки возможно только при естественном затвердевании металла, без искусственных ускорений. Если процесс остывания был ускорен, форма решетки изменится. В производстве это называют закаливанием, в результате которого меняется не только молекулярная структура, но и технические свойства.
Также, при нарушении норм производства металлического проката, может наблюдаться замена в кристаллической решетке. Это ведет к полному изменению качеств готового изделия. Чтобы условия производства соблюдались, были разработаны нормы стандартизации, гарантирующие четкое соответствие готового проката техническому описанию его свойств.
Техническая классификация металлов
Наиболее полную систему классификации предложил профессор Гуляев, хотя современные ученые и не согласны с некоторыми ее аспектами, ничего нового пока предложено не было. Итак, черные металлы делят на 5 основных подгрупп:
- Железные металлы. Сюда входят марганец, кобальт, никель, и конечно, железо. Наиболее распространенная в природе группа, используемая в сплавах как основной компонент.
- Тугоплавкие. Элементы, имеющие высокую температуру расплавления. В качестве эталона принята мера в 1539 градусов по Цельсию.
- Редкоземельные. Дорогостоящие в плане добычи и обработки элементы, к которым относят неодим, европий, самарий и другие металлы, используемые в качестве присадок к основному сплаву. Способны даже при небольшом проценте вмешательства существенно повысить или полностью изменить характеристики сплава.
- Щелочные. Особая группа, практически не применяемая в чистом виде. Чаще всего используются в атомной энергетике. Сюда относят: литий, барий, радий и другие.
- Урановые. Торий, уран, плутоний. Применяются исключительно в атомной энергетике.
Цветные металлы также делят на несколько подгрупп. Их три:
- Легкие. Алюминий, магний, бериллий. Обладают низким удельным весом и часто применяются в авиастроении и прочих сферах, где необходим твердый, но в то же время легкий материал.
- Легкоплавкие. Металлы с наиболее низкой температурой плавления: цинк, олово, свинец. Используются как в чистом виде, в качестве припоя и соединительного элемента, и как легирующие добавки, повышающие или изменяющие характеристики сплава.
- Благородные или драгоценные металлы. Наиболее редкие элементы, к которым относят: золото, серебро, палладий, платину. Обладают максимальной устойчивостью к коррозии и окислению, благодаря чему получают широкое распространение в различных промышленных сферах.
Практически все металлы из двух групп поддаются смешению, то есть производству из них сплавов с необходимыми техническими характеристиками.
Классификатор металлов по ГОСТ
Если рассматривать метлы с точки зрения геологии и распространения в природе, их делят на две большие группы: черные и цветные. Об этом мы уже говорили выше. В химии деление происходит по 4 направлениям, но чтобы привести виды металлов к общему знаменателю, необходимо более точное разделение. Начнем с основного типа классификации: металлы и сплавы. Металлы – это материалы, используемые в чистом, или практически чистом виде. Здесь допускаются примеси, но в незначительной степени, то есть те, которые не способны оказать влияния и изменить технические характеристики. Сплавами называют соединения, с высоким содержанием двух и более элементов.
Для того чтобы сплав получил маркировку, в его составе должно быть не менее 50 процентов основного компонента. То есть, если мы берем бронзу, то понимаем, что в ее составе больше половины занимает медь, а остальное делится между другими металлическими компонентами. Чистые металлы, в свою очередь, делятся на стали и чугуны. Эти металлы имеют в составе углерод. Если его содержание не превышает 2,14 %, его называют сталью. Свыше этого значения уже чугун.
Классификация металлов
Чтобы привести все виды металлов к единому стандарту качества, необходимо разделить их на группы. Таких групп 3:
- Стали,
- Чугуны,
- Сплавы на основе цветных металлов.
Каждая группа имеет деление на подгруппы. У стали это:
- углеродистая,
- легированная,
- специальная.
Углеродистая сталь не имеют легирующих, то есть изменяющих структуру элементов. Допускаются примеси, но в незначительном количестве. Углеродистая сталь в свою очередь делится на инструментальную и конструкционную. Кардинальные различия заключаются в процентах содержания в составе углерода. Конструкционная сталь содержит не более 0,6%, а инструментальная от 0,7 до 1,5%. Далее конструкционная сталь делится на обычное качество и высокое. В обычном качестве допускаются примеси серы и фосфора, но в количестве, не превышающем 0,3 процента. Соответственно высококачественная сталь не предусматривает наличия этих элементов в составе, или их количество должно быть меньше установленной нормы.
Далее легированная сталь, то есть материал, имеющий в составе компонент, влияющий на качественные характеристики сплава. Список легирующих элементов довольно большой, и здесь его приводить не имеет смысла. Содержание легирующего элемента начинается от 2,5%. Такая сталь называется низколегированной. Если в составе от 2,5 до 10 процентов, это уже среднелегированная марка, а при содержании свыше 10 процентов, получается высоколегированная сталь.
Помимо этого легированные стали делятся по назначению. Здесь три группы:
- инструментальная,
- конструкционная,
- специальная
В стандартизации каждый элемент имеет буквенное обозначение, а для причисления легированной стали к тому или иному классу используется отдельный список. Все легированные стали обозначаются сочетанием букв и цифр. Для примера рассмотрим такое соединение: 10Г2СД.
Первая цифра здесь – это количество углерода в сотых долях процента. Далее буква Г, в классификаторе означающая марганец. Следующая за буквой Г цифра 2 говорит нам о том, что марганец в этом составе присутствует в двухпроцентной доле. И последние две буквы – это дополнительные элементы, процентная доля которых менее 1,5%. В данном случае сюда добавлены медь и кремний.
Последний вид стали – специальный. Он делится на несколько групп:
- строительная,
- подшипниковая,
- арматурная,
- котельная,
- автоматная.
Соответственно для каждой группы имеются свои стандарты.
Далее идут чугуны, делящиеся на три группы:
- белый,
- отбеленный,
- и графитизированный.
У каждой группы также имеется свое разделения, но наибольший интерес представляет графитизированный чугун, который делится на:
- серый,
- вермикулярный,
- ковкий
- и высокопрочный.
Отношение к какой-либо группе определяется процентным соотношением углерода к металлу в составе, а также наличию примесей, допустимых стандартами, то есть ГОСТами.
И, наконец, последняя крупная группа – сплавы на основе цветных металлов. Здесь очень много разделений и видов классификации, поэтому остановимся на трех основных категориях, и представим их в виде таблиц:
.jpg)
.jpg)
Поиск сплава в классификаторе ГОСТ
Государственные стандарты четко определяют не только виды металлов и сплавов, но и качество производства заготовок для дальнейшей обработки и производства металлоизделий. Реестр очень большой, и первый пункт, который нам нужен – металлы и металлические изделия.
.jpg)
Далее переходим в необходимый раздел. Углеродистая и качественная сталь имеет маркировку В2 и В3 соответственно, а цветные металлы и их сплавы находятся в разделе В5. Также имеет смысл поискать в разделе В8, где перечислены стандарты литейных отливок.
.jpg)
Если мы говорим про изготовление крепежа, наибольший интерес представляет раздел В5, а внутри него подраздел В51.
.jpg)
Перед нами открывается список всех ГОСТов, связанных с этими определениями.
.jpg)
Он довольно большой, и не зная конкретного номера найти необходимую статью довольно сложно. Если же номер известен изначально, то на сайте ГосСтандарта есть готовый поиск, куда необходимо внести свой номер, чтобы сразу получить доступ к необходимому элементу.
Сферы применения основных металлов
Рассматривать радиоактивные и редкоземельные металлы не имеет смысла, так как в производстве крепежа они практически не принимают участия, как и в других сферах, не связанных с атомной энергетикой и некоторыми редкими видами промышленности. Нас интересуют основные металлы и сплавы рассмотренные выше.
Сферы их применения очень разнообразны:
- строительство,
- авиастроение,
- машиностроение,
- производство инструментов,
- металлоконструкции,
- станкостроение.
И так далее. Изготовление крепежа можно отнести нескольким категориям, но по сути, это металлоконструкции, называемые в народе Метизы. Для производства метизов используются десятки различных металлов и сплавов, от конструкционной стали и чугуна, до сложных сплавов на основе титана и меди.
Коротко по каждому виду, применяемому для изготовления крепежей
Перед тем как перейти к описанию конкретных видов металлов и сплавов, необходимо определиться, какие основные технические требования предъявляются к продуктам, попадающим под категорию «крепеж». Их несколько:
- прочность учитывается прочность на разрыв и излом.
- Пружинистость. Возможность металла возвращать изначальную форму после сжатия.
- Устойчивость к коррозии и окислению. Актуально для всех видов крепежа.
И многое друге. Теперь поговорим о конкретных металлах и сплавах. Их список выглядит следующим образом:
- Алюминий и сплавы на его основе,
- Медь,
- Латунь,
- Бронза,
- Инструментальная сталь,
- Легированная сталь,
- Ковкий чугун,
- Сталь нержавеющая.
Начнем по порядку: первый пункт – это алюминий и сплавы на его основе. Он применяется при изготовлении клепок и различных зажимов. Также в клепках может быть использована медь для повышения качества метиза. Помимо этого из меди изготавливают гайки специального назначения. Они используются, в частности, при судостроении, так как медь при контакте с другими металлами не создает искру.
.jpg)
Латунь и бронза отличаются повышенной, по сравнению с медью, прочностью, поэтому из них изготавливают различные шпонки, элементы анкеров, а также болты, шурупы и винты. Еще одна особенность этих сплавов заключается в отсутствии скипания. То есть при электрическом замыкании, сталь сплавляется, а медь остается цельной и не разрушается.
.jpg)
.jpg)
Из легированной и конструкционной стали изготавливаются барашковые гайки, струбцины и прочие удерживающие элементы. Это обусловлено высокой прочностью этих марок. Нержавеющая сталь, в свою очередь применяется там, где необходима максимальная устойчивость к коррозии. Что касается чугуна, то он чаще всего применяется при производстве запорной арматуры, то есть вентилей и запоров.
Читайте также:
