Катион какого металла придает хромопротеинам зеленую окраску
Хромопротеины (от греч. chroma — краска) — сложные белки, состоящие из простого белка и связанного с ним окрашенного небелкового компонента — простетической группы. Различают гемопротеины (содержат в качестве простетической группы гем), магнийпорфирины и флавопротеины (содержат производные изоаллоксазина). Хромопротеины участвуют в таких процессах жизнедеятельности, как фотосинтез, клеточное дыхание и дыхание всего организма, транспорт кислорода и углекислого газа, окислительно-восстановительные реакции, свето- и цветовосприятие.
Хромопротеины являются важнейшими участниками аккумулирования энергии, начиная от фиксации солнечной энергии в зелёных растениях и утилизации её до превращений в организме животных и человека. Хлорофилл (магнийпорфирин) вместе с белком обеспечивает фотосинтетическую активность растений, катализируя расщепление молекулы воды на водород и кислород (поглощением солнечной энергии). Гемопротеины (железопорфирины), напротив, катализируют обратную реакцию — образование молекулы воды, связанное с освобождением энергии.
Ссылки
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Хромопротеины" в других словарях:
хромопротеины — – группа сложных белков, простетическая группа которых представлена хромофорными соединениями (металлопорфиринами и др.) … Краткий словарь биохимических терминов
белки — Термин белки Термин на английском proteins Синонимы полипептиды Аббревиатуры Связанные термины биологическая мембрана, биологические моторы, биологические нанообъекты, биомиметические наноматериалы, биополимеры, биосенсор, биосовместимые покрытия … Энциклопедический словарь нанотехнологий
Гемоглобин — Молекула гемоглобина: 4 субъединицы глобина окрашены в разные цвета … Википедия
Миоглобин — кислород связывающий белок скелетных мышц и мышцы сердца. Миоглобин скелетных мышц и миоглобин миокарда (сердечной мышцы) слегка различны по аминокислотной последовательности. В практической медицине этот факт используется для определения… … Википедия
Сложные белки — (протеиды, холопротеины) двухкомпонентные белки, в которых помимо пептидных цепей (простого белка) содержится компонент неаминокислотной природы простетическая группа. При гидролизе сложных белков, кроме свободных аминокислот, освобождается… … Википедия
Гемопротеины — гем содержащие хромопротеины. В качестве небелкового компонента включают структурно сходные железо или магнийпорфирины. Белковый компонент может быть разнообразным как по составу, так и по структуре. К группе гемопротеинов относятся гемоглобин и… … Википедия
Флавопротеины — хромопротеины, содержащие простетические группы, представленные изоаллоксазиновыми производными окисленными флавинмононуклеотидом (ФМН) и флавинадениндинуклеотидом ФАД. Флавопротеины входят в состав оксидоредуктаз ферментов, катализирующих… … Википедия
Протеиды — Сложные белки (протеиды, холопротеины) двухкомпонентные белки, в которых помимо пептидных цепей (простого белка) содержится компонент неаминокислотной природы простетическая группа. При гидролизе сложных белков, кроме свободных аминокислот,… … Википедия
Холопротеины — Сложные белки (протеиды, холопротеины) двухкомпонентные белки, в которых помимо пептидных цепей (простого белка) содержится компонент неаминокислотной природы простетическая группа. При гидролизе сложных белков, кроме свободных аминокислот,… … Википедия
ПРОТЕИДЫ — сложные белки, состоящие из белковой части и небелкового компонента простетич. группы. В зависимости от природы простетич. группы различают гликопротеины (содержат углеводы), липопротеины (содержат липиды), нуклеопротеины (содержат нуклеиновые к… … Сельско-хозяйственный энциклопедический словарь
Гемопротеины
К группе гемопротеинов относятся гемоглобин и его производные, миогло-бин, хлорофиллсодержащие белки и ферменты (вся цитохромная система, каталаза и пероксидаза). Все они содержат в качестве небелкового компонента структурно сходные железо- (или магний)порфирины, но различные по составу и структуре белки, обеспечивая тем самым разнообразие их биологических функций. Далее более подробно рассмотрено химическое строение гемоглобина, наиболее важного для жизнедеятельности человека и животных соединения.
Гемоглобин в качестве белкового компонента содержит глобин, а небелкового – гем. Видовые различия гемоглобина обусловлены глобином, в то время как гем одинаков у всех видов гемоглобина.
Основу структуры простетической группы большинства гемосодержащих белков составляет порфириновое кольцо, являющееся в свою очередь производным тетрапиррольного соединения – порфирина. Последний состоит из четырех замещенных пирролов:
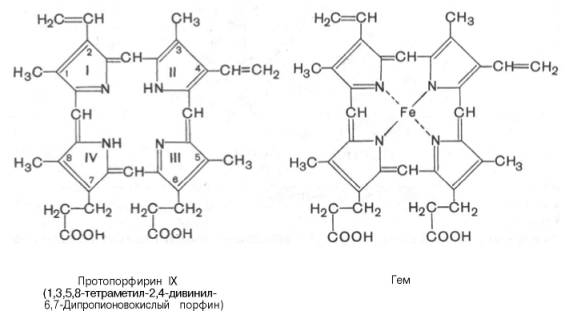
соединенных между собой метиновыми мостиками (—СН=). Незамещенный порфирин называется порфином. В молекуле гема порфин представлен в виде протопорфирина IX, содержащего четыре метильные группы (—СН3), две винильные группы (—СН=СН2) и два остатка пропионовой кислоты. Протопорфирин, присоединяя железо, превращается в гем.
Из формулы видно, что железо связано с двумя атомами азота молекулы протопорфирина ковалентно и с двумя другими – координационными связями, обозначенными пунктирными линиями. В зависимости от химической природы групп, находящихся в боковой цепи, порфирины классифицируют на этио-, мезо-, копро- и протопорфирины. Последние наиболее распространены в природе. Из возможных 15 изомеров протопорфиринов благодаря наличию трех разных заместителей самым распространенным оказался протопорфирин IX.
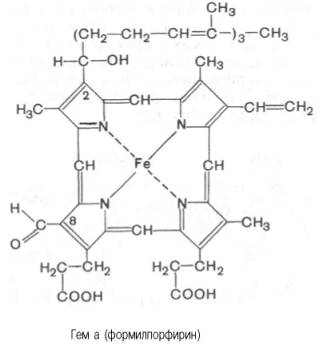
Гем в виде гем-порфирина является простетической группой не только гемоглобина и его производных, но и миоглобина, каталазы, пероксидазы и цитохромов b, с и c1 (см. главу 9); в то же время в цитохромах а и a3, входящих в состав интегрального комплекса, названного цитохромокси-дазой, содержится гем а, называемый также формилпорфирином:
Структурная организация гемоглобина (и миоглобина) была описана в главе 1. Дж. Кендрью и М. Перутц расшифровали конформацию этих молекул (Нобелевская премия 1962 г.). Дыхательная функция гемоглобина крови подробно рассматривается в курсе физиологии. Здесь следует указать на уникальную роль гемоглобина в траспорте кислорода от легких к тканям и диоксида углерода от тканей к легким. Это элементарное проявление жизни – дыхание, хотя и выглядит простым, основано на взаимодействии многих типов атомов в гигантской молекуле гемоглобина. Подсчитано, что в одном эритроците содержится около 340000000 молекул гемоглобина, каждая из которых состоит примерно из 10 3 атомов С, Н, О, N, S и 4 атомов железа.
Атом железа расположен в центре гема-пигмента, придающего крови характерный красный цвет. Каждая из 4 молекул гема «обернута» одной полипептидной цепью. В молекуле гемоглобина взрослого человека HbА (от англ. adult – взрослый) содержатся четыре полипептидные цепи, которые вместе составляют белковую часть молекулы – глобин. Две из них, называемые α-цепями, имеют одинаковую первичную структуру и по 141 аминокислотному остатку. Две другие, обозначаемые β-цепями, также идентично построены и содержат по 146 аминокислотных остатков. Таким образом, вся молекула белковой части гемоглобина состоит из 574 аминокислот. Во многих положениях α- и β-цепи содержат разные аминокислотные последовательности, хотя и имеют почти одинаковые пространственные структуры. Получены доказательства, что в структуре гемоглобинов более 20 видов животных 9 аминокислот в последовательности оказались одинаковыми, консервативными (инвариантными), определяющими функции гемоглобинов; некоторые из них находятся вблизи гема, в составе участка связывания с кислородом, другие – в составе неполярной внутренней структуры глобулы.
Рис. 2.1. Координационные связи атома железа в молекуле гема. Все 4 связи с атомами азота пиррольных колец расположены в одной плоскости, 5-я и 6-я координационные связи (с атомом азота имидазольного кольца гистидина и с кислородом соответственно) – по разные стороны перпендикулярно к этой плоскости.
В дополнение к основному гемоглобину HbA1в крови взрослого человека доказано существование мигрирующего с меньшей скоростью при электрофорезе гемоглобина НbА2, также состоящего из 4 субъединиц: двух α-цепей и двух δ-цепей. На долю НbА2 приходится около 2,5% от всего гемоглобина. Известен, кроме того, фетальный гемоглобин (гемоглобин новорожденных), обозначаемый HbF и состоящий из двух α-цепей и двух γ-цепей. Фетальный гемоглобин отличается от HbA1не только составом аминокислот, но и физико-химическими свойствами: спектральным показателем, электрофоретической подвижностью, устойчивостью к щелочной денатурации и др. Кровь новорожденного содержит до 80% HbF, но к концу 1-го года жизни он почти целиком заменяется на НbА (все же в крови взрослого человека открывается до 1,5% HbF от общего количества гемоглобина). Последовательность аминокислот в γ- и δ-цепях гемогло-бинов окончательно не расшифрована.
Установление первичной структуры субъединиц молекулы гемоглобина стимулировало исследования по расшифровке структуры так называемых аномальных гемоглобинов. В крови человека в общей сложности открыто около 150 различных типов мутантных гемоглобинов. Появляются мутантные формы гемоглобинов в крови вследствие мутации генов. Обычно мутации делят на 3 класса в соответствии с топографией измененного участка молекулы. Если замена аминокислоты происходит на поверхности молекулы гемоглобина, то это мутация первого класса; подобные мутации обычно не сопровождаются развитием тяжелой патологии, и болезнь протекает бессимптомно; исключение составляет серповидно-клеточная анемия. При замене аминокислоты вблизи гема нарушается связывание кислорода – это мутация второго класса, сопровождающаяся развитием болезни. И наконец, если замена происходит во внутреннем участке молекулы гемоглобина, говорят о третьем классе мутации; подобные мутации приводят к нарушению пространственной структуры и соответственно функции гемоглобина.
Аномальные гемоглобины, различающиеся по форме, химическому составу и величине заряда, были выделены при помощи электрофореза и хроматографии. Передающиеся по наследству изменения чаще всего являются результатом мутации единственного триплета, приводящей к замене одной какой-либо аминокислоты в полипептидных цепях молекулы гемоглобина на другую. В большинстве случаев происходит замена кислой аминокислоты на основную или нейтральную (табл. 2.1). Поскольку это замещение осуществляется в обеих полипептидных цепях одной из пар (α или β), образовавшийся аномальный гемоглобин будет отличаться от нормального величиной заряда и соответственно электрофоретической подвижностью.

В табл. 2.1 представлены некоторые типы аномальных гемоглобинов, составы их полипептидных цепей с указанием известной или вероятной локализации замены либо в α-, либо в β-цепях. Замены необычной аминокислотой в аномальных гемоглобинах имеют место как в α-, так и в β-цепях. Исключение составляет гемоглобин Н, все 4 полипептида которого представлены β-цепями, идентичными по структуре β-цепям нормального гемоглобина A1.
Следует указать, что некоторые мутации, вызывающие существенное изменение структуры и соответственно функции гемоглобина, оказываются летальными, и индивидуумы с подобным гемоглобином умирают в раннем возрасте. Однако при ряде мутаций замена аминокислот не вызывает заметного изменения функции гемоглобина, в этих случаях болезнь протекает бессимптомно.
Болезни гемоглобинов (их насчитывают более 200) называют гемогло-бинозами. Принято делить их на гемоглобинопатии, в основе развития которых лежит наследственное изменение структуры какой-либо цепи нормального гемоглобина (часто их относят также к «молекулярным болезням»), и талассемии, обусловленные наследственным нарушением синтеза какой-либо нормальной цепи гемоглобина. Различают также же-лезодефицитные анемии.
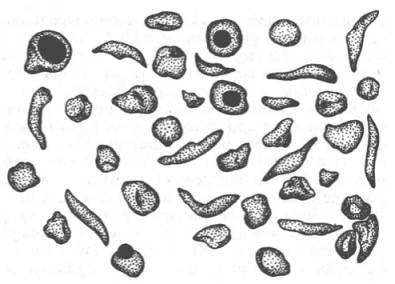
Рис. 2.2. Нормальные и серповидные эритроциты.
Классическим примером наследственной гемоглобинопатии является серповидно-клеточная анемия, широко распространенная в странах Южной Америки, Африки и Юго-Восточной Азии. При этой патологии эритроциты в условиях низкого парциального давления кислорода принимают форму серпа (рис. 2.2). Гемоглобин S, как показали Л. Полинг и др., отличается рядом свойств от нормального гемоглобина: в частности, после отдачи кислорода в тканях он превращается в плохо растворимую дез-окси-форму и начинает выпадать в осадок в виде веретенообразных кристаллоидов, названных тактоидами. Последние деформируют клетку и приводят к массивному гемолизу. Болезнь протекает остро, и дети, гомозиготные по мутантному гену, часто умирают в раннем возрасте.
Химический дефект при серповидно-клеточной анемии был раскрыт В. Ингремом и сводится к замене единственной аминокислоты, а именно глутаминовой, в 6-м положении с N-конца на валин в β-цепях молекулы гемоглобина HbS (см. табл. 2.1, рис. 2.2). Это результат мутации в молекуле ДНК, кодирующей синтез β-цепи гемоглобина. Все остальные аминокислоты располагаются в той же последовательности и в таком же количестве, как и в нормальном гемоглобине НbА:
Одной этой замены оказалось достаточно не только для нарушения формы эритроцита, но и для развития тяжелой наследственной болезни – серповидно-клеточной анемии.
Талассемии, строго говоря, не являются гемоглобинопатиями. Это генетически обусловленное нарушение синтеза одной из нормальных цепей гемоглобина. Если угнетается синтез β-цепей, то развивается β-талассемия; при генетическом дефекте синтеза α-цепей развивается α-талас-семия. При β-талассемии в крови наряду с HbA1появляется до 15% НbА2 и резко повышается содержание HbF – до 15–60%. Болезнь характеризуется гиперплазией и разрушением костного мозга, поражением печени, селезенки, деформацией черепа и сопровождается тяжелой гемолитической анемией. Эритроциты при талассемии приобретают мишеневидную форму. Механизм изменения формы эритроцитов объяснить пока не удалось.
В медицинской практике часто проводят анализ кровяных пигментов, который основан на исследовании спектроскопических свойств гема гемоглобина, точнее продуктов его окисления (хлорида гемина и гематина, образующихся соответственно при обработке гемоглобина уксусной кислотой в присутствии хлорида натрия или разведенными растворами щелочей). При восстановлении гематина сульфитом аммония в присутствии глобина образуется производное гемоглобина – гемохромоген, в котором денатурированный глобин соединен с гемом. Полученный комплекс имеет характерный спектр поглощения. Этот метод широко применяется в судебно-медицинской практике при исследовании кровяных пятен.
Из многообразия производных гемоглобина, представляющих несомненный интерес для врача, следует прежде всего указать на оксигемоглобин НbО2 – соединение молекулярного кислорода с гемоглобином. Кислород присоединяется к каждому гему молекулы гемоглобина при помощи координационных связей железа, причем присоединение одной молекулы кислорода к тетрамеру облегчает присоединение второй молекулы, затем третьей и т.д. Поэтому кривая насыщения гемоглобина кислородом имеет сиг-моидную форму, свидетельствующую о кооперативности связывания кислорода. Эта кооперативность обеспечивает не только связывание максимального количества кислорода в легких, но и освобождение кислорода в периферических тканях; этому способствует также наличие Н + и СО2 в тканях с интенсивным обменом. В свою очередь кислород ускоряет высвобождение СО2 и Н + в легочной ткани. Эта аллостерическая зависимость между присоединением Н + , О2 и СО2 получила название эффекта Бора.
Помимо кислорода, гемоглобин легко соединяется с другими газами, в частности с СО, NO и др. Так, при отравлении оксидом углерода гемоглобин прочно с ним связывается с образованием карбоксигемо-глобина (НbСО). При этом вследствие высокого сродства к СО гемоглобин теряет способность связывать кислород и наступает смерть от удушья, недостаточного снабжения тканей кислородом. Однако при быстром повышении парциального давления кислорода во вдыхаемом воздухе можно добиться частичного вытеснения СО из связи с гемоглобином и предотвратить летальный исход.
При отравлении оксидами азота, парами нитробензола и другими соединениями часть гемоглобина окисляется в метгемоглобин (НbОН), содержащий трехвалентное железо. Метгемоглобин также теряет способность к переносу кислорода от легких к тканям, поэтому при метгемо-глобинемии (вследствие отравления окислителями) в зависимости от степени отравления может наступить смерть от недостатка кислорода. Если вовремя оказать помощь, т.е. повысить парциальное давление кислорода (вдыхание чистого кислорода), то и в этом случае можно вывести больного из опасного состояния.
Следует отметить, что самым надежным методом качественного определения различных производных гемоглобина является исследование их спектров поглощения.
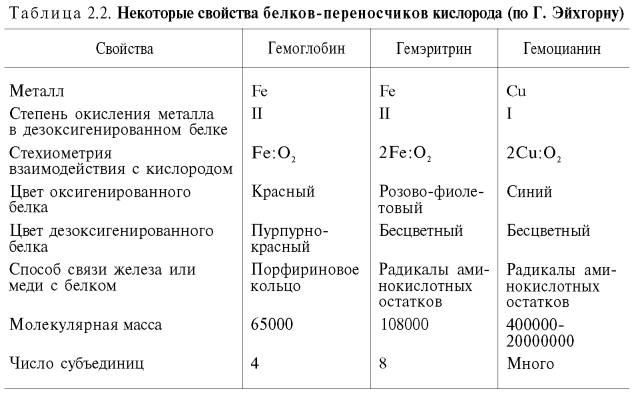
У беспозвоночных роль переносчика кислорода часто выполняют пигменты негеминовой природы – гемэритрин и гемоцианин. Они не относятся к гемсодержащим хромопротеинам, хотя в их названиях содержится корень «гем». Эти белки, как и гемоглобин, несмотря на то что выполняют одну и ту же функцию, сильно различаются между собой по молекулярной массе и четвертичной структуре, химической природе активного центра, характеру связывания железа (гемэритрин) и меди (гемоцианин) с кислородом и др. (табл. 2.2).
Трансферрины (сидерофилины) – группа сложных белков, полученных из разных источников и характеризующихся способностью специфично, прочно и обратимо связывать ионы железа Fe (III) и других переходных металлов. Наиболее подробно из этой группы белков изучен трансферрин сыворотки крови. Функция трансферрина заключается в транспорте ионов железа в ретикулоциты, в которых осуществляется биосинтез гемоглобина. Система трансферрин–ретикулоцит считается весьма перспективной для изучения взаимодействия металла с белком и белковой молекулы с клеткой.
ХРОМОПРОТЕИДЫ
Хромопротеиды (греческий chroma цвет, окраска + протеиды; синоним: хромопротеины) — сложные белки, молекулы которых содержат небелковые простетические хромофорные группы, поглощающие свет определенной длины волны в видимой части спектра и сообщающие всему соединению соответствующую окраску. Хромопротеиды являются важнейшими пигментами (см.), широко распространенными в живой природе и выполняющими в организме самые разнообразные биологической функции: перенос и депонирование кислорода и углекислого газа, участие в тканевом дыхании (см. Окисление биологическое), в окислительно-восстановительных реакциях (см.), фотосинтезе (см.), в механизмах зрения (см.). Генетически обусловленное нарушение обмена некоторых хромопротеидов является причиной тяжелых наследственных болезней (см.), например гемоглобинопатий (см.), заболеваний нервной и мышечной систем, связанных с дефицитом цитохромов (см.), и др.

Классификация хромопротеидов по функциональному признаку приведена на схеме (рис.).
К главным представителям хромо-протеидов принадлежат дыхательные пигменты (см.) — переносчики кислорода, содержащие или не содержащие гем — комплексное соединение протопорфирина с железом (см. Гемоглобин). Гемопротеиды или выполняющие аналогичные функции протеиды, содержащие медь, гемоцианины, обнаружены во всех организмах за исключением анаэробных клостридий и молочно-кислых бактерий. При высоком парциальном давлении кислорода гемопротеиды обратимо связывают его и отдают по мере снижения парциального давления кислорода. Для них характерен одинаковый тип укладки полипептидной цепи вокруг близких по структуре простетических групп, содержащих ион металла, и отсутствие изменения валентности иона металла при присоединении кислорода. В оксидазных системах, гидроксилазах и оксигеназах, участвующих в терминальном окислении, гемопротеиды активируют кислород за счет окисления железа, содержащегося в геме, облегчая тем самым взаимодействие кислорода с водородом субстратов дыхания. Существуют другие хромопротеиды, содержащие железо (см.) не в составе гема; они также осуществляют функции транспорта и депонирования веществ, связываемых железом. К таким хромопротеидам относятся трансферрин, концентрация которого в крови достигает 2 г/л, красно-коричневый водорастворимый хромопротеид ферритин (см.), гемосидерин, состоящий из нескольких молекул ферритина, лактоферрин — красный железосвязывающий белок молока и кональбумин — белок куриных яиц, подобный трансферрину.
Окраска хромопротеидов желтого цвета — флавопротеидов (см.), их восстановление и окисление обусловлены наличием в молекуле этих хромопротеидов в качестве хромофора изоаллоксазинового кольца (изоаллоксазила) рибофлавина (см.). Окисленные формы дыхательных ферментов (см.), относящихся к хромопротеидам, имеют красную, коричневую или зеленую окраску, а большинство хромопротеидов, содержащих медь (см.), окрашено в ярко-голубой цвет. Окраска хромопротеидов усиливается при образовании комплексных соединений с белком за счет координации с одним или несколькими атомами серы полипептидной цепи метионина (см.). Медьсодержащие белки, благодаря способности меди подвергаться обратимому окислению — восстановлению,— участвуют в некоторых окислительно-восстановительных реакциях как одноэлектронные переносчики. К таким белкам относятся стеллацианин — гликозаминопротеогликан из японского лакового дерева, пластоцианин зеленых растений, входящий в систему фотосинтеза, азурины — низкомолекулярные бактериальные переносчики электронов. Большая часть медьсодержащих ферментов катализирует окисление органических субстратов кислородом с образованием перекиси водорода (см.); к ним относятся галактозооксидаза (КФ 1.1.3.9), темно-зеленый оттенок этого фермента связан с присутствием в фермент-субстратном комплексе галактозы и кислорода, тирозиназа (КФ 4.1.99.2), участвующая в синтезе диоксифенилаланина (см.) и образовании меланинов (см.).
Из сока японского лакового дерева и гриба Polyporus выделен фермент лакказа (полифенолоксидаза; КФ 1.14.18.1). Продуктом реакции, катализируемой этим ферментом, является вода. Фермент не чувствителен к оксиду углерода СО и содержит три типа ионов меди. Ионы меди одного типа имеют голубой цвет, они связывают кислород, ионы другого типа (неокрашенные) участвуют в связывании анионов, стабилизируя тем самым образующуюся на промежуточной стадии ферментативной реакции перекись водорода. Третий тип ионов меди, содержащихся в лакказе, образует двухэлектронный акцептор, передающий электроны на кислород с промежуточным образованием перекиси водорода.
Регуляция содержания меди в организме человека и животных осуществляется церулоплазмином (см. Кровь), который по ферментативным свойствам напоминает лакказу и может участвовать в окислении двухвалентного железа на этапе его присоединения к трансферрину. Группа хромопротеидов, называемых супероксиддисмутазами, предотвращает превращение супероксидного анион-радикала в цитотоксический гидроксильный радикал (см. Радикалы свободные). Помимо атома меди в молекуле супероксиддисмутазы (пероксид-дисмутазы; КФ 1.15.1.1) может присутствовать цинк (см.), марганец (см.) или железо. В клетках кишечной палочки обнаружена железосодержащая супероксиддисмутаза; марганецсодержащие ферменты найдены в митохондриях млекопитающих и у некоторых бактерий.
Свойствами фотосенсибилизаторов обладают хромопротеиды родопсин (см.), хлорофиллы (см.), бактериохлорофилл, каротиноиды (см.) и синие или красные фикобилины. Каротиноиды и фикобилины, так же как и хлорофиллы, являются рецепторами энергии светового излучения, однако они используют ту часть видимого спектра, которую не поглощают хлорофиллы; эти хромопротеиды не содержат металла и окраска их обусловлена наличием полиненасыщенного углеродного скелета. Каротиноиды защищают хлорофиллы от распада в присутствии молекулярного кислорода. В противоположность хлорофиллам фикобилины не содержат магния, их простетическая группа представлена тетрапирролом с открытой цепью, они легко образуют сложные комплексы с белками — фикоэритрин и фикоцианин. Эти комплексы входят в систему фотосинтеза красных и сине-зеленых водорослей. Наличие фикобилинов в хроматофорах водорослей (наряду с хлорофиллом) рассматривают как приспособление, с помощью которого достигается лучшее обеспечение энергией светового излучения тех видов водорослей, которые существуют в условиях недостаточного освещения. К хромопротеидам можно отнести также меланопротеиды, красящие вещества кожи, волос и шерсти (в их состав входят меланины) и буро-зеленый пигмент панциря ракообразных, из которого при нагревании образуется красный каротиноид астацин.
В организме человека и животных гемсодержащие хромопротеиды участвуют во всех этапах утилизации кислорода, начиная от его транспорта — гемоглобин, миоглобин (см.) — и кончая терминальным окислением в митохондриях — цитохромы, цитохромоксидаза (см. Цитохромы).
Биохимический полиморфизм гемоглобина, выражающийся наличием в эритроцитах аномальных гемоглобинов, клинически проявляется гемоглобинопатиями (см.), протекающими чаще всего с гемолитической анемией (см.). К гемоглобинопатиям относят и случаи скрытого носительства аномальных гемоглобинов или генов талассемии (см.). Определение содержания миоглобина в крови и моче используется в качестве дополнительного диагностического теста при диагностике некоторых заболеваний сердца, сосудов и скелетных мышц, сопровождающихся нарушением обмена этого хромопротеида, в результате чего развивается миоглобинурия (см.). Активность цитохромоксидазы, фермента, чувствительного к действию цианистых соединений и оксида углерода, в сыворотке крови служит критерием тяжести отравления этими веществами (см. Отравления). Гемсодержащие ферменты каталаза (см.) и пероксида за (см. Пероксидазы) участвуют в разложении токсичных для организма перекиси водорода и гидроперекисей, образующихся в результате ряда ферментативных реакций и оказывающих повреждающее действие на клеточные компоненты. Предполагают, что при наследственной акаталазии (см.) происходит усиление окисления гемоглобина крови до метгемоглобина и изменение кислородтранспортной функции крови.
Функционирование цепи микросомного гидроксилирования стероидов (см.), жирных кислот (см.), ароматических соединений (см. Органические соединения) и лекарственных веществ сопряжено с действием цитохромов b5 и P-450, а также флавопротеидов, ускоряющих восстановление переносчика окислительно-восстановительных эквивалентов за счет НАД(Ф)-Н. В роли такого переносчика могут выступать белки типа ферродоксина, содержащие железо не в составе тема, например, адренодоксин из коры надпочечников.
При алиментарной недостаточности железа или после массивной кровопотери наблюдается снижение концентрации гемоглобина и других гемсодержащих хромопротеидов. Перенос железа в ткани регулируется содержанием трансферрина в сыворотке крови. Избыточное количество железа при низком содержании соответствующего транспортного белка приводит к отложению железа в тканях в виде метаболически неактивного гемосидерина (см. Гемосидероз).
Церулоплазмин (КФ 1.16.3.1) — медьсодержащая оксидаза, катализируя окисление полифенолов, полиаминов, аскорбиновой кислоты, в то же время принимает участие в транспорте меди. При недостаточности церулоплазмина медь может накапливаться в тканях, что наблюдают при гепатоцеребральной дистрофии (см.). Основным диагностическим признаком этого заболевания является низкая активность церулоплазмина в сыворотке крови. При снижении содержания в сыворотке крови альбумина и неконъюгированного (непрямого) билирубина она принимает голубой оттенок, обусловленный присутствием церулоплазмина. Алиментарная недостаточность меди вызывает снижение активности другого медьсодержащего фермента — супероксиддисмутазы. Это увеличивает чувствительность животного организма к повреждающему действию активных форм кислорода, а также УФ- и ионизирующего излучения.
При генетически обусловленном снижении активности глутатион-редуктазы (КФ 1.6.4.2), предотвращающей окислительный катаболизм гемоглобина путем восстановления глутатиона (см.), также снижается резистентность организма к повышенным концентрациям кислорода.
Недостаточная активность тирозиназы или блокирование ее активности в меланоцитах вызывает депигментацию кожи (см. Альбинизм).
Библиогр.: Верболович П. А. и Утешев А. Б., Железо в животном организме, Алма-Ата, 1967; Вилкинсон Д. Принципы и методы диагностической энзимологии, пер. с англ., М., 1981; Диксон М. и Уэбб Э. Ферменты, пер. с англ., т. 1—3, М., 1982; Мецлер Д. Биохимия, пер. с англ., т. 1—3, М., 1980; McGilvery R. W. Biochemistry, Philadelphia, 1970.
Читайте также:
