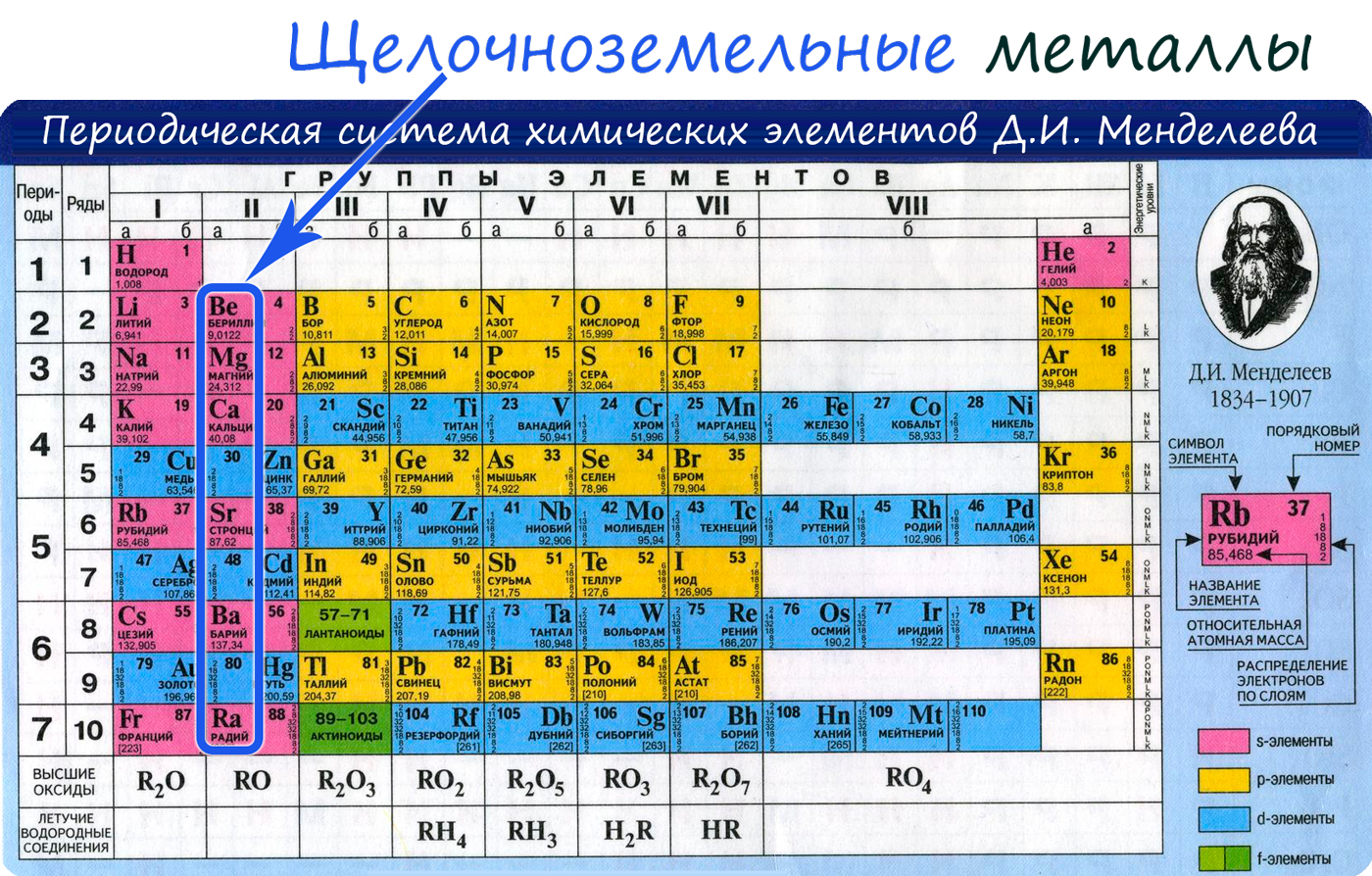
Кальций это щелочноземельный металл
КАЛЬЦИЙ
Ca (calcium),
химический элемент, относится к семейству щелочноземельных металлов Be, Mg, Ca, Sr, Ba, Ra, составляющих IIA подгруппу периодической системы элементов. Открыт Х.Дэви в 1808. Кальций - третий после алюминия и железа из наиболее распространенных металлов в земной коре, его получают преимущественно из известняка (карбонат кальция). Ведущими производителями кальция являются Австрия, Бразилия, Канада, Финляндия, Израиль и Норвегия. СВОЙСТВА КАЛЬЦИЯ
Атомный номер 20 Атомная масса 40,08 Изотопы
Температура плавления, ° С 842 Температура кипения, ° С 1495 Плотность, г/см3 1,55 Твердость (по Моосу) 1,5 Содержание в земной коре, % (масс.) 3,63 Степени окисления +2
Свойства. Кальций имеет в разрезе серебристо-белый цвет, но на воздухе тускнеет из-за образования оксида на его поверхности. Это пластичный металл тверже свинца. Кальций при нагревании в вакууме подвергается сублимации при температурах ниже точки плавления. Он умеренно растворим в воде, но плохо растворяется в этиловом спирте. При горении на воздухе образует оксид CaO и нитрид Ca3N2; нагретый металл непосредственно реагирует с галогенами. В соединениях кальций всегда двухвалентен.
Применение. Главное применение кальция - это использование его как восстановителя при получении металлов, особенно никеля, меди и нержавеющей стали. Кальций и его гидрид используются также для получения трудновосстанавливаемых металлов, таких, как хром, торий и уран. Сплавы кальция со свинцом находят применение в аккумуляторных батареях и подшипниковых сплавах. Кальциевые гранулы используются также для удаления следов воздуха из электровакуумных приборов.
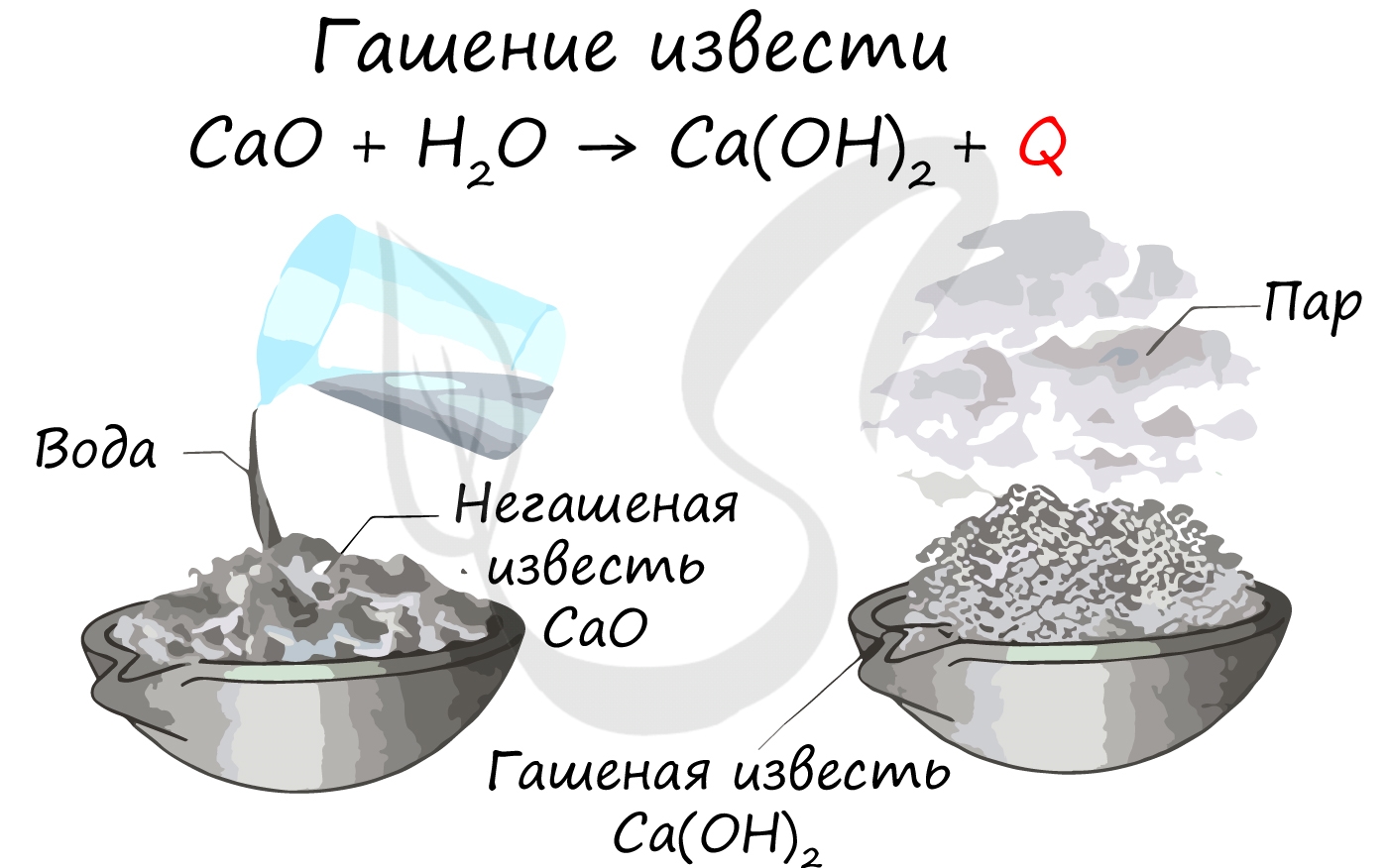
Соединения. Кальций образует множество соединений. В отличие от ограниченного применения металлического кальция, его соединения широко применяются с тех пор, как первобытный человек использовал в качестве убежища известняковые пещеры. Оксид кальция CaO - наиболее важный промышленный продукт, служащий исходным сырьем для производства других полезных соединений кальция. CaO имеет несколько коммерческих названий: известь, жженая известь, негашеная известь. Чистый оксид кальция - белое кристаллическое вещество, термостойкий (т.пл. 2630° С). Оксид получают обжигом известняка и мела, при котором удаляют выделяющийся углекислый газ; процесс ведут в шахтных печах с использованием в качестве топлива древесины, угля, нефти или газа; в результате получаются пористые куски жженой извести. При хранении на влажном воздухе жженая известь поглощает углекислый газ и влагу, превращаясь в рыхлую гашеную известь (пушонку). При добавлении воды к CaO выделяется много тепла и образуется гашеная известь (гидроксид кальция). При нагревании оксида кальция с диоксидом кремния или силикатами образуется силикат кальция (см. ниже). Жженую известь широко используют в строительстве для приготовления кладочных и штукатурных растворов, для получения хлорной извести, при выделке кожи, медицинских препаратов и кормов. Гидроксид кальция Ca(OH)2 в виде белого порошка образуется при гашении извести. Он слабо растворим в воде, насыщенный раствор известен под названием "известковая вода", а при избытке гидроксида кальция образуется белая взвесь - "известковое молоко". Ca(OH)2 является основанием и поглощает углекислый газ из воздуха. Гидроксид кальция используется в медицине (в основном для понижения кислотности), в производстве штукатурки, кладочных строительных растворов, цемента, клеевых красок и удаления волоса со шкур при выделке кожи. Известковый кладочный раствор готовят смешением гашеной извести с песком при добавлении воды до получения пластичной массы. Раствор служит вяжущим веществом при возведении стен, так как на воздухе происходит реакция гашеной извести с углекислым газом воздуха с образованием карбоната кальция и выделением воды, поэтому раствор твердеет. Штукатурный раствор ведет себя аналогично. Карбонат кальция CaCO3 в природе распространен в форме минералов известняка или мрамора. Он является основой кальцита, мела, кораллов, яичной скорлупы, раковин морских животных. Доломит - смешанный карбонат кальция и магния. Карбонат кальция используют для приготовления цемента и бетона. Цемент готовят прокаливанием тонкой смеси карбоната кальция (известняк, мел или мергель) с силикатом (глина, сланец) или доменным шлаком. Если цемент смешать с песком и гравием или щебнем и добавить воды до получения пластичной массы, то образуется бетон. Этот материал твердеет и в отсутствие углекислого газа. Карбонат кальция нерастворим в чистой воде, но растворяется в воде, насыщенной углекислым газом, так как при этом образуется растворимая кислая соль Ca(HCO3)2. При кипячении раствора происходит выделение углекислого газа и нерастворимый карбонат кальция выпадает в осадок. Этими реакциями объясняется образование накипи при использовании жесткой воды в чайниках, отопительных системах или бойлерах. Аналогичные реакции происходят в природе, приводя к образованию карстовых промоин в известняке и росту сталактитов и сталагмитов. Жесткая вода содержит бикарбонат или сульфат кальция и (или) магния. При стирке и кипячении в жесткой воде на мыле образуется осадок, блокируя способность мыла к удалению грязи.
Сульфат кальция CaSO4 существует в природе в виде минерала ангидрита. Дигидрат CaSO4*2H2O является важным промышленным минералом, известным под названиями гипс, алебастр, селенит и шелковистый шпат. Гипс добавляют в цемент для уменьшения скорости схватывания, его используют для изготовления пишущих мелков, сельскохозяйственной побелки, в качестве наполнителя красок, полировального порошка и для глянцевания бумаги. При 165-200° C гипс теряет 75% гидратной воды и образует штукатурный гипс. При увлажнении происходит поглощение воды и схватывание массы. Поскольку при затвердевании гипс слегка расширяется, он воспроизводит все тонкие детали любого объекта, на который нанесен, образуя слепок, и поэтому широко используется в изготовлении скульптур, хирургических и зубных слепков, производстве штукатурки и стеновых покрытий. Гипс, прокаленный до полного удаления гидратной воды, используется как высокотвердый поделочный материал. Специально приготовленный безводный сульфат кальция применяется для осушки газов и органических жидкостей, причем он легко регенерируется при нагревании.
Другие серусодержащие соединения. Сульфит кальция CaSO3 и бисульфит кальция Ca(HSO3)2 используются для отбеливания древесной массы в целлюлозно-бумажной промышленности, для предотвращения закисления при ферментации и вместо тиосульфата натрия для отбеливания тканей. Сульфид кальция CaS получают прокаливанием смесей сульфата кальция с углеродом или карбоната кальция с серой. Сульфид применяется для приготовления люминофоров и для удаления волосяного покрова со шкур в кожевенной промышленности.
Галогениды. Хлорид кальция CaCl2 получают из природных насыщенных соляных вод (рапы) или как побочный продукт производства соды по методу Сольве. Его можно получить также по реакции оксида или карбоната кальция с соляной кислотой. При комнатной температуре из раствора кристаллизуется бесцветный расплывающийся на воздухе гексагидрат CaCl2Ч6H2O. При прокаливании гексагидрат теряет воду и переходит последовательно в дигидрат, моногидрат и безводную соль. Эти соединения легко поглощают влагу и поэтому используются как осушители, а также в качестве соляной добавки для плавления снега и льда или для рассеяния тумана. Раствор хлорида кальция используют как антифриз для опрыскивания дорог и в шахтах, как хладагент в холодильных установках, при изготовлении цемента, огнестойких тканей и в огнетушителях. Фармакопейный хлорид кальция широко применяется в медицине, например для остановки кровотечения и увеличения свертываемости крови. Бромид CaBr2 и иодид CaI2 по химическим свойствам похожи на хлорид и применяются в фотографии и медицине. Фторид кальция, встречающийся в природе в виде минерала флюорита, или плавикового шпата, является основным сырьем для получения фтора. Фторид практически нерастворим в воде в отличие от других галогенидов.
Хлорная (белильная) известь. Состав этого вещества в основном соответствует формуле CaOCl2 (сложная смесь хлорида и гипохлорита кальция). Это вещество получают, подавая газообразный хлор снизу через раствор гашеной извести, непрерывно впрыскиваемый во вращающийся аппарат сверху. Хлорная известь - беловатый порошок с сильным запахом хлора. При выдерживании на воздухе он поглощает влагу и углекислый газ и выделяет хлор. Обычный коммерческий продукт содержит около 35% активного хлора (количество хлора, выделяющееся при взаимодействии с соляной кислотой). Хлорная известь используется для отбеливания тканей и древесной массы, для дезинфекции питьевой воды и обезвреживания сточных вод. Еще недавно ее применяли вместо хлора и гипохлорита кальция для отбеливания тканей. Гипохлорит кальция Ca(ClO)2, часто называемый просто гипохлоритом, - белый негигроскопичный порошок с запахом хлора, содержит около 99% активного хлора и поэтому вдвое эффективнее хлорной извести. Он прост в употреблении и хорошо сохраняется. Применяется так же, как и хлорная известь.
Фосфаты. Средний фосфат кальция Ca3(PO4)2 существует в природе в виде минерала фосфорита и является важным компонентом костей животных. Фосфат кальция служит сырьем для получения других фосфатов, фосфора, его соединений, используется в производстве фарфора, эмалей, молочного стекла. Гидрофосфат кальция CaHPO4 применяется как кормовая добавка скоту, в качестве цемента и пасты в стоматологии, как удобрение. Дигидрофосфат кальция Ca(H2PO4)2, или суперфосфат, лучше растворим в воде, чем другие, трех- или двухосновные соли, и поэтому пригоден для быстрой подкормки растений. Карбид кальция CaC2 получают восстановлением CaO коксом, древесным углем или антрацитом в электрической печи. При добавлении воды карбид разлагается с выделением ацетилена. При нагревании карбида кальция в среде азота можно получить цианамид кальция.
См. также УГЛЕРОД. Цианамид кальция CaCN2 - прежде одно из важнейших соединений для фиксации атмосферного азота, теперь в основном используется как удобрение и для цементации стали. При парофазном гидролизе в автоклаве цианамид выделяет аммиак; если его прокаливать в смеси с хлоридом натрия и углеродом, то образуется цианид натрия NaCN, широко используемый для извлечения золота из руд. Арсенат кальция Ca3(AsO4)2 - белый порошок, образующийся по реакции между хлоридом кальция, гидроксидом кальция и арсенатом аммония. Это вещество - распространенный инсектицид, широко применяемый при опылении хлопковых полей для уничтожения вредных насекомых. Силикат кальция CaSiO3 широко распространен в природе в виде минерала волластонита. Он является основным содержимым шлака, образующегося в металлургическом процессе при выплавке металлов из руд. Если в руде имеется избыток песка, то при выплавке добавляют известняк и, наоборот, при избытке известняка в руде добавляют песок; соответственно образующийся силикат кальция в виде шлака собирается на поверхности расплавленного металла и удаляется из печи. В природе существуют также силикаты кальция иного состава.
См. также ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ.
ЛИТЕРАТУРА
Родякин В.В. Кальций, его соединения и сплавы. М., 1967 Фрумина Н.С. и др. Аналитическая химия кальция. М., 1974
Энциклопедия Кольера. — Открытое общество . 2000 .
Полезное
Смотреть что такое "КАЛЬЦИЙ" в других словарях:
КАЛЬЦИЙ — (Са) желтый блестящий и тягучий металл. Удельный вес 1,6. Словарь иностранных слов, вошедших в состав русского языка. Павленков Ф., 1907. КАЛЬЦИЙ (ново лат. calcium, от лат. calx известь). Серебристого цвета металл. Словарь иностранных слов,… … Словарь иностранных слов русского языка
КАЛЬЦИЙ — КАЛЬЦИЙ, Calcium, хим. элемент, симв. Са, блестящий, серебристо белого цвета металл с кристаллич. изломом, относящийся к группе щелочно земельных металлов. Уд. вес 1,53; ат. в. 40,07; точка плавления 808°. Са относится к числу весьма… … Большая медицинская энциклопедия
КАЛЬЦИЙ — (Calcium), Ca, химический элемент II группы периодической системы, атомный номер 20, атомная масса 40,08; относится к щелочно земельным металлам; tпл 842шC. Содержится в костной ткани позвоночных, раковинах моллюсков, яичной скорлупе. Кальций… … Современная энциклопедия
КАЛЬЦИЙ — металл серебристо белого цвета, вязкий, ковкий, на воздухе быстро окисляющийся. Темп pa плавления 800 810°. В природе встречается в виде различных солей, образующих залежи мела, известняка, мрамора, фосфоритов, апатитов, гипса и др. На жел. дор.… … Технический железнодорожный словарь
КАЛЬЦИЙ — (лат. Calcium) Ca, химический элемент II группы периодической системы, атомный номер 20, атомная масса 40,078, относится к щелочноземельным металлам. Название от латинского calx, родительный падеж calcis известь. Серебристо белый металл,… … Большой Энциклопедический словарь
КАЛЬЦИЙ — (символ Са), широко распространенный серебристо белый металл из группы ЩЕЛОЧНОЗЕМЕЛЬНЫХ, впервые выделен в 1808 г. Содержится во многих горных породах и минералах, особенно в известняке и гипсе, а также в костях. В организме способствует… … Научно-технический энциклопедический словарь
Кальций — Ca (от лат. Calx, род. падеж calcis известь *а. calcium; н. Kalzium; ф. calcium; и. calcio), хим. элемент II группы периодич. системы Mенделеева, ат.н. 20, ат. м. 40,08. Cостоит из шести стабильных изотопов: 40Ca (96,97%), 42Ca (0,64%),… … Геологическая энциклопедия
КАЛЬЦИЙ — КАЛЬЦИЙ, кальция, мн. нет, муж. (от лат. calx известь) (хим.). Химический элемент металл серебристо белого цвета, содержащийся в извести. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
КАЛЬЦИЙ — КАЛЬЦИЙ, я, муж. Химический элемент, мягкий серебристо белый металл. | прил. кальциевый, ая, ое. Кальциевые соли. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
КАЛЬЦИЙ — муж. металл, составляющий химическую основу извести. Кальцинировать что, пережигать металл, соль или камень. Кальцинация жен. действие это, пережиг, перекалка. Толковый словарь Даля. В.И. Даль. 1863 1866 … Толковый словарь Даля
КАЛЬЦИЙ — (Calcium), Ca, хим. элемент II группы периодич. системы элементов, ат. номер 20, ат. масса 40,08, относится к щелочноземельным металлам. ПриродныйК. состоит из смеси 6 стабильных изотопов с массовыми числами 40, 42 44, 46 и 48, среди к рых наиб.… … Физическая энциклопедия
Кальций – полезные свойства и особенности металла
Этот химический элемент жизненно важен в буквальном смысле: из него состоят наши кости и зубы. Кальций – это также морские раковины, цветные мелки, сталактиты и сталагмиты в пещерах.

Что представляет собой
Кальций – это химический элемент периодической системы Д. И. Менделеева под №20. Мягкий серебристо-белый металл блестит, но затем тускнеет под пленкой-оксидом.
Состоит из шести стабильных изотопов, при этом 97% состава приходится на Ca40.
Относится к щелочноземельным металлам.
Международное обозначение – Calcium (Ca).
История
Применение кальциевых минералов – мрамора, гипса, известняка – исчисляется тысячелетиями.

Гипс
Чистый металл первым в истории получил британский химик Гемфри Дэви (1808 год). Для этого он применил электролиз к смеси из оксида ртути и мокрой гашеной извести. Получив амальгаму, отделил ртуть.
Он же предложил латинское название элемента: calcis означает мягкий камень, известка.
Физико-химические характеристики
Кальций представлен двумя модификациями кубической решетки: с гране- и объемноцентрированной структурой.

Металл наделен многими достоинствами: пластичен, режется ножом, обрабатывается прессованием, прокаткой.
Химические свойства проявляются при нагревании:
- Взаимодействие с горячей водой приводит к образованию водородного «фонтана». Но реакция проходит без взрывов или горения.
- Взаимодействует с кислотами, неметаллами, образуя соединения.
- Даже при комнатной температуре во влажном микроклимате покрывается пленкой.
Нагреваясь в кислороде либо на воздухе, кальций, его растворимые соли горят. Пламя получается красно-оранжевым. По цвету его легко отличить от других металлов.

Кальций в атмосфере аргона
Химическая активность вещества зашкаливает. Для устранения этого недостатка металл хранят в керосине, растопленном парафине либо закупоренном сосуде.
Уникальные свойства кальция как металла проявляются при усилении давления.
Под давлением он ведет себя как полупроводник, затем как металл, потом подобно сверхпроводнику. По проводимости в разы превосходит все химические элементы (например, ртуть – вшестеро).
Присутствие в природе
Кальций – третий по распространенности в земной коре среди металлов, пятый среди всех элементов. Четвертый по количеству минералов (385).
Однако высокая химическая активность исключает присутствие элемента в свободном виде:
- Это компонент минералов и соединений. Самые распространенные минералы – гипс, кальцит, алебастр, флюорит, апатит, доломит.
Вещество с формулой СаСО3 – обычный мел.
- Щелочноземельный металл обнаружен в каменных метеоритах – как почти ненаходимые на земле сульфиды.
Тонна земной коры содержит 32,7 кг кальция, литр морской воды – 410 мг.
Из морской воды кальций как строительный материал вытаскивают моллюски, кораллы.
Концентрацией кальция в составе определяется степень жесткости воды.
Технология получения
Конечный продукт промышленного производства – металлический кальций.

Металлический Кальций
Получение металла проходит двумя методами:
- Электролиз. Расплавляют CaCl2, задействуя медно-кальциевый анод. Из полученного медно-кальциевого сплава (2:1) отгоняют металл.
- Алюминотермия. Прокаливается смесь CaO и порошковый алюминий. Конденсат из кальциевых паров аккумулируется на охлаждаемой поверхности.
Для обоих способов получения металла требуется вакуум и 960-1900°С.
Единственный производитель кальция в Европе – Чепецкий механический завод. Его открыли в 1949 году для нужд отечественной урановой промышленности. Уже тогда СССР отработал процесс восстановления урана кальцием. Сегодняшний ассортимент шире.
Где используется
Утилитарные характеристики металла обусловили сферы применения.

Применение Кальция
Промышленность
Львиная доля продукции металлургических комбинатов достается промышленному комплексу.
Здесь миссия кальция многогранна:
- Восстановление редкоземельных, тугоплавких элементов из соединений. Речь о хроме, никеле, меди, тории, уране.
- Удаление серы из бензина, керосина, других нефтепродуктов.
- Раскисление стали и сплавов цветных металлов.
- Получение антифрикционных сплавов.
- Очистка электровакуумных приборов от воздуха, других газов.
- Обезвоживание органических растворителей.
Металл используется при производстве аккумуляторных батарей, подшипников, оболочек кабелей.
Наука
Изотоп Ca-48 – материал с высоким КПД для производства сверхтяжелых элементов.
Кальцием восстанавливают уран.
С его помощью ученые пополняют таблицу Менделеева.
Другие сферы
Кальциевые материалы нашли применение на бытовом уровне:
- Строительный материал (известняк, гипс, мрамор).
- Сырье при производстве гипса, включая медицинский.
- Дезинфектор (хлорка).
- Мелки для рисования.
- Аптечные препараты, БАДы (особенно с витамином D).
Эстетично выглядящие образцы (флюорит, кальцинит, мрамор) попадают в минералогические коллекции.
Биологическое влияние
Кальций – важный для биологических организмов макроэлемент (1,6-2,1% по массе): он есть в растениях, организме животных, человека.
Жизненные процессы
Макроэлемент аккумулируется костями и зубами.
Известь (карбонат кальция) – строительный материал ракушек, кораллов, яичной скорлупы, накипи в чайнике.
Вещество задействовано в следующих процессах:
- Свертывание крови.
- Сокращение мышц.
- Секреция гормонов.
Тело человека массой 60 кг содержит полтора килограмма кальция.
Достаточное количество металла критично для детей и подростков: их скелет растет каждую минуту. У младенцев может проявиться рахитичность.
Питание
Макроэлемент поступает в организм во время еды. В детском возрасте продукт номер один – молоко.
Рацион взрослых разнообразнее. Веществом насыщены продукты всех групп:
- Цельнозерновой хлеб, гречка.
- Морепродукты, рыба (особенно мягкие кости).
- Бобовые.
- Орехи, свежий кунжут.
- Листовой салат, укроп, петрушка, спаржа.
Всасыванию кальция содействует лактоза, препятствуют кофе, углеводы, пальмовое масло, животные жиры (кроме сала).
Нормы
Суточная потребность в макроэлементе определяется возрастом (г):
| Возраст (лет) | Количество кальция (мг) |
| 0-6 | 1490 |
| 7-9 | 750 |
| 10-12 (мальчики) | 910 |
| 10-12 (девочки) | 1250 |
| 13-19 | 1250 |
| 20-49 | 1050 |
| 49+ | 1150-1350 |
Беременным и кормящим матерям требуется повышенная норма вещества.
Симптомы нехватки/переизбытка
Дефицит металла в организме проявляется многопланово:
- судороги, онемение конечностей, суставная боль;
- тахикардия;
- гипертония;
- расслоение, ломкость ногтей.
На ментальном плане это депрессия, нервозность.
Хроническая нехватка макроэлемента ведет к хрупкости костей (остеопорозу).
Об избытке макроэлемента сигнализируют отвращение к еде, неутолимая жажда, расстройство ЖКТ (тошнота, рвота), повышенное мочеотделение, слабость.
Избыток вещества опасен: организм «цементируется».
Максимальная суточная доза кальция для взрослых – 2,5 г.
На российском рынке представлена промышленная и аптечная продукция.
Цены на промышленный кальций (руб. / кг):
- металлический – 450;
- кусковой (чистота: 99,82%) – 1500;
- хлористый технический – 47;
- хлористый пищевой – 95.
Аптечный сегмент представлен отечественной и зарубежной продукцией. Упаковка глюконата кальция (10 таблеток) российского производства стоит 15-25 руб., препарата «Кальций-Д3 Никомед» – 300 – 700 руб.
Щелочноземельные металлы – перечень, свойства и польза элементов
Этой группе металлов отдан весь второй столбец таблицы Менделеева. И атомщики, и ювелиры используют щелочноземельные металлы. С ними интересно экспериментировать, но требуется осторожность.

Что представляют собой
Щелочноземельные металлы – это вся вторая группа таблицы Менделеева.
К щёлочноземельным металлам относятся:
То есть «щелочноземельный» список насчитывает шесть позиций, которые обычно располагаются по возрастанию атомного номера – от бериллия к радию.
Двойное название группы – отражение природы и характеристик входящих в нее элементов:
- Они способны образовывать щелочи.
- Ряд свойств их оксидов близки окислам алюминия и железа. Такие вещества еще средневековые алхимики именовали «землями».
Сегодняшний состав щелочноземельной группы сформировался не сразу: бериллий и магний отсутствовали.
Это объяснялось отличием свойств данных элементов от остальных:
- По большинству характеристик они ближе к алюминию, чем к другим элементам группы.
- Их гидроксиды – не щелочи.
- Магний взаимодействует с водой в замедленном режиме, у бериллия реакция в таком растворе нулевая. Та же картина при контакте с неметаллами.
Однако специалисты Международного союза теоретической и прикладной химии (IUPAC) решили все-таки причислить бериллий и магний к щелочноземельной группе.
Формы нахождения в природе
Щёлочноземельным металлам присуща чрезмерная активность, поэтому в природе они как самостоятельный элемент отсутствуют.
Почти всегда это составляющая минералов либо руд:
- Самый распространенный элемент щелочноземельной группы – кальций (2,9-12,9% по массе). Его получают из известняков, им насыщены мрамор, гранит.
- Почти три процента забирает магний.
- В сто раз реже в литосфере представлены барий со стронцием.
- Содержание остальных элементов измеряется тысячными долями процента.
Самым редким на планете щёлочноземельным металлом является радий. Но найти его легче других: это обязательный компонент урановых рудников.
Элементы группы наделены общими физическими свойствами:
- Серебристый с сероватостью цвет.
- Твердость в стандартных условиях, ножом режется только стронций.
- Металлический блеск.
- Тускнение на воздухе с разной скоростью вследствие образования оксидной пленки.
- Хорошая пропускная способность для тепла и электричества.
- Два электрона на внешнем слое атома у каждого элемента, степень окисления – всегда +2. Это отражают формулы соединений, образованных металлами группы.
Самая тяжелая «щелочная земля» – радий. Кубик вещества с ребром в 1 см весит 5,5 грамма.
Более интересны химические свойства «земель».
Есть общие и оригинальные:
- Покрытый пленкой-оксидом бериллий способен на реакцию только при 600+°С (кроме фтора).
- Окисленный магний при средней температуре не реагирует ни с чем. Получение соединений металла возможно при температуре от 645°C.
- Кальций окисляется неспешно и только если воздух влажный. При незначительном нагреве горит, растворяется водой.
- Осмотрительности требуют барий, стронций, радий. На открытом пространстве взаимодействие этих металлов с кислородом и азотом чревато взрывом. Их держат в герметичных контейнерах, залив керосином. Эта особенность объединяет щелочные и щелочноземельные металлы.
Общие свойства щёлочноземельных металлов – растворение в кислотах, образование солей, щелочей при взаимодействии с водой.
Химическая активность щелочноземельных металлов усиливается с увеличением габаритов атома – от бериллия к радию.
Где используются
Свойства металлов щелочноземельной группы обусловили применение каждого во всех сегментах – от авиастроения до медицины и ювелирного дела:
- Бериллий. Исходник при выплавке сплавов, включая «атомные», получения ракетного топлива. Компонент ювелирных минералов первого ряда – аквамарина, гелиодора, изумруда.
- Кальций. Базис большинства огнеупоров, строительных материалов. Металл задействован при производстве топлива, аптечных препаратов.
- Магний. Самый легкий щелочноземельный металл. Как восстановитель нашел применение в металлургии. Без проблем куется, раскатывается. Чаще используется как «ингредиент» сплавов, снижающий их массивность, – материал корпусов и деталей ракет, самолетов, автомобилей, электроники. А также приборов для нужд оборонного комплекса и предприятий приборостроения.
Сегодня на первое место по использованию магниевых сплавов выходят смартфоны, планшеты, другие гаджеты.
- Стронций. Металлургами используется как лигатура сплавов, очиститель сталей, чугуна, меди от серы, других вредных примесей. Сырье закупают производители радиоэлектроники, химических источников тока, атомщики, пиротехники. Продукция «высокого сегмента» из металла – чистый уран, керамика-сверхпроводник, вакуумный инструментарий.
Стронций создает насыщенно-красные оттенки огней салюта. Изотопом вещества лечат онкологию.
- Барий. Используются соединения металла. Главный потребитель – атомщики. Ассортимент: вакуумные, пьезоэлектрические приборы, жидкий теплоноситель, линзы, стекло для урановых стержней, керамика-сверхпроводник. Нетоксичный сульфат используется рентгенологами как контрастное вещество.
На особом счету радий. Это самый редкий щелочноземельный металл: на планете его получено всего полтора килограмма.
Даже микродозы радиоактивного вещества смертельно опасны для человека. Однако это свойство используется исследователями ядерных процессов и для лечения онкологии.
Шкалы, стрелки компасов, бортовых приборов, изготовленных до 1970-х годов, покрыты краской, содержащей радий. Она светится в темноте, но с тех пор не используется как опасная для человека.
Биологическое значение
Значение щелочноземельных элементов разнообразно:
- Без кальция не формируется скелет, зубы, не сокращаются мышцы. Элемент «курирует» параметры крови.
- Магний – компонент биологических структур (к примеру, хлорофилла у растений). В организме человека содействует синтезу нуклеиновых кислот, работе ферментов, нервной системы.
- Микродозы стронция присутствуют в организме как аналог кальция. Особо важен щелочноземельный элемент для детей младше четырех лет.
Барий, радий, бериллий, их соединения ядовиты. Поэтому для биологических структур опасны.
Щелочноземельные металлы
К щелочноземельным металлам относятся металлы IIa группы: бериллий, магний, кальций, стронций, барий и радий. Отличаются легкостью, мягкостью и сильной реакционной способностью.
Общая характеристика
От Be к Ra (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств, реакционная способность. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
- Be - 2s 2
- Mg - 3s 2
- Ca - 4s 2
- Sr - 5s 2
- Ba - 6s 2
- Ra - 7s 2
Природные соединения
- Be - BeO*Al2O3*6SiO2 - берилл
- Mg - MgCO3 - магнезит, MgO*Al2O3 - шпинель, 2MgO*SiO2 - оливин
- Ca - CaCO3 - мел, мрамор, известняк, кальцит, CaSO4*2H2O - гипс, CaF2 - флюорит

Получение
Это активные металлы, которые нельзя получить электролизом раствора. С целью их получения применяют электролиз расплавов, алюминотермию и вытеснением их из солей другими более активными металлами.
MgCl2 → (t) Mg + Cl2 (электролиз расплава)
CaO + Al → Al2O3 + Ca (алюминотермия - способ получения металлов путем восстановления их оксидов алюминием)

Химические свойства
Все щелочноземельные металлы (кроме бериллия и магния) реагируют с холодной водой с образованием соответствующих гидроксидов. Магний реагирует с водой только при нагревании.
Щелочноземельные металлы - активные металлы, стоящие в ряду активности левее водорода, и, следовательно, способные вытеснить водород из кислот:
Хорошо реагируют с неметаллами: кислородом, образуя оксиды состава RO, с галогенами (F, Cl, Br, I). Степень окисления у щелочноземельных металлов постоянная +2.
Mg + O2 → MgO (оксид магния)
При нагревании реагируют с серой, азотом, водородом и углеродом.
Mg + S → (t) MgS (сульфид магния)
Ca + H2 → (t) CaH2 (гидрид кальция)
Ba + C → (t) BaC2 (карбид бария)

Ba + TiO2 → BaO + Ti (барий, как более активный металл, вытесняет титан)
Оксиды щелочноземельных металлов
Имеют общую формулу RO, например: MgO, CaO, BaO.
Оксиды щелочноземельных металлов можно получить путем разложения карбонатов и нитратов:
Рекомендую взять на вооружение общую схему разложения нитратов:

Проявляют преимущественно основные свойства, все кроме BeO - амфотерного оксида.
- Реакции с кислотами и кислотными оксидами
В нее вступают все, кроме оксида бериллия.
Амфотерные свойства оксида бериллия требуют особого внимания. Этот оксид проявляет двойственные свойства: реагирует с кислотами с образованием солей, и с основаниями с образованием комплексных солей.
BeO + NaOH + H2O → Na2[Be(OH)4] (тетрагидроксобериллат натрия)
Если реакция проходит при высоких температурах (в расплаве) комплексная соль не образуется, так как происходит испарение воды:
BeO + NaOH → Na2BeO2 + H2O (бериллат натрия)

Гидроксиды щелочноземельных металлов
Проявляют основные свойства, за исключением гидроксида бериллия - амфотерного гидроксида.
Получают гидроксиды в реакции соответствующего оксида металла и воды (все кроме Be(OH)2)
Основные свойства большинства гидроксидов располагают к реакциям с кислотами и кислотными оксидами.

Реакции с солями (и не только) идут в том случае, если соль растворимы и по итогам реакции выделяется газ, выпадает осадок или образуется слабый электролит (вода).
Гидроксид бериллия относится к амфотерным: проявляет двойственные свойства, реагируя и с кислотами, и с основаниями.
Жесткость воды
Жесткостью воды называют совокупность свойств воды, зависящую от присутствия в ней преимущественно солей кальция и магния: гидрокарбонатов, сульфатов и хлоридов.
Различают временную (карбонатную) и постоянную (некарбонатную) жесткость.
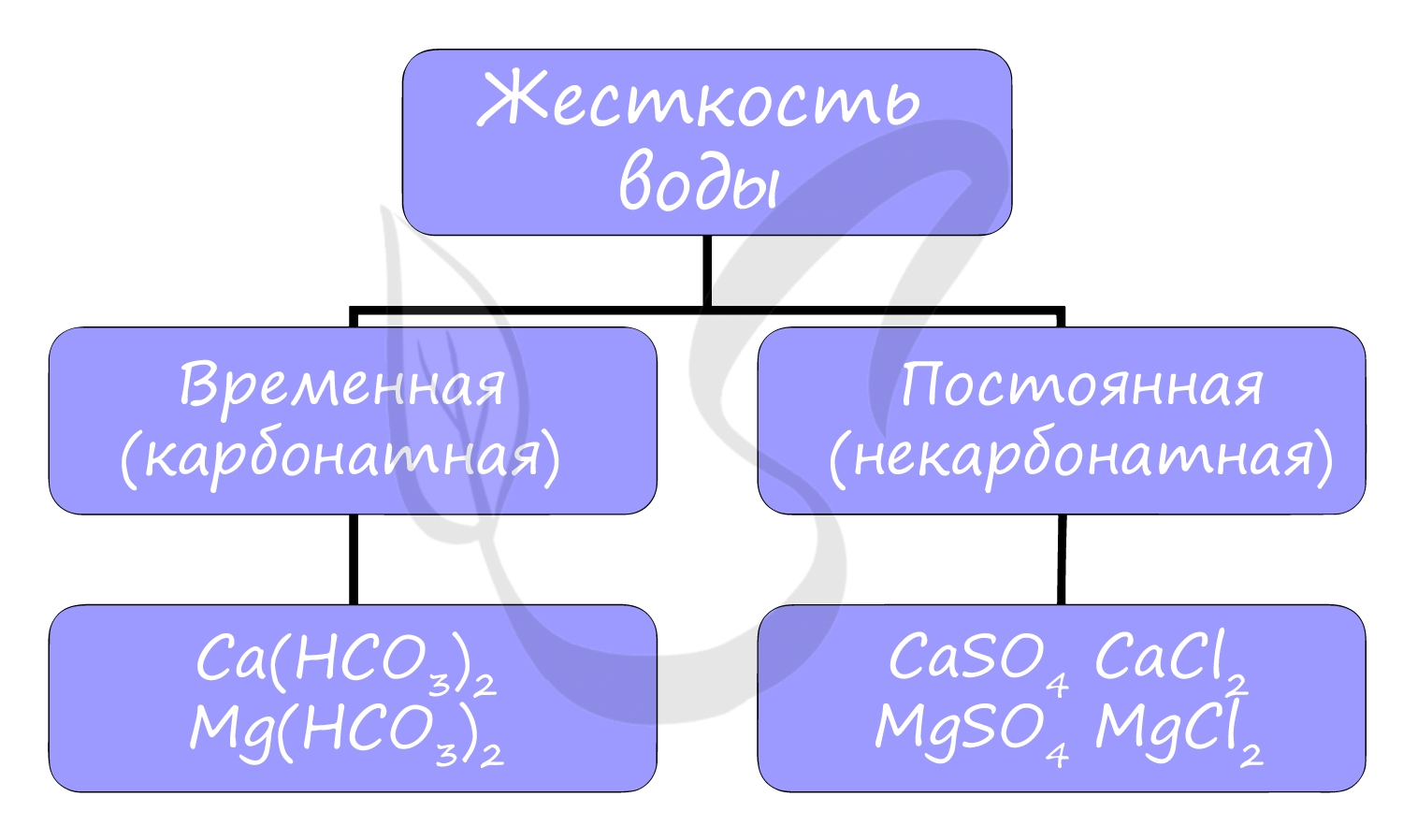
Вероятно, вы часто устраняете жесткость воды у себя дома, осмелюсь предположить - каждый день. Временная жесткость воды устраняется обычным кипячением воды в чайнике, и известь на его стенках - CaCO3 - бесспорное доказательство устранения жесткости:
Также временную жесткость можно устранить, добавив Na2CO3 в воду:
С постоянной жесткостью бороться кипячением бесполезно: сульфаты и хлориды не выпадут в осадок при кипячении. Постоянную жесткость воды устраняют добавлением в воду Na2CO3:
Жесткость воды можно определить с помощью различных тестов. Чрезмерно высокая жесткость воды приводит к быстрому образованию накипи на стенках котлов, труб, чайника.

Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Щёлочноземельные металлы

Щё́лочноземе́льные мета́ллы — химические элементы 2-й группы [1] периодической таблицы элементов: бериллий, магний, кальций, стронций, барий и радий [2] [3] . Названы так потому, что их оксиды — «земли» (по терминологии алхимиков) — сообщают в воде щелочную реакцию. Соли щёлочноземельных металлов, кроме радия, широко распространены в природе в виде минералов. Происхождение этого названия связано с тем, что их гидроксиды являются щелочами, а оксиды по тугоплавкости сходны с оксидами алюминия и железа, носившими ранее общее название "земли
Содержание
Физические свойства
Все щёлочноземельные металлы — серые, твёрдые при комнатной температуре вещества. В отличие от щелочных металлов, они существенно более твёрдые, и ножом преимущественно не режутся (исключение — стронций). Плотность щёлочноземельных металлов с порядковым номером растёт, хотя явно рост наблюдается только начиная с кальция, который имеет минимальную среди них плотность (ρ = 1,55 г/см³), самый тяжёлый — радий, плотность которого примерно равна плотности железа.
Химические свойства
Щёлочноземельные металлы имеют электронную конфигурацию внешнего энергетического уровня ns², и являются s-элементами, наряду с щелочными металлами. Имея два валентных электрона, щёлочноземельные металлы легко их отдают, и во всех соединениях имеют степень окисления +2 (очень редко +1).
Химическая активность щёлочноземельных металлов растёт с ростом порядкового номера. Бериллий в компактном виде не реагирует ни с кислородом, ни с галогенами даже при температуре красного каления (до 600 °C, для реакции с кислородом и другими халькогенами нужна ещё более высокая температура, фтор — исключение). Магний защищён оксидной плёнкой при комнатной температуре и более высоких (до 650 °C) температурах и не окисляется дальше. Кальций медленно окисляется и при комнатной температуре вглубь (в присутствии водяных паров), и сгорает при небольшом нагревании в кислороде, но устойчив в сухом воздухе при комнатной температуре. Стронций, барий и радий быстро окисляются на воздухе, давая смесь оксидов и нитридов, поэтому их, так же и как щелочные металлы (и кальций), хранят под слоем керосина.
Оксиды и гидроксиды щёлочноземельных металлов имеют тенденцию к усилению основных свойств с ростом порядкового номера: Be(OH)2 — амфотерный, нерастворимый в воде гидроксид, но растворим в кислотах (а также проявляет кислотные свойства в присутствии сильных щелочей), Mg(OH)2 — слабое основание, нерастворимое в воде, Ca(OH)2 — сильное, но малорастворимое в воде основание, Sr(OH)2 — лучше растворимо в воде, чем гидроксид кальция, сильное основание (щёлочь) при высоких температурах, близких к точке кипения воды (100 °C), Ba(OH)2 — сильное основание (щёлочь), по силе не уступающее KOH или NaOH, и Ra(OH)2 — одна из сильнейших щелочей, очень коррозионное вещество.
Нахождение в природе
Все щёлочноземельные металлы имеются (в разных количествах) в природе. Ввиду своей высокой химической активности все они в свободном состоянии не встречаются. Самым распространённым щёлочноземельным металлом является кальций, количество которого равно 3,38 % (от массы земной коры). Немногим ему уступает магний, количество которого равно 2,35 % (от массы земной коры). Распространены в природе также барий и стронций, которых соответственно 0,05 и 0,034 % от массы земной коры. Бериллий является редким элементом, количество которого составляет 6·10 −4 % от массы земной коры. Что касается радия, который радиоактивен, то это самый редкий из всех щёлочноземельных металлов, но он в небольшом количестве всегда содержится в урановых рудах. В частности, он может быть выделен оттуда химическим путём. Его содержание равно 1·10 −10 % (от массы земной коры) [4] .
Читайте также:
