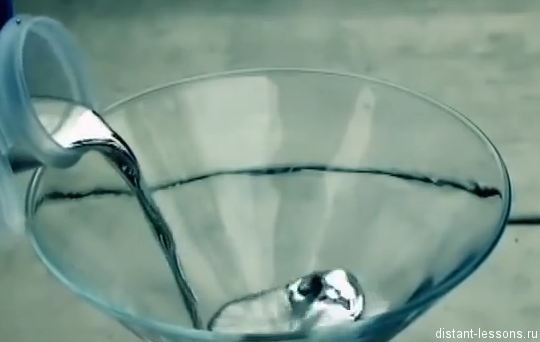Какой металл при комнатной температуре представляет собой серебристо белую жидкость

Ртуть — минерал, природная металлическая ртуть. Переходный металл, при комнатной температуре представляющий собой тяжёлую серебристо-белую жидкость, пары которой чрезвычайно ядовиты. Ртуть — один из двух химических элементов (и единственный металл), простые вещества которых при нормальных условиях находятся в жидком агрегатном состоянии (второй такой элемент — бром). Иногда содержит примесь серебра и золота.
Смотрите так же:
СТРУКТУРА
Сингония тригональная, гексагонально-скаленоэдрическая (ниже -39°С).
СВОЙСТВА

Цвет оловянно-белый. Блеск сильный металлический. Температура кипения 357 °C. Единственный жидкий минерал при обычной температуре. Затвердевает, приобретая кристаллическое состояние при −38°С. Плотность 13,55. На огне легко испаряется с образованием ядовитых паров. В древности вдыхание этих паров было единственным доступным средством лечения сифилиса (по принципу: если больной не умрёт, то поправится. Является диамагнетиком.
ЗАПАСЫ И ДОБЫЧА

Ртуть — относительно редкий элемент в земной коре со средней концентрацией 83 мг/т. Однако ввиду того, что ртуть слабо связывается химически с наиболее распространёнными в земной коре элементами, ртутные руды могут быть очень концентрированными по сравнению с обычными породами. Наиболее богатые ртутью руды содержат до 2,5 % ртути. Основная форма нахождения ртути в природе — рассеянная, и только 0,02 % её заключено в месторождениях. Содержание ртути в различных типах изверженных пород близки между собой (около 100 мг/т). Из осадочных пород максимальные концентрации ртути установлены в глинистых сланцах (до 200 мг/т). В водах Мирового океана содержание ртути — 0,1 мкг/л. Важнейшей геохимической особенностью ртути является то, что среди других халькофильных элементов она обладает самым высоким потенциалом ионизации. Это определяет такие свойства ртути, как способность восстанавливаться до атомарной формы (самородной ртути), значительную химическую стойкость к кислороду и кислотам.
Одно из крупнейших в мире ртутных месторождений находится в Испании (Альмаден). Известны месторождения ртути на Кавказе (Дагестан, Армения), в Таджикистане, Словении, Киргизии (Хайдаркан — Айдаркен) Украине (Горловка, Никитовский ртутный комбинат).
В России находятся 23 месторождения ртути, промышленные запасы составляют 15,6 тыс. тонн (на 2002 год), из них крупнейшие разведаны на Чукотке — Западно-Палянское и Тамватнейское.
Ртуть получают обжигом киновари (сульфида ртути(II)) или металлотермическим методом. Пары ртути конденсируют и собирают. Этот способ применяли ещё алхимики древности.
ПРОИСХОЖДЕНИЕ

Ртуть присутствует в большинстве сульфидных минералов. Особенно высокие её содержания (до тысячных и сотых долей процента) устанавливаются в блёклых рудах, антимонитах, сфалеритах и реальгарах. Близость ионных радиусов двухвалентной ртути и кальция, одновалентной ртути и бария определяет их изоморфизм во флюоритах и баритах. В киновари и метациннабарите сера иногда замещается селеном или теллуром; содержание селена часто составляет сотые и десятые доли процента. Известны крайне редкие селениды ртути — тиманит (HgSe) и онофрит (смесь тиманита и сфалерита).
ПРИМЕНЕНИЕ

Ртуть используется как рабочее тело в ртутных термометрах (особенно высокоточных), так как обладает довольно широким диапазоном, в котором находится в жидком состоянии, её коэффициент термического расширения почти не зависит от температуры и обладает сравнительно малой теплоёмкостью. Сплав ртути с таллием используется для низкотемпературных термометров.
Парами ртути заполняют люминесцентные лампы, поскольку пары светятся в тлеющем разряде. В спектре испускания паров ртути много ультрафиолетового света и, чтобы преобразовать его в видимый, стекло люминесцентных ламп изнутри покрывают люминофором. Без люминофора ртутные лампы являются источником жёсткого ультрафиолета (254 нм), в каковом качестве и используются. Такие лампы делают из кварцевого стекла, пропускающего ультрафиолет, поэтому они называются кварцевыми.
Ртуть и сплавы на её основе используются в герметичных выключателях, включающихся при определённом положении.
Ртуть используется в датчиках положения.
Иодид ртути(I) используется как полупроводниковый детектор радиоактивного излучения.
Фульминат ртути(II) («гремучая ртуть») издавна применяется в качестве инициирующего ВВ (Детонаторы).
Бромид ртути(I) применяется при термохимическом разложении воды на водород и кислород (атомно-водородная энергетика).
Перспективно использование ртути в сплавах с цезием в качестве высокоэффективного рабочего тела в ионных двигателях.
До середины 20 века ртуть широко применялась в барометрах, манометрах и сфигмоманометрах (отсюда традиция измерять давление в миллиметрах ртутного столба).
Соединения ртути использовались в шляпном производстве для выделки фетра.
Какой металл при комнатной температуре представляет собой серебристо белую жидкость

Ртуть – единственный в природе металл, который при комнатной температуре представляет собой тяжелую серебристо-белую жидкость. Ее пары чрезвычайно ядовиты. Сама по себе металлическая ртуть менее опасна, однако она постепенно испаряется даже при комнатной температуре. Ртуть и ее соединения применяются во многих отраслях народного хозяйства: технике, химической и фармацевтической промышленности, в медицинской практике.

Существует несколько форм ртути, различающихся по степени токсичности:
- Природная ртуть – элементарная, металлическая.
- Неорганические соединения ртути, например, ее хлорид (сулема) или сульфид (киноварь).
- Органическая ртуть – метилртуть и этилртуть.
В быту ртуть используется в термометрах («градусниках»). Высокотоксичные соединения ртути используют для протравливания семенного зерна и в качестве пестицидов. Парами ртути заполняют люминесцентные лампы, поскольку такие пары светятся в тлеющем разряде. В спектре испускания паров ртути много ультрафиолетового излучения и для преобразования его в видимый спектр, стекло ламп изнутри покрывают люминофором. Без люминофора ртутные лампы являются источником жёсткого ультрафиолетового излучения и используются для обеззараживания помещений (такие лампы делают из кварцевого стекла, пропускающего ультрафиолет, поэтому они называются кварцевыми). В некоторых домах можно найти предметы старины, покрытые ртутной амальгаммой – позолоченные шкатулки, зеркала, статуэтки. В прошлом соединения ртути использовались в шляпном производстве для выделки фетра.

В природе ртуть содержится в земной коре. В настоящее время примерно половина всех выбросов ртути в атмосферу обеспечивается природными источниками: вулканами и пожарами. Остальные источники — последствия деятельности человека:
Попав в окружающую среду, элементарная ртуть естественным образом трансформируется в метилртуть , которая накапливается в рыбе и моллюсках. Важно отличать МЕТИЛртуть от ЭТИЛртути. Этилртуть входит в состав тиомерсала (мертиолята ртути) - это консервант, используемый для предотвращения роста бактерий и грибков в многодозовых флаконах некоторых вакцин. Этилртуть НЕ представляет угрозы для здоровья и не вызывает аутизм у детей, как это часто утверждают противники прививок.
Ртуть оказывает токсическое действие на нервную, пищеварительную и иммунную системы, а также на легкие, почки, кожу и глаза. При вдыхании воздуха, содержащего пары ртути, она задерживается и накапливается в лёгких. В случае более высоких концентраций ртуть всасывается даже неповрежденной кожей. Особенно негативно ее действие на внутриутробное развитие плода и здоровье детей. По оценкам ВОЗ, среди населения, живущих рыбной ловлей, от 1,5 до 17 детей на каждую тысячу человек страдают от хронического отравления, вызываемого употреблением рыбы, содержащей ртуть.
Факторы , определяющие степень тяжести воздействия ртути:
- тип ртути;
- доза;
- возраст;
- длительность воздействия;
- пути поступления (дыхание, проглатывание или накожно).
Люди подвергаются воздействию ртути в любой ее форме и при многих обстоятельствах. Но основным путем поступления является употребление в пищу загрязненных рыбы и моллюсков и вдыхание элементарной ртути на вредном производстве.
Тепловая обработка пищевых продуктов не уничтожает и не обезвреживает ртуть!

Симптомы острого отравления ртутью проявляются уже через несколько часов:
- общая слабость,
- отсутствие аппетита,
- головная боль,
- боль при глотании,
- металлический вкус во рту,
- слюнотечение,
- набухание и кровоточивость десен,
- тошнота и рвота.
При острых отравлениях ртутью необходимо сразу вызвать медицинскую помощь! До прибытия врачей пострадавшему необходимо несколько раз промыть желудок водой (или по крайне мере вызвать рвоту) и дать активированный уголь (1 таблетка на 10 кг массы тела). После этого пострадавшего надо уложить в хорошо проветриваемом помещении и обеспечить ему полный покой.

Хроническое отравление ртутью в течение нескольких месяцев или лет называют Меркуриализмом (от имени греческого бога Меркурия). Его проявления во многом зависят от общего состояния организма и состояния нервной системы. Симптомы: повышенная утомляемость, сонливость, общая слабость, головные боли, головокружение, апатия, ослабление памяти и самоконтроля, снижение внимания и умственных способностей, а также эмоциональная неустойчивость — неуверенность в себе, застенчивость, общая подавленность, раздражительность.
Постепенно усиливается дрожание пальцев рук и ног при волнении — «ртутный тремор», частые позывы к мочеиспусканию, снижение обоняния, потеря кожной чувствительности, вкуса. Усиливается потливость, увеличивается щитовидная железа, возникают нарушения ритма сердечной деятельности, падает кровяное давление.

При проявлении подобных симптомов следует немедленно обратиться к врачу!
В 2014 году Российская Федерация подписала Минаматскую конвенцию о ртути (Minamata Convention on Mercury) — межгосударственный договор, направленный на защиту здоровья людей и окружающей среды от антропогенных выбросов и высвобождений ртути и её соединений. Согласно этой конвенции будет регулироваться использование ртути, сокращаться производство некоторых ртутьсодержащих приборов (медицинских, люминесцентных ламп). Также ограничивается ряд промышленных процессов и отраслей, в том числе горнодобывающая (особенно непромышленная добыча золота), производство цемента. А с 2020 года будет запрещено производство, экспорт и импорт нескольких видов ртутьсодержащей продукции. Например, электрических батарей, электрических выключателей и реле, некоторых видов компактных люминесцентных ламп, люминесцентных ламп с холодным катодом или с внешним электродом, ртутных термометров.
Как снизить риск вредного воздействия ртути?
- Во-первых, выбирая рыбу и моллюсков, удостовериться в качестве и безопасности этой продукции, что можно сделать, попросив продавца показать соответствующие документы.
- Во-вторых, использовать для рыбалки и отдыха экологически чистые водоемы.
- Быть осторожными при использовании бытовых приборов, содержащих ртуть – ртутных термометров, люминесцентных ламп. Такие приборы нельзя выбрасывать вместе с другими бытовыми отходами в мусорное ведро, а утилизировать при помощи специализированных служб.
- Работникам, занятым в опасных условиях труда с вредными выбросами ртути, следует регулярно проходить периодические медицинские осмотры.
Чем опасна ртуть и где она применяется
С детства нам твердят, что ртуть опасна, но при этом многие семьи до сих пор пользуются ртутными градусниками. В Европе их запретили из-за опасности для человека, но именно там ее добывают больше всего. Наравне с энергией атома именно ртуть является тем, опасность чего все понимают, но никак не могут от нее отказаться. Вот такая она противоречивая, но благодаря ее свойствам она до сих пор применяется в огромном количестве отраслей медицины и промышленности. Если вам интересно узнать, как ее получают, где применяют и чем она грозит человеку, кроме привычного ”очень опасно”, то вы зашли по адресу.

Ртуть красива, но опасна.
Что такое ртуть
Давайте сначала разберемся с тем, что вообще представляет из себя ртуть. На латыни ее название звучит, как Hydrargyrum. Она является элементом шестого периода периодической системы элементов, которую подарил нам Д. Менделеев. Атомный номер ртути в таблице — 80, а относится она к подгруппе цинка.
Ртуть не является газом, жидкостью или металлом — она является переходным металлом. При комнатной температуре она представляет собой тяжелую жидкость серебристо-белого цвета. Самой главной особенностью для простого человека является чрезвычайная опасность паров ртути, которые очень ядовиты.
Есть всего два химических элемента, которые при нормальных условиях находятся в жидком состоянии. Ртуть является одним из них наряду с бромом.
В чем опасность ртути
Несмотря на то, что ртуть выглядит как что-то целостное, она выделяет очень много паров, которые при попадании в организм приводят не только к поражению легких, но и к другим часто необратимым изменениям. Особенно опасна она на стадии внутриутробного развития.
При попадании в организм ртуть оказывает токсичное воздействие на пищеварительную, иммунную и нервную системы. Кроме этого, поражаются кожа, почки, легкие и даже глаза. Не зря же Всемирная организация здравоохранения (ВОЗ) относит ртуть к десятку основных веществ, которые представляют наибольшую угрозу для общественного здравоохранения.

Так лучше не делать.
Наиболее опасна ртуть в виде паров или раствора. При попадании в воду она приводит к гибели микроорганизмов и остается в ней навсегда в виде того самого раствора. В итоге, она может попасть в систему водоснабжения и нанести вред целому населенному пункту. Тем более, что для воздействия на человека достаточно даже минимального количества ртути.
Также разделяют два типа ртутных соединений — органические и неорганические. Первые (например, диметилртуть) являются намного более опасными, так как более эффективно взаимодействуют с системами организма.
Сколько таблиц химических элементов существует на самом деле?
Как добывают ртуть
Получение ртути производится промышленным способом. Для ее добычи приходится обрабатывать минерал под названием киноварь или красный камень. Извлечение металла производится путем окислительно-дистилляционного обжига. В результате образуются пары ртути. Они имеют высокую температуру и должны подвергнуться дополнительной обработке. Эти пары конденсируются и очищаются, давая на выходе привычную ртуть.
Крупные залежи ртути в настоящее время находятся в Испании и Словении.
Очень редко, но ртуть все же можно найти в виде месторождений в жидком виде. Впрочем, на современном уровне технологий это не так важно. В старые времена найти ртуть именно в ”готовом” виде действительно было важно.
Применение ртути в медицине
Продолжая тему опасности ртути, стоит отметить, что раньше люди об этом не знали и наоборот лечились ей в чистом виде. Вплоть до 60-х годов прошлого века люди не думали о возможных проблемах. Они ставили зубные пломбы, в которых были соединения ртути, принимали лекарства, в составе которых она была, и совершенно не переживали по поводу разбитого градусника. Более того, многие дети тогда специально разбивали градусники, чтобы играть с ртутью. Она интересно переливается, и если не знать о ее опасности, то все нормально. Скажете, что это так себе развлечение? Тогда вспомните, как все поголовно крутили спиннеры.

Они перетекают и сливаются, но еще и отравляют воздух.
Если взять более давние времена, то в средние века было нормой дать человеку выпить стакан ртути. Считалось, что тяжелая жидкость протолкнет все лишнее в организме, а заодно расправит кишки. Чем заканчивалось такое лечение, история умалчивает, но вряд ли пациенты жили долго и счастливо.
Вплоть до 1967 года в СССР и до конца 1970-х годов в США ртуть активно применялась для лечения сифилиса из-за его высокой устойчивости к другим препаратам. Правда, после такого ”лечения” у людей выпадали волосы и нарушались другие функции организма.
Можно сколько угодно приводить примеры антисептиков, диуретиков, слабительного и других препаратов, в состав которых входила ртуть. Сейчас она осталась только в градусниках (не во всех странах) и в качестве консерванта для некоторых вакцин, но в минимальных дозах.
Что делать, если разбил градусник
Если вы разлили небольшое количество ртути (разбитый градусник), первым делом выведите из помещения людей и животных, затем откройте окно и закройте дверь. Так же надо обязательно защитить органы дыхания маской или повязкой. После этого немедленно начинайте собирать ртуть.

Это выглядит очень безобидно, но расслабляться не стоит.
Два грамма ртути, которые содержаться в одном градуснике, в закрытом помещении объемом 20 кубических метров создают концентрацию паров, которая в тысячи раз превышает безопасный для человека уровень.
Как собрать ртуть
При сборе ртути ни в коем случае не сметайте ее веником, чтобы не спровоцировать образование мелкой ртутной пыли. Чем крупнее будут капли — тем лучше. Пылесос тоже плохой помощник, так как испарившаяся ртуть пройдет через фильтры и окажется в воздухе в еще более опасном виде.
Небольшое количество вытекшей из градусника ртути можно собрать с помощью обычной медицинской груши или листа бумаги и вязальной спицы или толстой иглы. Для сбора самых мелких капель можно использовать кусочки пластыря.
Все, что вы собрали и чем вы это собирали, положите в банку и плотно закройте крышкой. После этого тщательно вымойте место происшествия. Хорошим вариантом будет протереть это место раствором марганца или мыльно-содовым раствором. По окончании уборки обязательно тщательно вымойте руки с мылом.

Тщательно мойте руки после уборки ртути.
Как выкинуть разбитый градусник и ртуть из него
Ни в коем случае не выбрасывайте собранную ртуть в мусоропровод или канализацию. Это может привести к дальнейшему риску бесконтрольного заражения. Поставьте банку с собранными отходами на балкон или в гараж и при первой возможности передайте ее в демеркуризационный центр для утилизации.
Как понять, что отравился ртутью
Крем для кожи может стать причиной отравления. Как этого избежать?
Какой градусник точнее? Электронный или ртутный?
Специалистам часто приходится отвечать на этот вопрос. Обычно они говорят, что точнее будет именно ртутный градусник, но дома надо иметь и электронный. Объясняют они это тем, что оба прибора могут иметь погрешности и их показания надо перепроверять.

При обычных условиях ртуть всегда жидкая.
Погрешность ртутного градусника составляет примерно 0,1 градуса. Для электронного отклонения, как правило, находятся в диапазоне от 0,2 до 0,4 градуса. Самая большая погрешность у бесконтактных градусников — до 0,5 градуса. Если датчик бесконтактного градусника не протереть, то отклонения могут и вовсе составить 1,5-2 градуса.
Надо помнить, что особенностью ртутного градусника является то, что он показывает максимальную за время измерения температуру, в то время, как электронный обычно дает средние показания, а бесконтактный и вовсе сиюминутные. Температура тела может за 5 минут меняться в пределах одного градуса. Это тоже надо иметь в виду.
Применение бесконтактного термометра наиболее целесообразно для измерения температуры посетителей общественных мест или пассажиров самолетов, а также детей. В этих случаях не получится задержать человека на 5 минут для более точного измерения температуры
Ртуть в промышленности
В промышленности ртуть применяется куда чаще, чем в медицине. В том числе нашла она применение и в высокоточных термометрах благодаря широкому диапазону рабочих температур (тех, при которых она остается в жидком состоянии).

Ртуть надо не только производить, но и утилизировать.
Парами ртути до сих пор заполняются люминесцентные лампы. Ее пары светятся в тлеющем разряде, а в спектре испускания много ультрафиолетового света. Чтобы свет стал видимым, изнутри лампу покрывают люминофором. Без такого покрытия лампа будет источником жесткого ультрафилетового излучения. В таком виде их используют для обеззараживания поверхностей и помещений. Например, в вагонах метро (в депо) или при обработке поручней эскалатора, когда они находятся внизу.
Так ультрафиолетом обрабатывают вагоны метро.
Алхимики прошлого верили, что ртуть является основой любого вещества, и если вернуть ей твердое состояние при помощи серы или мышьяка, то она станет золотом, но у них естественно ничего не получилось
Ртуть применяется в некоторых частях электросхем с высокой средней силой тока (сотни ампер), в датчиках положения, в некоторых химических источниках тока, в полупроводниковых детекторах радиоактивного излучения и даже в качестве рабочего тела некоторых гидродинамических подшипников, работающих под большой нагрузкой.
Раньше ртуть также применялась при производстве краски, покрывающей подводную часть кораблей, чтобы избежать ее обрастания. До середины XX века ртуть активно применялась в манометрах, барометрах и других погодных приборах. Отсюда и пошла традиция измерять давление в миллиметрах ртутного столба.
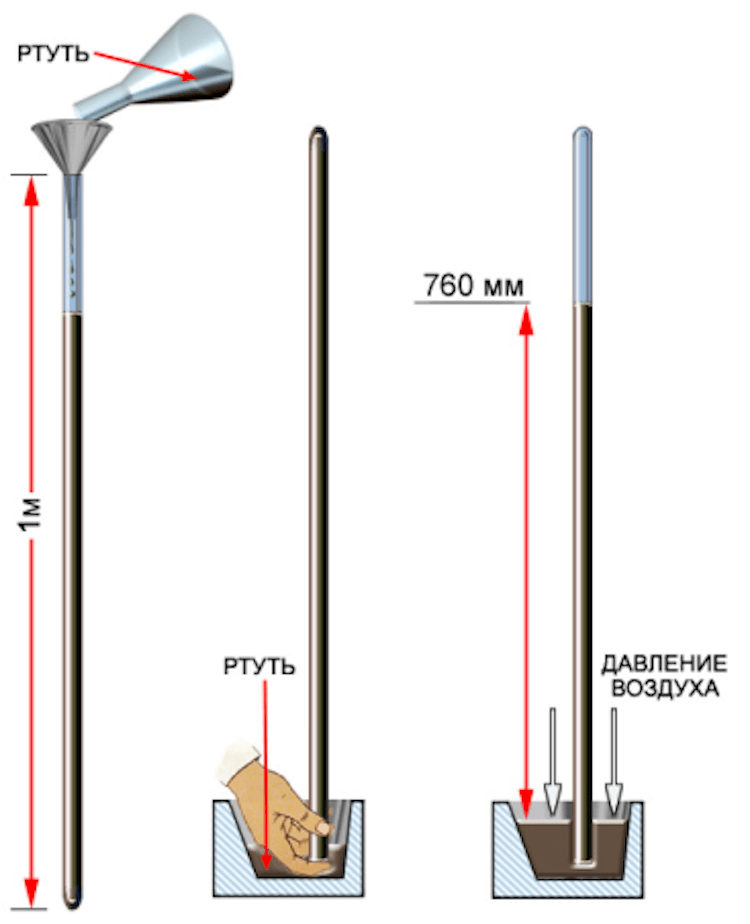
Принцип работы ртутного столба.
Нашла ртуть свое применение и в модной индустрии. Например, раньше ее использовали в шляпном производстве для выделки фетра и для амальгамирования поверхностей при производстве зеркал.
Сейчас ртути стараются находить аналоги, чтобы снизить зависимость от этого опасного элемента, но пока до конца это сделать не получилось. Нам же остается только относиться к ней с осторожностью и не пренебрегать нормами безопасности.
Ртуть

Ртуть (Hg, от лат. Hydrargyrum ) — элемент шестого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 80, относящийся к подгруппе цинка (побочной подгруппе II группы). Простое вещество ртуть — переходный металл, при комнатной температуре представляющий собой тяжёлую серебристо-белую жидкость, пары которой чрезвычайно ядовиты, контаминант. Ртуть — один из двух химических элементов (и единственный металл), простые вещества которых при нормальных условиях находятся в жидком агрегатном состоянии (второй такой элемент — бром). Название на английском - Mercury.

Тяжёлый жидкий металл серебристо-белого цвета
Содержание
- 1 История
- 1.1 Происхождение названия
- 2.1 Месторождения
- 7.1 Характерные степени окисления
- 7.2 Свойства металлической ртути
- 8.1 Медицина
- 8.2 Техника
- 8.3 Металлургия
- 8.4 Химическая промышленность
- 8.5 Сельское хозяйство
- 9.1 Гигиеническое нормирование концентраций ртути
- 9.2 Демеркуризация
- 9.3 Запрет использования содержащей ртуть продукции
История
![символ ртути]()
Ртуть известна с древних времён. Нередко её находили в самородном виде (жидкие капли на горных породах), но чаще получали обжигом природной киновари. Древние греки и римляне использовали ртуть для очистки золота (амальгамирование), знали о токсичности самой ртути и её соединений, в частности сулемы. Много веков алхимики считали ртуть главной составной частью всех металлов и полагали, что если жидкой ртути возвратить твёрдость при помощи серы или мышьяка, то получится золото. Выделение ртути в чистом виде было описано шведским химиком Георгом Брандтом в 1735 году. Для представления элемента как у алхимиков, так и в настоящее время используется символ планеты Меркурий. Но принадлежность ртути к металлам была доказана только трудами Ломоносова и Брауна, которые в декабре 1759 года смогли заморозить ртуть и установить её металлические свойства в твёрдом состоянии: ковкость, электропроводность и др.
Происхождение названия
Русское название ртути происходит от праслав. *rьtǫtь , связанного с лит. rìsti «катиться». Символ Hg заимствован от латинского алхимического названия этого элемента hydrargyrum (от др.-греч. ὕδωρ «вода» и ἄργυρος «серебро»).
Нахождение в природе
Ртуть присутствует в большинстве сульфидных минералов. Особенно высокие её содержания (до тысячных и сотых долей процента) устанавливаются в блёклых рудах, антимонитах, сфалеритах и реальгарах. Близость ионных радиусов двухвалентной ртути и кальция, одновалентной ртути и бария определяет их изоморфизм во флюоритах и баритах. В киновари и метациннабарите сера иногда замещается селеном или теллуром; содержание селена часто составляет сотые и десятые доли процента. Известны крайне редкие селениды ртути — тиманит (HgSe) и онофрит (смесь тиманита и сфалерита).
Ртуть является одним из наиболее чувствительных индикаторов скрытого оруденения не только ртутных, но и различных сульфидных месторождений, поэтому ореолы ртути обычно выявляются над всеми скрытыми сульфидными залежами и вдоль дорудных разрывных нарушений. Эта особенность, а также незначительное содержание ртути в породах, объясняются высокой упругостью паров ртути, возрастающей с увеличением температуры и определяющей высокую миграцию этого элемента в газовой фазе.
В обычных условиях киноварь и металлическая ртуть не растворимы в воде, но в присутствии некоторых веществ (Fe2(SO4)3, озон, пероксид водорода) растворимость в воде этих минералов достигает десятков мг/л. Особенно хорошо растворяется ртуть в сульфидах щелочных металлов с образованием, например, комплекса HgS•nNa2S. Ртуть легко сорбируется глинами, гидроксидами железа и марганца, глинистыми сланцами и углями.
В природе известно около 20 минералов ртути, но главное промышленное значение имеет киноварь HgS (86,2 % Hg). В редких случаях предметом добычи является самородная ртуть, метациннабарит HgS и блёклая руда — шватцит (до 17 % Hg). На единственном месторождении Гуитцуко (Мексика) главным рудным минералом является ливингстонит HgSb4S7. В зоне окисления ртутных месторождений образуются вторичные минералы ртути. К ним относятся, прежде всего, самородная ртуть, реже метациннабарит, отличающиеся от таких же первичных минералов большей чистотой состава. Относительно распространена каломель Hg2Cl2. На месторождении Терлингуа (Техас) распространены и другие гипергенные галоидные соединения — терлингуаит Hg2ClO, эглестонит Hg4Cl.
Месторождения
Ртуть считается редким металлом.
Одно из крупнейших в мире ртутных месторождений находится в Испании (Альмаден). Известны месторождения ртути на Кавказе (Дагестан, Армения), в Таджикистане, Словении, Киргизии (Хайдаркан — Айдаркен), Донбассе (Горловка, Никитовский ртутный комбинат).
В окружающей среде
![ртуть]()
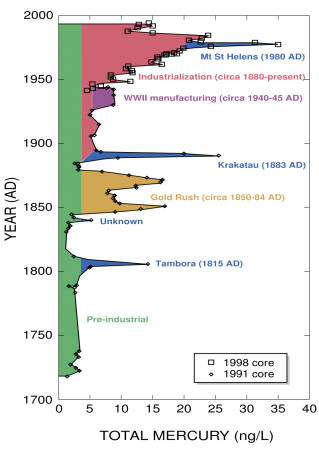
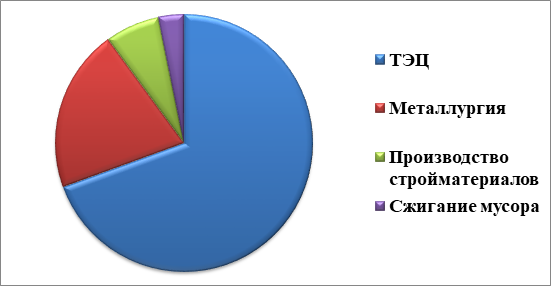
До индустриальной революции осаждение ртути из атмосферы составляло около 4 нанограммов на 1 кубический дециметр льда. Природные источники, такие, как вулканы, составляют примерно половину всех выбросов атмосферной ртути. Причиной появления остальной половины является деятельность человека. В ней основную долю составляют выбросы в результате сгорания угля (главным образом в тепловых электростанциях) — 65 %, добыча золота — 11 %, выплавка цветных металлов — 6,8 %, производство цемента — 6,4 %, утилизация мусора — 3 %, производство соды — 3 %, чугуна и стали — 1,4 %, ртути (в основном для батареек) — 1,1 %, остальное — 2 %.
Одно из тяжелейших загрязнений ртутью в истории случилось в японском городе Минамата в 1956 году, что привело к более чем трём тысячам жертв, которые либо умерли, либо сильно пострадали от болезни Минамата.
Изотопы
Природная ртуть состоит из смеси 7 стабильных изотопов: 196 Hg (распространённость 0,155 %), 198 Hg (10,04 %), 199 Hg (16,94 %), 200 Hg (23,14 %), 201 Hg (13,17 %), 202 Hg (29,74 %), 204 Hg (6,82 %). Искусственным путём получены радиоактивные изотопы ртути с массовыми числами 171—210.
Получение
Ртуть получают обжигом киновари (сульфида ртути II) или металлотермическим методом:
HgS + O2 ⟶ Hg + SO2↑ HgS + Fe ⟶ FeS↓ + Hg
Пары ртути конденсируют и собирают. Этот способ применяли ещё алхимики древности.
На протяжении многих столетий в Европе основным и единственным месторождением ртути был Альмаден в Испании. В Новое время с ним стала конкурировать Идрия во владениях Габсбургов (современная Словения). Там же появилась первая лечебница для поражённых отравлением парами ртути рудокопов. В 2012 г. ЮНЕСКО объявило промышленную инфраструктуру Альмадена и Идрии памятником Всемирного наследия человечества.
В надписях во дворце древнеперсидских царей Ахеменидов (VI—IV века до н. э.) в Сузах упоминается, что ртутную киноварь доставляли сюда с Зеравшанских гор и использовали в качестве краски.
Соединения ртути
Ртуть — элемент побочной подгруппы второй группы шестого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 80. Обозначается символом Hg (лат. Hydrargyrum). Простое вещество ртуть — переходный металл, при комнатной температуре представляет собой тяжёлую серебристо-белую жидкость, пары которой чрезвычайно ядовиты.
Ртуть — один из двух химических элементов (и единственный металл), простые вещества которых при нормальных условиях находятся в жидком агрегатном состоянии![соединения ртути]()
![соединения ртути]()
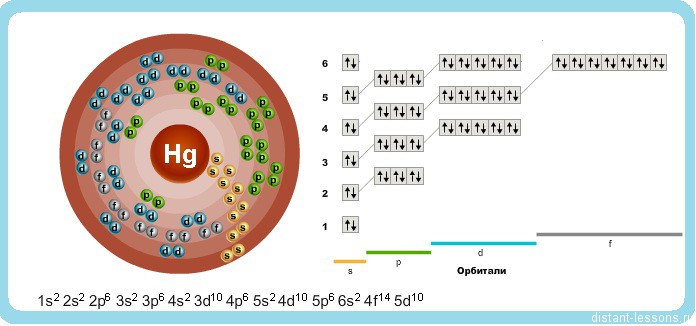
Исходя из электронного строения, можно сделать вывод, что для в соединениях ртуть будет проявлять степени окисления +2 и +1.
Физические свойства ртути:
- при комнатной температуре — сербристо-серая жидкость , легко переходящая в газообразное состояние ;
- электро- и теплопроводна;
- очень высокая плотность вещества;
Как видите, все вышеперечисленные свойства — характеристики металлического вещества, хотя и в жидком состоянии.
Химические свойства ртути:
1) Реакция с кислородом (при нагревании >300 ° С): 2Hg + O2 = 2HgO (красного цвета);
2) реагирует с водородом, но только с атомарным ( так же при нагревании): Hg + 2H = HgH2 — гидрид ртути;
3) C неметаллами ( при нагревании): Hg + S = HgS
4) Взаимодействие с кислотами: с кислотами-не окислителями не взаимодействует
![соединения ртути]()
В ряду активности металлов ртуть стоит после водорода, поэтому в реакциях с кислотами-окислителями водород не выделяется:
Как видно из реакции, чаще всего в соединениях ртуть проявляет степень окисления + 2, но +1 тоже встречается, причем в очень необычном виде:
Степень окисления
Соединения ртути
+1
Оксид — не выделен;
Гидроксид — не выделен
Катион ртути — Hg2 2+ , соответственно, соль — нитрат ртути (I) — Hg2(NO3)2
Кстати, таких соединений ртути (I) немало — смотрите таблицу растворимости:
+2
Что касается соединений ртути (II), то не смотря на то, что простое вещество ртуть — металл, в веществах HgS (черные или красные кристаллы) и HgJ2 (желтые кристаллы) cвязь ковалентная.
Связь ртуть-углерод в органических соединениях ртути самая прочная из всех известных металл-органических связей
Соединения ртути чрезвычайно ядовиты, соответственно, как и большинство других ядов, их часто используют в медицине:
- хлорид ртути (I) (каломель) — слабительное;
- меркузал и промеран — сильные мочегонные;
- хлорид ртути (II), цианид ртути (II), амидохлорид ртути и жёлтый оксид ртути(II) — антисептики (в том числе в составе мазей).
- Амальгаму серебра применяют в стоматологии в качестве материала зубных пломб.
Еще на эту тему:
Ввиду чрезвычайной токсичности современная медицина как лекарства соединения ртути не использует вообще. Перечисленные тутные диуретики сняты в производства в конце 60х годов, ртутные антисептики также более не используются — тем более, что в современных условиях имеется море аналогичных по эффекту, но практически нетоксичных и поэтому безопасных синтетических веществ.
Читайте также: