Какие щелочные металлы легче воды
Щелочными металлами называются химические элементы-металлы \(IA\) группы Периодической системы Д. И. Менделеева: литий \(Li\), натрий \(Na\), калий \(K\), рубидий \(Rb\), цезий \(Cs\) и франций \(Fr\).
Электронное строение атомов. На внешнем энергетическом уровне атомы щелочных металлов имеют один электрон ns 1 . Поэтому для всех металлов группы \(IA\) характерна степень окисления \(+1\).
- увеличение радиуса атомов;
- усиление восстановительных, металлических свойств.
Нахождение в природе. Из щелочных металлов наиболее широко распространены в природе натрий и калий. Но из-за высокой химической активности они встречаются только в виде соединений.
- каменная соль (хлорид натрия \(NaCl\)),
- глауберова соль, или мирабилит — декагидрат сульфата натрия Na 2 SO 4 \(·\) 10 H 2 O ,
- сильвин — хлорид калия \(KCl\),
- сильвинит — двойной хлорид калия-натрия \(KCl\) \(·\)\(NaCl\) и др.
Соединения лития, рубидия и цезия в природе встречаются значительно реже, поэтому их относят к числу редких и рассеянных.
Физические свойства простых веществ. В твёрдом агрегатном состоянии атомы связаны металлической связью. Наличие металлической связи обусловливает общие физические свойства простых веществ-металлов: металлический блеск, ковкость, пластичность, высокую тепло- и электропроводность.
В свободном виде простые вещества, образованные элементами \(IA\) группы — это легкоплавкие металлы серебристо-белого (литий, натрий, калий, рубидий) или золотисто-жёлтого (цезий) цвета, обладающие высокой мягкостью и пластичностью.


Наиболее твёрдым является литий, остальные щелочные металлы легко режутся ножом и могут быть раскатаны в фольгу.
Только у натрия плотность немного больше единицы ρ = 1,01 г / см 3 , у всех остальных металлов плотность меньше единицы.
Химические свойства. Щелочные металлы обладают высокой химической активностью, реагируя с кислородом и другими неметаллами.
Поэтому хранят щелочные металлы под слоем керосина или в запаянных ампулах. Они являются сильными восстановителями.
Взаимодействие натрия с водой протекает с выделением большого количества теплоты (т. е. реакция является экзотермической). Кусочек натрия, попав в воду, начинает быстро двигаться по её поверхности. Под действием выделяющейся теплоты он расплавляется, превращаясь в каплю, которая, взаимодействуя с водой, быстро уменьшается в размерах. Если задержать её, прижав стеклянной палочкой к стенке сосуда, капля воспламенится и сгорит ярко-жёлтым пламенем.
Получение. Металлический натрий в промышленности получают главным образом электролизом расплава хлорида натрия с инертными (графитовыми) электродами.
ТОП-20 самых легких металлов

К легким причисляют металлы, плотность которых колеблется в диапазоне 5-7,5 граммов на кубический сантиметр. Еще один определяющий показатель — атомный вес. Легкие металлы задействованы в фармацевтической, энергетической, автомобильной, авиакосмической и других отраслях промышленности, в металлургии, строительной сфере и медицине. Они составляют 20 % от массы земной коры. ТОП-20 самых легких металлов во вселенной собраны в нашем перечне.
Литий
Это самый легкий металл из существующих в мире. Он выделяется серебристо-белым окрасом, предельно низким атомным весом и плотностью, которая в два раза меньше, нежели у воды. Пластичный литий имеет тридцать минералов, два изотопа природного происхождения. Температура плавления щелочного металла составляет +180,5 градуса Цельсия.
Литий — уникальный элемент, который всплывает на поверхности керосина. Он редко эксплуатируется в чистом виде, поскольку очень активен, легко вступает в реакции с окружающей средой. Это токсичный металл, поэтому в быту не применяется, но подходит для создания пиротехники, используется в роли окислителя, в пищевой промышленности, электронике, при производстве аккумуляторов, смартфонов, электромобилей. Литий в сорок раз меньше весит, чем иридий и осмий. Он был открыт в 1817 году шведским ученым — выделен из природного петалита.

Калий
Вторую строчку в ТОПе занимает калий. Это мягкий щелочной металл. В природе он обнаруживается исключительно в химических соединениях — в морской воде. Калий реактивно окисляется при попадании на воздух. Его открыли в 1807 году — выделили путем электролиза. К свойствам его относятся:
В жидком виде металл применяется для производства теплоносителей. Важнейший биогенный элемент используется при изготовлении удобрений, в гальванотехнике.

Натрий
Это высоко-реактивный металл с бело-серебристым окрасом (относится к категории щелочных). Мягкий натрий без труда режется ножом, блестит на срезе. В природе он содержится в морской воде. На воздухе он легко окисляется до оксида натрия. Этот легкий металл плавится при +97 градусах Цельсия, а кипит — при +882 градусах. Натрий впервые был добыт путем электролиза химиком Хэмфри Дэви в Великобритании.
Этот металл активно эксплуатируется в металлургии, при изготовлении энергоемких аккумуляторов, в создании ядерных реакторов и при анализе органических веществ, в газоразрядных лампах.

Рубидий
Один из самых легких щелочных металлов, с плотностью выше чем у воды. Рубидий имеет серый цвет с белым отливом. Его смогли выделить немецкие химики в 1861 году методом пламенной спектроскопии. Этот металл вступает в химическую реакцию с водой, самовоспламеняется на воздухе, плавится при +39,3 градусах Цельсия.
Рубидий — моноизотопный, радиоактивный элемент. Он занимает 23 ступень по уровню распространенности в земной коре, встречается чаще меди и цинка. Этот металл используется при изготовлении пиротехнической продукции, в ядерной медицине и промышленности. Его эксплуатация важна при производстве паровых турбин, топливных генераторов.

Кальций
Это щелочноземельный металл, легко взаимодействующий с углекислым газом и кислородом. Кальций имеет серую тусклую поверхность со светло-желтым оттенком. Получают его путем электролиза или алюминотермии. Природный калий состоит из трех изотопов. По степени распространенности элементов в земной коре он занимает пятое место. Металлический кальций плавится при +884 градусах Цельсия. Он активно применяется при выплавке стали из-за сходства по свойствам с кислородом. Кальций используется в металлургии, для выделения азота из чистого аргона, при производстве циркония и урана.

Магний
Этот металл с малой атомной массой был получен в 1808 году. Он характеризуется пластичностью, без труда поддается резке, обработке. Магний плавится при +650 градусах, не боится коррозии.
В составе минералов и солей металл обнаруживается в земной коре, морской воде. Залежи природного магния находятся в Таджикистане и Восточной Сибири. Он используется в автомобиле- и самолетостроении, при производстве пиротехники, поскольку обладает высокими горючими свойствами. Магний применяется и при создании вооружения. В порошкообразной форме он применяется в фотографическом мастерстве.

Бериллий
Сероватый цвет, высокая хрупкость и токсичность характеризуют еще один легкий металл. В чистом виде он был получен в 1828 году. Название металл получил от известного минерала — берилла. В природе он встречается в магме, горных породах. Бериллий добывают в Индии, Бурятии, Казахстане.
Этот металл применяется в виде добавок при легировании сплавов. Он почти не поглощает рентгеновское излучение, поэтому применяется при создании детекторов гамма-излучения. Используется бериллий в аэрокосмической промышленности, в акустике, задействован в ядерной энергетике.

Цезий
Один из самых мягких и легких металлов с температурой плавления всего +28,6 градуса Цельсия. При комнатной температуре он находится в полужидком состоянии. Он представляет собой вещество золотистого цвета, отлично отражает свет. Этот металл открыли в 1860 году в Германии, но в чистом виде его получил уже шведский химик и только через 22 года.
Цезий используется как катализатор в органическом и неорганическом синтезе, в инфракрасных аппаратах и очках, при изготовлении светящихся трубок. Он применяется в энергетике и медицинской сфере. Кстати, на основе цезия создают твердые электролиты для автомобильного топлива.

Стронций
Месторождения стронциевых руд разрабатываются в Тульской области и в Дагестане. Стронций эксплуатируется в металлургии, пищевой и радиоэлектронной промышленности.

Алюминий
Один из самых распространенных металлов, который был открыт в 1825 году. До запуска масштабного производства алюминий ценился выше золота. Он обладает незначительными парамагнитными свойствами, проводит электрический ток и тепло. Алюминий подвергается механическому воздействию, но не коррозийному. Сплавы на его основе могут похвастаться пластичностью. Этот металл занимает третье место по степени распространенности в земной коре, плавится при +660 градусах.
Алюминий находит применение в черной металлургии, при производстве пиротехники, посуды, столовых приборов, в авиационной промышленности.

Барий
Это щелочноземельный металл, который быстро окисляется на воздухе, реагирует с водой, воспламеняется даже при слабом нагревании. Он активно взаимодействует с разбавленными кислотами. К другим свойствам бария относятся:
Серебристо-белый металл применяется в ядерно-энергетической отрасли, пиротехнике, оптике. В чистом виде барий получили в 1774-ом.

Титан
Металл насыщенного серебристого окраса был открыт в конце восемнадцатого века немецким химиком — выделен из минерала рутила. Образец металлического титана получили лишь в 1825 году. Он характеризуется высокой удельной прочностью и устойчивостью к коррозии. По концентрации титановых руд Россия находится на второй позиции в мире после Китая. К свойствам металла относятся:
- пластичность;
- хорошая ударная вязкость;
- температура плавления, которая составляет +1670 градусов Цельсия.
Титан используется в авиа-, кораблестроении, при производстве трубопроводов, в химической, автомобильной промышленности, при создании вооружения.

Германий
Хрупкий металл стального цвета с четко выраженным блеском. Это твердосплавный элемент, который плавится при +938 градусах Цельсия, кипит при +2850 градусах, является полупроводником. Германий был выделен в 1886 году немецким химиком Клеменсом Винклером. Это аномальное вещество, плотность которого увеличивается при плавлении.
Главные сферы применения германия — волоконная и тепловизорная оптика, электроника, химическая промышленность (в качестве катализаторов).

Галлий
Это мягкий, хрупкий металл стального цвета с синеватым оттенком. Он выделен в 1875 году французским химиком. Галлий плавится при +29,7 градусах Цельсия. Это один из наиболее дорогих металлов, свыше 97 % которого уходит на производство полупроводников. Галлий активно используется в медицине — в онкологии, в качестве антисептика.

Теллур
Хрупкий белый металл с блеском, применяется при производстве свинцовых сплавов. На просвет он выглядит красно-коричневым. Редкое, слегка токсичное вещество было обнаружено в Трансильвании в конце восемнадцатого века. Но выделить его в чистом виде удалось только через 17 лет. При нагревании металл становится пластичным. Он плавится при +448,8 градусах Цельсия.
Теллур широко применяется при создании полупроводников, в процессе вулканизации каучука. Металл используют при изготовлении ламп, специальных марок халькогенидных стекол.

Ванадий
Это пластичный металл средней твердости сине-стального цвета. Ванадий — хороший полупроводник. Он обладает высокими показателями теплоизоляции, отличается:
- податливостью;
- прочностью (тверже большинства сплавов).
Это редкий тугоплавкий элемент, который был открыт в 1801 году мексиканским профессором минералогии. Но сам ученый назвал его хроматом свинца. В чистом виде из железной руды ванадий был получен только в 1830 году шведским химиком. Этот металл плавится при +1887 градусах Цельсия. Он применяется как легирующая добавка для сталей, для изготовления электроники, сувенирной продукции, в металлургии, автомобильной промышленности, при производстве буровых установок.

Цирконий
Этот металл обладает высокой коррозийной стойкостью. Он встречается в природе в виде четырех стабильных изотопов. Серо-белый блестящий переходный металл отличается химической стойкостью. Он плавится при +1852 градусах Цельсия. Температура плавления составляет 4377 градусов. Цирконий встречается в 140 минералах, но не в самородном виде.
Металл был открыт в 1789 году, а в чистом виде — получен по истечении 35 лет после этого. Цирконий широко используется в авиационной, космической промышленности и медицине.

Это металл, который становится пластичным при 150 градусах Цельсия, а при 210 градусах — может деформироваться. Температура плавления — низкая. Она составляет 418 градусов. Металл характеризуется:
- высокой электропроводностью;
- химической активностью — сплавляется с щелочами, подвергается воздействию серной кислоты.
Цинк имеет голубовато-серый окрас. Он тускнеет на воздухе и покрывается слоем оксида, имеет пять стабильных изотопов. Этот металл был получен в 1746 году в Германии путем прокалки смеси оксида с углем. Цинк применяется при производстве ювелирных украшений (сплавы добавляются в золото), в автомобилестроении, для защиты металлов от коррозии, при изготовлении аккумуляторов и батареек.

Тугоплавкий, твердый металл с характерным блеском, имеет голубовато-белый окрас. Он царапает стекло, в чистом виде характеризуется пластичностью, отлично поддается механической обработке. При наличии азотно-кислородных примесей становится хрупким. Температура плавления — 1856 градусов Цельсия. Хром — составляющий компонент стали, который повышает ее прочность, закаливаемость, жаростойкость. Он был открыт во Франции в 1797 году. Химик Воклен выделил тугоплавкий металл с примесью карбидов. Используется хром в легированных сталях, в качестве эстетических гальванических покрытий. Он относится к токсичным элементам.

Марганец
Этот серебристо-серый металл напоминает железо. Он обладает незначительными парамагнитными свойствами, медленно окисляется и тускнеет на воздухе. Это твердый и хрупкий металл, который был открыт в 1774 году. Марганец имеет температурные показатели плавления и кипения 1246 и 2061 градус Цельсия соответственно.
Марганец используется для раскисления стали при ее выплавке, в металлургии и химической промышленности. Металл является остродефицитным сырьем в России. Известно лишь несколько месторождений (в Кемеровской области, Красноярском крае).
Щелочные металлы
Щелочные металлы — элементы главной подгруппы I группы Периодической системы химических элементов Д. И. Менделеева:
литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr.
Данные металлы получили название щелочных, потому что большинство их соединений растворимо в воде. По-славянски «выщелачивать» означает «растворять», это и определило название данной группы металлов. При растворении щелочных металлов в воде образуются растворимые гидроксиды, называемые щёлочами.
Основная характеристика щелочных металлов: В Периодической системе они следуют сразу за инертными газами, поэтому особенность строения атомов щелочных металлов заключается в том, что они содержат один электрон на новом энергетическом уровне: их электронная конфигурация ns1.
Валентные электроны щелочных металлов могут быть легко удалены, потому что атому энергетически выгодно отдать электрон и приобрести конфигурацию инертного газа.
Поэтому для всех щелочных металлов характерны восстановительные свойства. Это подтверждают низкие значения их потенциалов ионизации (потенциал ионизации атома цезия — один из самых низких) и электроотрицательности (ЭО).
Далее таблица свойств щелочных металлов:
| Атомный номер | Название, символ | Металлический радиус, нм | Ионный радиус, нм | Потенциал ионизации, эВ | ЭО | p, г/см³ | tпл, °C | tкип, °C |
|---|---|---|---|---|---|---|---|---|
| 3 | Литий Li | 0,152 | 0,078 | 5,32 | 0,98 | 0,53 | 181 | 1347 |
| 11 | Натрий Na | 0,190 | 0,098 | 5,14 | 0,93 | 0,97 | 98 | 883 |
| 19 | Калий K | 0,227 | 0,133 | 4,34 | 0,82 | 0,86 | 64 | 774 |
| 37 | Рубидий Rb | 0,248 | 0,149 | 4,18 | 0,82 | 1,53 | 39 | 688 |
| 55 | Цезий Cs | 0,265 | 0,165 | 3,89 | 0,79 | 1,87 | 28 | 678 |
Все металлы этой подгруппы имеют серебристо-белый цвет (кроме серебристо-жёлтого цезия), они очень мягкие, их можно резать скальпелем. Литий, натрий и калий легче воды и плавают на её поверхности, реагируя с ней.
Щелочные металлы встречаются в природе в форме соединений, содержащих однозарядные катионы.
Многие минералы содержат в своём составе металлы главной подгруппы I группы. Например, ортоклаз, или полевой шпат, состоит из алюмюсиликата калия K2[Al2Si6O16], аналогичный минерал, содержащий натрий — альбит — имеет состав Na2[Al2Si6O16]. В морской воде содержится хлорид натрия NaCl, а в почве — соли калия — сильвин KCl, сильвинит NaCl • KCl, карналлит KCl • MgCl2 • 6H2O, полигалит K2SO4 • MgSO4 • CaSO4 • 2H2O.
Химические свойства щелочных металлов
Из-за высокой химической активности щелочных металлов по отношению к воде, кислороду, азоту их хранят под слоем керосина. Чтобы провести реакцию со щелочным металлом, кусочек нужного размера аккуратно отрезают скальпелем под слоем керосина, в атмосфере аргона тщательно очищают поверхность металла от продуктов его взаимодействия с воздухом и только потом помещают образец в реакционный сосуд.
1. Взаимодействие с водой. Важное свойство щелочных металлов — их высокая активность по отношению к воде. Наиболее спокойно (без взрыва) реагирует с водой литий:
При проведении аналогичной реакции натрий горит жёлтым пламенем и происходит небольшой взрыв. Калий ещё более активен: в этом случае взрыв гораздо сильнее, а пламя окрашено в фиолетовый цвет.
2. Взаимодействие с кислородом. Продукты горения щелочных металлов на воздухе имеют разный состав в зависимости от активности металла.
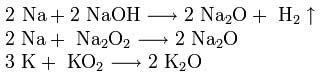
Только литий сгорает на воздухе с образованием оксида стехиометрического состава:
При горении натрия в основном образуется пероксид Na2O2 с небольшой примесью надпероксида NaO2:
В продуктах горения калия, рубидия и цезия содержатся в основном надпероксиды:
Для получения оксидов натрия и калия нагревают смеси гидроксида, пероксида или надпероксида с избытком металла в отсутствие кислорода:
Для кислородных соединений щелочных металлов характерна следующая закономерность: по мере увеличения радиуса катиона щелочного металла возрастает устойчивость кислородных соединений, содержащих пероксид-ион О22-и надпероксид-ион O2-.
Для тяжёлых щелочных металлов характерно образование довольно устойчивых озонидов состава ЭО3. Все кислородные соединения имеют различную окраску, интенсивность которой углубляется в ряду от Li до Cs:
Оксиды щелочных металлов обладают всеми свойствами, присущими основным оксидам: они реагируют с водой, кислотными оксидами и кислотами:
Пероксиды и надпероксиды проявляют свойства сильных окислителей:
Пероксиды и надпероксиды интенсивно взаимодействуют с водой, образуя гидроксиды:
3. Взаимодействие с другими веществами. Щелочные металлы реагируют со многими неметаллами. При нагревании они соединяются с водородом с образованием гидридов, с галогенами, серой, азотом, фосфором, углеродом и кремнием с образованием, соответственно, галогенидов, сульфидов, нитридов, фосфидов, карбидов и силицидов:
При нагревании щелочные металлы способны реагировать с другими металлами, образуя интерметаллиды. Активно (со взрывом) реагируют щелочные металлы с кислотами.
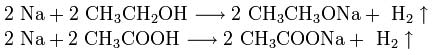
Щелочные металлы растворяются в жидком аммиаке и его производных — аминах и амидах:
При растворении в жидком аммиаке щелочной металл теряет электрон, который сольватируется молекулами аммиака и придаёт раствору голубой цвет. Образующиеся амиды легко разлагаются водой с образованием щёлочи и аммиака:
Щелочные металлы взаимодействуют с органическими веществами спиртами (с образованием алкоголятов) и карбоновыми кислотами (с образованием солей):
4. Качественное определение щелочных металлов. Поскольку потенциалы ионизации щелочных металлов невелики, то при нагревании металла или его соединений в пламени атом ионизируется, окрашивая пламя в определённый цвет:
| Li | Карминно-красный |
| Na | Жёлтый |
| K | Фиолетовый |
| Rb | Беловато-розовый |
| Cs | Фиолетово-красный |
Получение щелочных металлов
1. Для получения щелочных металлов используют в основном электролиз расплавов их галогенидов, чаще всего — хлоридов, образующих природные минералы:
катод: Li+ + e → Li
анод: 2Cl- — 2e → Cl2
2. Иногда для получения щелочных металлов проводят электролиз расплавов их гидроксидов:
катод: Na+ + e → Na
анод: 4OH- — 4e → 2H2O + O2
Поскольку щелочные металлы в электрохимическом ряду напряжений находятся левее водорода, то электролитическое получение их из растворов солей невозможно; в этом случае образуются соответствующие щёлочи и водород.
Соединения щелочных металлов. Гидроксиды
Для получения гидроксидов щелочных металлов в основном используют электролитические методы. Наиболее крупнотоннажным является производство гидроксида натрия электролизом концентрированного водного раствора поваренной соли:
Периодическая система химических элементов Менделеева
Классификация хим. элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона/
198095, г.Санкт-Петербург, ул.Швецова, д.23, лит.Б, пом.7-Н, схема проезда
Читайте также:
