Какие металлы вытесняют водород из воды
Общая характеристика переходных элементов-металлов
К переходным элементам относятся такие, которые расположены в побочных подгруппах больших периодов периодической системы Д.И. Менделеева. К ним принадлежат d– и f–элементы. Название «переходные» связано с тем, что переходные элементы расположены между s– и р–элементами.
Мы рассмотрим три металла: железо, хром и медь.
Железо — металл VIIIB-группы четвёртого периода. Его особенностью, как и особенностью других переходных металлов, является наличие валентных электронов как на внешнем (4s), так и на предвнешнем (3d) подуровнях.
Хром — металл VIB-группы четвёртого периода. Как и железо, это d-элемент, у которого валентные электроны находятся и на внешнем слое и на предвнешнем подуровне. Помимо этого, в атоме хрома в основном состоянии происходит провал электрона.
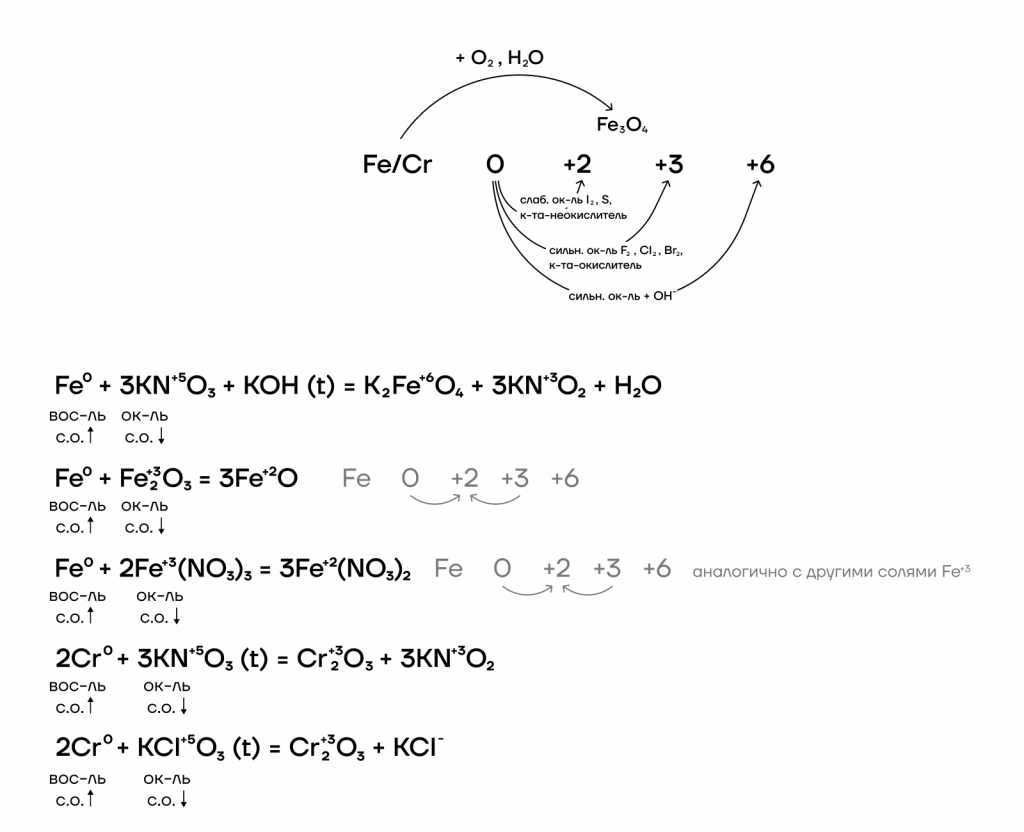
Железо и хром имеют идентичный набор степеней окисления, а также возможных оксидов и гидроксидов: 0, +2, +3, +6.
Медь — металл IB-группы четвёртого периода. Как и в случае других элементов побочных подгрупп, особенностью для неё является наличие валентных электронов как на внешнем (4s), так и на предвнешнем (3d) подуровнях. Как и у хрома, у меди в электронной конфигурации наблюдается провал электрона.
Степени окисления меди следующие:
- низшая степень окисления равна 0, как и у всех металлов;
- высшая равна +2;
- промежуточная равна +1.
Физические свойства
По физическим свойствам железо и хром — совершенно типичные металлы серебристо-белого цвета, которые не растворяются в воде, а на воздухе покрываются прочной оксидной плёнкой.
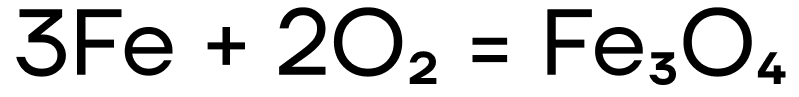
Особенностью железа является его быстрая коррозия (то есть окисление) кислородом во влажном воздухе, а особенностью хрома — высокая твёрдость: он является одним из самых твёрдых металлов.
Медь же — металл красного цвета, один из четырёх металлов, имеющих явную цветовую окраску, которая отлична от серой или серебристой.
Способы получения
Основным способом получения меди, хрома и железа является пирометаллургия, то есть различные реакции, происходящие при высоких температурах.
Химические свойства
- Взаимодействие с простыми веществами
Как и другие металлы, железо и хром способны взаимодействовать со своими противоположностями, неметаллами, с образованием различных бинарных соединений.
При этом неметаллы, являющиеся сильными окислителями, окисляют железо и хром до +3, а неметаллы, являющиеся слабыми окислителями, — только до +2.
Железо и хром не реагируют с водородом и азотом ввиду неактивности последних. При взаимодействии с кислородом железо ржавеет: образуется смесь оксидов железа, то есть железная окалина Fe3O4.
Медь способна также окисляться до разных степеней окисления в зависимости от силы окислителя или его избытка/недостатка.
Железо и хром являются металлами, стоящими в ряду активности до водорода, поэтому они могут вытеснять его из воды с образованием оксидов и вытесненного водорода.
Так как это металлы средней активности (стоящие в промежутке от алюминия до водорода) они реагируют с водой не при нормальных условиях, а при очень высокой температуре.
При взаимодействии с водой железо ржавеет: образуется железная окалина Fe3O4, как и в случае с кислородом.

Медь же находится в ряду активности после водорода, следовательно, она “слабее” водорода и не способна вытеснить такого сильного соперника.
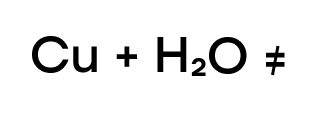
- Реакция с кислотами-неокислителями
Благодаря нахождению железа и хрома до водорода в ряду активности металлов они также способны вытеснять водород из растворов кислот-неокислителей.
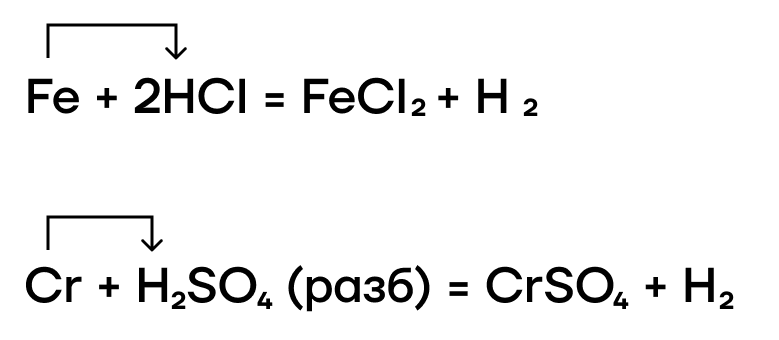
Так же, как и в случае с водой, медь не может вытеснить “качка”-водорода из таких кислот.
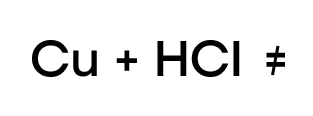
Как и прочие металлы, железо, хром и медь могут вытеснять менее активные металлы из растворов их солей.
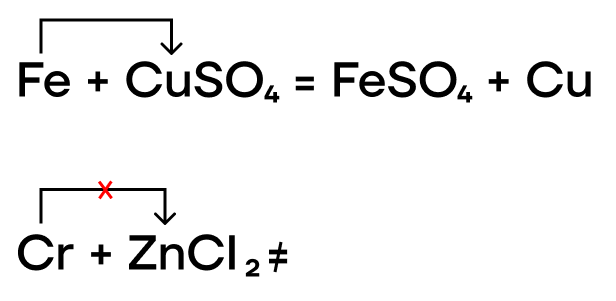
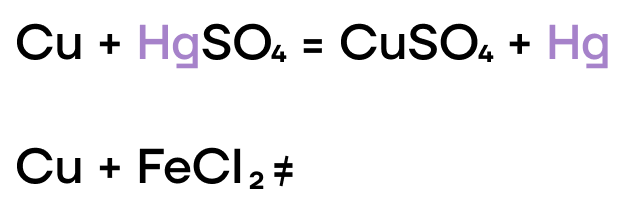
Из-за низких значений электроотрицательности, железо, хром и медь являются типичными восстановителями, а следовательно, способны реагировать с окислителями.
Ниже представлены различные способы повышения степеней окисления железа и хрома и основные реагенты, которые используются.
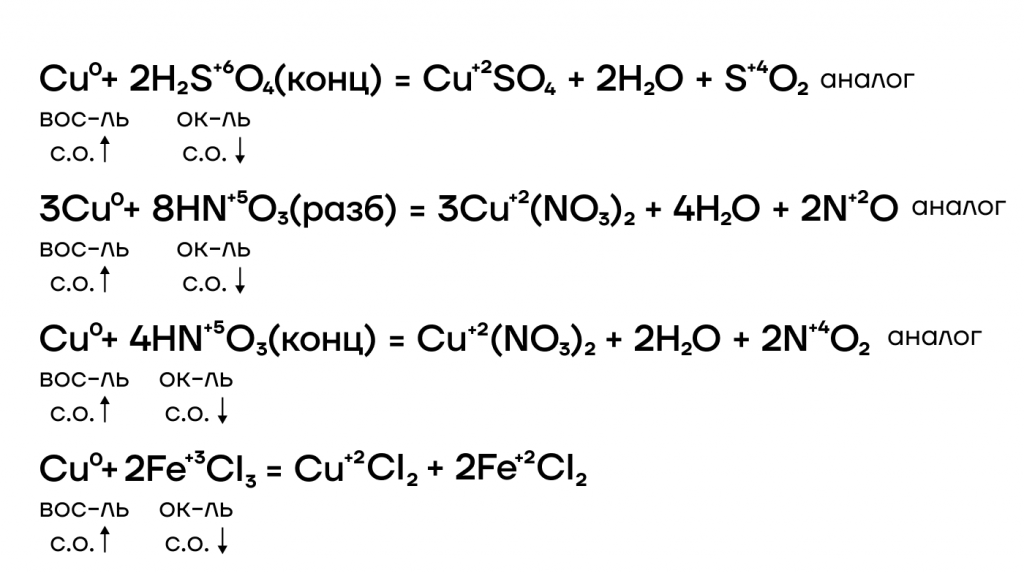
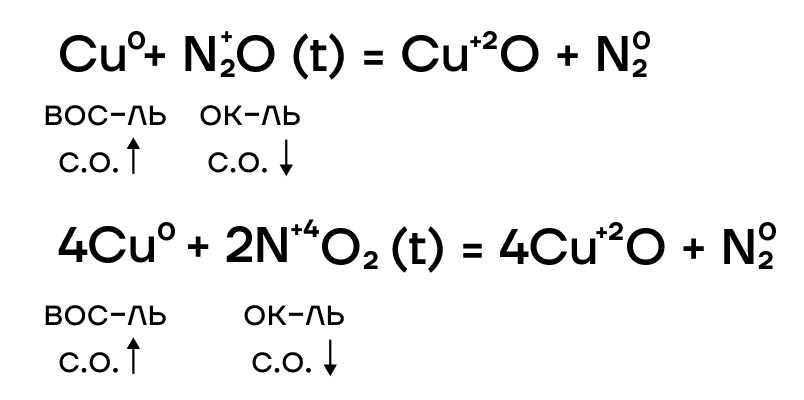
Фактчек
- Медь, железо и хром относятся к переходным металлам, то есть таким, которые расположены в побочных подгруппах больших периодов;
- Возможные степени окисления железа и хрома: 0, +2, +3, +6. Возможные степени окисления меди: 0, +1, +2.
Проверь себя
Задание 1.
У атома какого химического элемента не наблюдается «проскок» электрона?
Задание 2.
С какой солью будет реагировать медь?
- Хлорид натрия;
- Сульфат ртути(II);
- Хлорид железа(III);
- Фосфат кальция.
Задание 3.
Для какого металла характерна степень окисления +1?
Ответы: 1. — 3; 2. — 2; 3. — 4
Водород
Водород (лат. hydrogenium = греч. ὕδωρ — вода + γεννάω — рождаю) - самый легкий химический элемент, при обычных условиях - газ без цвета, запаха и вкуса. В соединении с кислородом образует воду.
Водород - самый распространенный элемент Вселенной, входит в состав всего живого и небесных тел (73% массы Солнца).

Степени окисления
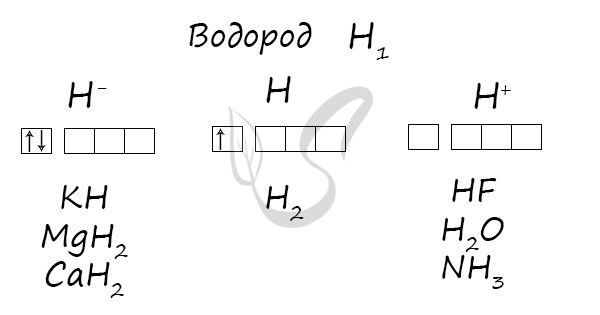
Проявляет степени окисления: -1, 0, +1.
Получение
- Конверсия с водяным паром при t = 1000 °C

- Вытеснением водорода из кислот
Химические свойства
В реакциях водород проявляет себя как восстановитель и окислитель. Как восстановитель реагирует с элементами, электроотрицательность которых выше, чем у водорода:
H2 + F2 → HF (со взрывом в темноте)
H2 + Cl2 → (t) HCl (со взрывом только на свету)

Na + H2 → NaH (гидрид натрия)
- Реакция с металлами
Металлы, стоящие в ряду активности до водорода, вытесняют водород из воды.
Реагирует с основными оксидами - с образованием оснований (реакция идет, если основание растворимо), и с кислотными оксидами - с образованием соответствующих кислот. Не забывайте сохранять степени окисления!
Отмечу здесь реакцию двойного гидролиза, которая заключается в гидролизе одной соли по катиону (CrBr3), а другой - по аниону (Na2CO3).
Cl2 + H2O → HCl + HClO (соляная и хлорноватистая кислоты - без нагревания)
Cl2 + H2O → HCl + HClO3 (соляная и хлорноватая кислоты - при нагревании)

Кристаллогидраты
Кристаллогидраты - кристаллические соединения, содержащие молекулы воды как самостоятельные структурные единицы. Вода, входящая в состав кристаллогидратов, называется кристаллической. Примеры: CaSO4*2H2O, Na2SO4*10H2O.
При нагревании кристаллогидраты теряют воду. Одним из наиболее известных кристаллогидратов является медный купорос: CuSO4*5H2O. Медный купорос имеет характерный голубой цвет, а безводный сульфат меди - белый.

В задачах бывает дана масса медного купороса. Надо помнить о том, что часто в реакции не участвует кристаллическая вода. В таком случае следует вычесть кристаллизационную воду и найти массу безводного сульфата меди.

Пероксид водорода
Представляет собой бесцветную жидкость с металлическим вкусом. Концентрированные растворы пероксида водорода взрывоопасны.
Получают пероксид водорода в реакции с пероксидами и супероксидами металлов.
В разбавленных растворах пероксид водорода легко разлагается:
Также перекись проявляет окислительные свойства:
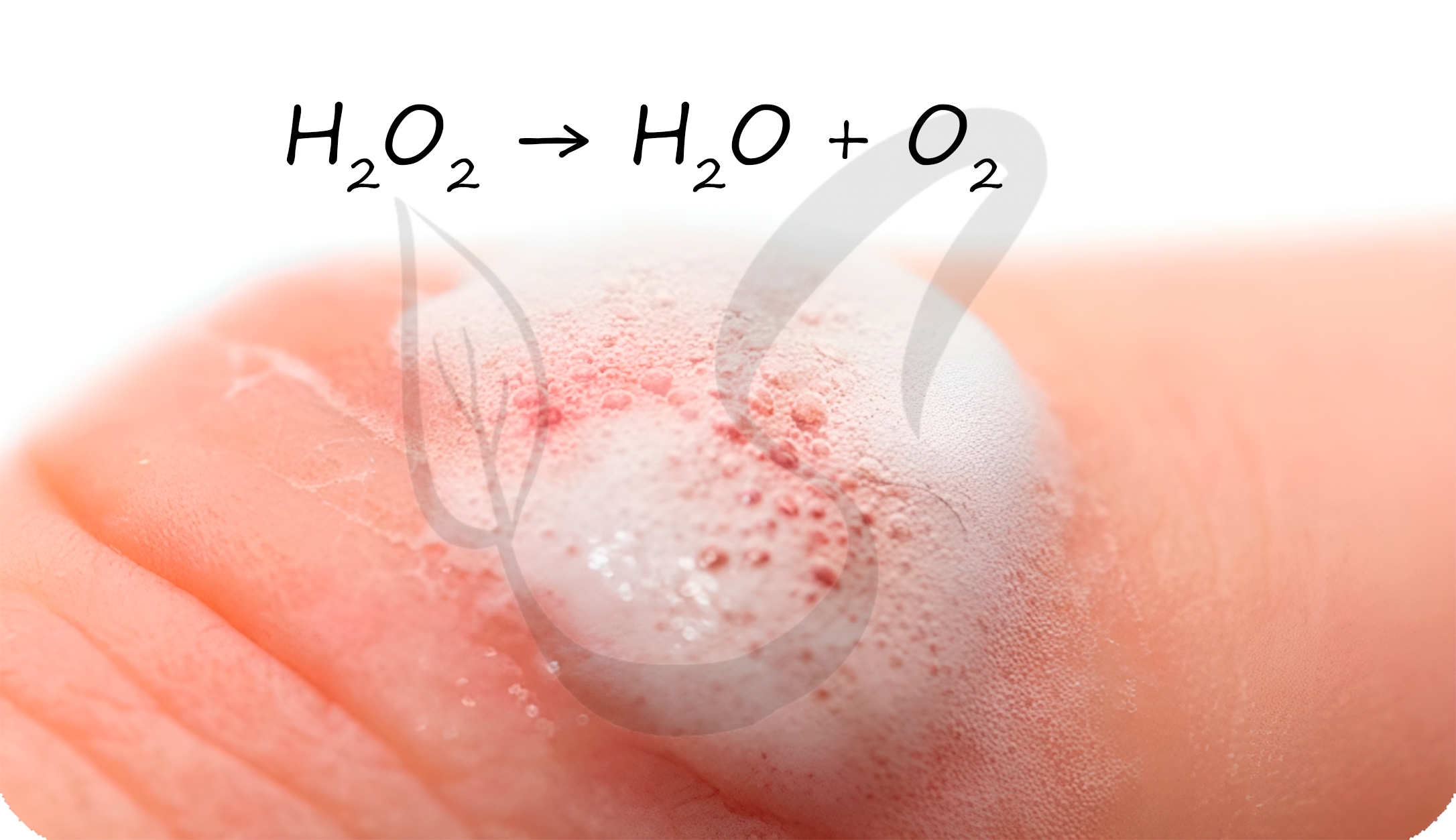
Перекисью водорода обрабатывают раневую поверхность. Выделяющийся при разложении атомарный кислород разрушает бактериальные клетки, предотвращая осложнение в виде бактериальной инфекции.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Химические свойства металлов

Свойства металлов начинают изучать на уроках химии в 8–9 классе. В этом материале мы подробно разберем химические свойства этой группы элементов, а в конце статьи вы найдете удобную таблицу-шпаргалку для запоминания.
О чем эта статья:
8 класс, 9 класс, ЕГЭ/ОГЭ
Металлы — это химические элементы, атомы которых способны отдавать электроны с внешнего энергетического уровня, превращаясь в положительные ионы (катионы) и проявляя восстановительные свойства.
В окислительно-восстановительных реакциях металлы способны только отдавать электроны, являясь сильными восстановителями. В роли окислителей выступают простые вещества — неметаллы (кислород, фосфор) и сложные вещества (кислоты, соли и т. д.).
Металлы в природе встречаются в виде простых веществ и соединений. Активность металла в химических реакциях определяют, используя электрохимический ряд, который предложил русский ученый Н. Н. Бекетов. По химической активности выделяют три группы металлов.
Ряд активности металлов
Металлы средней активности
Общие химические свойства металлов
Взаимодействие с неметаллами
Щелочные металлы сравнительно легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
оксид образует только литий
натрий образует пероксид
калий, рубидий и цезий — надпероксид
Остальные металлы с кислородом образуют оксиды:
2Zn + O2 = 2ZnO (при нагревании)
Металлы, которые в ряду активности расположены левее водорода, при контакте с кислородом воздуха образуют ржавчину. Например, так делает железо:
С галогенами металлы образуют галогениды:
Медный порошок реагирует с хлором и бромом (в эфире):
При взаимодействии с водородом образуются гидриды:
Взаимодействие с серой приводит к образованию сульфидов (реакции протекают при нагревании):
Реакции с фосфором протекают до образования фосфидов (при нагревании):
Основной продукт взаимодействия металла с углеродом — карбид (реакции протекают при нагревании).
Из щелочноземельных металлов с углеродом карбиды образуют литий и натрий:
Калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом:
С азотом из металлов IA группы легко реагирует только литий. Реакция протекает при комнатной температуре с образованием нитрида лития:
Взаимодействие с водой
Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется H2. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур. Результат данной реакции — образование оксида.
Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.


Металлы IА группы:
Металлы IIА группы
Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
Zn + CuSO4 = ZnSO4 + Cu
На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
Взаимодействие с органическими веществами
Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.
Взаимодействие металлов с оксидами
Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
Вопросы для самоконтроля
С чем реагируют неактивные металлы?
С чем связаны восстановительные свойства металлов?
Верно ли утверждение, что щелочные и щелочноземельные металлы легко реагируют с водой, образуя щелочи?
Методом электронного баланса расставьте коэффициенты в уравнении реакции по схеме:
Mg + HNO3 → Mg(NO3)2 + NH4NO3 + Н2O
Как металлы реагируют с кислотами?
Подведем итоги
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Напоследок поделимся таблицей, которая поможет запомнить, с чем реагируют металлы, и подготовиться к контрольной работе по химии.
Таблица «Химические свойства металлов»
Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb
Cu, Hg, Ag, Pt, Au
Восстановительная способность металлов в свободном состоянии
Возрастает справа налево
Взаимодействие металлов с кислородом
Быстро окисляются при обычной температуре
Медленно окисляются при обычной температуре или при нагревании
Взаимодействие с водой
Выделяется водород и образуется гидроксид
При нагревании выделяется водород и образуются оксиды
Водород из воды не вытесняют
Взаимодействие с кислотами
Вытесняют водород из разбавленных кислот (кроме HNO3)
Не вытесняют водород из разбавленных кислот
Реагируют с концентрированными азотной и серной кислотами
С кислотами не реагируют, растворяются в царской водке
Взаимодействие с солями
Не могут вытеснять металлы из солей
Более активные металлы (кроме щелочных и щелочноземельных) вытесняют менее активные из их солей
Взаимодействие с оксидами
Для металлов (при высокой температуре) характерно восстановление неметаллов или менее активных металлов из их оксидов
Урок 28. Химические свойства воды. Какой металл реагирует с водой
Изучить взаимодействие оксида кальция CaO с водой. Для этого небольшое количество CaO добавляют в стакан воды и хорошо перемешивают. Это вызывает химическую реакцию: CaO затем смешивается с небольшим количеством воды.
Какие металлы взаимодействуют с водой при повышенной температуре
Металлы традиционно делятся на различные группы. Они характеризуются отличной от других металлов химической активностью. Эти группы следующие.
- благородные металлы (серебро, золото, платина);
- щелочные металлы (металлы, образованные элементами (I)А группы периодической системы);
- щелочноземельные металлы (кальций, стронций, барий, радий).
Простые вещества со свойствами металлов всегда восстанавливаются в химических реакциях. Положение металла в последовательности активности указывает на то, насколько активен металл в химической реакции (т.е. насколько он восстановлен).
Серия реактивных металлов.
1. чем дальше по шкале в левой части находится металл, тем более сильным восстановителем он является.
2.Металл, расположенный справа от каждого металла в последовательности действий, может быть преобразован в соль. 3.3.
Металлы, расположенные слева от водорода в последовательности действий, могут замещать водород из кислых растворов.
Щелочные и щелочноземельные металлы реагируют с водой во всех водных растворах.
Общие химические свойства металлов
Взаимодействие с простыми неметаллами
1. металлы реагируют с кислородом, образуя оксиды.
Например, при взаимодействии магния с кислородом образуется оксид магния.
Серебро, золото и платина не реагируют с кислородом.
2. металлы реагируют с галогенами (фтор, хлор, бром и йод) с образованием галогенидов.
Металл + галоген → галогенид металла.
Например, при взаимодействии натрия с хлором образуется хлорид натрия. 3:
3. металлы взаимодействуют с серой, образуя сульфиды.
Металл + сера → сульфид металла.
Например, при взаимодействии цинка с серой образуется сульфид цинка.
Цинк реагирует с серой
4Активные металлы при нагревании реагируют с азотом, фосфором и другими неметаллами.
Например, литий реагирует с азотом, образуя нитрид лития.
Когда кальций взаимодействует с фосфором, образуется фосфид кальция.
Взаимодействие со сложными веществами.
1. щелочные металлы и щелочноземельные металлы взаимодействуют с водой при нормальных условиях с образованием водорастворимых оснований (щелочей) и водорода.
Активный металл + вода → щелочь + водород.
Например, при взаимодействии натрия с водой образуется гидроксид натрия и водород.
Взаимодействие натрия с водой
Некоторые промежуточные продукты реагируют с водой при высоких температурах с образованием оксидов металлов и водорода.
Например, расплавленное железо реагирует с водяным паром с образованием смешанного оксида железа (окалина Fe_3O_4 и водород).
2. металлы, расположенные слева от водорода в последовательности металл-актив, реагируют с кислыми растворами с образованием солей и водорода.
Взаимодействие с простыми веществами
с кислородом
Бериллий и магний не реагируют ни с кислородом воздуха, ни с чистым кислородом, если их не нагревать. Это объясняется тем, что бериллий и магний покрыты тонкой защитной пленкой, состоящей из оксидов BeO и MgO соответственно. Их хранение не требует специальной защиты от ветра или влаги, в отличие от щелочноземельных металлов, которые хранятся под слоем инертной жидкости, обычно парафина.
Be, Mg, Ca и Sr при сгорании в кислороде образуют оксиды MeO, а Ba — смесь оксида бария (BaO) и пероксида бария (BaO2).
Следует отметить, что при сгорании щелочно-гибридных металлов и магния на воздухе они реагируют с азотом воздуха, образуя нитриды с общей формулой ME3N2, в дополнение к соединениям металлов с кислородом.
с галогенами
Бериллий реагирует с лошадью только при высоких температурах, а другие металлы группы IIA — уже при комнатной температуре:.
Mg + I2 = MGI2 — йодистый магний
CA + BR2 = CABR2 — кальций бромелиевый
BA + CL2 = BACL2 — хлорид бария
с неметаллами IV–VI групп
Все металлы группы IIA реагируют при нагревании со всеми неметаллами групп IV-VI, но требуют разной степени нагрева, в зависимости от положения металла в группе и активности неметалла. Бериллий — самый химически инертный из всех металлов группы IIA, поэтому для его неметаллических реакций требуются значительно более высокие температуры.
Следует отметить, что реакции металл-углерод могут приводить к образованию карбидов с различными свойствами. Различают гидрокарбиды метана, которые считаются обычными производными метана, где все атомы водорода заменены на металлы. Как и метан, они содержат углерод в степени окисления -4, и при гидролизе или реакции с неокисляющими кислотами одним из продуктов является метан. Существует также другой тип карбида, ацетилененид, который фактически содержит C22-, фрагмент молекулы ацетилена. Карбиды ацетилена образуют ацетилен как один из продуктов гидролиза или реакции с неокисляющими кислотными взаимодействиями. Тип карбида — метанового или ацетиленового — который образуется при взаимодействии металла и углерода, зависит от размера катиона металла. Как правило, метаны образуются с ацетиленом, содержащим ионы металлов малого радиуса и более крупные ионы металлов. Для металлов группы II метан образуется при взаимодействии бериллия с углеродом.
Другие металлы группы IIA образуют ацетилен с углеродом:.
Металлы группы IIA образуют пирит кремния — соединение в форме ME2SI, азота — азот — азот (ME3N2), фосфора — фосфид (ME3P2):.
с водородом
Все щелочноземельные металлы при нагревании реагируют с водородом. Чтобы заставить магний реагировать с водородом, недостаточно одного лишь нагревания, как в случае со щелочными землями, в дополнение к высокой температуре. Также требуется повышение давления водорода. Бериллий не реагирует с водородом ни при каких обстоятельствах.
Взаимодействие со сложными веществами
с водой
Все щелочноземельные металлы положительно реагируют с водой, образуя щелочи (растворимые гидроксиды) и водород. Магний реагирует с водой только при кипячении, так как защитная пленка оксида MGO растворяется при нагревании. В случае берилла оксидная защитная пленка очень прочная. Вода не вступает с ним в реакцию при кипячении или даже в горячем состоянии.
c кислотами-неокислителями
Все металлы главной подгруппы II подгруппы реагируют с неокисляющими кислотами, поскольку в порядке активности они находятся слева от водорода. В результате образуются соли этой кислоты и водорода. Пример реакции.
CA + 2CH3COOH = (CH3COO)2CA + H2↑
c кислотами-окислителями
− разбавленной азотной кислотой
Все металлы группы IIA реагируют с редкой азотной кислотой. В этом случае при восстановлении вместо водорода (как в случае неокисляющихся кислот) образуется в основном оксид азота (I) (N2O), а в случае очень разреженной азотной кислоты — нитрат аммония (NH4NO3): оксид азота (N2O)
4mg + 10hno3 (очень разбавленный) = 4mg(no3)2 + nh4no3 + 3h2o
− концентрированной азотной кислотой
Концентрированная азотная кислота пассивирует бериллий при комнатной (или низкой) температуре. Другими словами, он не вступает в реакцию с бериллием. В условиях кипения возможны реакции, которые протекают в основном в соответствии со следующим уравнением
Магний и щелочноземельные металлы реагируют с концентрированной азотной кислотой с образованием различных продуктов восстановления азота.
− концентрированной серной кислотой
Бериллий пассивируется концентрированной серной кислотой. Это означает, что при нормальных условиях он не вступает в реакцию, но в условиях кипения реакция продолжается с образованием сульфата бериллия, диоксида серы и воды.
Барий также пассивируется концентрированной серной кислотой, образуя нерастворимый сульфат бария, который вступает в реакцию при нагревании. Сульфат бария превращается в сульфат водорода бария и растворяется в концентрированной серной кислоте при нагревании.
Другие основные металлы группы IIA реагируют с концентрированной серной кислотой при любых условиях, даже при низких температурах. Сера в основном восстанавливается до сероводорода.
4Mg + 5H2SO4 (агломерация) = 4MgSO4+H2S↑+4H2O
с щелочами
Магний и щелочноземельные металлы не реагируют со щелочами, тогда как бериллий легко реагирует с безводными щелочами в щелочных растворах и плавится. Если реакция протекает в водном растворе, то в реакции участвует вода, а продуктами являются щелочные или щелочноземельные тетрагидроксобутиратные соли и газообразный водород:.
Be + 2KOH + 2H2O = H2↑+K2Be(OH)4-тетрагидроксибутират калия
При реакции с твердой щелочью при плавлении образуются щелочные или щелочноземельные соли бериллия и водород.
Be + 2KOH = H2↑+K2BeO2-калиевый бериллий
с оксидами
Щелочноземельные металлы и магний можно нагревать для восстановления менее активных металлов и некоторых неметаллов из их оксидов. Например
Метод восстановления металлов из оксидов с помощью магния называется магнитотермией.
- Химические свойства щелочных металлов: взаимодействие, получение
- Химические свойства щелочноземельных металлов: взаимодействие, получение
- Химические свойства алюминия
- Химические свойства переходных металлов (меди, цинка, хрома, железа)
Все элементы группы IIA являются s-элементами. Это означает, что плоскость s-sub содержит все валентные электроны. Поэтому электронная конфигурация внешней электронной оболочки всех химических элементов этой группы имеет вид ns 2 где n — номер периода, в котором расположен элемент.
Урок 28. Химические свойства воды
В Уроке 28 «Химические свойства воды» урока «Химия тупых вещей» вы узнаете о взаимодействии воды с различными веществами.
При нормальных условиях вода очень активна по сравнению с другими веществами. Это означает, что он вступает в химическую реакцию со многими из них.
Взаимодействие с оксидами неметаллов
В случае струи монооксида углерода (IV) CO2 (углекислый газ) направляется к воде, часть его растворяется (рис. 109).
В результате химических реакций в растворе образуется новое вещество — карбоновая кислота H2CO3:.
Кстати, Дж. Пристли обнаружил, что, собирая углекислый газ в воде, часть газа растворяется в воде, придавая ей приятный горький вкус. Фактически, Пристли был первым, кто получил такие напитки, как газированная вода и содовая вода.
Комбинированные реакции также происходят в случае твердых оксидов фосфора (V)P2O5 Происходит химическая реакция, в результате которой образуется H-фосфорная кислота3PO4 (рис. 110):.
Испытайте растворы, полученные в результате взаимодействия CO2 и P2O5С водой, метелкокальциевый индекс. Для этого в полученный раствор добавьте одну-две капли раствора индекса. Цвет индекса меняется с оранжевого на красный, что указывает на присутствие кислоты в растворе. Это подразумевает взаимодействие между CO2 и P2O5 h, который фактически образует кислоту в воде.2CO3 и h3PO4.
Оксиды, такие как со2 и P2O5которые образуют кислоты при реакции с водой, называются кислотными оксидами.
Окисляющие кислоты являются оксидами, соответствующими оксидам.
Некоторые из этих кислотных оксидов и соответствующих кислот перечислены в таблице 11. Обратите внимание, что это безотходные продукты. Как правило, неметаллические оксиды являются кислотными оксидами.
Взаимодействие с оксидами металлов
Вода по-разному реагирует с неметаллическими оксидами.
Изучить взаимодействие оксида кальция CaO с водой. Для этого небольшое количество CaO добавляют в стакан воды и хорошо перемешивают. Это вызывает химическую реакцию: CaO затем смешивается с небольшим количеством воды.
В результате образуется новое вещество под названием Ca(OH)2, которое относится к категории основных. Литий и оксид натрия одинаково реагируют с водой. При этом также образуется база, например.
Узнайте больше об основаниях в следующем уроке. Оксиды металлов, основания которых соответствуют основным оксидам.
Основной оксид — это оксид, которому соответствует основание.
В таблице 12 приведены конкретные типы основных оксидов и соответствующие им основания. Обратите внимание, что, как и кислотные оксиды, основные оксиды содержат атомы металлов. Большинство оксидов металлов являются основными оксидами.
Каждый основной оксид соответствует основанию, но не все основные оксиды, содержащие воду, такие как CAO, взаимодействуют с образованием основания.
При сокрушительно высоких температурах алюминий бурно реагирует с кислородом, выделяя большое количество тепла. В результате образуется оксид алюминия.
Взаимодействие металлов с кислотами. ряд активности металлов
Что такое кислоты? Какие кислотные вещества вы встречали в природе?
По определению, кислоты должны реагировать с металлами. Все ли металлы реагируют с кислотами? Это можно подтвердить опытным путем.
В четыре пронумерованные пробирки налейте одинаковое количество раствора соляной кислоты и добавьте следующим образом: вторая пробирка — добавьте от второго Зн- к четвертому Зп- к третьему Зп-.
Как видите, не все металлы, включая кислоты, могут взаимодействовать и имеют разные скорости взаимодействия (рис. 18).
На основе интенсивности взаимодействия металла с кислотой русский ученый н.н. Бекетов составил ряд активностей:.
li k ca na mg al zn fe ni sn pb (h2) cu hg ag au
При использовании серии химических мероприятий необходимо учитывать следующие правила
1) металлы, стоящие в начале этого ряда, химически активны, они могут вытеснить водород из воды. 2) активность металлов в этом ряду снижается слева направо 3) только металлы, стоящие в ряду активности до водорода, вытесняют водород из растворов кислот
Активный металл + кислота — > соль + водород
Происходят реакции замещения. Металлы, следующие за водородом в порядке реакционной способности, не реагируют с растворами редких кислот (Таблица 6).
Лабораторный эксперимент 3 Взаимодействие металлов с кислыми растворами
Цель: исследовать реакции различных металлов с кислыми растворами и сделать выводы о наличии химических минералов.
Раствор соляной кислоты наливают в четыре пробирки. В одну пробирку насыпают порошок магния, в другую — зерна цинка, в третью — железную стружку, в четвертую — медную.
Можно ли разъесть железо? Да, если он очень чистый. Например, в Дели (Индия) есть колонна высотой 7 м и весом 6,5 тонн. Он был заселен в IX веке до н.э. Он содержит 99,72% Fe. До сих пор колонна не подвергалась коррозии.
Взаимодействие металлов с растворами солей
С какими солями вы сталкивались в повседневной жизни?
Химически активные металлы вытесняют менее активные металлы, чем солевые растворы, вызывая реакции вытеснения. Например, железо вытесняет медь из раствора сульфата меди (III) (рис. 19).
Выделение красного налета меди является признаком реакции. Обратная реакция не протекает
Форма реакции смещения выглядит следующим образом
Соль 4 — активный металл = новая соль + новый металл (менее активный)
Этот тип реакции происходит при следующих условиях: 1) соль, с которой происходит взаимодействие, должна быть растворима в воде; 2) новый металл должен быть активен в воде.
Демонстрация трех вытеснений металла из солевого раствора
Цель: Понять, что более активный металл вытесняет менее активный металл, чем его соль.
Поместите гранулу цинка в пробирку и прилейте раствор сульфата меди. В другую пробирку поместите небольшой кусочек железа и залейте раствором сульфата меди. Что вы заметили? Напишите уравнение реакции. Сделайте вывод.
Рабочий лист 1 Сравнение действий с металлами
Цель: Разработать серию мероприятий по металлу. Обобщите результаты и сделайте выводы.
Налейте 5 мл солевого раствора в пять пробирок и поместите медный наконечник в каждую пробирку. Затем повторите эксперимент с другими металлами. Наблюдайте за интенсивностью реакции. Заполните таблицу: где происходят реакции и символы» — «нет». Составьте ряд активности металлов на основе сравнительной интенсивности, т.е. по количеству происходящих реакций.
- 1. Атомы металлов в реакциях только отдают электроны, образуя положительно заряженные ионы.
- 2. Самопроизвольное разрушение металлов в результате их взаимодействия с веществами окружающей среды называется коррозией.
- 3. Сравнительную активность металлов можно определить с помощью ряда активности, составленного Н. Н. Бекетовым.
- 4. Металлы IA, НА группы очень легко вступают во взаимодействие с кислородом и водой. Многие металлы образуют оксидную пленку, которая препятствует дальнейшему окислению. Благородные металлы вообще не реагируют с кислородом и водой.
Лекции по химии:.
Лекции по неорганической химии:.
Лекции по органической химии:.
Отправляйте задания в любое время дня и ночи
Официальный сайт Брилёновой Натальи Валерьевны, профессора факультета информатики Екатеринбургского государственного института.
Какой из металлов способен вытеснять водород из воды при комнатной температуре?
Какой из металлов способен вытеснять водород из воды при комнатной температуре?
А) медь, б) железо, в)натрий, г)серебро Какой металл не будет взаимодействовать с водой?
А) кальций, б) хром, в) литий, г) натрий.
Нужно написать ответ в виде объяснения и формулы.

1. Ответ : в) - натрий вытесняет водород из воды
Натрий - щелочной металл, активно взаимодействует с водой, превращаясь в шарик, бегает по воде, уменьшаясь в размерах.
Выделяющийся водород может вспыхнуть
2Na + 2H2O = 2NaOH + H2
Ответ : б) - хром не взаимодействует с водой
Хром - при обычных условияхнеактивный металл.
Это объясняется тем, что его поверхность покрыта оксидной плёнкой.
Которая очень прочная.

Какой из металлов не будет взаимодействовать с соляной кислотой?
Какой из металлов не будет взаимодействовать с соляной кислотой?
Натрий железо барий серебро.

3. Назовите металлы, которые вытесняют водород из воды при н?
3. Назовите металлы, которые вытесняют водород из воды при н.

Какие из перечисленных металлов не вытесняют водород из кислот : Натрий, Свинец, Золото, Барий?
Какие из перечисленных металлов не вытесняют водород из кислот : Натрий, Свинец, Золото, Барий.
Укажите металлы, имеющие окраску : а) железо и цинк б)алюминий и хром в)калий и натрий г)медь и золото?
Укажите металлы, имеющие окраску : а) железо и цинк б)алюминий и хром в)калий и натрий г)медь и золото.
Выберите пары металлов, в которых первый металл вытесняет второй из водного раствора его соли : а) кальций и цинк б) цинк и серебро в) никель и медь г) железо и магний?
Выберите пары металлов, в которых первый металл вытесняет второй из водного раствора его соли : а) кальций и цинк б) цинк и серебро в) никель и медь г) железо и магний.

Какой из перечисленных металлов реагирует с водой при комнатной температуре?
Какой из перечисленных металлов реагирует с водой при комнатной температуре?
А)железо б)цинк в)медь г)кальций д)нет правильного ответа.
Какой из металлов или неметаллов сильнее и почему хром - железо?
Какой из металлов или неметаллов сильнее и почему хром - железо.
СРОЧНО ОЧЕНЬ СРОЧНО железо вытесняет из раствора солей металлы : а)только щелочные в)только щелочноземельные с)металлы , стоящие после железа д)только металлы , стоящие после водорода е)железо не спос?
СРОЧНО ОЧЕНЬ СРОЧНО железо вытесняет из раствора солей металлы : а)только щелочные в)только щелочноземельные с)металлы , стоящие после железа д)только металлы , стоящие после водорода е)железо не способен выделят металлы из растворов солей.
Металл вытесняющий водород из воды при температуре образованием оксида металла?
Металл вытесняющий водород из воды при температуре образованием оксида металла.

Вставьте нужные слова вместо многоточий : 1) Металлы стоящие?
Вставьте нужные слова вместо многоточий : 1) Металлы стоящие.
, вытесняют металлы, стоящие .
Из их солей в растворе 2) Металлы стоящие в ряду активности до .
, вытесняют его из кислот в растворе, кроме .
И . , причём тем активнее, чем .
Стоит этот метал 3) Металлы, стоящие в этом ряду до алюминия, взаимодействуют с водой с образованием .
; другие металлы до водорода могут взаимодействовать с водой в жёстких условиях (.
На странице вопроса Какой из металлов способен вытеснять водород из воды при комнатной температуре? из категории Химия вы найдете ответ для уровня учащихся 10 - 11 классов. Если полученный ответ не устраивает и нужно расшить круг поиска, используйте удобную поисковую систему сайта. Можно также ознакомиться с похожими вопросами и ответами других пользователей в этой же категории или создать новый вопрос. Возможно, вам будет полезной информация, оставленная пользователями в комментариях, где можно обсудить тему с помощью обратной связи.
Я про алюминийАлюминий – легкий, прочный и пластичный металл. Это один из самых востребованных металлов, и по темпам роста потребления он давно и с большим отрывом оставил позади сталь, никель, медь и цинк. Алюминий без преувеличений можно назвать ..
Тому що рН показує ступінь концентрації катіонів гідрогену у воді, що є дуже важливим для косметики.

1. дано N(NH3) = 4. 816 * 10 ^ 23 - - - - - - - - - - - - - - - - - - - - - - - - - - - - - V(NH3) - ? N(NH3) / N(A) = V(NH3) / Vm V(NH3) = N(NH3) * Vm / N(A) = 4. 816 * 10 ^ 23 * 22. 4 / 6. 02 * 10 ^ 23 = 15. 58 L ответ 15. 58 л 2) дано m(O2)..
Соотвественно правильным ответом будет являться : 4) KCl ; 5) AgCl ; 6) NH4Cl.
Дано W(O) = 47 % - - - - - - - - - - - - - - - - E - ? Е - это неизвестный элемент W(O) = Ar(O) * n / M(X2O3) * 100% 47% = 16 * 3 / 2x + 48 * 100% 94x + 2256 = 4800 X = 27 - это алюминий Al2O3 ответ алюминий.

Напиши нормально не понятно или сфоткай.
В SO3 32 / (32 + 3 * 16) = 0, 4 или 40 %.

Реакции есть на фотографии.

4HCl + MnO2 = MnCl2 + Cl2 + 2H2O соляная кислота отдаёт в свободном виде половину имеющегося хлора. M(Cl общ. ) = 1000 * 0, 365 * 0, 9726 = 355 г масса выделившегося хлора = 355 / 2 = 177, 5 г.
Типы химической реакции соединение, разложение замещение.
© 2000-2022. При полном или частичном использовании материалов ссылка обязательна. 16+
Сайт защищён технологией reCAPTCHA, к которой применяются Политика конфиденциальности и Условия использования от Google.
Читайте также:
