Какие металлы реагируют с концентрированной серной кислотой
ОТНОШЕНИЕ МЕТАЛЛОВ К КИСЛОТАМ
Чаще всего в химической практике используются такие сильные кислоты как серная H 2 SO 4 , соляная HCl и азотная HNO 3 . Далее рассмотрим отношение различных металлов к перечисленным кислотам.
Соляная кислота ( HCl )
Соляная кислота – это техническое название хлороводородной кислоты. Получают ее путем растворения в воде газообразного хлороводорода – HCl . Ввиду невысокой его растворимости в воде, концентрация соляной кислоты при обычных условиях не превышает 38%. Поэтому независимо от концентрации соляной кислоты процесс диссоциации ее молекул в водном растворе протекает активно:
Образующиеся в этом процессе ионы водорода H + выполняют роль окислителя, окисляя металлы, расположенные в ряду активности левее водорода. Взаимодействие протекает по схеме:
Me + HCl соль + H 2 ↑
При этом соль представляет собой хлорид металла ( NiCl 2 , CaCl 2 , AlCl 3 ), в котором число хлорид-ионов соответствует степени окисления металла.
Соляная кислота является слабым окислителем, поэтому металлы с переменной валентностью окисляются ей до низших положительных степеней окисления:
Fe 0 → Fe 2+
Co 0 → Co 2+
Ni 0 → Ni 2+
Cr 0 → Cr 2+
Mn 0 → Mn 2+ и др .
2 Al + 6 HCl → 2 AlCl 3 + 3 H 2 ↑
2│ Al 0 – 3 e - → Al 3+ - окисление
3│2 H + + 2 e - → H 2 – восстановление
Соляная кислота пассивирует свинец ( Pb ). Пассивация свинца обусловлена образованием на его поверхности трудно растворимого в воде хлорида свинца ( II ), который защищает металл от дальнейшего воздействия кислоты:
Pb + 2 HCl → PbCl 2 ↓ + H 2 ↑
Серная кислота ( H 2 SO 4 )
В промышленности получают серную кислоту очень высокой концентрации (до 98%). Следует учитывать различие окислительных свойств разбавленного раствора и концентрированной серной кислоты по отношению к металлам.
Разбавленная серная кислота
В разбавленном водном растворе серной кислоты большинство ее молекул диссоциируют:
Образующиеся ионы Н + выполняют функцию окислителя.
Как и соляная кислота, разбавленный раствор серной кислоты взаимодействует только с металлами активными и средней активности (расположенными в ряду активности до водорода).
Химическая реакция протекает по схеме:
1│2Al 0 – 6e - → 2Al 3+ - окисление
Металлы с переменной валентностью окисляются разбавленным раствором серной кислоты до низших положительных степеней окисления:
Mn 0 → Mn 2+ и др .
Свинец ( Pb ) не растворяется в серной кислоте (если ее концентрация ниже 80%) , так как образующаяся соль PbSO 4 нерастворима и создает на поверхности металла защитную пленку.
Концентрированная серная кислота
В концентрированном растворе серной кислоты (выше 68%) большинство молекул находятся в недиссоциированном состоянии, поэтому функцию окислителя выполняет сера, находящаяся в высшей степени окисления ( S +6 ). Концентрированная H 2 SO 4 окисляет все металлы, стандартный электродный потенциал которых меньше потенциала окислителя – сульфат-иона SO 4 2- (0,36 В). В связи с этим, с концентрированной серной кислотой реагируют и некоторые малоактивные металлы.
Процесс взаимодействия металлов с концентрированной серной кислотой в большинстве случаев протекает по схеме:
Me + H 2 SO 4 (конц.) соль + вода + продукт восстановления H 2 SO 4
Продуктами восстановления серной кислоты могут быть следующие соединения серы:
Практика показала, что при взаимодействии металла с концентрированной серной кислотой выделяется смесь продуктов восстановления, состоящая из H 2 S , S и SO 2. Однако, один из этих продуктов образуется в преобладающем количестве. Природа основного продукта определяется активностью металла: чем выше активность, тем глубже процесс восстановления серы в серной кислоте.
Взаимодействие металлов различной активности с концентрированной серной кислотой можно представить схемой:

Алюминий ( Al ) и железо ( Fe ) не реагируют с холодной концентрированной H 2 SO 4 , покрываясь плотными оксидными пленками, однако при нагревании реакция протекает.
Ag , Au , Ru , Os , Rh , Ir , Pt не реагируют с серной кислотой.
Концентрированная серная кислота является сильным окислителем, поэтому при взаимодействии с ней металлов, обладающих переменной валентностью, последние окисляются до более высоких степеней окисления, чем в случае с разбавленным раствором кислоты:
Fe 0 → Fe 3+ ,
Cr 0 → Cr 3+ ,
Mn 0 → Mn 4+ ,
Sn 0 → Sn 4+
Свинец ( Pb ) окисляется до двухвалентного состояния с образованием растворимого гидросульфата свинца Pb ( HSO 4 )2 .
Серная кислота
Серная кислота H2SO4 – это сильная кислота, двухосновная, прочная и нелетучая. При обычных условиях серная кислота – тяжелая маслянистая жидкость, хорошо растворимая в воде.
Растворение серной кислоты в воде сопровождается выделением значительного количества кислоты. Поэтому по правилам безопасности в лаборатории при смешивании серной кислоты и воды мы добавляем серную кислоту в воду небольшими порциями при постоянном перемешивании.

Валентность серы в серной кислоте равна VI.
Способы получения
1. Серную кислоту в промышленности производят из серы, сульфидов металлов, сероводорода и др. Один из вариантов — производство серной кислоты из пирита FeS2.
Основные стадии получения серной кислоты :
- Сжигание или обжиг серосодержащего сырья в кислороде с получением сернистого газа.
- Очистка полученного газа от примесей.
- Окисление сернистого газа в серный ангидрид.
- Взаимодействие серного ангидрида с водой.


Рассмотрим основные аппараты, используемые при производстве серной кислоты из пирита (контактный метод):
В контактном аппарате производится окисление сернистого газа до серного ангидрида. Процесс является обратимым. Поэтому необходимо выбрать оптимальные условия протекания прямой реакции (получения SO3):
- температура: оптимальной температурой для протекания прямой реакции с максимальным выходом SO3 является температура 400-500 о С. Для того чтобы увеличить скорость реакции при столь низкой температуре в реакцию вводят катализатор – оксид ванадия (V) V2O5.
- давление: прямая реакция протекает с уменьшением объемов газов. Для смещения равновесия вправо процесс проводят при повышенном давлении.
Однако, если для поглощения оксида серы использовать воду, то образуется серная кислота в виде тумана, состоящего из мельчайших капелек серной кислоты. Для того, чтобы не образовывался сернокислотный туман, используют 98%-ную концентрированную серную кислоту. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H2SO4·nSO3.
Общие научные принципы химического производства:
- Непрерывность.
- Противоток
- Катализ
- Увеличение площади соприкосновения реагирующих веществ.
- Теплообмен
- Рациональное использование сырья
Химические свойства
Серная кислота – это сильная двухосновная кислота .
1. Серная кислота практически полностью диссоциирует в разбавленном в растворе по первой ступени:
По второй ступени серная кислота диссоциирует частично, ведет себя, как кислота средней силы:
HSO4 – ⇄ H + + SO4 2–
2. Серная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например , серная кислота взаимодействует с оксидом магния:
Еще пример : при взаимодействии серной кислоты с гидроксидом калия образуются сульфаты или гидросульфаты:
Серная кислота взаимодействует с амфотерным гидроксидом алюминия:
3. Серная кислота вытесняет более слабые из солей в растворе (карбонаты, сульфиды и др.). Также серная кислота вытесняет летучие кислоты из их солей (кроме солей HBr и HI).
Например , серная кислота взаимодействует с гидрокарбонатом натрия:
Или с силикатом натрия:
Концентрированная серная кислота реагирует с твердым нитратом натрия. При этом менее летучая серная кислота вытесняет азотную кислоту:
Аналогично – концентрированная серная кислота вытесняет хлороводород из твердых хлоридов, например , хлорида натрия:
4. Т акже серная кислота вступает в обменные реакции с солями.
Например , серная кислота взаимодействует с хлоридом бария:
5. Разбавленная серная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Например , серная кислота реагирует с железом. При этом образуется сульфат железа (II):
Серная кислота взаимодействует с аммиаком с образованием солей аммония:
Концентрированная серная кислота является сильным окислителем . При этом она обычно восстанавливается до сернистого газа SO2. С активными металлами может восстанавливаться до серы S, или сероводорода Н2S.
Железо Fe, алюминий Al, хром Cr пассивируются концентрированной серной кислотой на холоде. При нагревании реакция возможна.
При взаимодействии с неактивными металлами концентрированная серная кислота восстанавливается до сернистого газа:
При взаимодействии с щелочноземельными металлами и магнием концентрированная серная кислота восстанавливается до серы:
При взаимодействии с щелочными металлами и цинком концентрированная серная кислота восстанавливается до сероводорода:
6. Качественная реакция на сульфат-ионы – взаимодействие с растворимыми солями бария. При этом образуется белый кристаллический осадок сульфата бария:
BaCl2 + Na2SO4 → BaSO4 ↓ + 2NaCl
Видеоопыт взаимодействия хлорида бария и сульфата натрия в растворе (качественная реакция на сульфат-ион) можно посмотреть здесь.
7. Окислительные свойства концентрированной серной кислоты проявляются и при взаимодействии с неметаллами.
Например , концентрированная серная кислота окисляет фосфор, углерод, серу. При этом серная кислота восстанавливается до оксида серы (IV):
Уже при комнатной температуре концентрированная серная кислота окисляет галогеноводороды и сероводород:
Серная кислота - сильная двухосновная кислота, при н.у. маслянистая жидкость без цвета и запаха.
Обладает выраженным дегидратационным (водоотнимающим) действием. При попадании на кожу или слизистые оболочки приводит к тяжелым ожогам.
Замечу, что существует олеум - раствор SO3 в безводной серной кислоте, дымящее жидкое или твердое вещество. Олеум применяется при изготовлении красителей, органическом синтезе и в производстве серной кислот.

Получение
Известны несколько способов получения серной кислоты. Применяется промышленный (контактный) способ, основанный на сжигании пирита, окислении образовавшегося SO2 до SO3 и последующим взаимодействием с водой.

Нитрозный способ получения основан на взаимодействии сернистого газа с диоксидом азота IV в присутствии воды. Он состоит из нескольких этапов:
В окислительной башне смешивают оксиды азота (II) и (IV) с воздухом:
Смесь газов подается в башни, орошаемые 75-ной% серной кислотой, здесь смесь оксидов азота поглощается с образованием нитрозилсерной кислоты:
В ходе гидролиза нитрозилсерной кислоты получают азотистую кислоту и серную:
В упрощенном виде нитрозный способ можно записать так:

Химические свойства
В водном растворе диссоциирует ступенчато.
Сильная кислота. Реагирует с основными оксидами, основаниями, образуя соли - сульфаты.
KOH + H2SO4 = KHSO4 + H2O (гидросульфат калия, соотношение 1:1 - кислая соль)
2KOH + H2SO4 = K2SO4 + 2H2O (сульфат калия, соотношение 2:1 - средняя соль)

С солями реакция идет, если в результате выпадает осадок, образуется газ или слабый электролит (вода). Серная кислота, как и многие другие кислоты, способна растворять осадки.

Серная кислота окисляет неметаллы - серу и углерод - соответственно до угольной кислоты (нестойкой) и сернистого газа.
Реакции разбавленной серной кислоты с металлами не составляют никаких трудностей: она реагирует как самая обычная кислота, например HCl. Все металлы, стоящие до водорода, вытесняют из серной кислоты водород, а стоящие после - не реагируют с ней.
Подчеркну, что реакции разбавленной серной кислоты с железом и хромом не сопровождаются переходом этих элементов в максимальную степень окисления. Они окисляются до +2.
Cu + H2SO4(разб.) ⇸ (реакция не идет, медь не может вытеснить водород из кислоты)

Концентрированная серная кислота ведет себя совершенно по-иному. Водород никогда не выделяется, вместо него с активными металлами выделяется H2S, с металлами средней активности - S, с малоактивными металлами - SO2.


Холодная концентрированная серная кислота пассивирует Al, Cr, Fe, Ni, Be, Co. При нагревании или амальгамировании данных металлов реакция идет.
Обратите особое внимание, что при реакции железа, хрома с концентрированной серной кислотой достигается степень окисления +3. В подобных реакциях с разбавленной серной кислотой (написаны выше) достигается степень окисления +2.

Иногда в тексте задания даны подсказки. Например, если написано, что выделился газ с неприятным запахом тухлых яиц - речь идет об H2S, если же написано, что выделилось простое вещество - речь о сере (S).
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Азотная кислота
Азотная кислота является одной из самых сильных минеральных кислот, в концентрированном виде выделяет пары желтого цвета с резким запахом. За исключением золота и платины растворяет все металлы.
Применяют азотную кислоту для получения красителей, удобрений, органических нитропродуктов, серной и фосфорной кислот. В результате ожога азотной кислотой образуется сухой струп желто-зеленого цвета.

В промышленности азотную кислоту получают в результате окисления аммиака на платино-родиевых катализаторах.
Чистая азотная кислота впервые была получена действием на селитру концентрированной серной кислоты:
Является одноосновной сильной кислотой, вступает в реакции с основными оксидами, основаниями. С солями реагирует при условии выпадения осадка, выделения газа или образования слабого электролита.

При нагревании азотная кислота распадается. На свету (hv) также происходит подобная реакция, поэтому азотную кислоту следует хранить в темном месте.
Азотная кислота способна окислить все неметаллы, при этом, если кислота концентрированная, азот обычно восстанавливается до NO2, если разбавленная - до NO.

В любой концентрации азотная кислота проявляет свойства окислителя, при этом азот восстанавливается до степени окисления от +5 до -3. На какой именно степени окисления остановится азот, зависит от активности металла и концентрации азотной кислоты.
Для малоактивных металлов (стоящих в ряду напряжений после водорода) реакция с концентрированной азотной кислотой происходит с образованием нитрата и преимущественно NO2.
С разбавленной азотной кислотой газообразным продуктом преимущественно является NO.
В реакциях с металлами, стоящими левее водорода в ряду напряжений, возможны самые разные газообразные (и не газообразные) продукты: бурый газ NO2, NO, N2O, атмосферный газ N2, NH4NO3.
Помните о закономерности: чем более разбавлена кислота и активен металл, тем сильнее восстанавливается азот. Ниже представлены реакции цинка с азотной кислотой в различных концентрациях.

Посмотрите на таблицу ниже, в которой также отражены изученные нами закономерности.

Концентрированная холодная азотная кислота пассивирует хром, железо, алюминий, никель, свинец и бериллий. Это происходит за счет оксидной пленки, которой покрыты данные металлы.
Al + HNO3(конц.) ⇸ (реакция не идет)
При нагревании или амальгамировании (покрытие ртутью) перечисленных металлов реакция с азотной кислотой идет, так как оксидная пленка на поверхности металлов разрушается.
Соли азотной кислоты - нитраты NO3 -
Получают нитраты в ходе реакции азотной кислоты с металлами, их оксидами и основаниями.
В реакциях с оксидами и основаниями газообразный продукт обычно не выделяется.

Нитрат аммония получают реакция аммиака с азотной кислотой.
Обратите внимание на следующую закономерность: концентрированная азотная кислота, как правило, окисляет железо и хром до +3. Разбавленная кислота - до +2.
- Реакции с металлами, основаниями и кислотами
Как и для всех солей, из нитратов можно вытеснить металл другим более активным. Соли реагируют с основаниями и кислотами, если в результате реакции выпадает осадок, выделяется газ или образуется слабый электролит (вода).

Нитраты разлагаются в зависимости от активности металла, входящего в их состав.


Блиц-опрос по теме Азотная кислота
Холодная концентрированная азотная кислота не вступает в реакцию с алюминием, происходит пассивирование.
2. Реакция концентрированной азотной кислоты с малоактивными металлами сопровождается выделением газа
В реакциях концентрированной азотной кислоты и малоактивных металлов преимущественно выделяется NO2.
3. Если в результате реакции активного металла с азотной кислотой выделилось твердое вещество, то речь идет о
Твердый продукт, образовавшийся в ходе реакции с азотной кислотой, нитрат аммония - NH4NO3
Разложение нитрата аммония протекает по схеме: AgNO3 → Ag + NO2 + O2
Азотной кислотой окрашивает пораженную в результате ожога кожу в желтый цвет.
кислот-окислителей
Концентрированная серная кислота – бесцветная тяжелая маслянистая нелетучая жидкость. Не имеет запаха и тянет сказать: «без вкуса», но вкус у нее все же есть, пробовать не советую.
Разбавленная серная кислота ничем особым непримечательна. Свойства как и у других кислот. За исключением того, что она не реагирует со свинцом, так как образующийся сульфат свинца нерастворим. Нерастворимое вещество покрывает кусочек металла и «защищает его от реакции»
А вот концентрированная серная кислота – сильный окислитель (за счет атома серы в высшей степени окисления).
Раз сера – окислитель, то она будет восстанавливаться:
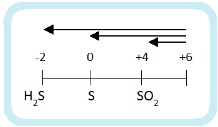
Глубина восстановления серы зависит от активности восстановителя:
- сильные восстановители восстанавливают серную кислоту до H2S,
- слабые — до SO2,
- восстановители средней активности – до S.
На практике образуются несколько продуктов в разных пропорциях. Преобладание того или иного продукта зависит от множества факторов: от вышеупомянутой активности восстановителя, температуры, концентрации кислоты (95%, 90%. 85%, 80%, 75% – это все концентрированная кислота). Но в реалиях школьной программы все схематично и пишем один единственный продукт.
1. Взаимодействие металлов в концентрированной серной кислотой.
Концентрированная серная кислота реагирует с металлами, даже стоящими после водорода. Но кроме платины и золота – эти металлы слишком малоактивны.
Схема этих реакций:

- Активные металлы восстанавливают серную кислоту до H2S:
- Металлы средней активности восстанавливают серную кислоту до S:
- Малоактивные металлы восстанавливают серную кислоту до SO2:
Некоторые металлы (конкретно нужно запомнить — Fe, Al, Cr) при контакте с концентрированной серной кислотой покрываются защитной пленкой – и реакция не идет. Поэтому серную кислоту без всякой опасности перевозят в железных цистернах. Это явление называют пассивацией.
То, что железо, алюминий и хром пассивируются не означает, что реакция невозможна. Просто нужно нагреть – при нагревании от защитной пленки не остаётся и следа:

2. Взаимодействие неметаллов с концентрированной серной кислотой.
Не все неметаллы реагируют с концентрированной серной кислотой: лишь те, что проявляют восстановительные свойства. Поэтому кислород, азот и галогены не вступают в эти реакции.
Мы рассмотрим взаимодействие с фосфором, углеродом, бором, серой. Неметаллы – не такие активные восстановители как типичные металлы – поэтому серная кислота восстанавливается до SO2.
Неметалл окисляется до высшей степени окисления: образуется оксид. Поскольку оксид неметалла – кислотный, то он тут же в момент получения реагирует с водой и образуется кислота:
Угольная кислота не образуется – получается углекислый газ:
Концентрированная серная кислота окисляет серу:

3. Взаимодействие концентрированной серной кислоты с галогенидами.
Галогениды металлов – это соли галогеноводородов (HF, HCl, HBr, HI). Галогеноводороды – летучие кислоты, а HF еще к тому же и слабая.
Поэтому серная кислота их вытесняет из солей:
Соли нужно брать твердые, не раствор. Тогда галогеноводороды будут вытесняться в виде газов.
А к фториду можно и в раствор прилить кислоты, так как фтороводородная кислота – слабая, она вытеснится. Только останется в растворе, вот и вся разница.
С хлоридами и фторидами происходит простая реакция обмена, без изменения степеней окисления.
Галоген окисляется до простого вещества. Сера восстанавливается:

А вот бромиды и иодиды – восстановители. После вытеснения галогеноводорода он тут же окисляется. Поэтому реакции концентрированной серной кислоты с бромидами и иодидами протекают с изменением степеней окисления.
Бромоводород и иодоводород окисляются так же, как и их соли:
Азотная кислота — окислитель.
Производство.
Сырье для производства азотной кислоты – аммиак. Три последовательные реакции окисления:
1. Каталитическое окисление аммиака:
Реакция экзотермическая, необратимая.
2. Окисление NO до NO2:
Реакция экзотермическая, обратимая.
3. Поглощение NO2 водой и одновременно его окисление:
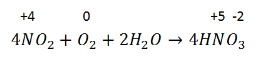
Реакция экзотермическая, обратимая – по этой же схеме азотная кислота разлагается при хранении. Поэтому с течением времени прозрачная изначально азотная кислота буреет. Бурый цвет кислоте придает, образующийся при разложении NO2.
Если растворять NO2 в воде без доступа кислорода, то азот диспропорционирует:
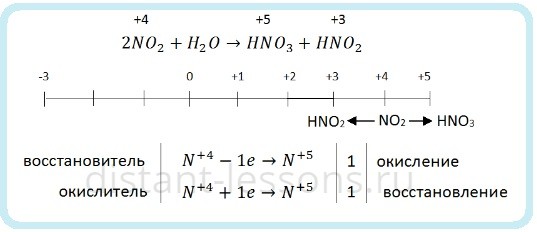
Поэтому оксид азота (IV) NO2 мы относим к кислотным. Хоть у него и нет соответствующей кислоты, при растворении его в воде образуются HNO3 и HNO2.
Азотная кислота – жидкость с резким запахом. Свежая азотная кислота бесцветная. При хранении она разлагается и за счет бурого NO2 приобретает желтоватый цвет.
Важно знать, что азотная кислота летучая, легкокипящая, поэтому и имеет запах. А раз она летучая, то ее можно вытеснить из соли нелетучей кислотой, например, концентрированной серной:
Важно, чтобы нитрат был твердым, а серная кислота концентрированная – меньше воды. Чтобы азотная кислота испарялась, испаряется – значит покидает реакционную смесь, значит реакция идет до конца.
Химические свойства.
Свойства азотной кислоты в целом повторяют свойства концентрированной серной. Но с одной поправкой, в отличие от серной, азотная кислота и концентрированная, и разбавленная проявляет сильные окислительные свойства.
1. Взаимодействие с металлами.
До чего может восстанавливаться азот? Вспомним диаграмму степеней окисления азота:

Получиться может любой из этих продуктов. А на практике – несколько сразу. Мы рассмотрим упрощенный вариант: берем только преобладающий продукт и только два фактора, влияющие на глубину восстановления:
- Активность металла – чем активнее, тем глубже идет восстановление.
- Концентрация кислоты – разбавленная кислота восстанавливается глубже.
Еще больше упрощая берем только четыре продукта: NH4NO3, N2O, NO, NO2.
Наиболее глубокое восстановление дает разбавленная кислота и активный металл – NH4NO3.
Соответственно при взаимодействии концентрированной кислоты и малоактивного металла образуется NO2. Самое неглубокое восстановление.
Теперь нужно определить в каком случае будет N2O, а в каком NO. Фактор активности металла – решающий. С активным металлом и концентрированной кислотой будет N2O. А с малоактивным металлом и разбавленной кислотой образуется NO.
8Na + 10HNO3 конц → 8NaNO3 + N 2 O ↑ + 5H2O

Концентрированная азотная кислота пассивирует Fe, Cr, Al, как и концентрированная серная.
Чтобы провести реакцию нужно нагреть:
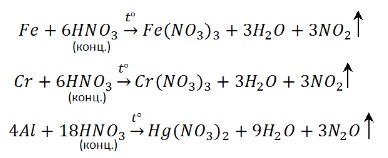
С разбавленной кислотой эти металлы реагируют и без нагревания:
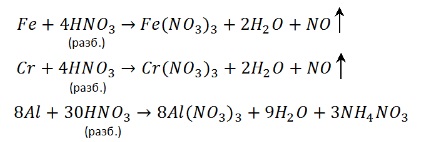
2. Взаимодействие с неметаллами (C, P, B, S).
Неметаллы окисляются до высших кислот. Реагирует и концентрированная, и разбавленная азотная кислота. Неметаллы – не очень хорошие восстановители, поэтому кислота восстанавливается как в реакции с малоактивными металлами (образуются N2O и NO2).

В отличие от серной кислоты, очень концентрированная азотная кислота (безводная) окисляет при нагревании иод до иодноватой кислоты (HIO3):
3. Взаимодействие с галогенидами.
Эти реакции могут запутать, хотя ничего сложного в них нет. Вам нужно просто понять логику каждой из них.
На что следует опираться:
- Реакции могут быть либо окислительно-восстановительными, либо обменными.
- Помним, что фториды (F–) и хлориды (Cl–) – восстановители плохие, если быть точнее, то никакие. А бромиды (Br–) и иодиды (I–) – хорошие восстановители.
- HF – слабая кислота, HCl, HBr, HI – сильные.
Фториды металлов – это соли слабых кислот, поэтому сильная азотная кислота вытесняет фтороводород. И не важно концентрированная или разбавленная – это простая реакция обмена/p>
Фтороводород не реагирует с азотной кислотой. Реакция обмена невозможна и окислительно-восстановительная тоже: фторид – слабый восстановитель.
Хлориды металлов и хлороводород не реагируют с азотной кислотой. Хлорид ион – слабый восстановитель – не возможна ОВР. Хлориды металлов не реагируют, потому что соляная кислота – сильная (предыдущая плавиковая – слабая, если помните).
Бромиды и иодиды вступают с азотной кислотой в окислительно-восстановительное взаимодействие. Сами окисляются до простых веществ. Азотная кислота восстанавливается до NO2 если концентрированная, разбавленная – до NO, то есть так, как будто взаимодействует с малоактивным металлом.
Читайте также:
