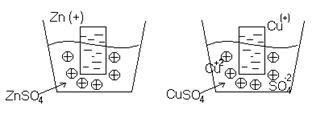
Как вытеснить металл из соли
Металлы в химических реакциях всегда восстановители. Восстановительную активность металла отображает его положение в электрохимическом ряду напряжений.
На основании ряда можно сделать следующие выводы:
1. Чем левее стоит металл в этом ряду, тем более сильным восстановителем он является.
2. Каждый металл способен вытеснять из солей в растворе те металлы, которые стоят правее
3. Металлы, находящиеся в ряду напряжений левее водорода способны вытеснять его из кислот.
Zn + 2HCl → ZnCl2 + H2
4. Металлы, являющиеся самыми сильными восстановителями (щелочные и щелочноземельные) в любых водных растворах прежде сего реагируют с водой.
Восстановительная способность металла, определённая по электрохимическому ряду не всегда соответствует его положению в периодической системе т.к в ряду напряжений учитывается не только радиус атома, но и энергия отрыва электронов.
Альдегиды, их строение и свойства. Получение, применение муравьиного и уксусного альдегидов.
Альдегиды – это органические соединения, в состав молекулы которых входит карбонильная группа, соединённая с водородом и углеводородным радикалом.
Физические свойства
Метаналь – газообразное вещество, водный раствор – формалинь
Химические свойства
Реактивом на альдегиды является Cu(OH)2
Применение
Наибольшее применение имеют метаналь и этаналь. Большое количество метаналя используется для получения фенолформальдегидной смолы, которую получают при взаимодействии метаналя с фенолом. Эта смола необходима для производства различных пластмасс. Пластмассы изготовлены для из фенолформальдегидной смолы в сочетании с различными наполнителями, называются фенопластами. При растворении фенолформальдегидной смолы в ацетоне или спирту получают различные лаки. При взаимодействии метаналя с карбамидом CO(NH2)2 получают карбидную смолу, а из нее – аминопласты. Из этих пластмасс изготавливают микропористые материалы для нужд электротехники.Метаналь идёт так же на производство некоторых лекарственных веществ и красителей. Широко применяется водный раствор, содержащий в массовых долях 40% метаналя. Он называетсяформалином. Его использование основано на свойстве свёртывать белок.
Получение
Альдегиды получают окислением алканов и спиртов. Этаналь получают гидротациейэтина и окислением этена.
Билет №12
Высшие оксиды химических элементов третьего периода. Закономерности в измерении их свойств в связи с положением химических элементов в периодической системе. Характерные химические свойства оксидов: основных, амфотерных, кислотных.
Оксиды – это сложные вещества, состоящие из двух химических элементов, один из которых является кислород со степенью окисления «-2»
С увеличением степени окисления элементов, увеличиваются кислотные свойства оксидов.
Na2O, MgO – основные оксиды
Al2O3 – амфотерный оксид
Основные оксиды реагируют с кислотами с образованием соли и воды.
Оксиды щелочных и щелочноземельных металлов реагируют с водой с образованием щёлочи.
Na2O + HOH → 2NaOH
Основные оксиды реагируют с кислотными оксидами с образованием соли.
Na2O + SO2 → Na2SO3
Кислотные оксиды реагируют со щелочами с образованием соли и воды
Реагирует с водой, с образованием кислоты
Амфотерные оксиды реагируют с кислотами и щелочами
Жиры, их свойства и состав. Жиры в природе, превращение жиров в организме. Продукты технической переработки жиров, понятие о синтетических моющих средствах. Защита природы от загрязнения СМС.
Жиры – это сложные эфиры глицерина и карбоновых кислот.
Общая формула жиров:
Твёрдые жиры образованы преимущественно высщими предельными карбоновыми кислотами – стеариновой C17H35COOH, пальмитиновой C15H31COOH и некоторыми другими. Жидкие жиры образованы главным образом высшими непредельными карбоновыми кислотами – олеиновойC17H33COOH, ленолевойC17H31COOH
Жиры наряду с углеводородами и белками входят в состав организмов животных и растений. Они являются важной составной частью пищи человека и животных. При окислении жиров в организме выделяется энергия. Когда в органы пищеварения поступают жиры, то под влиянием ферментов они гидролизуются на глицерин и соответствующие кислоты.
Продукты гидролиза всасываются ворсинками кишечника, а затем синтезируется жир, но уже свойственный организм. Потоком крови жиры переносятся в другие органы и ткани организма, где накапливаются или снова гидролизуются и постепенно окисляются до оксида углерода (IV) и воды.
Физические свойства.
Животные жиры в большинстве случаев твёрдые вещества, но встречаются и жидкие (рыбий жир). Растительные жиры чаше всего жидкие вещества – масла; известны и твёрдые растительные жиры – кокосовое масло.
Химические свойства.
Жиры в животных организмах в присутствии ферментов гидролизуются. Кроме реакций с водой, жиры взаимодействуют со щелочами.
В состав растительных масел входят сложные эфиры непредельных карбоновых кислот, то их можно подвергнуть гидрированию. Они превращаются в предельные соединения
Пример: Из растительного масла в промышленности получают маргарин.
Применение.
Жиры в основном применяют в качестве пищевого продукта. Раньше жиры использовали для получения мыла
Синтетические моющие средства.
Синтетические моющие средства оказывают вредное действие на окружающую среду, т.к. они устойчивы и с трудом подвергаются разрушению.
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH - | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | - | - | Н | Н | Н | |
| F - | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | - | Н | Р | Р |
| Cl - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | - | - | - | Н | - | - | Н | - | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | - | Н | ? | Н | Н | ? | М | М | - | Н | ? | ? |
| HSO3 - | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | - | Н | Р | Р |
| HSO4 - | Р | Р | Р | Р | Р | Р | Р | Р | - | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р |
| NO2 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | - | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO - | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р | Р | - | Р | Р | Р | Р | Р | Р | Р | - | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые (
Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую:
Скопируйте эту ссылку, чтобы разместить результат запроса " " на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Внимание, если вы не нашли в базе сайта нужную реакцию, вы можете добавить ее самостоятельно. На данный момент доступна упрощенная авторизация через VK. Здесь вы можете выбрать параметры отображения органических соединений. Эти параметры действуют только для верхнего изображения вещества и не применяются в реакциях.
Корректная работа сайта обеспечена на всех браузерах, кроме Internet Explorer. Если вы пользуетесь Internet Explorer, смените браузер. На сайте есть сноски двух типов: Подсказки - помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация - такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Разделение и осаждение металлов, получение конечных продуктовНаиболее распространенные методы разделения и выделения металлов и их соединений из растворов — осаждение (электролиз, цементация, перевод в нерастворимые соединения, кристаллизация), сорбция, экстракция. Выбор наиболее рационального метода должен производиться в каждом отдельном случае с учетом ряда факторов, из которых первостепенное значение имеют состав поступающего на осаждение раствора и требования, предъявляемые к чистоте конечной продукции. Например, в медной промышленности применяют электролиз для переработки богатых растворов и цементацию меди — для осаждения меди при концентрации менее 15 г/л [20, 76]. Осаждение металлов производят электролизом, цементацией, восстановлением соединений до металла водородом, разложением комплексных солей. Электролиз используют для извлечения металлов из очищенных растворов после выщелачивания (электроосаждение) и для получения чистых металлов из черновых продуктов (электрорафинирование). Этот метод получил широкое применение в гидрометаллургии меди, цинка, кадмия и марганца. При цементации вытеснение ионов одного металла из растворов его солей производя ионами другого металла, расположенного выше в ряду напряжений (более электроотрицательного). Медь цементируют железом; или чугунной стружкой, железным скрапом губчатым железом, обезоловяненными консервными банками; золото — цинковой стружкой, цинковой и алюминиевой пылью; кадмий — цинковой пылью, никель — кобальтовым порошком. Цементацию металлов производят в различных. аппаратах периодического или непрерывного действия (конусах барабанах, желобах, чанах, ваннах, аппаратах кипящего слоя). Кроме того, никель, кобальт и медь осаждают из аммиачных растворов восстановлением их до металла водородом под давлением 3,5—5 МПа. Осаждение меди или никеля из аммиачных растворов производят также разложением образовавшихся при выщелачивании комплексных углеаммониевых солей этих металлов. Медь осаждается в виде черной окиси меди, а никель — в виде карбоната. В результате дистилляции получают газообразный амиак и углекислоту, которые улавливают и вновь используют в процессе. Часто металлы осаждаются в виде нерастворимых соединений: гидроокисей, сульфидов, ксантогенатов, карбонатов, вольфраматов, молибдатов и др. При оптимальном рН среды можно практически полностью отделить молибден от вольфрама в виде сульфида из растворов, содержащих вольфрамат натрия тиосоединения молибдена. Большое распространение в гидрометаллургических процeccax получил гидролиз, при котором возможно селективное осаждение некоторых металлов в виде гидроокисей иди основных шей. При кристаллизации значительная часть извлекаемого металла осаждается в результате упарки и охлаждения раствора или изменения рН среды. Таким образом выделяют из раствора сульфат натрия при хлорирующем обжиге пиритных огарков и сульфат марганца при сернокислотном выщелачивании марганцевых руд. В вольфрамовой и молибденовой промышленности кристаллизацию применяют для получения чистых вольфрамата и молибдата аммония, содержание вредных примесей в которых не должно превышать тысячных долей процента. В некоторых случаях, особенно при получении полупроводниковых соединений редких металлов, требуется, чтобы суммарное содержание всех примесей не превышало 0,05—0,1%. Поэтому полученные соединения перечищают (растворяют или разлагают их, затем повторно осаждают, часто завершающей стадией осаждения является электролиз, кристаллизация или восстановление до металла водородом). Сорбционные и экстракционные методы извлечения металлов из растворов для значительного повышения концентрации их и очистки от вредных примесей получили широкое распространение в технологии урановых, золотосодержащих, вольфрамовых, молибденовых, медных и редко-метальных руд [20, 46, 92]. В качестве сорбентов применяют иониты— вещества, способные к обмену ионами с окружающим раствором и практически не растворимые в применяемых в гидрометаллургии растворителях. В зависимости от характера обмениваемых ионов эти вещества делят на катиониты и аниониты. Наибольшее распространение получила сорбция осветленных растворов в колонках с неподвижным слоем ионита. Однако в урановой и золотодобывающей промышленности успешно внедрена сорбция металла ионитами из жидкой фазы пульпы — бесфильтрационная сорбция. Возможность применения такого способа определяется значительной разницей в крупности ионита и выщелачиваемого материала, что позволяет отделить ионит пропусканием пульпы через сито с отверстиями соответствующего размера. При осуществлении такого варианта ионообменного процесса значительно упрощается и делается более экономичной технологическая схема вследствие исключения операций предварительного фильтрования пульпы. Весьма эффективно совмещение йоннообменной сорбции с выщелачиванием из руды полезных компонентов (ионообменное выщелачивание), позволяющее значительно повысить технико-экономические показатели гидрометаллургического процесса. Для последующей десорбции металлов из ионитов (элюирование) применяют растворы различных реагентов — нитрата аммоний или натрия, хлористого натрия, аммиака, едкого натра, углекислого натрия, минеральных кислот и др. Во многих случаях сорбция металлов характеризуется высокими технологическими показателями. Так, емкость анионита по урану составляет 30—50 кг/м 3 смолы в набухшем состоянии, извлечение металла из раствора достигает 98—99,8 %, На 1 м 3 загруженной смолы сорбируется 12—23 кг урана в сутки. Еще более высокая емкость получена по вольфраму и молибдену — до 160 кг/м 3 анионита. Продолжительность использования ионообменных сорбентов во многих случаях определяется постепенным снижением их емкости вследствие частичного «отравления» ионитов, образования инертных пленок и разрушения обменных групп. Кроме того, неизбежны механические потери ионитов. Например, после двух лет работы опытной установки, на которой уран извлекался непосредственно из пульпы, общие потери ионита вследствие истирания составили 23 %, а емкость уменьшилась на 10 %. Скорость поглощения и элюирования осталась прежней. В качестве сорбента применяют также активированный уголь, главным образом для сорбции золота и серебра из цианистых растворов. Очистка растворов от мышьяка и сурьмы, коллоидальной серы и некоторых других вредных примесей осуществляется сорбцией их гидратом окиси железа. Все большее значение в гидрометаллургии приобретают экстракционные процессы, при которых водный раствор солей металлов вступает в контакт с несмешивающейся с водой органической жидкостью, извлекающей определенные металлы из исходного раствора в виде комплексных соединений. Эффективность экстракционного процесса количественно характеризуется коэффициентом распределения извлекаемого металла где Y — концентрация металла в органической фазе; X — то же, в водной фазе. Практически процесс экстракции может быть реализован при коэффициенте распределения металла не менее 0,3—0,5. Высокое извлечение или практически полное разделение металлов достигается при условии противоточного осуществления процесса, когда операция экстракции повторяется многократно. В ряде случаев при экстракции достигается высокая селекция металлов из растворов, позволяющая осуществить разделение весьма близких по химическим свойствам элементов. В качестве экстрагентов используют амины, кетоны, карбоновые кислоты, спирты, эфиры, фосфорсодержащие соединения.. В качестве растворителей экстрагентов (разбавителей) применяют углеводороды и их хлорпроизводные. После отделения органической фазы от водной производится реэкстракцкя металла обработкой органической фазы щелочным или кислым раствором, а иногда только водой. В реэкстракте можно получить концентрацию извлекаемых элементов во много раз выше, чем в исходном растворе. Экстракцию широко применяют в урановой промышленности. В настоящее время значительные успехи по экстракции достигнуты также в технологии извлечения и очистки многих редких и некоторых цветных металлов — меди, никеля, кобальта, тантала, ниобия, вольфрама, молибдена, рения, индия, германия, гафния и др. В промышленности для экстракции применяют смесители, отстойники, колонны с насадкой, тарельчатые колонны с пульсацией, центробежные экстракторы и т. д. Модели организации как закрытой, открытой, частично открытой системы: Закрытая система имеет жесткие фиксированные границы, ее действия относительно независимы. Как распознать напряжение: Говоря о мышечном напряжении, мы в первую очередь имеем в виду мускулы, прикрепленные к костям . Организация как механизм и форма жизни коллектива: Организация не сможет достичь поставленных целей без соответствующей внутренней. Как построить свою речь (словесное оформление): При подготовке публичного выступления перед оратором возникает вопрос, как лучше словесно оформить свою.
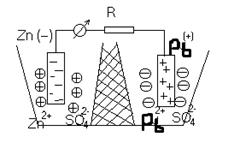
Металлы в растворе собственной соли.
Количество ионов, которые будут взаимодействовать с раствором соли, будет меньше, т.к. соль уже содержит некоторое количество ионов этого металла. Т.е. имеет большое значение какой металл и какая концентрация металла в соли, поведение металла. Например: медь из раствора соли перейдет в электрод, т.е. имеются в виду положительные ионы. Гальванический элемент – любое устройство, позволяющее получать электрический ток, за счет протекания химических реакций. Гальваническая цепь – последовательная совокупность скачков потенциала на границе раздела фаз. Максимальная разность потенциалов, отвечающая обратимому протеканию химической реакции – ЭДС (Е)
Каждые два металла, будучи погруженными в растворы их солей, которые сообщаются между собой посредством сифона, заполненного электролитом, образуют гальванический элемент. Пластинки металлов, погруженные в растворы, называются электродами элемента. Если соединить наружные концы электродов (полюсы элемента) проволокой, то от металла, у которого величина потенциала меньше, начинают перемещаться электроны к металлу, у которого она больше (например, от Zn к Pb). Уход электронов нарушает равновесие, существующее между металлом и его ионами в растворе, и вызывает переход в раствор нового количества ионов – металл постепенно растворяется. В то же время электроны, переходящие к другому металлу, разряжают у его поверхности находящиеся в растворе ионы - металл выделяется из раствора. Электрод, на котором протекает окисление, называется анодом. Электрод, на котором протекает восстановление, называется катодом. В свинцово-цинковом элементе цинковый электрод является анодом, а свинцовый – катодом. Таким образом, в замкнутом гальваническом элементе происходит взаимодействие между металлом и раствором соли другого металла, не соприкасающимися непосредственно друг с другом. Атомы первого металла, отдавая электроны, превращаются в ионы, а ионы второго металла, присоединяя электроны, превращаются в атомы. Первый металл вытесняет второй из раствора его соли. Например, при работе гальванического элемента, составленного из цинка и свинца, погруженных соответственно в растворы Zn(NO3)2 и Pb(NO3)2 у электродов происходят следующие процессы: Суммируя оба процесса, получаем уравнение Zn + Pb 2+ ↔ Pb + Zn 2+ , выражающее происходящую в элементе реакцию в ионной форме. Молекулярное уравнение той же реакции будет иметь вид: Электродвижущая сила гальванического элемента равна разности потенциалов двух его электродов. При определении его всегда вычитают из большего потенциала меньший. Например, электродвижущая сила (Э.д.с.) рассмотренного элемента равна:
Такую величину она будет иметь при условии, что металлы погружены в растворы, в которых концентрация ионов равна 1 г-ион/л. При других концентрациях растворов величины электродных потенциалов будут несколько иные. Их можно вычислить по формуле: E = E 0 + (0,058 / n) • lgC уравнение Нернста или E = E 0 + • lgC где E - искомый потенциал металла (в вольтах) E 0 - его нормальный потенциал n - валентность металла (зарядность иона) С - концентрация ионов в растворе (г-ион/л) F – число Фарадея R – универсальная газовая постоянная Т – температура по абсолютной шкале Пример: Найти электродвижущую силу элемента (э. д. с.) образованного цинковым электродом, опущенным в 0,1 М раствор Zn(NO3)2 и свинцовым электродом, опущенным в 2 М раствор Pb(NO3)2. Решение: Вычисляем потенциал цинкового электрода: EZn = -0,76 + (0,058 / 2) lg 0,1 = -0,76 + 0,029 • (-1) = -0,79 v Вычисляем потенциал свинцового электрода: EPb = -0,13 + (0,058 / 2) lg 2 = -0,13 + 0,029 • 0,3010 = -0,12 v Находим электродвижущую силу элемента: Э. д. с. = -0,12 – (-0,79) = 0,67 v Электролиз Совокупность окислительно-восстановительных реакций, которые протекают на электродах в растворах или расплавах электролитов при пропускании через них электрического тока, называют электролизом. Сущность электролиза заключается в том, что при пропускании тока через раствор электролита (или расплавленный электролит) положительно заряженные ионы перемещаются к катоду, а отрицательно заряженные – к аноду. Достигнув электродов, ионы разряжаются, в результате чего у электродов выделяются составные части растворенного электролита или водород и кислород из воды. Для перевода различных ионов в нейтральные атомы или группы атомов требуется различное напряжение электрического тока. Одни ионы легче теряют свои заряды, другие труднее. Степень легкости, с которой разряжаются (присоединяют электроны) ионы металлов, определяется положением металлов в ряду напряжений. На катоде источника тока происходит процесс передачи электронов катионам из раствора или расплава, поэтому катод является “восстановителем”. На аноде происходит отдача электронов анионами, поэтому анод является “окислителем”. При электролизе как на аноде, так и на катоде могут происходить конкурирующие процессы. При проведении электролиза с использованием инертного (нерасходуемого) анода (например, графита или платины), как правило, конкурирующими являются два окислительных и два восстановительных процесса: на аноде — окисление анионов и гидроксид-ионов, на катоде — восстановление катионов и ионов водорода. При проведении электролиза с использованием активного (расходуемого) анода процесс усложняется и конкурирующими реакциями на электродах являются: на аноде — окисление анионов и гидроксид-ионов, анодное растворение металла — материала анода; на катоде — восстановление катиона соли и ионов водорода, восстановление катионов металла, полученных при растворении анода. При выборе наиболее вероятного процесса на аноде и катоде следует исходить из положения, что будет протекать та реакция, для которой требуется наименьшая затрата энергии. При использовании инертных электродов используют следующие правила: 1. На аноде могут образовываться следующие продукты: а) при электролизе растворов, содержащих в своем составе анионы F - , SO4 2- , NО3 - , РО4 3- (если электролизу подвергается соль кислородсодержащей кислоты или сама кислота, то разряжаются гидроксильные ионы, а не ионы кислородных остатков), а также растворов щелочей выделяется кислород Образующиеся при разряде гидроксильных ионов нейтральные группы ОН - тотчас же разлагаются по уравнению: 4OH- ® 2H2O + O2В результате у анода выделяется кислород. б) при окислении анионов Сl - , Вr - , I - выделяются соответственно хлор, бром, иод; в) при окислении анионов органических кислот происходит процесс: 2. При электролизе растворов солей, содержащих ионы, расположенные в ряду напряжений левее Аl 3+ , на катоде выделяется водород; если ион расположен в ряду напряжений правее водорода, то на катоде выделяется металл. Чем левее стоит металл в ряду напряжений, чем больше его отрицательный потенциал (или меньше положительный потенциал), тем труднее при прочих равных условиях разряжаются его ионы (легче всего разряжаются ионы Аu 3+ , Ag + ; труднее всегоLi + , Rb + , K + ). Если в растворе одновременно находятся ионы нескольких металлов, то в первую очередь разряжаются ионы того металла, у которого отрицательный потенциал меньше (или положительный – больше). Например, из раствора, содержащего ионы Zn 2+ и Cu 2+ , сперва выделяется металлическая медь. Но величина потенциала металла зависит также и от концентрации его ионов в растворе; точно также изменяется и легкость разряда ионов каждого металла в зависимости от их концентрации: увеличение концентрации облегчает разряд ионов, уменьшение – затрудняет. Поэтому при электролизе раствора, содержащего ионы нескольких металлов может случиться, что выделение более активного металла будет происходить раньше, чем выделение менее активного (если концентрация ионов первого металла значительна, а второго – очень мала). 3. При электролизе растворов солей, содержащих ионы, расположенные в ряду напряжений между Al + и Н + , на катоде могут протекать конкурирующие процессы как восстановления катионов, так и выделения водорода. Только при электролизе солей натрия, кальция и других металлов до алюминия включительно разряжаются ионы водорода и выделяется водород. Рассмотрим в качестве примера электролиз водного раствора хлорида меди на инертных электродах. В растворе находятся ионы Сu 2+ и 2Сl - , которые под действием электрического тока направляются к соответствующим электродам: На катоде выделяется металлическая медь, на аноде — газообразный хлор. Если в рассмотренном примере электролиза раствора CuCl2 в качестве анода взять медную пластинку, то на катоде выделяется медь, а на аноде, где происходят процессы окисления, вместо разрядки ионов Сl - и выделения хлора протекает окисление анода (меди). В этом случае происходит растворение самого анода, и в виде ионов Си он переходит в раствор. Электролиз CuCl2 с растворимым анодом можно записать так: Электролиз растворов солей с растворимым анодом сводится к окислению материала анода (его растворению) и сопровождается переносом металла с анода на катод. Это свойство широко используется при рафинировании (очистке) металлов от загрязнений. Электролиз раствора хлорида никеля NiCl2 Раствор содержит ионы Ni 2+ и Cl - , а также в ничтожной концентрации ионы Н + и ОН - . При пропускании тока ионы Ni 2+ перемещаются к катоду, а ионы Cl - – к аноду. Принимая от катода по два электрона, ионы Ni 2+ превращаются в нейтральные атомы, выделяющиеся из раствора. Катод постепенно покрывается никелем. Ионы хлора,достигая анода, отдают ему электроны и превращаются в атомы хлора, которые, соединяясь попарно, образуют молекулы хлора. У анода выделяется хлор. Таким образом, у катода происходит процесс восстановления, у анода – процесс окисления. Читайте также:
|