Как называется цвет металла
Цветные металлы — особый класс нержавеющих металлов и сплавов, в составе которых нет железа. Сюда входят олово, медь, цинк, никель, серебро, золото. Металлы называются цветными, потому что каждый из них имеет определенный окрас. Они отличаются прочностью и долговечностью, поскольку формируют на своей поверхности защитную оксидную пленку и проявляют устойчивость к негативным факторам внешней среды.
В начале XX века насчитывалось около 20 наименований нежелезных металлов, а сегодня их количество уже превышает 70. Добычей, обогащением руд и выплавкой таких материалов занимается цветная металлургия. Способ производства — высокотемпературная плавка. За каждым изделием стоит долгая и кропотливая работа — металлы подвергаются механической обработке и проходят через ковку, сварку, прессование, штамповку, грунтование и прочие процессы.
Свойства
Цветные металлы обладают высокой тепло– и электропроводностью, коррозионной стойкостью, стабильностью в температурном диапазоне и инертностью к воздействию агрессивной среды. В отличие от железа, они не реагируют на влагу и кислород, растворяют газы при нагревании (кроме интертных) и с легкостью взаимодействуют с ними.
Группы
Ученые подразделяют цветные металлы на несколько групп:
- Тяжелые. Олово, медь, никель, цинк, свинец и т.п. Добываются из сульфидных и окисленных полиметаллических руд. Мировое производство металлов данной категории достигает нескольких миллионов тонн в год.
- Легкие. Алюминий, титан, магний, натрий, калий, кальций, бериллий, стронций, барий и другие элементы этой группы имеют самую низкую удельную массу среди остальных нежелезных металлов.
- Благородные. Золото, серебро, платина, рутений, родий, палладий, осмий и иридий входят в число редких драгоценных металлов и отличаются повышенной стойкостью к окислению и коррозии.
- Малые. Представители группы — ртуть, кобальт, мышьяк, сурьма, висмут и т.п. Добываются в небольшом количестве вместе с тяжелыми металлами.
- Тугоплавкие. Известны как самые износостойкие металлы. К ним относится цирконий, ванадий, хром, вольфрам, молибден и другие элементы с высокой плотностью и температурой плавления.
- Редкоземельные. Представлены 17 металлами серебристо–белого цвета: гольмий, тулий, скандий, самарий, европий, диспрозий, лютеций, прометий и т.д. Обладают одинаковыми химическими свойствами.
Применение
В последние годы спрос на цветные металлы резко увеличился. Они влияют на развитие многих отраслей промышленности и широко применяются в авиа– и машиностроении, радиоэлектронике, ракетной и атомной технике, сфере высоких технологий, а также в быту.
Нежелезные металлы — незаменимое сырье в производстве металлопроката, крупных конструкций и небольших изделий.
Вы можете заказать цветные металлы и сплавы на нашем сайте. На странице каталога представлен широкий ассортимент товаров с подробным описанием и ценами. Стоимость за 1 кг зависит от вида материала и варьируется от 135 до 2200 рублей. Денежные средства принимаем на расчетный счет. Подробнее об условиях покупки цветного металла в Москве и регионах России читайте здесь.
Цветные металлы: список, названия, классификация и использование
Ведущей отраслью в экономике нашей страны является металлургия. Для успешного ее развития нужно много металла. В данной статье речь пойдет о цветных тяжелых и легких металлах и их использовании.
Классификация цветных металлов
В зависимости от физических свойств и назначения, они подразделяются на такие группы:
- Легкие цветные металлы. Список этой группы большой: в ее состав входит кальций, стронций, цезий, калий, а также литий. Но в металлургической промышленности чаще всего используются алюминий, титан и магний.
- Тяжелые металлы пользуются большой популярностью. Это всем известные цинк и олово, медь и свинец, а также никель.

- Благородные металлы, такие как платина, рутений, палладий, осмий, родий. Золото и серебро широко применяются для изготовления украшений.
- Редкоземельные металлы - селен и цирконий, германий и лантан, неодим, тербий, самарий и другие.
- Тугоплавкие металлы - ванадий и вольфрам, тантал и молибден, хром и марганец.
- Малые металлы, такие как висмут, кобальт, мышьяк, кадмий, ртуть.
- Сплавы – латунь и бронза.
Легкие металлы
Они имеют широкое распространение в природе. Эти металлы обладают маленькой плотностью. У них высокая химическая активность. Они представляют собой прочные соединения. Металлургия этих металлов начала развиваться в девятнадцатом веке. Их получают путем электролиза солей в расплавленном виде, электротермии и металлотермии. Легкие цветные металлы, список которых имеет много пунктов, используются для производства сплавов.
Алюминий
Относится к легким металлам. Имеет серебристый цвет и точку плавления около семисот градусов. В промышленных условиях используется в сплавах. Он применяется везде, где нужен металл. У алюминия плотность низкая, а прочность – высокая. Этот металл легко режется, пилится, сваривается, сверлится, паяется и сгибается.

Сплавы образует с металлами различных свойств, такими как медь, никель, магний, кремний. Они обладают большой прочностью, не ржавеют при неблагоприятных погодных условиях. У алюминия высокая электро- и теплопроводность.
Магний
Он относится к группе легких цветных металлов. Имеет серебристо-белый цвет и пленочное окисное покрытие. Обладает маленькой плотностью, хорошо обрабатывается. Металл устойчив к воздействию горючими веществами: бензином, керосином, минеральными маслами, но подвержен растворению в кислотах. Магний не магнитен. Обладает низкими упругими и литейными свойствами, подвергается коррозии.
Титан
Это легкий металл. Он не магнитен. Имеет серебристый цвет с отливом голубоватого тона. Обладает высокой прочностью и устойчивостью к коррозии. Но у титана маленькая электропроводность и теплопроводность. Теряет механические свойства при температуре 400 градусов, приобретает хрупкость при 540 градусах.

Механические свойства титана повышаются в сплавах с молибденом, марганцем, алюминием, хромом и другими. В зависимости от легирующего металла, сплавы имеют разную прочность, среди них есть и высокопрочные. Такие сплавы применяются в самолетостроении, машиностроении, судостроении. Из них производят ракетную технику, бытовые приборы и многое другое.
Тяжелые металлы
Тяжелые цветные металлы, список которых весьма широк, получают из сульфидных и окисленных полиметаллических руд. В зависимости от их типов, методы получения металлов отличаются по способу и сложности производства, в процессе которого должны полностью извлекаться ценные составляющие сырья.
Металлы этой группы бывают гидрометаллургическими и пирометаллургическими. Полученные любым методом металлы называются черновыми. Они подвергаются процедуре рафинирования. Только после этого их можно использовать в промышленных целях.
Цветные металлы, список которых представлен выше, в промышленности используются не все. В данном случае речь идет о распространенном тяжелом металле – меди. У нее высокая теплопроводность, электропроводность и пластичность.

Сплавы меди нашли широкое применение в такой отрасли промышленности, как машиностроение, а все благодаря тому, что этот тяжелый металл хорошо сплавляется с другими.
Он тоже представляет цветные металлы. Список названий большой. Однако далеко не все тяжелые цветные металлы, к которым относится цинк, используются в промышленности. Этот металл хрупкий. Но если нагреть его до ста пятидесяти градусов, он будет без проблем коваться и с легкостью прокатываться. У цинка высокие антикоррозионные свойства, но он поддается разрушению при воздействии щелочью и кислотой.
Свинец
Список цветных металлов будет неполным без свинца. Он серого цвета с проблеском голубого оттенка. Температура плавления составляет триста двадцать семь градусов. Он тяжелый и мягкий. Хорошо куется молотком, при этом не твердеет. Из него выливают различные формы. Устойчив к воздействию кислот: соляной, серной, уксусной, азотной.
Латуни
Это сплавы из меди и цинка с добавлением марганца, свинца, алюминия и других металлов. Стоимость латуни меньше, чем меди, а прочность, вязкость и коррозионная стойкость – выше. У латуни хорошие литейные свойства. Из нее производят детали путем штамповки, раскатки, вытяжки, вальцовки. Из этого металла делают гильзы для снарядов и многое другое.
Использование цветных металлов
Цветными называют не только сами металлы, но и их сплавы. Исключение составляет так называемый "чермет": железо и, соответственно, его сплавы. В странах Европы цветные металлы носят название нежелезистых. Цветные металлы, список которых немаленький, нашли широкое применение в разных отраслях во всем мире, в том числе и в России, где являются основной специализацией. Производятся и добываются на территориях всех регионов страны. Легкие и тяжелые цветные металлы, список которых представлен большим разнообразием наименований, составляют отрасль промышленности под названием «Металлургия». Это понятие включает в себя добычу, обогащение руд, выплавку как металлов, так и их сплавов.

В настоящее время отрасль цветной металлургии получила широкое распространение. Качество цветных металлов очень высокое, они отличаются долговечностью и практичностью, применяются в строительной индустрии: ими отделывают здания и сооружения. Из них производят профильный металл, проволоку, ленты, полосы, фольгу, листы, прутки различной формы.
ЦВЕТНЫЕ МЕТАЛЛЫ — всё, кроме железа
Цветные металлы отличаются от черных. Цветных металлов много, а к черным относятся только железо, его сплавы. Часто к черным металлам относят ванадий, марганец, хром.
В Европе цветные металлы называют нежелезными, происхождение этих названий точнее отражает суть и свойства наших героев.
- Англичане называют их non-ferrous metals.
- Для немцев их название — Nichteisenmetalle, Buntmetalle.
- Французы обозначили цветные металлы как меtaux non-ferreux.
Разделяем металлы по свойствам и группам
Условно цветные металлы различают на 2 большие группы — тяжелые и легкие.

Более подробная классификация проводится по свойствам (физико-химическим). Есть разделение на 5 и 7 групп.
Виды цветных металлов:
- Легкие цветные металлы.
- Тяжелые металлы. .
- Редкие и малые.
- Рассеянные.
- Радиоактивные.
- Тугоплавкие.
Свойства цветных металлов разнообразны. Это устойчивость к коррозии, высокие электро-и теплопроводность, устойчивость во многих агрессивных средах.
Где применяются
Представьте мир без цветных металлов. Выбросите телефон и компьютер, вместе с ними ключи от машины. Отключите свет — ведь ток течет по проводам из цветмета. Газовую и электрическую плиту тоже придется выбросить, а готовить на костре или построить печку. Поэтому к этим разным и таким нужным человечеству металлам давайте относиться уважительно.
Невозможно представить современный мир без использования цветных металлов.
Некоторые из них добываются миллионами тонн в год, другие по несколько тонн в год. Но все они абсолютно необходимы современной промышленности и нам, потребителям.
Электротехника, легировка сталей, сенсоры, диоды, термопары, инфракрасная оптика, военно-промышленный комплекс.
Знакомство с нежелезными металлами
Список цветных металлов обширен. Руд цветных металлов в разы больше.

Важными рудами на медь являются халькозин, борнит, халькопирит. Встречается и самородная медь, но редко. Про медь читайте здесь.

Добычу медных руд производят:
Познавательно: крупнейшее месторождение в мире находится в знойной пустыне Атакама, его пока не разрабатывают.
Алюминий
Главное сырье на алюминий — бокситы. Руды бокситов — диаспор (его ювелирная разновидность султанит подробно описана здесь), гетит, бемит, каолинит. Подробнее про этот металл читайте на этой странице.

Российские месторождения бокситов находятся в областях:
- Архангельской;
- Белгородской;
- Свердловской;
- Челябинской.
Богатые запасы бокситов расположены в Корее, Венгрии, Югославии, Китае.
Значительные запасы бокситовых руд в Австралии, Бразилии, США, Франции.
Свинец
Главная руда на свинец — галенит, кроме него церуссит и англезит.

Галенит образует полиметаллические руды со сфалеритом и халькопиритом.
48 стран мира могут добывать на своей территории свинец.
Основная цинковая руда — сфалерит. Это сульфид цинка, и в природе его естественными спутниками являются галенит и халькопирит.

Главные мировые запасы цинка находятся в Канаде, немногим отстают Китай, Австралия, США.
В России цинк добывают на Каменном Поясе. Есть месторождения в Сибири и Приморье.
Магний
Этого цветного металла в земной коре около 2%.

Руд, содержащих магний, около 60, но для промышленной добычи используют:
- доломит;
- магнезит;
- брусит;
- карналлит;
- морская вода.
Каждая страна обладает запасами магния. Магнезит находят в США, Испании, Австралии, Канаде, Югославии, Греции. Карналлит используют в странах СНГ.
Огромные запасы магния находятся в воде залива Кара-Богаз-Гол.
Никель
Никелевые руды могут быть сульфидные и силикатные. Подробнее о металле читайте здесь.

- халькопирит;
- пирротин;
- магнетит;
- пентландит.
Силикатные никелевые руды:
- гарниерит;
- гетит;
- ревдинскит;
- контронит;
- асболан.
Кобальт
В природе немного кобальтсодержащих руд, особенно пригодных для промышленного использования. Среди них кобальтин, скуттерудит, линнеит, шмальтин, эритрин.

По минеральному и химическому составу кобальтовые руды делятся на сульфидные, арсенидные, оксидные. В основном все руды комплексные, собственно кобальтовые встречаются только среди мышьяковых (арсенидных) руд.
За рубежом кобальтосодержащие месторождения находятся в Канаде, Финляндии, Австралии, Африке.
В России — на Урале, в Красноярском крае, на Кольском полуострове.
Основные добытчики кобальта — Заир и Замбия.
Олово
Главные минералы для добычи олова — касситерит и станнин. Половина добычи олова приходится на месторождения Юго-Восточной Азии. Подробнее про олово написано здесь.

Немного отстает Китай, за ним идут Индонезия, Малайзия, Бразилия, Россия.
Молибден
Основной рудный минерал на молибден — молибденит. В природе «дружит» с сульфидами меди и касситеритом.

В добыче металла первенствуют США, следом идут Чили и Китай, на третьем месте — Канада.
В России тоже есть молибденовые руды, в Забайкалье, на Северном Кавказе, на юге Западной Сибири.
Вольфрам
Основные руды на вольфрам — вольфрамит и шеелит.

Китаю повезло, у него более 40% мировых запасов вольфрамита. Россия отстала не сильно, у нас шеелит есть на Кавказе, в Забайкалье, на Чукотке.
Есть месторождения в Германии, Канаде, Турции, США.
Висмут
Существует самородный висмут. В Боливии и Австралии его добывают вместе с висмутином. Подробнее о нём читайте здесь.

Боливия единственная страна, где металл добывают прямо из висмутовой руды. В основном висмут извлекают из полиметаллических руд.
Мировые лидеры по запасам:
- Перу;
- Мексика;
- Китай;
- Австралия;
- Канада.
Месторождения висмутовых руд редки и невелики по масштабам.
Сурьма
Главный источник сурьмы — антимонит. Кроме него, рудой на сурьму могут служить бертьерит, джемсонит, ливингстонит, стибиконит.

Австралия, Россия и Китай обладают залежами антимонита, остальные страны могут только облизываться на такое богатство. Среди завидующих США, КНР, ЮАР. У них есть полиметаллические месторождения.
Ртуть
Киноварь — единственный минерал для качественной добычи ртути.

Основные производители жидкого металла:
Россия обладает небольшими запасами киновари на Чукотке, Алтае, Камчатке.
У Америки с этим и того хуже — маленький рудничок в Неваде.
А вот на юге Испании известно ртуть добывают почти две тысячи лет.
Вторичное сырье
Уже понятно, что добыча цветмета не всегда обеспечивает потребности промышленности. Приходится изворачиваться. То есть организовывать пункты приема вторсырья, собирать металлолом для сдачи в этих пунктах. Кстати, за лом цветных металлов платят довольно неплохо.
Стоимость металлических отходов формируется, исходя из нескольких компонентов:
- Металл (тип, редкость).
- Габариты.
- Размер партии.
- Чистота металла, его качество.
Охотникам за металлоломом
Большим спросом у приемщиков пользуются медь, алюминий, свинец, титан.
- Медь содержат сплавы меди (латунь).
- Олово гораздо дороже меди, особенно в чистом виде, но и в виде посуды, баббита (в подшипниках, например).
- Никель металл дорогостоящий, но в чистом виде попадается редко. В мельхиоровой посуде, отработанных электродах, ТЭНах бытовых приборов.
- Свинец сдают «в виде» аккумуляторов, типографского оборудования, оплетки кабелей.
- Алюминий стоит недорого.
- Чистый цинк найти проблематично, сдают его в виде сплавов.
- Самые дорогие металлы — молибден и вольфрам.
Плюсы и минусы переработки вторсырья
Перерабатывать металлолом выгодно, это понижает себестоимость продукции.
Цветмет приходится сортировать — это самый нудный и трудоемкий этап работы.
Рассортированное сырье измельчают. Для этого применяют газовые резки, шредеры, а потом прессуют для уменьшения объемов и удобства транспортировки.
Далее подготовленное сырье отправляют на металлургические комбинаты, или продают (чаще всего на экспорт).

Мне 42 года и я специалист в области минералогии. Здесь на сайте я делюсь информацией про камни и их свойства — задавайте вопросы и пишите комментарии!
Цвета побежалости металлов
Цвета побежалости – спектр цветов, образующихся на поверхности железных сплавов в результате появления окисной пленки. Они образуются при нагревании поверхностей из металла до определенных температур без участия воды. Цвета побежалости являются дефектом сварного соединения.
Происхождение
В природе цвета побежалости образуются на поверхности многих минералов, включая пирит и халькопирит. Из-за окисления они покрываются тонкой оксидной пленкой, преломляющий солнечный свет. В результате интерференции поверхности металла окрашивается в разные цвета. Яркость побежалости зависит от толщины оксидной пленки и длины волны. Наиболее яркие цвета побежалости образуются на медных минералах. Также цвет зависит от качественного состава металла. Если в элементе присутствует большое количество ионов металлов, то он окрашивается в синие цвета. При наличии хромофоров минералы становятся красными.

Также цвета побежалости могут образовывать в естественных условиях на поверхностях старых стекол или монет. Изменение окраса может быть обусловлено длительным контактом этих материалов с землей. Если на них присутствует жировая пленка, то они окрашиваются в радужный цвет. Побежалость скрывает настоящий цвет металла. Поэтому нельзя определять его истинный окрас на свежем изломе. Рекомендуется определять цвет при рассмотрении оксидной пленки.
Искусственно цвета побежалости образуются на поверхности металлических заготовок при сварке или закалке. Они появляются при нагревании металлов до критических температур без участия молекул воды или иных жидкостей. Во время нагревания происходит процесс образования оксидной пленки. Ее толщина составляет несколько молекул и уменьшается по мере нагрева. Это обусловлено явлением диффузии – процессом проникновения мельчайших частиц одного химического элемента в другой. В данном случае происходит взаимодействие атомов металла и кислорода. На углеродистых сталях пленки из оксидов возникают быстрее, чем на легированных.
Процедура покрытия стали и железа слоем оксидной пленки называется воронением. После проведения этой процедуры повышается коррозийная стойкость изделия. Обработанные детали не покрываются ржавчиной. Процедура воронения позволяет придать изделию окрас, даже если металлическая поверхность по условиям эксплуатации не подлежит покраске. Во время воронения заготовку протирают минеральным маслом и нагревают на железном листе. После выгорания масляной жидкости на заготовке появляются цвета побежалости. Для нужного окраса необходимо нагреть деталь до соответствующей температуры. Получившийся слой окисла является влагоустойчивым и не подвергается воздействию воздуха.

На скорость образования окисных пленок влияют следующие факторы:
- Структура поверхности: закаленные детали окисляются с большей скоростью.
- Загрязненность изделия: поверхности, покрытые маслом, при длительном нагреве обугливаются, что приводит к возникновению сажи. По этой причине образуется неровная и тонкая оксидная пленка.
- Наличие шероховатостей: если нагревается заготовка с шершавой поверхностью, то оксидная пленка получается плотной. Если перед процедурой термообработки отполировать деталь, то образуется тонкая пленка из оксидов.
- Оборудование для нагрева: если при термообработке применяются специальные нагревательные печи, способные поддерживать устойчивую температуру, то окисная пленка будет плотной. В бытовых условиях можно также использовать духовые шкафы, газовые горелки или металлургические печи (горны).
Тонкие оксидные пленки поглощают световые волны с меньшей длиной волны, но отражают – с большей. Цвет металлических деталей меняется в зависимости от температуры и плотности оксидной пленки. Чем толще оксидная пленка, тем светлее окраска. Синий или фиолетовый цвет получается, когда из спектра отражаются наиболее длинные волны. Если пленка из оксидов отражает волны с малой длиной волны, то металлическая поверхность становится желтой. Светлые цвета соответствуют высокой температуре нагрева, светлые – более низкой. По этой причине многие мастер часто определяют при помощи цветов побежалости степень закалки изделий, стальной стружки и режущих инструментов, применяемых во время проведения токарных работ.
Несмотря на эти факторы, при помощи цветов побежалости нельзя точно определить температуру металла, потому что на величину этого показателя оказывают влияние следующие факторы:
- время нагрева: промежуток времени, в течение которого металлическая деталь нагревается до температуры окружающей среды при отсутствии теплоотдачи.
- наличие различных примесей в составе металла;
- особенности освещения в помещении, где проводилась сварка или закалка заготовок;
- скорость разогревания: изменение температуры изделия в единицу времени при его нагревании.
В современной промышленности контроль температуры производится при помощи специальных приборов – пирометров. Они оснащены специальными датчиками, определяются степень нагрева заготовки при помощи лазера.

Цвета побежалости используются при изготовлении рабочих инструментов, лазерной маркировке и внешней обработке изделий из железа, меди, алюминия и латуни. Если требуется изготовить инструментарии с высокой плотностью (бритвенные лезвия, предметы для проведения хирургических операций, режущие кромки резцов и грабштихели), то побежалость должна быть яркого цвета: красного, оранжевого или желтого. До пурпурных и зеленых тонов нагревают инструменты, применяющихся в деревообрабатывающем секторе. Для достижения упругости при изготовлении пил, ножей, вил и пружин необходимо нагреть заготовки до появления синих или черных цветов.
В процессе нагревания металлическая заготовка становится гибкой, что позволяет мастеру придать ей необходимую форму. После данного процесса изделие закаляется при определенных температурах. Согласно рекомендациям специалистов, оптимальной температурой для закалки металлов является 700–800 °C. В этом случае изделие окрашивается в разные оттенки красного или розового цветов. При превышении этих значений на 300 °C заготовка становится оранжевой или желтой. При больших температурах происходит перекал, что негативно сказывается на прочности изделия.
Закалка улучшает следующие параметры металлической поверхности:
- Твердость: этот показатель является номинальным. Он прописан в шкале Роквелла и измеряется в HRC. Твердость определяет степень сопротивляемости металла к механическим повреждениям. На мягких изделиях при длительном соприкосновении с иными поверхностями остаются следы, что ухудшает их режущие свойства. Твердость ножей европейского образца составляет 60 HRC, азиатских – 70 HRC.
- Упругость: данный параметр определяет степень деформации металла при изгибах и ударах. Если сталь закалена, при изгибе на 10–30° она вернется в исходное положение. При перегреве снижается упругость поверхности, что приводит к поломке инструментов.
- Износостойкость: данный критерий показывает общую стойкость металла (сопротивление абразивному износу, стойкость к большим нагрузкам). При правильной закалке изделие сможет стабильно функционировать в течение более длительного срока.
После закалки заготовка приобретает высокую твердость. Для восстановления ее прочности необходимо провести процедуру отпуска, представляющую собой повторную термообработку детали. Металлическое изделие нагревается до более низких температур и охлаждается. Между закалкой и охлаждением также осуществляется полное остывание металлической поверхности при помощи его погружения в раствор соли или в масло. При выборе отпуска необходимо учитывать следующие особенности:
- Для изделий, подвергающимся деформациям или ударным нагрузкам, нужно использовать высокотемпературный отпуск: до 700 °C.
- Для легких клинков используется среднетемпературный отпуск: до 500 °C.
- Для обеспечения оптимальной твердости применяется низкотемпературный отпуск: до 250 °C. Но в этом случае изделие не сможет выдерживать высокие ударные нагрузки и будет легко деформироваться.

Температура цветов побежалости и каления
Во время отпуска возникают цвета каления. По ним можно определить, до какой температуры нагрелась заготовка. В отличие от побежалости, цвета каления меняются в процессе охлаждения металлической поверхности. Переход между цветами осуществляется в строгой последовательности, но с быстрой скоростью, поэтому мастер должен тщательно контролировать процесс термообработки.
Шкала цветов побежалости стали
Окрас углеродистых деталей при соответствующих температурах указан в следующей шкале цветов побежалости стали:
| Окрас | Пределы температур, °С |
| Лимонный | 220 – 229 |
| Желтый (цвет соломы) | 230 – 245 |
| Золотой | 246 – 255 |
| Земляной или коричневый | 256 – 264 |
| Алый или красно-оранжевый | 265 — 274 |
| Пурпурный | 275 – 279 |
| Аметистовый | 280 – 289 |
| Небесный | 290 – 294 |
| Твиттера | 295 – 299 |
| Индиго Крайола | 300 – 309 |
| Светло-голубой | 310 – 329 |
| Аквамариновый | 320 — 339 |

На заготовках из нержавеющей стали12Х18Н10Т, содержащей 18% хрома, 10% никеля и 1% титана (значения определены в ГОСТ 5632-2014), цвета побежалости образуются при иных температурах. Это обусловлено тем, что данный материал коррозийно-стойкий и жаропрочный. Поэтому при закалке и охлаждении мельчайшие частицы металлов и кислорода взаимодействуют медленнее, что препятствует образования оксидной пленки во время закалки и каления.
ГОСТ 5632-2014 Легированные нержавеющие стали и сплавы коррозионно-стойкие, жаростойкие и жаропрочные
В следующей таблице цветов побежалости представлены особенности изменения цвета изделий из нержавеющей стали:
| Окрас | Пределы температур,°С |
| Светло-соломенный | 300 – 399 |
| Золотистый | 400 – 499 |
| Земляной или коричневый | 500 – 599 |
| Красный или пурпурный | 600 – 699 |
| Синий или черный | 700 – 779 |

На поверхностях заготовок из нержавеющей стали могут появиться радужные полосы. Они могут появиться при нагревании изделия до температуры кипения (100 °С). Появление радужных следов обусловлено изменениями в кристаллической решетке металла. Радужный окрас на поверхности обрабатываемой заготовки не свидетельствуют о перегреве нержавеющей стали.
14 различных типов металлов

Термин "металл" происходит от греческого слова "metalléuō", что означает выкапываю или добываю из земли. Наша планета содержит много металла. На самом деле из 118 элементов периодической системы порядка 95 являются металлами.
Это число не является точным, потому что граница между металлами и неметаллами довольно расплывчата: нет стандартного определения металлоида, как нет и полного согласия относительно элементов, соответствующим образом классифицированных как таковые.
Сегодня мы используем различные виды металлов, даже не замечая их. Начиная с зажимов в сантехнике и заканчивая устройством, которое вы используете для чтения этой статьи, все они сделаны из определенных металлов. Фактически, некоторые металлические элементы необходимы для биологических функций, таких как приток кислорода и передача нервных импульсов. Некоторые из них также широко используются в медицине в виде антацидов.
Все металлы в периодической таблице можно классифицировать по их химическим или физическим свойствам. Ниже мы перечислили некоторые различные типы металлов вместе с их реальным применением.
Классификация по физическим свойствам
14. Легкие металлы

Сплав титана 6AL-4V
Примеры: Алюминий, титан, магний
Легкие металлы имеют относительно низкую плотность. Формального определения или критериев для идентификации этих металлов нет, но твердые элементы с плотностью ниже 5 г/см³ обычно считаются легкими металлами.
Металлургия легких металлов была впервые развита в середине 19 века. Хотя большинство из них происходит естественным путем, значительная их часть образуется при электротермии и электролизе плавленых солей.
Их сплавы широко используются в авиационной промышленности благодаря их низкой плотности и достаточным механическим свойствам. Например, сплав титана 6AL-4V составляет почти 50 процентов всех сплавов, используемых в авиастроении. Он используется для изготовления роторов, лопастей компрессоров, мотогондол, компонентов гидравлических систем.
13. Тяжелые металлы

Окисленные свинцовые конкреции и кубик размером 1 см3
Примеры: железо, медь, кобальт, галлий, олово, золото, платина.
Тяжелые металлы - это элементы с относительно высокой плотностью (обычно более 5 г/см³) и атомным весом. Они, как правило, менее реактивны и содержат гораздо меньше растворимых сульфидов и гидроксидов, чем более легкие металлы.
Эти металлы редки в земной коре, но они присутствуют в различных аспектах современной жизни. Они используются в солнечных батареях, сотовых телефонах, транспортных средствах, антисептиках и ускорителях частиц.
Тяжелые металлы часто смешиваются в окружающей среде из-за промышленной деятельности, ухудшая качество почвы, воды и воздуха, а затем вызывая проблемы со здоровьем у животных и растений. Выбросы транспортных средств, горнодобывающие и промышленные отходы, удобрения, свинцово-кислотные батареи и микропластики, плавающие в океанах, являются одними из наиболее распространенных источников тяжелых металлов в этом контексте.
12. Белый металл

Подшипники из белого металла
Примеры: Обычно изготавливается из олова, свинца, висмута, сурьмы, кадмия, цинка.
Белые металлы - это различные светлые сплавы, используемые в качестве основы для украшений или изделий из серебра. Например, многие сплавы на основе олова или свинца используются в ювелирных изделиях и подшипниках.
Белый металлический сплав изготавливается путем объединения определенных металлов в фиксированных пропорциях в соответствии с требованиями конечного продукта. Основной металл для ювелирных изделий, например, формуется, охлаждается, экстрагируется, а затем полируется, чтобы придать ему точную форму и блестящий вид.
Они также используются для изготовления тяжелых подшипников общего назначения, подшипников внутреннего сгорания среднего размера и электрических машин.
11. Хрупкий металл

Хрупкое разрушение чугуна
Примеры: сплавы углеродистой стали, чугуна и инструментальной стали.
Металл считается хрупким, если он твердый, но не может противостоять ударам или вибрации под нагрузкой. Такие металлы под воздействием напряжения ломаются без заметной пластической деформации. Они имеют низкую прочность на разрыв и часто издают щелкающий звук при поломке.
Многие стальные сплавы становятся хрупкими при низких температурах, в зависимости от их обработки и состава. Чугун, например, твердый, но хрупкий из-за высокого содержания углерода. Напротив, керамика и стекло гораздо более хрупки, чем металлы, из-за их ионных связей.
Галлий, висмут, хром, марганец и бериллий также хрупки. Они часто используются в различных гражданских и военных целях, связанных с высокими деформационными нагрузками. Чугун, устойчивый к повреждениям в результате окисления, используется в машинах, трубах и деталях автомобильной промышленности, таких как корпуса коробок передач и головки цилиндров.
10. Тугоплавкий металл
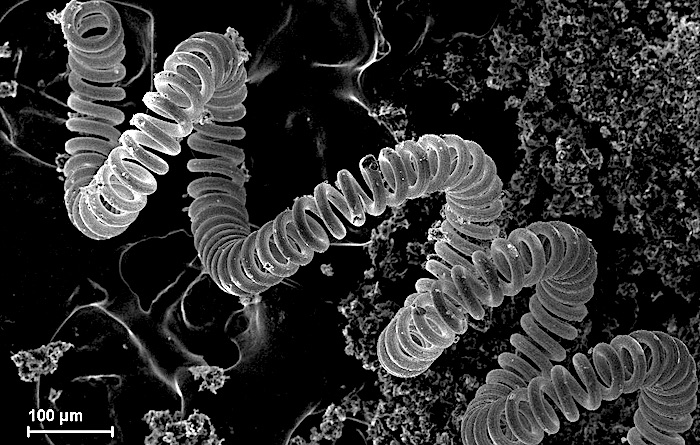
Микроскопическое изображение вольфрамовой нити в лампе накаливания
Примеры: молибден, вольфрам, тантал, рений, ниобий.
Тугоплавкие металлы имеют чрезвычайно высокие температуры плавления (более 2000 °С) и устойчивы к износу, деформации и коррозии. Они являются хорошими проводниками тепла и электричества и имеют высокую плотность.
Другой ключевой характеристикой является их термостойкость: они не расширяются и не растрескиваются при многократном нагревании и охлаждении. Однако они могут деформироваться при высоких нагрузках и окисляться при высоких температурах.
Благодаря своей прочности и твердости они идеально подходят для сверления и резки. Карбиды и сплавы тугоплавких металлов используются почти во всех отраслях промышленности, включая горнодобывающую, автомобильную, аэрокосмическую, химическую и ядерную.
Металлический вольфрам, например, используется в ламповых нитях. Сплавы рения используются в гироскопах и ядерных реакторах. А ниобиевые сплавы используются для форсунок жидкостных ракетных двигателей.
9. Черные и цветные металлы

Валы-шестерни из (черной) нержавеющей стали
Черные металлы: Сталь, чугун, сплавы железа.
Цветные металлы: Медь, алюминий, свинец, цинк, серебро, золото.
Термин "железо" происходит от латинского слова "Ferrum", что переводится как "железо". Таким образом, термин "черный металл" обычно означает "содержащий железо", тогда как "цветной металл" означает металлы и сплавы, которые не содержат достаточного количества железа.
Поскольку черные металлы могут иметь широкий спектр легирующих элементов, которые значительно изменяют их характеристики, очень трудно поместить свойства всех черных металлов под один зонт. Тем не менее некоторые обобщения могут быть сделаны, например, большинство черных металлов являются твердыми и магнитными.
Черные металлы используются для применения с высокой нагрузкой и низкой скоростью, в то время как цветные металлы предпочтительны для применения с высокой скоростью и нулевой нагрузкой для применения с низкой нагрузкой.
Сталь является наиболее распространенным черным металлом. Она составляет около 80% всего металлического материала благодаря своей доступности, высокой прочности, низкой стоимости, простоте изготовления и широкому спектру свойств. Она широко используется в строительстве и обрабатывающей промышленности. Фактически, рост производства стали показывает общее развитие промышленного мира.
8. Цветные и благородные металлы

Ассортимент благородных металлов
Цветные металлы: медь, алюминий, олово, никель, цинк
Благородные металлы: родий, ртуть, серебро, рутений, осмий, иридий
Цветные металлы - это обычные и недорогие металлы, которые корродируют, окисляются или тускнеют быстрее, чем другие металлы, когда подвергаются воздействию воздуха или влаги. Они в изобилии встречаются в природе и легко добываются.
Они широко используются в промышленных и коммерческих целях и имеют неоценимое значение для мировой экономики благодаря своей полезности и повсеместности. Некоторые цветные металлы обладают отличительными характеристиками, которые не могут быть продублированы другими металлами. Например, цинк используется для гальванизации стали, чтобы защитить ее от коррозии, а никель - для изготовления нержавеющей стали.
Благородные металлы, с другой стороны, устойчивы к окислению и коррозии во влажном воздухе. Согласно атомной физике, благородные металлы имеют заполненный электрон d-диапазона. В соответствии с этим строгим определением, медь, серебро и золото являются благородными металлами.
Они находят применение в таких областях, как орнамент, металлургия и высокие технологии. Их точное использование варьируется от одного элемента к другому. Некоторые благородные металлы, такие как родий, используются в качестве катализаторов в химической и автомобильной промышленности.
7. Драгоценные металлы

Родий: 1 грамм порошка, 1 грамм прессованного цилиндра и 1 г аргонодуговой переплавленной гранулы
Примеры: палладий, золото, платина, серебро, родий.
Драгоценные металлы считаются редкими и имеют высокую экономическую ценность. Химически они менее реакционноспособны, чем большинство элементов (включая благородные металлы). Они также пластичны и имеют высокий блеск.
Несколько веков назад эти металлы использовались в качестве валюты. Но сейчас они в основном рассматриваются как промышленные товары и инвестиции. Многие инвесторы покупают драгоценные металлы (в основном золото), чтобы диверсифицировать свои портфели или победить инфляцию.
Серебро - второй по популярности драгоценный металл для ювелирных изделий (после золота). Однако его значение выходит далеко за рамки красоты. Оно обладает исключительно высокой тепло- и электропроводностью и чрезвычайно низким контактным сопротивлением. Именно поэтому серебро широко используется в электронике, батареях и противомикробных препаратах.
Классификация по химическим свойствам
6. Щелочные металлы

Твердый металлический натрий
Примеры: натрий, калий, рубидий, литий, цезий и франций.
Щелочь относится к основной природе гидроксидов металлов. Когда эти металлы реагируют с водой, они образуют сильные основания, которые легко нейтрализуют кислоты.
Они настолько реактивны, что обычно встречаются в природе в слиянии с другими веществами. Карналлит (хлорид калия-магния) и сильвин (хлорид калия), например, растворимы в воде и, таким образом, легко извлекаются и очищаются. Нерастворимые в воде щелочи, такие, как фторид лития, также существуют в земной коре.
Одно из самых популярных применений щелочных металлов - использование цезия и рубидия в атомных часах, наиболее точных из известных эталонов времени и частоты. Литий используется в качестве анода в литиевых батареях, композиты калия используются в качестве удобрений, а ионы рубидия используются в фиолетовых фейерверках. Чистый металлический натрий широко используется в натриевых лампах, которые очень эффективно излучают свет.
5. Щелочноземельные металлы

Изумрудный кристалл, основной минерал бериллия.
Примеры: бериллий, кальций, магний, барий, стронций и радий.
Щелочноземельные металлы в стандартных условиях мягкие и серебристо-белые. Они имеют низкую плотность, температуру кипения и температуру плавления. Хотя они не так реакционноспособны, как щелочные металлы, они очень легко образуют связи с элементами. Как правило, они вступают в реакцию с галогенами, образуя галогениды щелочноземельных металлов.
Все они встречаются в земной коре, кроме радия, который является радиоактивным элементом. Радий уже распадался в ранней истории Земли из-за относительно короткого периода полураспада (1600 лет). Современные образцы поступают из цепочки распада урана и тория.
Щелочноземельные металлы имеют широкий спектр применения. Бериллий, например, используется в полупроводниках, теплопроводниках, электрических изоляторах и в военных целях. Магний часто сплавляют с цинком или алюминием для получения материалов со специфическими свойствами. Кальций в основном используется в качестве восстановителя, а барий используется в вакуумных трубках для удаления газов.
4. Переходные металлы
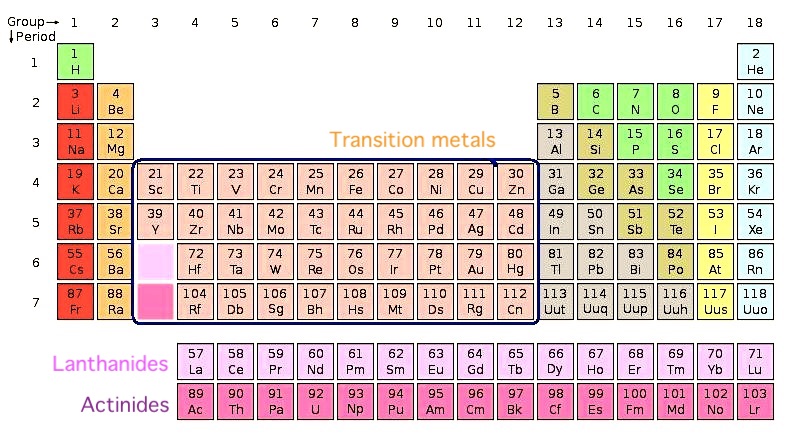
Примеры: титан, ванадий, хром, никель, серебро, вольфрам, платина, кобальт.
Большинство элементов используют электроны из своей внешней оболочки для связи с другими элементами. Переходные металлы, однако, могут использовать две крайние оболочки для соединения с другими элементами. Это химическая особенность, которая позволяет им связываться со многими различными элементами в различных формах.
Они занимают среднюю часть таблицы Менделеева, служа мостом между (или переходом) между двумя сторонами таблицы. Более конкретно, есть 38 переходных металлов в группах с 3 по 12 периодической таблицы. Все они являются пластичными, податливыми и хорошими проводниками тепла и электричества.
Многие из этих металлов, такие как медь, никель, железо и титан, используются в конструкциях и в электронике. Большинство из них образуют полезные сплавы друг с другом и с другими металлическими веществами. Некоторые из них, включая золото, серебро и платину, называются благородными металлами, потому что они крайне инертны и устойчивы к кислотам.
3. Постпереходные металлы

Висмут в виде синтетических кристаллов
Примеры: алюминий, галлий, олово, свинец, таллий, индий, висмут.
Постпереходные металлы в периодической таблице - это элементы, расположенные справа от переходных металлов и слева от металлоидов. Из-за своих свойств они также называются "бедными" или "другими" металлами.
Физически они хрупки (или мягки) и имеют более низкую температуру плавления и механическую прочность, чем переходные металлы. Их кристаллическая структура довольно сложна: они проявляют ковалентные или направленные эффекты связи.
Различные металлы этого семейства имеют различное применение. Алюминий, например, используется для изготовления оконных рам, кухонной посуды, банок, фольги, деталей автомобилей. Оловянные сплавы используются в мягких припоях, оловянных и сверхпроводящих магнитах.
Индиевые сплавы используются для изготовления плоских дисплеев и сенсорных экранов, а галлий - в топливных элементах и полупроводниках.
2. Лантаноиды

1-сантиметровый кусок чистого лантана
Примеры: лантан, церий, прометий, гадолиний, тербий, иттербий, лютеций.
Лантаноиды - это редкоземельные металлы с атомными номерами от 57 до 71. Впервые они были обнаружены в 1787 году в необычном черном минерале (гадолините), обнаруженном в Иттербю, Швеция. Позже минерал был разделен на различные элементы лантаноидов.
Лантаноиды - это металлы с высокой плотностью, плотность которых колеблется от 6,1 до 9,8 г/см³, и они, как правило, имеют очень высокие температуры кипения (1200-3500 °C) и очень высокие температуры плавления (800-1600 °C).
Сплавы лантаноидов используются в металлургии из-за их сильных восстановительных способностей. Около 15 000 тонн лантаноидов ежегодно расходуется в качестве катализаторов и при производстве стекол. Они также широко используются в лазерах и оптических усилителях.
Некоторые исследования показывают, что лантаноиды могут быть использованы в качестве противораковых средств. Лантан и церий, в частности, могут подавлять пролиферацию раковых клеток и способствовать цитотоксичности.
1. Актиниды

Металлический уран, высокообогащенный ураном-235
Примеры: актиний, уран, торий, плутоний, фермий, нобелий, лоренций
Подобно лантаноидам, актиниды образуют семейство редкоземельных элементов с аналогичными свойствами. Они представляют собой серию из 15 последовательных химических элементов в периодической системе от атомных номеров 89 до 103.
Все они радиоактивны по своей природе. Синтетически произведенный плутоний, а также природные уран и торий являются наиболее распространенными актинидами на Земле. Первым актинидом, который был открыт в 1789 году, был уран. И большая часть существующих продуктов актинидов была произведена в 20 веке.
Их свойства, такие как излучение радиоактивности, пирофорность, токсичность и ядерная критичность, делают их опасными для обращения. Сегодня значительная часть (кратковременных) актинидов производится ускорителями частиц в исследовательских целях.
Некоторые актиниды нашли применение в повседневной жизни, например, газовые баллоны (торий) и детекторы дыма (америций), большинство из них используются в качестве топлива в ядерных реакторах и для изготовления ядерного оружия. Уран-235 является наиболее важным изотопом для применения в ядерной энергетике, который широко используется в тепловых реакторах.
Читайте также:
