Хром самый твердый металл

Кристаллы (99,999%) хрома различной формы, полученные разложением йодида хрома.
Хром — твёрдый металл голубовато-белого цвета. Хром иногда относят к чёрным металлам. Этот металл способен окрашивать соединения в разные цвета, потому и был назван «хром», что означает «краска». Хром – микроэлемент, необходимый для нормального развития и функционирования человеческого организма. Важнейшая его биологическая роль состоит в регуляции углеводного обмена и уровня глюкозы в крови.
Смотрите так же:
СТРУКТУРА

Кристаллическая структура хрома
В зависимости от типов химической связи – как и все металлы хром имеет металлический тип кристаллической решетки, то есть в узлах решетки находятся атому металла.
В зависимости от пространственной симметрии – кубическая, объемно-центрированная а = 0,28839 нм. Особенностью хрома является резкое изменение его физических свойств при температуре около 37°С. Кристаллическая решетка металла состоит из его ионов и подвижных электронов. Аналогично атом хрома в основном состоянии имеет электронную конфигурацию. При 1830 °С возможно превращение в модификацию с гранецентрированной решеткой, а = 3,69Å.
СВОЙСТВА

Хром имеет твердость по шкале Мооса 9, один из самых твердых чистых металлов (уступает только иридию, бериллию, вольфраму и урану). Очень чистый хром достаточно хорошо поддаётся механической обработке. Устойчив на воздухе за счёт пассивирования. По этой же причине не реагирует с серной и азотной кислотами. При 2000 °C сгорает с образованием зелёного оксида хрома(III) Cr2O3, обладающего амфотерными свойствами. При нагревании реагирует со многими неметаллами, часто образуя соединения нестехиометрического состава карбиды, бориды, силициды, нитриды и др. Хром образует многочисленные соединения в различных степенях окисления, в основном +2, +3, +6. Хром обладает всеми характерными для металлов свойствами – хорошо проводит тепло, электрический ток, имеет присущий большинству металлов блеск. Является антиферромагнетиком и парамагнетиком, то есть, при температуре 39 °C переходит из парамагнитного состояния в антиферромагнитное (точка Нееля).
ЗАПАСЫ И ДОБЫЧА

Самые большие месторождения хрома находятся в ЮАР (1 место в мире), Казахстане, России, Зимбабве, Мадагаскаре. Также есть месторождения на территории Турции, Индии, Армении, Бразилии, на Филиппинах.nГлавные месторождения хромовых руд в РФ известны на Урале (Донские и Сарановское). Разведанные запасы в Казахстане составляют свыше 350 миллионов тонн (2 место в мире)Хром встречается в природе в основном в виде хромистого железняка Fe(CrO2)2 (хромит железа). Из него получают феррохром восстановлением в электропечах коксом (углеродом). Чтобы получить чистый хром, реакцию ведут следующим образом:
1) сплавляют хромит железа с карбонатом натрия (кальцинированная сода) на воздухе;
2) растворяют хромат натрия и отделяют его от оксида железа;
3) переводят хромат в дихромат, подкисляя раствор и выкристаллизовывая дихромат;
4) получают чистый оксид хрома восстановлением дихромата натрия углём;
5) с помощью алюминотермии получают металлический хром;
6) с помощью электролиза получают электролитический хром из раствора хромового ангидрида в воде, содержащего добавку серной кислоты.
ПРОИСХОЖДЕНИЕ

Среднее содержание Хрома в земной коре (кларк) 8,3·10 -3 % . Этот элемент, вероятно, более характерен для мантии Земли, так как ультраосновные породы, которые, как полагают, ближе всего по составу к мантии Земли, обогащены Хромом (2·10 -4 %). Хром образует массивные и вкрапленные руды в ультраосновных горных породах; с ними связано образование крупнейших месторождений Хрома. В основных породах содержание Хрома достигает лишь 2·10 -2 %, в кислых – 2,5·10 -3 %, в осадочных породах (песчаниках) – 3,5·10 -3 %, глинистых сланцах – 9·10 -3 % . Хром – сравнительно слабый водный мигрант; содержание Хрома в морской воде 0,00005 мг/л.
В целом Хром – металл глубинных зон Земли; каменные метеориты (аналоги мантии) тоже обогащены Хромом (2,7·10 -1 %). Известно свыше 20 минералов Хрома. Промышленное значение имеют только хромшпинелиды (до 54% Сr); кроме того, Хром содержится в ряде других минералов, которые нередко сопровождают хромовые руды, но сами не представляют практическое ценности (уваровит, волконскоит, кемерит, фуксит).
Различают три основных минерала хрома: магнохромит (Mg, Fe)Cr2O4, хромпикотит (Mg, Fe)(Cr, Al)2O4 и алюмохромит (Fe, Mg)(Cr, Al)2O4. По внешнему виду они неразличимы, и их неточно называют «хромиты».
ПРИМЕНЕНИЕ

Хром — важный компонент во многих легированных сталях (в частности, нержавеющих), а также и в ряде других сплавов. Добавка хрома существенно повышает твердость и коррозийную стойкость сплавов. Использование Хрома основано на его жаропрочности, твердости и устойчивости против коррозии. Больше всего Хрома применяют для выплавки хромистых сталей. Алюмино- и силикотермический Хром используют для выплавки нихрома, нимоника, других никелевых сплавов и стеллита.
Значительное количество Хрома идет на декоративные коррозионно-стойкие покрытия. Широкое применение получил порошковый Хром в производстве металлокерамических изделий и материалов для сварочных электродов. Хром в виде иона Cr 3+ – примесь в рубине, который используется как драгоценный камень и лазерный материал. Соединениями Хрома протравливают ткани при крашении. Некоторые соли Хрома используются как составная часть дубильных растворов в кожевенной промышленности; PbCrO4, ZnCrO4, SrCrO4 – как художественные краски. Из смеси хромита и магнезита изготовляют хромомагнезитовые огнеупорные изделия.
Используется в качестве износоустойчивых и красивых гальванических покрытий (хромирование).
Хром применяется для производства сплавов: хром-30 и хром-90, незаменимых для производства сопел мощных плазмотронов и в авиакосмической промышленности.
40 интересных фактов о металлах

Большинство элементов в периодической таблице это металлы, плюс есть многочисленные сплавы, состоящие из смесей металлов. Итак, неплохо было бы узнать, что такое металлы и кое-что о них. Вот 40 интересных и полезных фактов об этих важных материалах:
Самый чистый металл - Германий
Германий, очищенный по технологии зонального синтеза с чистотой "тринадцать девять" (99,999999999%).

Самый распространенный металл – Алюминий
Около 8 процентов земной коры состоит из Алюминия. Соединения алюминия встречаются по всему миру. Обычная почва также содержит много алюминатов.
Хотите больше узнать про алюминий? Тогда мы советуем прочитать в нашем блоге статью: «Как обрабатывать алюминий: Все, что вам нужно знать!».

Трехводный боксит представляет собой минерал гидроксида алюминия и является основным компонентом в месторождении бокситов.
Самый редкий металл – Полоний

Самый легкий металл – Литий

Первой найденной литиевой рудой был пертит.
Самый тугоплавкий металл - Вольфрам
Температура плавления составляет 3410 ℃, температура кипения - 5700 ℃. Вольфрам используется в лампах накаливания. При включенной лампе, температура накала нити выше 3000 ℃, только вольфрам может выдержать такую высокую температуру. Китай является крупнейшей в мире страной по хранению вольфрама, в основном шеелита и вольфрамита.

Металл с самой низкой температурой плавления - Ртуть
Киноварь является основным минеральным сырьем для рафинирования ртути. Кристалл может быть использован в качестве важного материала для лазерной технологии.

Самый производимый металл - железо
Железо является металлом с самым высоким годовым объемом производства. В 2017 году мировое производство нерафинированной стали достигло 1,6912 млрд тонн. Железо также является вторым по распространенности металлическим элементом в земной коре.

Гематит широко распространен в природе, является важным сырьем для получения железа, а также может использоваться в качестве красного пигмента.
Металл, который лучше всего поглощают газ - Палладий
Один объем металлического палладия при комнатной температуре может поглотить 900-2 800 объемов водорода.

Платино-палладиевый рудник
Самый податливый металл – Золото
1 грамм золота может быть вытянут в нить длиной 4000 метров; если сплющивать золото, то толщина может достигать 5x10e-4 мм.

Самый ковкий металл - Платина

Самородная платина
Самый проводящий металл - Серебро

Самородное серебро
Самые распространенный металл в организме человека - Кальций
Кальций является самым распространенным металлическим элементом в организме человека, составляя примерно 1,4% человеческого тела.

Основной состав доломита - CaMg(CO3)2
Переходный металл высшего класса - Скандий
Порошок скандия является легковоспламеняющимся веществом. Есть предположения, что скандий будет основой нового ракетного топлива, которое сможет обеспечить передвижение кораблей между планетами.

Самый дорогой металл – Калифорний
В 1975 году считалось, что в мире всего около грамма калифорния, а грамм стоил около 1 миллиарда долларов.

Самый простой в использовании сверхпроводящий элемент - Ниобий
Когда он охлаждается до температуры -263,9℃, он превращается в сверхпроводник, который практически не имеет сопротивления.

Pyrochlore. A mineral containing niobium
Самый тяжелый металл - Осмий
Иридий весит 22,59 грамма на кубический сантиметр, его плотность примерно в два раза выше свинца и в три раза выше железа.

Наименее твердый металл - Натрий

Sodium chloride
Самый твердый металл - Хром
Хром (Cr), известный как "твердая кость", - это серебристо-белый металл, чрезвычайно твердый и хрупкий. По шкале Мооса - 9, уступает только алмазам.

Хромово-свинцовая руда является первым искусственным минералом, который был открыт.
Самый ранний из используемых металлов - Медь

Chalcopyrite. Chinese Shang Dynasty already used chalcopyrite to refine copper
Металл с наибольшим количеством жидкости - Галлий

Галлий является побочным продуктом промышленной переработки сфалерита, пирита, бокситов и германия. На рисунке изображен чистый галлий.
Металл, который с наибольшей вероятностью создаст электрический ток при воздействии света - Цезий

Цезиевый цеолит, ранее известный как креманит
Самый активный элемент щелочноземельных металлов - Барий
Химическая активность бария очень велика, он является самым активным среди щелочноземельных металлов. Он был введен в качестве металлического элемента в 1808 году.

Наиболее распространенным минералом в природе является барит.
Металл, который больше всех боится холода - Олово
Когда температура ниже 13,2 ℃, олово начинает разрушаться; когда температура ниже -30 ~ -40 ℃, оно немедленно превращается в порошок, это явление часто называют "оловянной чумой".

"Оловянная чума"
Наиболее токсичный металл для человека – Плутоний
Он в 486 миллионов раз смертоноснее мышьяка и является самым мощным канцерогеном, а 1х10-6 граммов плутония способны вызвать рак.

Самый крупный самородок золота
Находка была сделана 19 октября 1872 года на золотом руднике "Звезда надежды" в районе Хиллендер в Австралии, вес находки 214,3 килограмма.

Самое большое природное золото было сфотографировано вместе с его первооткрывателем в 1872 году.
Самое крупное натуральное серебро

Крупнейший самородок меди

Самые большие запасы радиоактивных элементов в море - Уран
Уран - самый распространенный радиоактивный элемент в морской воде, его количество оценивается в 4 миллиарда тонн, что в 1544 раза больше, чем на суше.

Урановая руда
Самые распространенные элементы в морской воде - калий
Калий присутствует в морской воде в виде ионов калия, его содержание составляет около 0,38 г/кг, это элемент с самым высоким содержанием в морской воде.

Нитрат может быть непосредственно произведен путем добычи и обогащения
Металл с наибольшим атомным номером среди стабильных элементов - свинец
Свинец имеет самый высокий атомный номер среди всех стабильных химических элементов. В природе существует четыре стабильных изотопа: свинец 204, 206, 207 и 208.

Свинцовая руда
Самый распространенный аллергенный металл для человека - Никель
Никель является наиболее распространенным сенсибилизирующим металлом, и около 20 процентов людей имеют аллергию на ионы никеля.

Nickel mine, also known as “red nickel mine”
Самый важный металл в аэрокосмической промышленности - Титан
Титан - это серый переходный металл, характеризующийся легкостью, высокой прочностью и хорошей коррозионной стойкостью, который называют "космическим металлом".

Титановая руда
Самый кислотный металл - Тантал
Как в холодных, так и в жарких условиях он не вступает в реакцию с соляной кислотой, концентрированной азотной кислотой и “хлороазотической кислотой”. Даже при помещении в концентрированную серную кислоту при температуре 175 ℃ в течение года толщина коррозии составляет всего 0,0004 мм.

Танталовая руда
Металл с наименьшим атомным радиусом - Бериллий

Самый коррозионностойкий металл - Иридий
Иридиевая кислота очень химически стабильна, нерастворима в кислотах, и только губчатый иридий медленно растворяется в горячей водной среде. Если он находится в компактном состоянии, то даже кипящая водная вытяжка не может его разъесть.

Иридий естественным образом присутствует в платиновом руднике
Самый отличительный по цвету металл - Медь

Медный порошок
Металл с наибольшим количеством изотопов - Олово

Самый тяжелый щелочной металл - Франций
Образуется при распаде актинидов, является радиоактивным металлом. Это самый тяжелый металл в ряду щелочных металлов. Атомная масса - 223.

Последний металл, найденный человеком - Рений
Суперметалл рений - действительно редкий элемент, к тому же он не образует фиксированных минералов, обычно связанных с другими металлами. Это делает его последним элементом, найденным в природе.

Металл Рений содержится в молибдене
Самые особенный металл при комнатной температуре - Ртуть
При комнатной температуре металлы обычно находятся в твердом состоянии, но ртуть является самым необычным металлом, и единственная находится в жидком состоянии при комнатной температуре.

Жидкая ртуть, также известная как "меркурий"
Если вам понравилась статья, то ставьте лайк, делитесь ею со своими друзьями и оставляйте комментарии!
Хром

Хром — элемент побочной подгруппы 6-й группы 4-го периода периодической системы химических элементов Д. И. Менделеева с атомным номером 24. Обозначается символом Cr (лат. Chromium ). Простое вещество хром — твёрдый металл голубовато-белого цвета. Хром иногда относят к чёрным металлам.
| Название, символ, номер | Хром / Chromium (Cr), 24 |
|---|---|
| Атомная масса (молярная масса) | 51,9961(6) а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 3d 5 4s 1 |
| Радиус атома | 130 пм |
| Ковалентный радиус | 118 пм |
| Радиус иона | (+6e)52 (+3e)63 пм |
| Электроотрицательность | 1,66 (шкала Полинга) |
| Электродный потенциал | −0,74 |
| Степени окисления | 6, 3, 2, 0 |
| Энергия ионизации (первый электрон) | 652,4 (6,76) кДж/моль (эВ) |
| Плотность (при н. у.) | 7,19 г/см³ |
| Температура плавления | 2130 K |
| Температура кипения | 2945 K |
| Уд. теплота плавления | 21 кДж/моль |
| Уд. теплота испарения | 342 кДж/моль |
| Молярная теплоёмкость | 23,3 Дж/(K·моль) |
| Молярный объём | 7,23 см³/моль |
| Структура решётки | кубическая объёмноцентрированая |
| Параметры решётки | 2,885 Å |
| Температура Дебая | 460 K |
| Теплопроводность | (300 K) 93,9 Вт/(м·К) |
| Номер CAS | 7440-47-3 |

Содержание
- 1 История
- 1.1 Происхождение названия
- 1.2 История
- 2.1 Месторождения
- 5.1 Изотопы
- 6.1 Характерные степени окисления
- 6.2 Простое вещество
- 6.3 Соединения Cr(+2)
- 6.4 Соединения Cr(+3)
- 6.5 Соединения хрома (+4)
- 6.6 Соединения хрома (+6)
История
Происхождение названия
Название элемент получил от греч. χρῶμα — цвет, краска — из-за разнообразия окраски своих соединений.
История
Открыт на Среднем Урале, в Березовском золоторудном месторождении. Впервые упоминается в труде М. В. Ломоносова «Первые основания металлургии» (1763 год), как красная свинцовая руда, PbCrO4. Современное название — крокоит. В 1797 году французский химик Л. Н. Воклен выделил из него новый тугоплавкий металл (скорее всего, Воклен получил карбид хрома).
Нахождение в природе
Хром является довольно распространённым элементом в земной коре (0,012 % по массе). Основные соединения хрома — хромистый железняк (хромит) FeO·Cr2O3. Вторым по значимости минералом является крокоит PbCrO4.
Месторождения
Самые большие месторождения хрома находятся в ЮАР (1-е место в мире), Казахстане, России, Зимбабве, Мадагаскаре. Также есть месторождения на территории Турции, Индии, Армении, Бразилии, на Филиппинах.
Главные месторождения хромовых руд в РФ известны на Урале (Донские и Сарановское).
Разведанные запасы в Казахстане составляют свыше 350 миллионов тонн (2-е место в мире).
Геохимия и минералогия
Среднее содержание хрома в различных изверженных породах резко непостоянно. В ультраосновных породах (перидотитах) оно достигает 2 кг/т, в основных породах (базальтах и др.) — 200 г/т, а в гранитах десятки г/т. Кларк хрома в земной коре 83 г/т. Он является типичным литофильным элементом и почти весь заключен в минералах типа хромшпинелидов. Хром вместе с железом, титаном, никелем, ванадием и марганцем составляют одно геохимическое семейство.
Различают три основных минерала хрома: магнохромит (Mg, Fe)Cr2O4, хромпикотит (Mg, Fe)(Cr, Al)2O4 и алюмохромит (Fe, Mg)(Cr, Al)2O4. По внешнему виду они неразличимы, и их неточно называют «хромиты». Состав их изменчив:
- Cr2O3 18—62 %,
- FeO 1—18 %,
- MgO 5—16 %,
- Al2O3 0,2 — 0,4 (до 33 %),
- Fe2O3 2 — 30 %,
- примеси TiO2 до 2 %,
- V2O5 до 0,2 %,
- ZnO до 5 %,
- MnO до 1 %; присутствуют также Co, Ni и др.
Собственно, хромит, то есть FeCr2O4 сравнительно редок. Помимо различных хромитов, хром входит в состав ряда других минералов — хромовой слюды (фуксита), хромового хлорита, хромвезувиана, хромдиопсида, хромтурмалина, хромового граната (уваровита) и др., которые нередко сопровождают руды, но сами промышленного значения не имеют. В экзогенных условиях хром, как и железо, мигрирует в виде взвесей и может накапливаться в глинах. Наиболее подвижной формой являются хроматы.
Получение
Хром встречается в природе в основном в виде хромистого железняка Fe(CrO2)2 (хромит железа). Из него получают феррохром восстановлением в электропечах коксом (углеродом):
Fe(CrO2)2 + 4C → Fe + 2Cr + 4CO
Феррохром применяют для производства легированных сталей.
Чтобы получить чистый хром, реакцию ведут следующим образом:
1) сплавляют хромит железа с карбонатом натрия (кальцинированная сода) на воздухе:
4Fe(CrO2)2 + 8Na2CO3 + 7O2 → 8Na2CrO4 + 2Fe2O3 + 8CO2
2) растворяют хромат натрия и отделяют его от оксида железа;
3) переводят хромат в дихромат, подкисляя раствор и выкристаллизовывая дихромат;
4) получают чистый оксид хрома восстановлением дихромата натрия углём:
Na2Cr27 + 2C → Cr2O3 + Na2CO3 + CO
5) с помощью алюминотермии получают металлический хром:
Cr2O3 + 2Al → Al2O3 + 2Cr + 130kcal
6) с помощью электролиза получают электролитический хром из раствора хромового ангидрида в воде, содержащего добавку серной кислоты. При этом на катодах совершаются в основном 3 процесса:
- восстановление шестивалентного хрома до трехвалентного с переходом его в раствор;
- разряд ионов водорода с выделением газообразного водорода;
- разряд ионов, содержащих шестивалентный хром, с осаждением металлического хрома;
Физические свойства
В свободном виде — голубовато-белый металл с кубической объёмноцентрированной решёткой, a = 0,28845 нм. Ниже температуры 38 °C является антиферромагнетиком, выше переходит в парамагнитное состояние (точка Нееля).
Хром имеет твёрдость по шкале Мооса 5, один из самых твёрдых чистых металлов (уступает только иридию, бериллию, вольфраму и урану). Очень чистый хром достаточно хорошо поддаётся механической обработке.
Изотопы
Природный хром состоит из четырех стабильных изотопов ( 50 Cr (изотопная распространённость 4,345 %), 52 Cr (83.789 %), 53 Cr (9.501 %), 54 Cr (2.365 %)).
Химические свойства
Характерные степени окисления
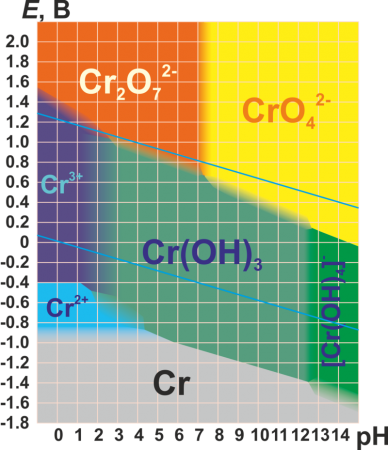
Для хрома характерны степени окисления +2, +3 и +6 (см. табл.). Практически все соединения хрома окрашены.
Кислотный CrO4 2− (хроматы, желтые) ![цвета хрома]()
Простое вещество
Устойчив на воздухе за счёт пассивирования. По этой же причине не реагирует с серной и азотной кислотами. При 2000 °C сгорает с образованием зелёного оксида хрома(III) Cr2O3, обладающего амфотерными свойствами.
Синтезированы соединения хрома с бором (бориды Cr2B, CrB, Cr3B4, CrB2, CrB4 и Cr5B3), с углеродом (карбиды Cr23C6, Cr7C3 и Cr3C2), c кремнием (силициды Cr3Si, Cr5Si3 и CrSi) и азотом (нитриды CrN и Cr2N).
Соединения Cr(+2)
Степени окисления +2 соответствует основный оксид CrO (чёрный). Соли Cr 2+ (растворы голубого цвета) получаются при восстановлении солей Cr 3+ или дихроматов цинком в кислой среде («водородом в момент выделения»):
Все эти соли Cr 2+ — сильные восстановители вплоть до того, что при стоянии вытесняют водород из воды. Кислородом воздуха, особенно в кислой среде, Cr 2+ окисляется, в результате чего голубой раствор быстро зеленеет.
Коричневый или жёлтый гидроксид Cr(OH)2 осаждается при добавлении щелочей к растворам солей хрома(II).
Синтезированы дигалогениды хрома CrF2, CrCl2, CrBr2 и CrI2
Соединения Cr(+3)
Степени окисления +3 соответствует амфотерный оксид Cr2O3 и гидроксид Cr(OH)3 (оба — зелёного цвета). Это — наиболее устойчивая степень окисления хрома. Соединения хрома в этой степени окисления имеют цвет от грязно-лилового (в водных растворах ион Cr 3+ существует в виде аквакомплексов [Cr(H2O)6] 3+ ) до зелёного (в координационной сфере присутствуют анионы).
Cr 3+ склонен к образованию двойных сульфатов вида M I Cr(SO4)2·12H2O (квасцов)
Гидроксид хрома (III) получают, действуя аммиаком на растворы солей хрома (III):
Можно использовать растворы щелочей, но в их избытке образуется растворимый гидроксокомплекс:
Сплавляя Cr2O3 со щелочами, получают хромиты:
Непрокаленный оксид хрома(III) растворяется в щелочных растворах и в кислотах:
При окислении соединений хрома(III) в щелочной среде образуются соединения хрома(VI):
То же самое происходит при сплавлении оксида хрома (III) со щелочью и окислителями, или со щелочью на воздухе (расплав при этом приобретает жёлтую окраску):
Соединения хрома (+4)
При осторожном разложении оксида хрома(VI) CrO3 в гидротермальных условиях получают оксид хрома(IV) CrO2, который является ферромагнетиком и обладает металлической проводимостью.
Среди тетрагалогенидов хрома устойчив CrF4, тетрахлорид хрома CrCl4 существует только в парах.
Соединения хрома (+6)
Степени окисления +6 соответствует кислотный оксид хрома (VI) CrO3 и целый ряд кислот, между которыми существует равновесие. Простейшие из них — хромовая H2CrO4 и двухромовая H2Cr2O7. Они образуют два ряда солей: желтые хроматы и оранжевые дихроматы соответственно.
Оксид хрома (VI) CrO3 образуется при взаимодействии концентрированной серной кислоты с растворами дихроматов. Типичный кислотный оксид, при взаимодействии с водой он образует сильные неустойчивые хромовые кислоты: хромовую H2CrO4, дихромовую H2Cr2O7 и другие изополикислоты с общей формулой H2CrnO3n+1. Увеличение степени полимеризации происходит с уменьшением рН, то есть увеличением кислотности:
Но если к оранжевому раствору K2Cr2O7 прилить раствор щёлочи, как окраска вновь переходит в жёлтую, так как снова образуется хромат K2CrO4:
До высокой степени полимеризации, как это происходит у вольфрама и молибдена, не доходит, так как полихромовая кислота распадается на оксид хрома(VI) и воду:
Растворимость хроматов примерно соответствует растворимости сульфатов. В частности, жёлтый хромат бария BaCrO4 выпадает при добавлении солей бария как к растворам хроматов, так и к растворам дихроматов:
Образование кроваво-красного малорастворимого хромата серебра используют для обнаружения серебра в сплавах при помощи пробирной кислоты.
Известны пентафторид хрома CrF5 и малоустойчивый гексафторид хрома CrF6. Также получены летучие оксигалогениды хрома CrO2F2 и CrO2Cl2 (хромилхлорид).
Соединения хрома(VI) — сильные окислители, например:
Добавление к дихроматам перекиси водорода, серной кислоты и органического растворителя (эфира) приводит к образованию синего монопероксида хрома(VI) CrO5 (CrO(O2)2), который экстрагируется в органический слой; данная реакция используется как аналитическая.
Хром — важный компонент во многих легированных сталях (в частности, нержавеющих), а также и в ряде других сплавов. Добавка хрома существенно повышает твердость и коррозийную стойкость сплавов.
Используется в качестве износоустойчивых и красивых гальванических покрытий (хромирование).
Хром применяется для производства сплавов: хром-30 и хром-90, незаменимых для производства сопел мощных плазмотронов и в авиакосмической промышленности.
![хромированные детали]()
Биологическая роль и физиологическое действие
Хром — один из биогенных элементов, постоянно входит в состав тканей растений и животных. У животных хром участвует в обмене липидов, белков (входит в состав фермента трипсина), углеводов. Снижение содержания хрома в пище и крови приводит к уменьшению скорости роста, увеличению холестерина в крови.
В чистом виде хром довольно токсичен, металлическая пыль хрома раздражает ткани лёгких. Соединения хрома(III) вызывают дерматиты.
![хром окись]()
Соединения хрома в степени окисления +6 особо токсичны. Практически вся хромовая руда обрабатывается через преобразование в дихромат натрия. В 1985 году было произведено примерно 136 000 тонн шестивалентного хрома. Другими источниками шестивалентного хрома являются триоксид хрома и различные соли — хроматы и дихроматы. Шестивалентный хром используется при производстве нержавеющих сталей, текстильных красок, консервантов для дерева, при хромировании и пр.
Шестивалентный хром является признанным канцерогеном при вдыхании. На многих рабочих местах сотрудники подвержены воздействию шестивалентного хрома, например, при гальваническом хромировании или сварке нержавеющих сталей. В Европейском союзе использование шестивалентного хрома существенно ограничено директивой RoHS.
Шестивалентный хром транспортируется в клетки человеческого организма с помощью сульфатного транспортного механизма благодаря своей близости к сульфатам по структуре и заряду. Трёхвалентный хром, более часто встречающийся, не транспортируется в клетки.
Внутри клетки Cr(VI) восстанавливается до метастабильного пятивалентного хрома (Cr(V)), затем до трехвалентного хрома (Cr(III)). Трехвалентный хром, присоединяясь к протеинам, создает гаптены, которые включают иммунную реакцию. После их появления чувствительность к хрому не пропадает. В этом случае даже контакт с текстильными изделиями, окрашенными хромсодержащими красками или с кожей, обработанной хромом, может вызвать раздражение кожи. Витамин C и другие агенты реагируют с хроматами и образуют Cr(III) внутри клетки.
Продукты шестивалентного хрома являются генотоксичными канцерогенами. Хроническое вдыхание соединений шестивалентного хрома увеличивает риск заболеваний носоглотки, риск рака лёгких. (Лёгкие особенно уязвимы из-за большого количества мелких капилляров). Видимо, механизм генотоксичности запускается пяти- и трёхвалентным хромом.
В США предельно допустимая концентрация шестивалентного хрома в воздухе составляет 5 мкг/м³ (0,005 мг/м³). В России предельно допустимая концентрация хрома (VI) существенно ниже — 1,5 мкг/м³ (0,0015 мг/м³).
Одним из общепризнанных методов избежания шестивалентного хрома является переход от технологий гальванического хромирования к газотермическому и вакуумному напылению.
Основанный на реальных событиях фильм «Эрин Брокович» режиссёра Стивена Содерберга рассказывает о крупном судебном процессе, связанном с загрязнением окружающей среды шестивалентным хромом, в результате которого у многих людей развились серьёзные заболевания.
Фото соединений хрома:
![хром окись пигментная]()
Хром окись пигментная![паста ГОИ]()
Паста ГОИ (содержит Окись хрома)![Хром хлористый]()
![Хром хлористый]()
Хром (III) хлорид
Калий двуххромовокислый (бихромат) - Хромпик)![Калий хромовокислый]()
Калий хромовокислый (калий хромат)
Хромовой ангидрид (Хрома (VI) окись
Хром (III) окись
Хром азотнокислый![хромокалиевые квасцы]()
![хромокалиевые квасцы]()
Хромокалиевые квасцыСоединения двухвалентного хрома.
Оксид хрома (II) CrO
Гидроксид хрома (II) Cr(OH)2
Фторид хрома (II) CrF2
Хлорид хрома (II) CrCl2
Бромид хрома (II) CrBr2
Йодид хрома (II) CrI2
Сульфид хрома (II) CrS
Сульфат хрома (II) CrSO4Соединения трехвалентного хрома.
Оксид хрома (III) Cr2O3
Гидроксид хрома (III) Cr(OH)3
Фторид хрома (III) CrF3
Хлорид хрома (III) CrCl3
Бромид хрома (III) CrBr3
Иодид хрома (III) CrI3
Оксифторид хрома (III) CrOF
Сульфид хрома (III) Cr2S3
Сульфат хрома (III) Cr2(SO4)3
Ортофосфат хрома (III) CrPO4Соединения четырехвалентного хрома.
Оксид хрома (IV) CrO2
Фторид хрома (IV) CrF4
Хлорид хрома (IV) CrCl4Хром самый твердый металл
Читайте также:
- Реакция металлов с соляной кислотой
- Соль состоит из металла и кислотного остатка
- Гравировка на тонком металле
- Положение о драгоценных металлах
- Атом рпг рецепт металлический арбалет