Hno3 с оксидами металлов
MgO + H2O → Реакция не идет, ак как Mg(OH)2 нерастворим*
FeO + H2O → Реакция не идет, так как Fe(OH)2 нерастворим
CrO + H2O → Реакция не идет, так как Cr(OH)2 нерастворим
CuO + H2O → Реакция не идет, так как Cu(OH)2 нерастворим
Все реакции идут за исключением SiO2 (кварц, песок):
SO3 + H2O → H2SO4
N2O5 + H2O → 2HNO3
P2O5 + 3H2O → 2H3PO4 и т.д.
SiO2 + H2O → реакция не идет
* Источник: [2] "Я сдам ЕГЭ. Курс самоподготовки", стр. 143.
Взаимодействие оксидов друг с другом
1. Оксиды одного типа друг с другом не взаимодействуют:
Na2O + CaO → реакция не идет
CO2 + SO3 → реакция не идет
2. Как правило, оксиды разных типов взаимодействуют друг с другом (исключения: CO2, SO2, о них подробнее ниже):
Na2O + SO3 → Na2SO4
CaO + CO2 → CaCO3
Na2O + ZnO → Na2ZnO2
Взаимодействие оксидов с кислотами
1. Как правило, основные и амфотерные оксиды взаимодействуют с кислотами:
Na2O + HNO3 → NaNO3 + H2O
ZnO + 2HCl → ZnCl2 + H2O
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Исключением является очень слабая нерастворимая (мета)кремниевая кислота H2SiO3. Она реагирует только с щелочами и оксидами щелочных и щелочноземельных металлов.
CuO + H2SiO3 → реакция не идет.
2. Кислотные оксиды не вступают в реакции ионного обмена с кислотами, но возможны некоторые окислительно-восстановительные реакции:
SO2 + 2H2S → 3S + 2H2O
SO3 + H2S → SO2 + H2O
SiO2 + 4HF(нед.) → SiF4 + 2H2O
С кислотами-окислителями (только если оксид можно окислить):
SO2 + HNO3 + H2O → H2SO4 + NO
Взаимодействие оксидов с основаниями
1. Основные оксиды с щелочами и нерастворимыми основаниями НЕ взаимодействуют.
2. Кислотные оксиды взаимодействуют с основаниями с образованием солей:
SiO2 + 2NaOH → Na2SiO3 +H2O
CO2 + 2NaOH → Na2CO3 + H2O
CO2 + NaOH → NaHCO3 (если CO2 в избытке)
3. Амфотерные оксиды взаимодействуют с щелочами (т.е. только с растворимыми основаниями) с образованием солей или комплексных соединений:
а) Реакциях с растворами щелочей:
ZnO + 2NaOH + H2O → Na2[Zn(OH)4] (тетрагидроксоцинкат натрия)
BeO + 2NaOH + H2O → Na2[Be(OH)4] (тетрагидроксобериллат натрия)
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4] (тетрагидроксоалюминат натрия)
б) Сплавление с твердыми щелочами:
ZnO + 2NaOH → Na2ZnO2 + H2O (цинкат натрия)
(кислота: H2ZnO2)
BeO + 2NaOH → Na2BeO2 + H2O (бериллат натрия)
(кислота: H2BeO2)
Al2O3 + 2NaOH → 2NaAlO2 + H2O (алюминат натрия)
(кислота: HAlO2)
Взаимодействие оксидов с солями
1. Кислотные и амфотерные оксиды взаимодействуют с солями при условии выделения более летучего оксида, например, с карбонатами или сульфитами все реакции протекают при нагревании:
SiO2 + CaCO3 → CaSiO3 + CO2
P2O5 + 3CaCO3 → Ca3(PO4)2 + 3CO2
Al2O3 + Na2CO3 → 2NaAlO2 + CO2
Cr2O3 + Na2CO3 → 2NaCrO2 + CO2
ZnO + 2KHCO3 → K2ZnO2 + 2CO2 + H2O
SiO2 + K2SO3 → K2SiO3 + SO2
ZnO + Na2SO3 → Na2ZnO2 + SO2
Если оба оксида являются газообразными, то выделяется тот, который соответствует более слабой кислоте:
K2CO3 + SO2 → K2SO3 + CO2 (H2CO3 слабее и менее устойчива, чем H2SO3)
2. Растворенный в воде CO2 растворяет нерастворимые в воде карбонаты (с образованием растворимых в воде гидрокарбонатов):
CO2 + H2O + CaCO3 → Ca(HCO3)2
CO2 + H2O + MgCO3 → Mg(HCO3)2
В тестовых заданиях такие реакции могут быть записаны как:
MgCO3 + CO2 (р-р), т.е. используется раствор с углекислым газом и, следовательно, в реакцию необходимо добавить воду.
Это один из способов получения кислых солей.
Восстановление слабых металлов и металлов средней активности из их оксидов возможно с помощью водорода, углерода, угарного газа или более активного металла (все реакции проводятся при нагревании):
1. Реакции с CO, C и H2:
CuO + C → Cu + CO
CuO + CO → Cu + CO2
CuO + H2 → Cu + H2O
ZnO + C → Zn + CO
ZnO + CO → Zn + CO2
ZnO + H2 → Zn + H2O
PbO + C → Pb + CO
PbO + CО → Pb + CO2
PbO + H2 → Pb + H2O
FeO + C → Fe + CO
FeO + CО → Fe + CO2
FeO + H2 → Fe + H2O
Fe2O3 + 3C → 2Fe + 3CO
Fe2O3 + 3CО → 2Fe + 3CO2
Fe2O3 + 3H2 → 2Fe + 3H2O
WO3 + 3H2 → W + 3H2O
2. Восстановление активных металлов (до Al включительно) приводит к образованию карбидов, а не свободного металла:
CaO + 3C → CaC2 + 3CO
2Al2O3 + 9C → Al4C3 + 6CO
3. Восстановление более активным металлом:
3FeO + 2Al → 3Fe + Al2O3
Cr2O3 + 2Al → 2Cr + Al2O3.
4. Некоторые оксиды неметаллов также возможно восстановить до свободного неметалла:
2P2O5 + 5C → 4P + 5CO2
SO2 + C → S + CO2
2NO + C → N2 + CO2
2N2O + C → 2N2 + CO2
SiO2 + 2C → Si + 2CO
Только оксиды азота и углерода реагируют с водородом:
2NO + 2H2 → N2 + 2H2O
N2O + H2 → N2 + H2O
SiO2 + H2 → реакция не идет.
В случае углерода восстановления до простого вещества не происходит:
CO + 2H2 CH3OH (t, p, kt)
Особенности свойств оксидов CO2 и SO2
1. Не реагируют с амфотерными гидроксидами:
CO2 + Al(OH)3 → реакция не идет
2. Реагируют с углеродом:
CO2 + C → 2CO
SO2 + C → S + CO2
3. С сильными восстановителями SO2 проявляет свойства окислителя:
SO2 + 2H2S → 3S + 2H2O
SO2 + 4HI → S + 2I2 + 2H2O
SO2 + 2C → S + CO2
SO2 + 2CO → S + 2CO2 (Al2O3, 500°C)
4. Сильные окислители окисляют SO2:
SO2 + Cl2 SO2Cl2
SO2 + Br2 SO2Br2
SO2 + NO2 → SO3 + NO
SO2 + H2O2 → H2SO4
5SO2 + 2KMnO4 +2H2O → 2MnSO4 + K2SO4 + 2H2SO4
SO2 + 2KMnO4 + 4KOH → 2K2MnO4 +K2SO4 + 2H2O
SO2 + HNO3 + H2O → H2SO4 + NO
6. Оксид углерода (IV) CO2 проявляет менее выраженные окислительные свойства, реагируя только с активными металлами, например:
CO2 + 2Mg → 2MgO + C (t)
Особенности свойств оксидов азота (N2O5, NO2, NO, N2O)
1. Необходимо помнить, что все оксиды азота являются сильными окислителями. Совсем необязательно помнить какие продукты образуются в подобных реакциях, так как подобные вопросы возникают только в тестах. Нужно лишь знать основные восстановители, такие как C, CO, H2, HI и йодиды, H2S и сульфиды, металлы (и т.д.) и знать, что оксиды азота их с большой вероятностью окислят.
2NO2 + 4CO → N2 + 4CO2
2NO2 + 2S → N2 + 2SO2
2NO2 + 4Cu → N2 + 4CuO
N2O5 + 5Cu → N2 + 5CuO
2N2O5 + 2KI → I2 + 2NO2 + 2KNO3
N2O5 + H2S → 2NO2 + S + H2O
2NO + 2H2 → N2 + 2H2O
2NO + C → N2 + CO2
2NO + Cu → N2 + 2Cu2O
2NO + Zn → N2 + ZnO
2NO + 2H2S → N2 + 2S + 2H2O
N2O + H2 → N2 + H2O
2N2O + C → 2N2 + CO2
N2O + Mg → N2 + MgO
2. Могут окисляться сильными окислителями (кроме N2O5, так как степень окисления уже максимальная):
2NO + 3KClO + 2KOH → 2KNO3 + 3KCl + H2O
8NO + 3HClO4 + 4H2O → 8HNO3 + 3HCl
14NO + 6HBrO4 + 4H2O → 14HNO3 + 3Br2
NO + KMnO4 + H2SO4 → HNO3 + K2SO4 + MnSO4 + H2O
5N2O + 2KMnO4 + 3H2SO4 → 10NO + 2MnSO4 + K2SO4 + 3H2O.
3. Несолеобразующие оксиды N2O и NO не реагируют ни с водой, ни с щелочами, ни с обычными кислотами (кислотами-неокислителями).
Химические свойства CO как сильного восстановителя
1. Реагирует с некоторыми неметаллами:
2CO + O2 → 2CO2
CO + 2H2 CH3OH (t, p, kt)
CO + Cl2 COCl2 (фосген)
2. Реагирует с некоторыми сложными соединениями:
CO + KOH → HCOOK
CO + Na2O2 → Na2CO3
CO + Mg → MgO + C (t)
3. Восстанавливает некоторые металлы (средней и малой активности) и неметаллы из их оксидов:
CO + CuO → Cu + CO2
3CO + Fe2O3 → 2Fe + 3CO2
3CO + Cr2O3 → 2Cr + 3CO2
2CO + SO2 → S + 2CO2 (Al2O3, 500°C)
5CO + I2O5 → I2 + 5CO2
4CO + 2NO2 → N2 + 4CO2
3. С обычными кислотами и водой CO (также как и другие несолеобразующие оксиды) не реагирует.
Химические свойства SiO2
1. Взаимодействует с активными металлами:
SiO2 + 2Mg → 2MgO + Si
SiO2 + 2Ca → 2CaO + Si
SiO2 + 2Ba → 2BaO + Si
2. Взаимодействует с углеродом:
SiO2 + 2C → Si + 2CO
(Согласно пособию "Курс самоподготовки" Каверина, SiO2 + CO → реакция не идет)
3 С водородом SiO2 не взаимодействует.
4. Реакции с растворами или расплавами щелочей, с оксидами и карбонатами активных металлов:
SiO2 + 2NaOH → Na2SiO3 +H2O
SiO2 + CaO → CaSiO3
SiO2 + BaO → BaSiO3
SiO2 + Na2CO3 → Na2SiO3 + CO2
SiO2 + CaCO3 → CaSiO3 + CO2
SiO2 + Cu(OH)2 → реакция не идет (из оснований оксид кремния реагирует только с щелочами).
5. Из кислот SiO2 взаимодействует только с плавиковой кислотой:
SiO2 + 4HF → SiF4 + 2H2O.
Свойства оксида P2O5 как сильного водоотнимающего средства
HCOOH + P2O5 → CO + H3PO4
2HNO3 + P2O5 → N2O5 + 2HPO3
2HClO4 + P2O5 → Cl2O7 + 2HPO3.
Термическое разложение некоторых оксидов
В вариантах экзамена такое свойство оксидов не встречается, но рассмотрим его для полноты картины:
Основные:
4CuO → 2Cu2O + O2 (t)
2HgO → 2Hg + O2 (t)
Кислотные:
2SO3 → 2SO2 + O2 (t)
2N2O → 2N2 + O2 (t)
2N2O5 → 4NO2 + O2 (t)
Амфотерные:
4MnO2 → 2Mn2O3 + O2 (t)
6Fe2O3 → 4Fe3O4 + O2 (t).
Особенности оксидов NO2, ClO2 и Fe3O4
1. Диспропорционирование: оксидам NO2 и ClO2 соответствуют две кислоты, поэтому при взаимодействии с щелочами или карбонатами щелочных металлов образуются две соли: нитрат и нитрит соответствующего металла в случае NO2 и хлорат и хлорит в случае ClO2:
2N +4 O2 + 2NaOH → NaN +3 O2 + NaN +5 O3 + H2O
4NO2 + 2Ba(OH)2 → Ba(NO2)2 + Ba(NO3)2 + 2H2O
2NO2 + Na2CO3 → NaNO3 + NaNO2 + CO2
В аналогичных реакциях с кислородом образуются только соединения с N +5 , так как он окисляет нитрит до нитрата:
4NO2 + O2 + 4NaOH → 4NaNO3 + 2H2O
4NO2 + O2 + 2H2O → 4HNO3 (растворение в избытке кислорода)
2Cl +4 O2 + H2O → HCl +3 O2 + HCl +5 O3
2ClO 2 + 2NaOH → NaClO2 + NaClO3 + H2O
2. Оксид железа (II,III) Fe3O4 (FeO·Fe2O3) содержит железо в двух степенях окисления: +2 и +3, поэтому в реакциях с кислотами образуются две соли:
Азотная кислота
Азотная кислота HNO3 – это сильная одноосновная кислота-гидроксид. При обычных условиях бесцветная, дымящая на воздухе жидкость, температура плавления −41,59 °C, кипения +82,6 °C ( при нормальном атмосферном давлении). Азотная кислота смешивается с водой во всех соотношениях. На свету частично разлагается.
Валентность азота в азотной кислоте равна IV, так как валентность V у азота отсутствует. При этом степень окисления атома азота равна +5. Так происходит потому, что атом азота образует 3 обменные связи и одну донорно-акцепторную, является донором электронной пары.
Поэтому строение молекулы азотной кислоты можно описать резонансными структурами:


Обозначим дополнительные связи между азотом и кислородом пунктиром. Этот пунктир по сути обозначает делокализованные электроны. Получается формула:

Способы получения
В лаборатории азотную кислоту можно получить разными способами:
1. Азотная кислота образуется при действии концентрированной серной кислоты на твердые нитраты металлов. При этом менее летучая серная кислота вытесняет более летучую азотную.
Например , концентрированная серная кислота вытесняет азотную из кристаллического нитрата калия:
2. В промышленности азотную кислоту получают из аммиака . Процесс осуществляется постадийно.
1 стадия. Каталитическое окисление аммиака.
2 стадия. Окисление оксида азота (II) до оксида азота (IV) кислородом воздуха.
3 стадия. Поглощение оксида азота (IV) водой в присутствии избытка кислорода.
Химические свойства
Азотная кислота – это сильная кислота . За счет азота со степенью окисления +5 азотная кислота проявляет сильные окислительные свойства .
1. Азотная кислота практически полностью диссоциирует в водном растворе.
2. Азотная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например , азотная кислота взаимодействует с оксидом меди (II):
Еще пример : азотная кислота реагирует с гидроксидом натрия:
3. Азотная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов, сульфитов).
Например , азотная кислота взаимодействует с карбонатом натрия:
4. Азотная кислота частично разлагается при кипении или под действием света:
5. Азотная кислота активно взаимодействует с металлами. При этом никогда не выделяется водород! При взаимодействии азотной кислоты с металлами окислителем всегда выступает азот +5. Азот в степени окисления +5 может восстанавливаться до степеней окисления -3, 0, +1, +2 или +4 в зависимости от концентрации кислоты и активности металла.
металл + HNO3 → нитрат металла + вода + газ (или соль аммония)
С алюминием, хромом и железом на холоду концентрированная HNO3 не реагирует – кислота «пассивирует» металлы, т.к. на их поверхности образуется пленка оксидов, непроницаемая для концентрированной азотной кислоты. При нагревании реакция идет. При этом азот восстанавливается до степени окисления +4:
Золото и платина не реагируют с азотной кислотой, но растворяются в «царской водке» – смеси концентрированных азотной и соляной кислот в соотношении 1 : 3 (по объему):
HNO3 + 3HCl + Au → AuCl3 + NO + 2H2O
Концентрированная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (IV), азот восстанавливается минимально:
С активными металлами (щелочными и щелочноземельными) концентрированная азотная кислота реагирует с образованием оксида азота (I):
Разбавленная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (II).
С активными металлами (щелочными и щелочноземельными), а также оловом и железом разбавленная азотная кислота реагирует с образованием молекулярного азота:
При взаимодействии кальция и магния с азотной кислотой любой концентрации (кроме очень разбавленной) образуется оксид азота (I):
Очень разбавленная азотная кислота реагирует с металлами с образованием нитрата аммония:
Таблица . Взаимодействие азотной кислоты с металлами.
| Азотная кислота | ||||
| Концентрированная | Разбавленная | |||
| с Fe, Al, Cr | с неактивными металлами и металлами средней активности (после Al) | с щелочными и щелочноземельными металлами | с неактивными металлами и металлами средней активности (после Al) | с металлами до Al в ряду активности, Sn, Fe |
| пассивация при низкой Т | образуется NO2 | образуется N2O | образуется NO | образуется N2 |
6. Азотная кислота окисляет и неметаллы (кроме кислорода, водорода, хлора, фтора и некоторых других). При взаимодействии с неметаллами HNO3 обычно восстанавливается до NO или NO2, неметаллы окисляются до соответствующих кислот, либо оксидов (если кислота неустойчива).
Например , азотная кислота окисляет серу, фосфор, углерод, йод:
Безводная азотная кислота – сильный окислитель. Поэтому она легко взаимодействует с красным и белым фосфором . Реакция с белым фосфором протекает очень бурно. Иногда она сопровождается взрывом.
Видеоопыт взаимодействия фосфора с безводной азотной кислотой можно посмотреть здесь.
Видеоопыт взаимодействия угля с безводной азотной кислотой можно посмотреть здесь.
7. Концентрированная а зотная кислота окисляет сложные вещества (в которых есть элементы в отрицательной, либо промежуточной степени окисления): сульфиды металлов, сероводород, фосфиды, йодиды, соединения железа (II) и др. При этом азот восстанавливается до NO2, неметаллы окисляются до соответствующих кислот (или оксидов), а металлы окисляются до устойчивых степеней окисления.
Например , азотная кислота окисляет оксид серы (IV):
Еще пример : азотная кислота окисляет иодоводород:
Сера в степени окисления -2 окисляется без нагревания до простого вещества, при нагревании до серной кислоты.
Например , сероводород окисляется азотной кислотой без нагревания до молекулярной серы:
При нагревании до серной кислоты:
Соединения железа (II) азотная кислота окисляет до соединений железа (III):
8. Азотная кислота окрашивает белки в оранжево-желтый цвет («ксантопротеиновая реакция«).
Ксантопротеиновую реакцию проводят для обнаружения белков, содержащих в своем составе ароматические аминокислоты. К раствору белка прибавляем концентрированную азотную кислоту. Белок свертывается. При нагревании белок желтеет. При добавлении избытка аммиака окраска переходит в оранжевую.

Видеоопыт обнаружения белков с помощью азотной кислоты можно посмотреть здесь.
Азотная кислота
Азотная кислота является одной из самых сильных минеральных кислот, в концентрированном виде выделяет пары желтого цвета с резким запахом. За исключением золота и платины растворяет все металлы.
Применяют азотную кислоту для получения красителей, удобрений, органических нитропродуктов, серной и фосфорной кислот. В результате ожога азотной кислотой образуется сухой струп желто-зеленого цвета.

В промышленности азотную кислоту получают в результате окисления аммиака на платино-родиевых катализаторах.
Чистая азотная кислота впервые была получена действием на селитру концентрированной серной кислоты:
Является одноосновной сильной кислотой, вступает в реакции с основными оксидами, основаниями. С солями реагирует при условии выпадения осадка, выделения газа или образования слабого электролита.

При нагревании азотная кислота распадается. На свету (hv) также происходит подобная реакция, поэтому азотную кислоту следует хранить в темном месте.
Азотная кислота способна окислить все неметаллы, при этом, если кислота концентрированная, азот обычно восстанавливается до NO2, если разбавленная - до NO.

В любой концентрации азотная кислота проявляет свойства окислителя, при этом азот восстанавливается до степени окисления от +5 до -3. На какой именно степени окисления остановится азот, зависит от активности металла и концентрации азотной кислоты.
Для малоактивных металлов (стоящих в ряду напряжений после водорода) реакция с концентрированной азотной кислотой происходит с образованием нитрата и преимущественно NO2.
С разбавленной азотной кислотой газообразным продуктом преимущественно является NO.
В реакциях с металлами, стоящими левее водорода в ряду напряжений, возможны самые разные газообразные (и не газообразные) продукты: бурый газ NO2, NO, N2O, атмосферный газ N2, NH4NO3.
Помните о закономерности: чем более разбавлена кислота и активен металл, тем сильнее восстанавливается азот. Ниже представлены реакции цинка с азотной кислотой в различных концентрациях.

Посмотрите на таблицу ниже, в которой также отражены изученные нами закономерности.

Концентрированная холодная азотная кислота пассивирует хром, железо, алюминий, никель, свинец и бериллий. Это происходит за счет оксидной пленки, которой покрыты данные металлы.
Al + HNO3(конц.) ⇸ (реакция не идет)
При нагревании или амальгамировании (покрытие ртутью) перечисленных металлов реакция с азотной кислотой идет, так как оксидная пленка на поверхности металлов разрушается.
Соли азотной кислоты - нитраты NO3 -
Получают нитраты в ходе реакции азотной кислоты с металлами, их оксидами и основаниями.
В реакциях с оксидами и основаниями газообразный продукт обычно не выделяется.

Нитрат аммония получают реакция аммиака с азотной кислотой.
Обратите внимание на следующую закономерность: концентрированная азотная кислота, как правило, окисляет железо и хром до +3. Разбавленная кислота - до +2.
- Реакции с металлами, основаниями и кислотами
Как и для всех солей, из нитратов можно вытеснить металл другим более активным. Соли реагируют с основаниями и кислотами, если в результате реакции выпадает осадок, выделяется газ или образуется слабый электролит (вода).

Нитраты разлагаются в зависимости от активности металла, входящего в их состав.


Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Азотная кислота
Холодная концентрированная азотная кислота не вступает в реакцию с алюминием, происходит пассивирование.
2. Реакция концентрированной азотной кислоты с малоактивными металлами сопровождается выделением газа
В реакциях концентрированной азотной кислоты и малоактивных металлов преимущественно выделяется NO2.
3. Если в результате реакции активного металла с азотной кислотой выделилось твердое вещество, то речь идет о
Твердый продукт, образовавшийся в ходе реакции с азотной кислотой, нитрат аммония - NH4NO3
Разложение нитрата аммония протекает по схеме: AgNO3 → Ag + NO2 + O2
Азотной кислотой окрашивает пораженную в результате ожога кожу в желтый цвет.
Hno3 с оксидами металлов
Температура кипения азота составляет -195,8 °C. Однако быстрого замораживания объектов, которое часто демонстрируют в кинофильмах, не происходит. Даже для заморозки растения нужно продолжительное время, это связано с низкой теплоемкостью азота.
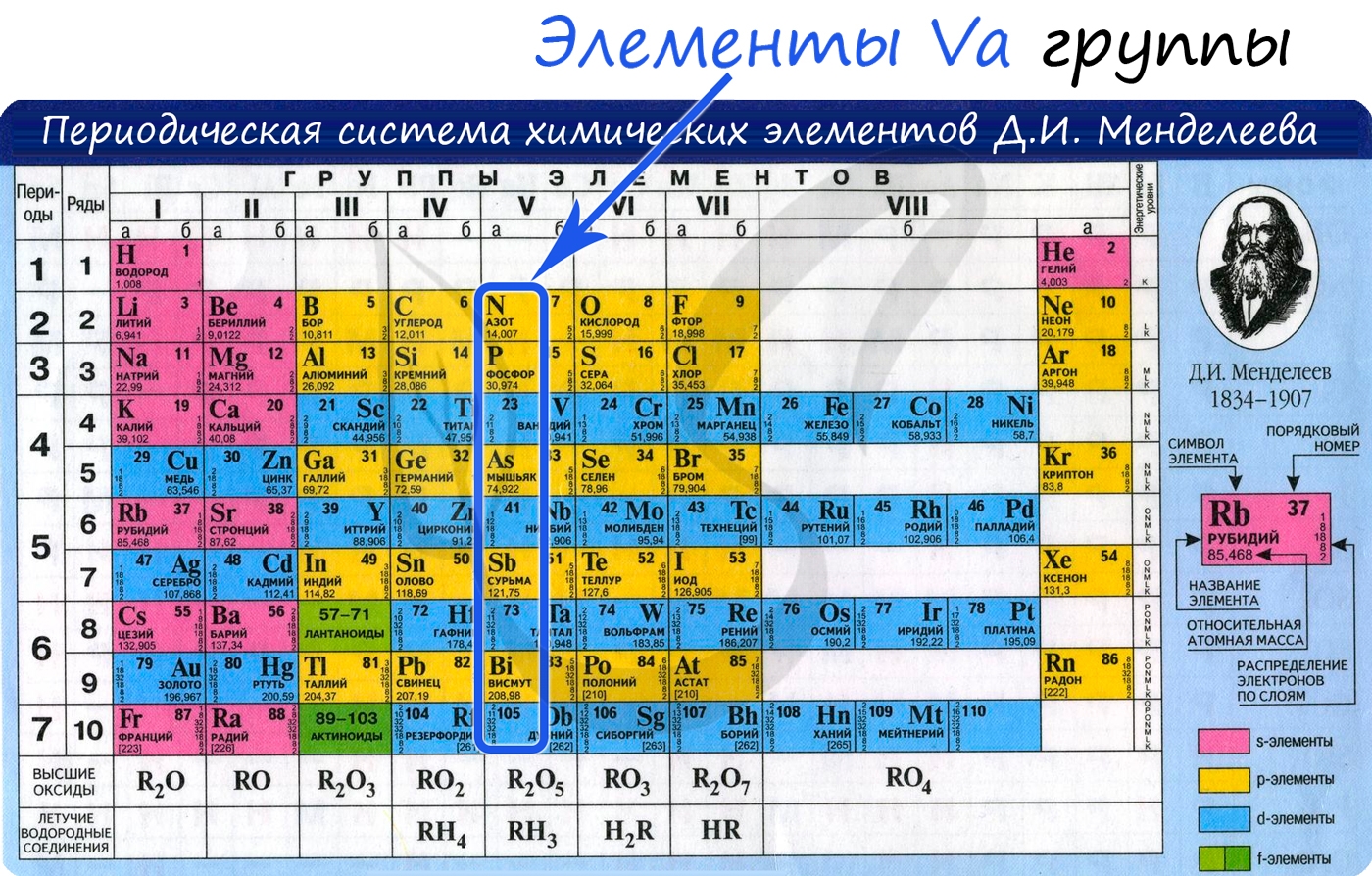
Общая характеристика элементов Va группы
От N к Bi (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Азот, фосфор и мышьяк являются неметаллами, сурьма - полуметалл, висмут - металл.
- N - 2s 2 2p 3
- P - 3s 2 3p 3
- As - 4s 2 4p 3
- Sb - 5s 2 5p 3
- Bi - 6s 2 6p 3
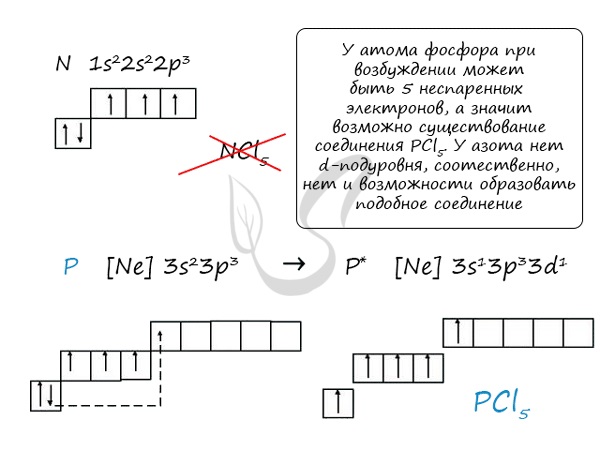
Основное и возбужденное состояние азота
При возбуждении атома фосфора электроны на s-подуровне распариваются и переходят на p-подуровень. Однако с азотом ситуация иная. Поскольку азот находится во втором периоде, то 3ий уровень у него отсутствует, а значит распаривание электронов на s-подуровне невозможно - возбужденное состояние у азота отсутствует.
Сравнивая возможности перемещения электронов у азота и фосфора, разница становится очевидна.
Природные соединения
- Воздух - во вдыхаемом нами воздухе содержится 78% азота
- Азот входит в состав нуклеиновых кислот, белков
- KNO3 - индийская селитра, калиевая селитра
- NaNO3 - чилийская селитра, натриевая селитра
- NH4NO3 - аммиачная селитра (искусственный продукт, в природе не встречается)
Селитры являются распространенными азотными удобрениями, которые обеспечивают быстрый рост и развитие растений, повышают урожайность. Однако, следует строго соблюдать правила их применения, чтобы не превысить допустимые концентрации.

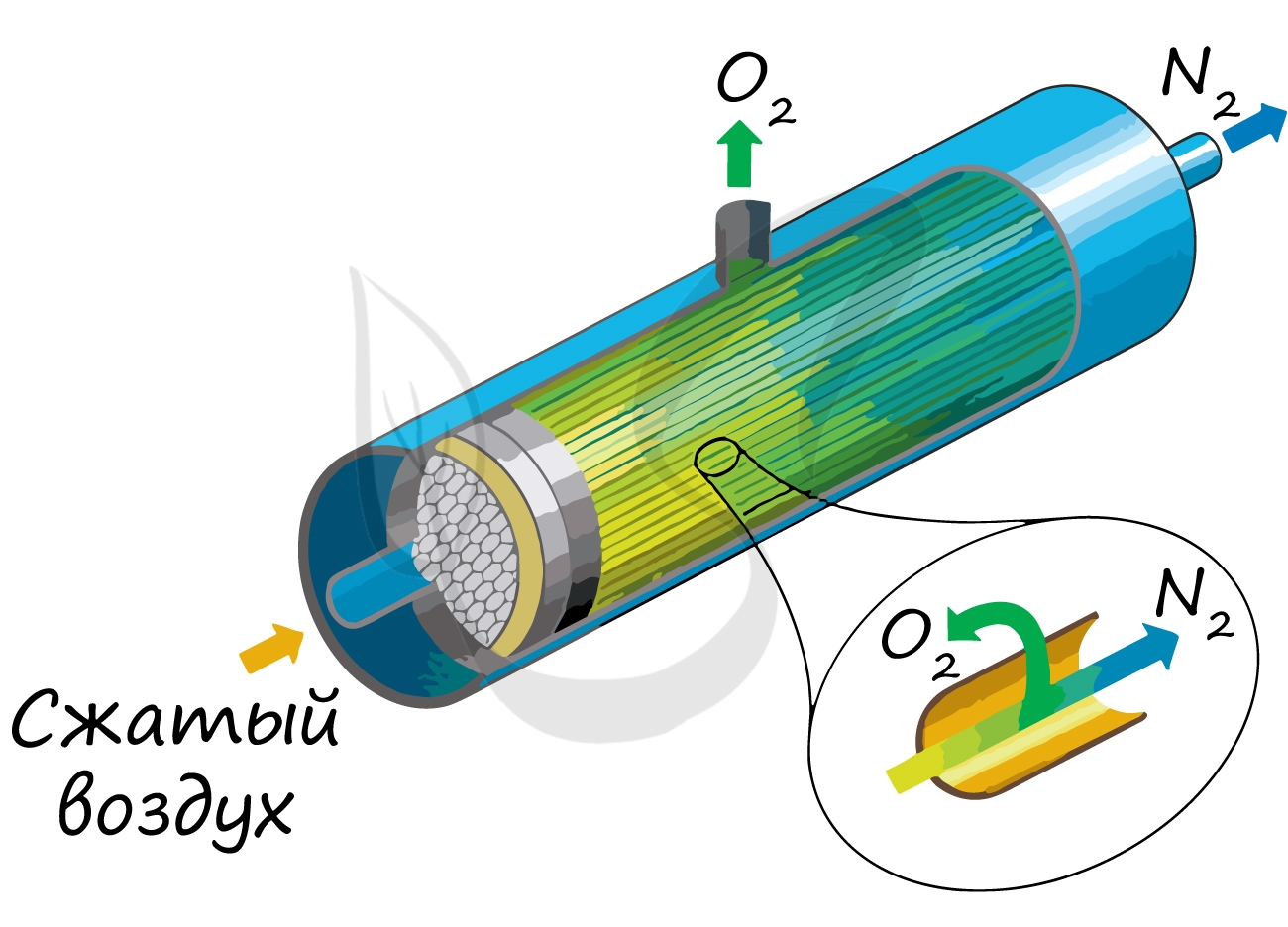
В промышленности азот получают путем сжижения воздуха. В дальнейшем путем испарения из сжиженного воздуха получают азот.
Применяют и метод мембранного разделения, при котором через специальный фильтр из сжатого воздуха удаляют кислород.
В лаборатории методы не столь экзотичны. Чаще всего получают азот разложением нитрита аммония
Также азот можно получить путем восстановления азотной кислоты активными металлами.

Азот восхищает - он принимает все возможные для себя степени окисления от -3 до +5.

Молекула азота отличается большой прочностью из-за наличия тройной связи. Вследствие этого многие реакции эндотермичны: даже горение азота в кислороде сопровождается поглощением тепла, а не выделением, как обычно бывает при горении.

Без нагревания азот взаимодействует только с литием. При нагревании реагирует и с другими металлами.
Важное практическое значение имеет синтез аммиака, который применяется в дальнейшим при изготовлении удобрений, красителей, лекарств.
Аммиак
Бесцветный газ с резким едким запахом, раздражающим слизистые оболочки. Раствор концентрацией 10% аммиака применяется в медицинских целях, называется нашатырным спиртом.
В промышленности аммиак получают прямым взаимодействием азота и водорода.
В лабораторных условиях сильными щелочами действуют на соли аммония.
Аммиак проявляет основные свойства, окрашивает лакмусовую бумажку в синий цвет.
- Реакция с водой
Образует нестойкое соединение - гидроксид аммония, слабое основание. Оно сразу же распадается на воду и аммиак.
Как основание аммиак способен реагировать с кислотами с образованием солей.
NH3 + HCl → NH4Cl (хлорид аммония)

Поскольку азот в аммиаке находится в минимальной степени окисления -3 и способен только ее повышать, то аммиак проявляет выраженные восстановительные свойства. Его используют для восстановления металлов из их оксидов.
Горение аммиака без катализатора приводит к образованию азота в молекулярном виде. Окисление в присутствии катализатора сопровождается выделением NO.

Соли аммония
Помните, что по правилам общей химии, если по итогам реакции выпадает осадок, выделяется газ или образуется вода - реакция идет.
- Реакции с кислотами
В реакциях с щелочами образуется гидроксид аммония - NH4OH. Нестойкое основание, которое легко распадается на воду и аммиак.
В воде ион аммония подвергается гидролизу с образованием нестойкого гидроксида аммония.

Оксид азота I - N2O
Закись азота, веселящий газ - N2O - обладает опьяняющим эффектом. Несолеобразующий оксид. При н.у. является бесцветным газом с приятным сладковатым запахом и привкусом. В медицине применяется в больших концентрациях для ингаляционного наркоза.

Получают N2O разложением нитрата аммония при нагревании:
Оксид азота I разлагается на азот и кислород:
Оксид азота II - NO
Окись азота - NO. Несолеобразующий оксид. При н.у. бесцветный газ, на воздухе быстро окисляется до оксида азота IV.
В промышленных масштабах оксид азота II получают при каталитическом окислении аммиака.
В лабораторных условиях - в ходе реакции малоактивных металлов с разбавленной азотной кислотой.
На воздухе быстро окисляется с образованием бурого газа - оксида азота IV - NO2.
Оксид азота III - N2O3
При н.у. жидкость синего цвета, в газообразной форме бесцветен. Высокотоксичный, приводит к тяжелым ожогам кожи.

Получают N2O3 в две стадии: сначала реакцией оксида мышьяка III с азотной кислотой (две реакции, в которых образуется смесь оксидов азота), затем охлаждением полученной смеси газов до температуры - 36 °C.
При охлаждении газов образуется оксид азота III.
Является кислотным оксидом. соответствует азотистой кислоте - HNO2, соли которой называются нитриты (NO2 - ). Реагирует с водой, основаниями.
Оксид азота IV - NO2
Бурый газ, имеет острый запах. Ядовит.

В лабораторных условиях данный оксид получают в ходе реакции меди с концентрированной азотной кислотой. Также NO2 выделяется при разложении нитратов.
Проявляет высокую химическую активность, кислотный оксид.
Как окислитель NO2 ведет себя в реакциях с фосфором, углеродом и серой, которые сгорают в нем.
Окисляет SO2 в SO3 - на этой реакции основана одна из стадий получения серной кислоты.
Оксид азота IV соответствует сразу двум кислотам - азотистой HNO2 и азотной HNO3. Реакции с водой и щелочами протекают по одной схеме.
Если растворение в воде оксида проводить в избытке кислорода, образуется азотная кислота.

Классификация неорганических веществ
Неорганическая химия - раздел химии, изучающий строение и химические свойства неорганических веществ.
Среди простых веществ выделяют металлы и неметаллы. Среди сложных: оксиды, основания, кислоты и соли. Классификация неорганических веществ построена следующим образом:

Большинство химических свойств мы изучим по мере продвижения по периодической таблице Д.И. Менделеева. В этой статье мне хотелось бы подчеркнуть ряд принципиальных деталей, которые помогут в дальнейшем при изучении химии.
Оксиды
Все оксиды подразделяются на солеобразующие и несолеобразующие. Солеобразующие имеют соответствующие им основания и кислоты (в той же степени окисления (СО)!) и охотно вступают в реакции солеобразования. К ним относятся, например:
- CuO - соответствует основанию Cu(OH)2
- Li2O - соответствует основанию LiOH
- FeO - соответствует основанию Fe(OH)2 (сохраняем ту же СО = +2)
- Fe2O3 - соответствует основанию Fe(OH)3 (сохраняем ту же СО = +3)
- P2O5 - соответствует кислоты H3PO4
Солеобразующие оксиды, в свою очередь, делятся на основные, амфотерные и кислотные.

Основным оксидам соответствуют основания в той же СО. В химических реакциях основные оксиды проявляют основные свойства, образуются исключительно металлами. Примеры: Li2O, Na2O, K2O, Rb2O CaO, FeO, CrO, MnO.
Основные оксиды взаимодействуют с водой с образованием соответствующего основания (реакцию идет, если основание растворимо) и с кислотными оксидами и кислотами с образованием солей. Между собой основные оксиды не взаимодействуют.
Li2O + H2O → LiOH (основный оксид + вода → основание)
Здесь не происходит окисления/восстановления, поэтому сохраняйте исходные степени окисления атомов.
Эти оксиды действительно имеют двойственный характер: они проявляют как кислотные, так и основные свойства. Примеры: BeO, ZnO, Al2O3, Fe2O3, Cr2O3, MnO2, PbO, PbO2, Ga2O3.
С водой они не взаимодействуют, так как продукт реакции, основание, получается нерастворимым. Амфотерные оксиды реагируют как с кислотами и кислотными оксидами, так и с основаниями и основными оксидами.
ZnO + KOH + H2O → K2[Zn(OH)4] (амф. оксид + основание = комплексная соль)
ZnO + N2O5 → Zn(NO3)2 (амф. оксид + кисл. оксид = соль; СО азота сохраняется в ходе реакции)
Fe2O3 + HCl → FeCl3 + H2O (амф. оксид + кислота = соль + вода; обратите внимание на то, что СО Fe = +3 не меняется в ходе реакции)

Проявляют в ходе химических реакций кислотные свойства. Образованы металлами и неметаллами, чаще всего в высокой СО. Примеры: SO2, SO3, P2O5, N2O3, NO2, N2O5, SiO2, MnO3, Mn2O7.
- SO2 - H2SO3
- SO3 - H2SO4
- P2O5 - H3PO4
- N2O5 - HNO3
- NO2 - HNO2, HNO3
Кислотные оксиды вступают в реакцию с основными и амфотерными, реагируют с основаниями. Реакции между кислотными оксидами не характерны.
SO2 + Na2O → Na2SO3 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +4)
SO3 + Li2O → Li2SO4 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +6)
P2O5 + NaOH → Na3PO4 + H2O (кисл. оксид + основание = соль + вода)
При реакции с водой кислотный оксид превращается в соответствующую ему кислоту. Исключение SiO2 - не реагирует с водой, так как продукт реакции - H2SiO3 является нерастворимой кислотой.

- CO
- N2O
- NO
- SiO
- S2O
Реакции несолеобразующих оксидов с основаниями, кислотами и солеобразующими оксидов редки и не приводят к образованию солей. Некоторые из несолеобразующих оксидов используют в качестве восстановителей:
FeO + CO → Fe + CO2 (восстановление железа из его оксида)

Основания
Основания - химические соединения, обычно характеризуются диссоциацией в водном растворе с образованием гидроксид-анионов. Растворимые основания называются щелочами: NaOH, LiOH, Ca(OH)2, Ba(OH)2.
Гидроксиды щелочных металлов (Ia группа) называются едкими: едкий натр - NaOH, едкое кали - KOH.

Основания классифицируются по количеству гидроксид-ионов в молекуле на одно-, двух- и трехкислотные.

Так же, как и оксиды, основания различаются по свойствам. Все основания хорошо реагируют с кислотами, даже нерастворимые основания способны растворяться в кислотах. Также нерастворимые основания при нагревании легко разлагаются на воду и соответствующий оксид.
NaOH + HCl → NaCl + H2O (основание + кислота = соль + вода - реакция нейтрализации)
Mg(OH)2 → (t) MgO + H2O (при нагревании нерастворимые основания легко разлагаются)
Если в ходе реакции основания с солью выделяется газ, выпадает осадок или образуется слабый электролит (вода), то такая реакция идет. Нерастворимые основания с солями почти не реагируют.
Ba(OH)2 + NH4Cl → BaCl2 + NH3 + H2O (в ходе реакции образуется нестойкое основание NH4OH, которое распадается на NH3 и H2O)
KOH + BaCl2 ↛ реакция не идет, так как в продуктах нет газа/осадка/слабого электролита (воды)
В растворах щелочей pH > 7, поэтому лакмус окрашивает их в синий цвет.

Амфотерные оксиды соответствуют амфотерным гидроксидам. Их свойства такие же двойственные: они реагирую как с кислотами - с образованием соли и воды, так и с основаниями - с образованием комплексных солей.
Al(OH)3 + HCl → AlCl3 + H2O (амф. гидроксид + кислота = соль + вода)
Al(OH)3 + KOH → K[Al(OH)4] (амф. гидроксид + основание = комплексная соль)
При нагревании до высоких температур комплексные соли не образуются.
Al(OH)3 + KOH → (t) KAlO2 + H2O (амф. гидроксид + основание = (прокаливание) соль + вода - при высоких температурах вода испаряется, и комплексная соль образоваться не может)

Кислоты
Кислота - химическое соединение обычно кислого вкуса, содержащее водород, способный замещаться металлом при образовании соли. По классификации кислоты подразделяются на одно-, двух- и трехосновные.
Основность кислоты определяется числом атомов водорода, которое способна отдать молекула кислоты, реагируя с основанием. Определять основность кислоты по числу атомов водорода в ней - часто верный способ, но не всегда: например, борная кислота H3BO3 является слабой одноосновной кислотой, фосфористая кислота H3PO3 - двухосновной кислотой.

Кислоты отлично реагируют с основными оксидами, основаниями, растворяя даже те, которые выпали в осадок (реакция нейтрализации). Также кислоты способны вступать в реакцию с теми металлами, которые стоят в ряду напряжений до водорода (то есть способны вытеснить его из кислоты).
H3PO4 + LiOH → Li3PO4 + H2O (кислота + основание = соль + вода - реакция нейтрализации)
Zn + HCl → ZnCl2 + H2↑ (реакция идет, так как цинк стоил в ряду активности левее водорода и способен вытеснить его из кислоты)
Cu + HCl ↛ (реакция не идет, так как медь расположена в ряду активности правее водорода, менее активна и не способна вытеснить его из кислоты)
Записать эти кислоты в растворе в виде "H2CO3 или H2SO3" - будет считаться ошибкой. Пишите угольную и сернистую кислоты в разложившемся виде - виде газа и воды.

Все кислоты подразделяются на сильные и слабые. Напомню, что мы составили подробную таблицу сильных и слабых кислот (и оснований!) в теме гидролиз. В реакции из сильной кислоты (соляной) можно получить более слабую, например, сероводородную или угольную кислоту.
Однако невозможно (и противоречит законам логики) получить из более слабой кислоты сильную, например из уксусной - серную кислоту. Природу не обманешь :)
K2S + HCl → H2S + KCl (из сильной - соляной кислоты - получили более слабую - сероводородную)
K2SO4 + CH3COOH ↛ (реакция не идет, так как из слабой кислоты нельзя получить сильную: из уксусной - серную)
Подчеркну важную деталь: гидроксиды это не только привычные нам NaOH, Ca(OH)2 и т.д., некоторые кислоты также считаются кислотными гидроксидами, например серная кислота - H2SO4. С полным правом ее можно записать как кислотный гидроксид: SO2(OH)2
В завершении подтемы кислот предлагаю вам вспомнить названия основных кислот и их кислотных остатков.

Соль - ионное соединение, образующееся вместе с водой при нейтрализации кислоты основанием (не единственный способ). Водород кислоты замещается металлом или ионом аммония (NH4). Наиболее известной солью является поваренная соль - NaCl.
- Средние - продукт полного замещения атомов водорода в кислоте на металл: KNO3, NaCl, BaSO4, Li3PO4
- Кислые - продукт неполного замещения атомов водорода: LiHSO4, NaH2PO4 и Na2HPO4 (гидросульфат лития, дигидрофосфат и гидрофосфат натрия)
- Основные - продукт неполного замещения гидроксогрупп на кислотный остаток: CrOHCl (хлорид гидроксохрома II)
- Двойные - содержат два разных металла и один кислотный остаток (NaCr(SO4)2
Читайте также:
