Химия 9 класс габриелян металлы
Из курса химии 9 класса вы уже имеете представление о природе химической связи, существующей в кристаллах металлов, — металлической связи. Напомним, что в узлах металлических кристаллических решёток располагаются атомы и положительные ионы металлов, связанные посредством обобществлённых внешних электронов, принадлежащих всему кристаллу. Эти электроны компенсируют силы электростатического отталкивания между положительными ионами и тем самым связывают их, обеспечивая устойчивость металлической решётки.
Металлическая связь обусловливает все важнейшие физические свойства металлов: пластичность, электро- и теплопроводность, металлический блеск и другие свойства, характерные для этого класса простых веществ.
Пластичность — это свойство вещества изменять форму под внешним воздействием и сохранять принятую форму после прекращения этого воздействия.
Способность расплющиваться от удара или вытягиваться в проволоку под действием силы составляет важнейшее механическое свойство металлов. Оно лежит в основе такой уважаемой большинством народов мира профессии, как профессия кузнеца. Недаром покровителем кузнечного дела у разных народов был бог огня: у греков — Гефест, у римлян — Вулкан, у славян — Сварог.
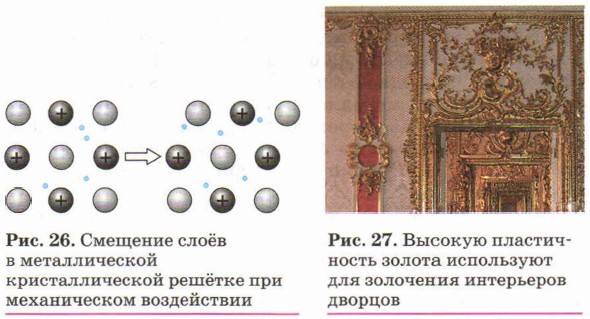
Пластичность металлов обусловлена способностью одних слоёв атом-ионов в кристаллах под внешним воздействием легко смещаться (как бы скользить) по отношению к другим слоям без разрыва связей между ними (рис. 26). Наиболее пластичны золото, серебро и медь. Например, из золота можно изготовить «золотую фольгу» толщиной 0,003 мм, которую используют для золочения изделий (рис. 27).
Высокая электропроводность большинства металлов обусловлена присутствием в их кристаллических решётках подвижных электронов, которые направленно перемещаются под действием электрического поля (рис. 28).
При нагревании колебательные движения ионов в кристалле усиливаются, что затрудняет направленное движение электронов и ведёт к снижению электрической проводимости. При охлаждении электропроводность металлов увеличивается и вблизи абсолютного нуля переходит в сверхпроводимость. Наибольшую электропроводность имеют серебро и медь, наименьшую — марганец, свинец, ртуть и вольфрам.
Такое свойство, как теплопроводность металлов, также связано с высокой подвижностью свободных электронов: сталкиваясь с колеблющимися в узлах решётки ионами, электроны обмениваются с ними энергией. С повышением температуры колебания ионов при посредстве электронов передаются другим ионам, и температура всего металлического предмета быстро выравнивается.
Для гладкой поверхности металлов характерен металлический блеск — результат отражения световых лучей. В порошкообразном состоянии большинство металлов теряет блеск, приобретая чёрную или серую окраску, и только алюминий и магний сохраняют блеск в порошке. Из алюминия, серебра и палладия, обладающих наиболее высокой отражательной способностью, изготовляют зеркала, в том числе и применяемые в прожекторах.
Для большинства металлов характерен белый или серый цвет. Золото и медь окрашены соответственно в жёлтый и жёлто-красный цвет. Из других физических свойств металлов наибольший практический интерес представляют твёрдость, плотность и температура плавления.
Для большинства металлов характерен белый или серый цвет. Золото и медь окрашены соответственно в жёлтый и жёлто-красный цвет.
Из других физических свойств металлов наибольший практический интерес представляют твёрдость, плотность и температура плавления.
Для всех металлов (кроме ртути) при обычных условиях характерно твёрдое агрегатное состояние. Однако твёрдость их различна. Наиболее твёрдые — металлы побочной подгруппы VI группы (VIB группы) Периодической системы Д. И. Менделеева. Так, хром по твёрдости приближается к алмазу. Самые мягкие — металлы главной подгруппы I группы (IA группы) Периодической системы Д. И. Менделеева — щелочные металлы. Например, натрий и калий легко режутся ножом.

По плотности металлы делят на лёгкие (плотность меньше 5 г/см 3 ) и тяжёлые (плотность больше 5 г/см 3 ). К лёгким относят щелочные, щёлочноземельные металлы и алюминий. Из переходных металлов сюда включают скандий, иттрий и титан. Эти металлы, благодаря лёгкости и тугоплавкости, всё шире применяют в различных областях техники.
Самый лёгкий металл — это литий (р = 0,53 г/см 3 ). Самый тяжёлый — осмий (р = 22,6 г/см 3 ).
Лёгкие металлы обычно легкоплавки, галлий может плавиться уже на ладони руки, а тяжёлые металлы — тугоплавки. Наибольшей температурой плавления, которая равна 3380 °С, обладает вольфрам. Это свойство вольфрама используют для изготовления ламп накаливания (рис. 29, 2). Кроме него в конструкцию лампы входят ещё семь металлов.
В Российской Федерации в настоящее время, как и ранее в Евросоюзе и США, на государственном уровне принято решение о замене привычных ламп накаливания на более экономичные и долговечные современные лампы, например галогенные, люминесцентные и светодиодные. Галогенная лампа (рис. 29, 2) — это та же лампа накаливания с вольфрамовой нитью, заполненная инертными газами с добавкой паров галогенов (брома или иода).

Люминесцентные (рис. 29, 3) — это хорошо знакомые вам лампы дневного света, имеющие один существенный недостаток — они содержат ртуть, а потому нуждаются в соблюдении особых правил утилизации на специальных пунктах приёма. Светодиодные лампы (рис. 29, 4) — самые экономичные и самые долговечные (срок работы до 100 тыс. ч), но пока и самые дорогие из ламп.
В технике, как вы уже знаете, металлы делят на чёрные (железо и его сплавы) и цветные (все остальные, более подробно о них будет рассказано в следующем параграфе) (рис. 30). Золото, серебро, платину и некоторые другие металлы относят к драгоценным металлам (рис. 31). 1


1. Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания.

1. Назовите самый легкоплавкий металл.
2. Какие физические свойства металлов используют в технике?
3. Фотоэффект, т. е. свойство металлов испускать электроны под действием лучей света, характерен для щелочных металлов, например для цезия. Почему? Где это свойство находит применение?
4. Какие физические свойства вольфрама лежат в основе его применения в лампах накаливания?
5. Какие свойства металлов лежат в основе образных литературных выражений: «серебряный иней», «золотая заря», «свинцовые тучи»?
§ 11. Химические свойства металлов
В химических реакциях металлы проявляют только восстановительные свойства, т. е. их атомы отдают электроны, образуя в результате положительные ионы. Окислителями при этом могут выступать неметаллы (кислород, галогены, сера и др.), катионы водорода Н + и катионы других металлов.
С кислородом воздуха легко взаимодействуют щелочные и щёлочноземельные металлы (поэтому их хранят под керосином):
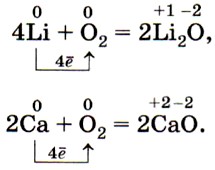
Железо, цинк, медь и другие менее активные металлы энергично окисляются кислородом только при нагревании:
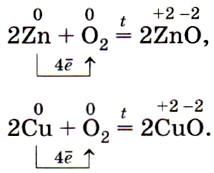
Золото и платиновые металлы не окисляются кислородом воздуха ни при каких условиях.
Как вы уже знаете, металлы образуют с неметаллами бинарные соединения — оксиды, хлориды, сульфиды, фосфиды ит. д., например:
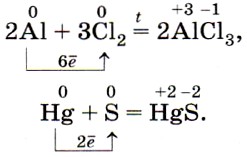
Щелочные и щёлочноземельные металлы легко реагируют с водой, восстанавливая катионы водорода до свободного водорода, и образуют при этом растворимые основания — щёлочи:
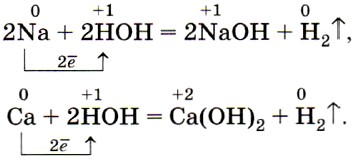
Менее активные металлы, например железо, взаимодействуют с водой только в раскалённом виде:
При этом, как и при горении железа, получается оксид состава Fe3O4 (железная окалина), который представляет собой смесь двух оксидов FeO • Fe2O3.
По восстановительной способности, как вы уже знаете, металлы располагают в ряд, который называют электрохимическим рядом напряжений:
К, Са, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, (H2), Cu, Hg, Ag, Au.
В этот ряд помещён и водород, который, как и металлы, способен отдавать электроны, образуя при этом положительно заряженные ионы Н + .
Как вы, очевидно, помните из курса химии 9 класса, из положения металлов в ряду напряжений вытекают два правила, характеризующие химические свойства металлов. Повторим их.
1. Металлы, стоящие в ряду напряжений левее водорода, вытесняют его из растворов кислот (рис. 35), а стоящие правее, как правило, не вытесняют водород из растворов кислот:
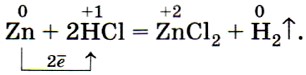
- правило соблюдается, если в реакции металла с кислотой образуется растворимая соль;
- концентрированная серная кислота и азотная кислота любой концентрации реагирует с металлами по-особому, при этом водород не образуется;
- на щелочные металлы правило не распространяется, так как они легко взаимодействуют с водой (а указанное правило относится к реакциям водных растворов кислот с металлами).
2. Каждый металл вытесняет из растворов солей другие металлы, находящиеся правее него в ряду напряжений, и сам может быть вытеснен металлами, расположенными левее, например (рис. 36):
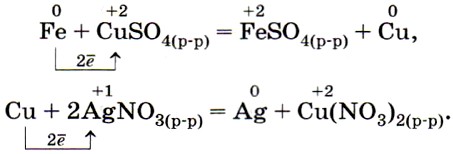

Это правило также имеет поправки, аналогичные таковым к первому правилу, а именно — правило соблюдается при условии образования растворимой соли; правило не распространяется на щелочные металлы.


1. Определите число электронов, которое отдают три атома железа молекуле воды в реакции образования железной окалины.
2. Вычислите объём воздуха (н. у.), который потребуется для сжигания 36 г магния. (Напоминаем, что объёмная доля кислорода в воздухе равна 0,21.)
3. Вычислите объём водорода (н. у.), который может быть получен при растворении в воде 120 мг кальция, если выход газа составляет 80% от теоретически возможного.
4. Почему щелочные и щёлочноземельные металлы хранят под керосином? Почему литий, в отличие от натрия и калия, хранят в вазелине?
5. Методом электронного баланса определите коэффициенты в уравнении реакции, схема которого:
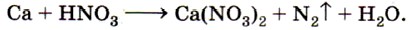
Какой ион проявляет в этой реакции окислительные свойства?
6. Можно ли получить водород при взаимодействии свинца с раствором серной кислоты?
7. Методом электронного баланса определите коэффициенты в уравнении реакции, схема которой:
Урок по химии 9 класс пол теме :"Металлы. Общие свойства металлов" по курсу О.С.Габриеляна
Автор УМК: Габриелян О.С. «Химия. 9 класс». Учебник для общеобразовательных учреждений. М.: Дрофа, 2011г.
Тема урока: «Химические свойства металлов»
Тип урока: изучение нового материала
· Образовательная: формирование системы знаний об общих химических свойствах металлов
· Развивающая: способствовать развитию умения ставить и разрешать проблему; формулировать гипотезу и искать подтверждающие или опровергающие её факты; обобщать, сравнивать и систематизировать
· Воспитательная: формирование положительной мотивации учения, интереса к предмету, изучаемому материалу; закрепление знаний о технике безопасности при работе с химическим оборудованием и реактивами.
· изучить и закрепить знания учащихся о химических свойствах металлов;
· рассмотреть взаимодействие металлов с различными веществами: с неметаллами, водой, растворами кислот и солей;
· развитие навыков учащихся самостоятельно проводить химический эксперимент с использованием инструкций и соблюдать правила техники безопасности при работе в кабинете химии.
· электрохимический ряд напряжения металлов (таблица);
· Металлы: натрий, цинк, алюминий, железо, медь, магний;
· Кислород (в колбе), сера, вода, соляная и серная кислоты, фенолфталеин, раствор сульфата меди( II );
· Пробирки, газоотводные трубки, ложки для сжигания веществ, фарфоровая и стеклянная посуда
Этапы урока
Содержание учебного материала. Деятельность учителя
Деятельность учащихся
Формирование УУД
Определение потребностей и мотивов.
а) мотивация к учебной деятельности
б) актуализация знаний
Учитель приветствует детей. Создаёт положительный настрой и рабочую атмосферу в классе.
- На прошлом уроке мы с вами начали изучать тему «Металлы». Поэтому, к сегодняшнему уроку я выбрала следующий эпиграф:
«Границ научному познанию и предсказанию предвидеть невозможно…» - Д. И. Менделеев.
Учитель демонстрирует слайд №2 или эпиграф заранее написан на доске.
Прокомментируйте, пожалуйста, эти слова, как вы их понимаете?
-Да, действительно, познание безгранично, но всё-таки, что вы уже знаете о металлах?
Фронтальная беседа с классом, сопровождающаяся показом слайдов № 5,6,7
- Охарактеризуйте положение металлов в П.С.Х.Э. Д. И. Менделеева;
- Назовите особенности строения атомов металлов;
- Перечислите основные физические свойства металлов;
- Чем они обусловлены?
- У Анны Ахматовой есть такие стихи:
«…На рукомойнике моём
Позеленела медь
Но так играет луч на нём,
Что весело глядеть…»
- Что произошло?
- Какие свойства вещества описала поэтесса?
И мы сегодня на уроке изучим «Химические свойства металлов»
Запись темы урока на доске.
На уроках в 8 классе вы знакомились с некоторыми химическими свойствами металлов. Назовите их основное химическое свойство.
Учитель записывает на доске:
Ме 0 – n e - Me n +
Для того чтобы прошла реакция, записанная на доске, необходимо наличие окислителя.
- Какие вещества могут выступать в роли окислителя?
- Как вы думаете, имея сходное строение, все ли металлы одинаково будут реагировать с предложенными вами веществами?
ГДЗ рабочая тетрадь по химии за 9 класс Габриелян, Остроумов

Зачем ребятам нужно ГДЗ по химии за 9 класс рабочая тетрадь Габриелян
Работа с пособием позволит подросткам полностью разобраться во всех нюансах химии. И эти знания обязательно пригодятся ученикам во время написания тестов и экзамена. Даже родители могут пользоваться справочником. С ним они в любой момент проверят ход выполнения домашнего задания.
Как устроен решебник
Ребята могут пользоваться сборником целый учебный год. Авторы включили в него весь материал курса. В ГДЗ подробно рассмотрены следующие темы:
- Химические реакции.
- Щелочные металлы и их соединения.
- Водород и вода.
- Азот и его соединения.
- Строение атома.
- Неметаллы.
Благодаря решебнику школьники смогут самостоятельно подтянуть все «хвосты» и подготовиться к важным тестированиям. Они обретут уверенность в своих силах и будут более активно отвечать на уроках. Со временем улучшится и их успеваемость по предмету.
Школьников перешедших в девятый класс ожидает насыщенная расширенная и усложнившаяся программа по всем дисциплинам в том числе и по химии. Ребятам предстоит не только осваивать солидный объем нового материала но и повторять практически все что было выучено ранее. К тому же преподаватели усиленно готовят будущих выпускников к сдаче ОГЭ. Потрудиться школьникам придется очень серьезно а поможет им в этом учебно-методический комплекс.
Учеба с онлайн-решебником по химии за 9 класс рабочая тетрадь Габриелян
В этом году школьникам предстоит ознакомиться с важными законами а также выучить немало формул. Помимо этого, ребят ожидает освоение крайне сложных разделов наполненных многочисленными определениями и терминами. Чтобы не отстать от программы и своевременно вникать в нюансы материала необходимо воспользоваться методическим пособием. Благодаря понятной и грамотной подаче важной дополнительной информации а также сопутствующим комментариям оно позволит девятиклассникам избежать проблем при изучении особо трудных разделов. Также сборник способствует более легкому освоению следующих тем:
- Атмосферные оксиды и гидроксиды.
- Классификация химических реакций.
- Щелочные металлы и их соединения.
- Водород.
- Кремний и его соединения.
Имея постоянный доступ к решебнику содержащему верные ответы к каждому номеру из базового учебника ребята сэкономят время и силы при выполнении домашнего задания.
Польза ГДЗ по химии за 9 класс рабочая тетрадь авторы: Габриелян О.С., Остроумов И.Г., Сладков С.А.
- одобрен федеральным государственным образовательным стандартом;
- верные ответы присутствуют на все номера упражнений к самым сложным добавлены пояснительные «ремарки» от опытных историков;
- ребята осилят домашнее задание любой трудности в кратчайшие сроки.
ГДЗ по химии за 9 класс Габриелян, Остроумов ФГОС

Девятый класс — знаменательный период в жизни ребят. Помимо государственных экзаменов, он принесёт свидетельство взросления, первую возможность серьёзного выбора, а ещё заставит немало поработать и поволноваться. Химию ребята будут изучать только второй год, поэтому немногие рискнут сейчас выбирать такой сложный и новый предмет для сдачи аттестационного испытания, но сделать это можно будет в будущем при условии регулярной и старательной работы. Даже если решение учащегося в итоге будет принято в пользу другой предметной области, данная дисциплина даст о себе знать и не позволит отодвинуть на последний план, поэтому заниматься нужно прилежно. А чтобы никакие проблемы не задерживали на одном месте, в момент сомнений обращайтесь к ГДЗ по химии 9 класс Габриелян.
Самые высокие оценки с онлайн-решебником по химии 9 класс Габриелян
Химия всегда считалась одной из самых непростых дисциплин школьного курса. Хоть в любом классе находятся любители науки о веществах, атомах и молекулах, неизменно у учеников возникают трудности. Нелегко разобраться с принципами, лежащими в основе химических задач и уравнений реакции. После каждой непонятой темы начинаются неурядицы с успеваемостью, а иногда это выливается в запущенную проблему, потому что информация из одного раздела подхватывается следующим, отставания нельзя допускать ни в какой момент. Подросткам, которые справляются с трудом, необходимо своевременно подыскать способ подтянуть знания. Одним из надёжных вариантов в этой ситуации будет обратиться к ГДЗ по химии 9 класс Габриелян О.С., Остроумов И.Г., Сладков С.А. Как организовать эффективную работу с пособием:
- начинайте с чтения параграфов и конспектов, используйте по максимуму весь потенциал предлагаемых вам материалов, освежите в памяти теоретические сведения;
- в любом случае у вас останутся вопросы, поэтому приступая к решению заданий, четко сформулируйте их;
- наконец после подготовки записей отыщите в сборнике ответы и проясните то, что не было очевидным, внесите коррективы.
Теперь то, какие вы получаете оценки, в ваших руках, показывайте только высокие результаты.
§ 1. Классификация химических соединений
Проверьте свои знания
Примените свои знания
Используйте дополнительную информацию
§ 2. Классификация химических реакций
Лабораторные опыты
§ 3. Скорость химических реакций. Катализ
§ 4. Электролитическая диссоциация
§ 5. Основные положения теории электролитической диссоциации
Выразите своё мнение
§ 6. Химические свойства кислот как электролитов
§ 7. Химические свойства оснований как электролитов
§ 8. Химические свойства солей как электролитов
§ 9. Гидролиз солей
§ 10. Общая характеристика неметаллов
§ 11. Общая характеристика элементов VIIA-группы — галогенов
§ 12. Соединения галогенов
§ 13. Халькогены. Сера
§ 14. Сероводород и сульфиды
§ 15. Кислородные соединения серы
§ 16. Общая характеристика элементов VA-группы. Азот
Выразите свое мнение
§ 17. Аммиак. Соли аммония
§ 18. Кислородные соединения азота
§ 19. Фосфор и его соединения
§ 20. Общая характеристика элементов IVA-группы. Углерод
§ 21. Кислородные соединения углерода
§ 22. Углеводороды
§ 23. Кислородсодержащие органические соединения
§ 24. Кремний и его соединения
§ 25. Силикатная промышленность
§ 26. Получение неметаллов
§ 27. Получение важнейших химических соединений неметаллов
§ 28. Общая характеристика металлов
§ 29. Химические свойства металлов
§ 30. Общая характеристика элементов IA-группы
§ 31. Общая характеристика элементов IIA-группы
§ 32. Жёсткость воды и способы её устранения
§ 33. Алюминий и его соединения
§ 34. Железо и его соединения
§ 35. Коррозия металлов и способы защиты от неё
§ 36. Металлы в природе. Понятие о металлургии
§ 37. Химический состав планеты Земля
§ 38. Охрана окружающей среды от химического загрязнения
§ 39. Вещества
§ 40. Химические реакции
§ 41. Основы неорганической химии
Практические работы
Лучшие стороны учебного процесса с ГДЗ по химии 9 класс Габриелян
Приходя домой с занятий, школьники обречённо вздыхают, потому что учебный день уже окончен, а обязанности нет. Нужно подготовить уроки на завтра, хотя усталость валит с ног. Не все так уж хотят превозмогать себя, поэтому тетради часто остаются пустыми, а книги непрочитанными, потом девятиклассник будет надеяться на товарища, у которого спишет, или на удачу — хоть бы не спросили. Только чем больше будет из-за такого отношения расти отставание, тем выше вероятность, что спросят именно неуспевающего ученика, чтобы дать ему возможность реабилитироваться. Упустить шанс или воспользоваться им — ваш выбор, но для повторения и закрепления существует решебник, поэтому дело будет не в тягость. К тому же он удобен в использовании и предоставляет ряд преимуществ:
- онлайн-доступ к нужной информации в любое время, если у вас рядом телефон или компьютер;
- простую и быструю навигацию по разделам сайта и номерам сборника;
- регулярную техническую поддержку портала;
- постоянное расширение и обновление контента.
Содержание онлайн-сборника по химии 9 класс Габриелян О.С., Остроумов И.Г., Сладков С.А.
Издание расширяет и дополняет основной учебник по курсу. На его страницах девятиклассники найдут отражение актуальных программ:
Читайте также:
