Химический состав металлов таблица
Металлы, как и все химические элементы, имеют три формы существования: атомы, простые и сложные вещества. Из 118 элементов периодической системы к металлам относят 96.
Общие физические свойства металлов.
Физические свойства металлов обусловлены металлической кристаллической решёткой и металлической химической связью. Напомним, что для металлов характерны металлический блеск, пластичность, высокая электро- и теплопроводность, рост электрического сопротивления при повышении температуры, а кроме того, такие практически значимые свойства, как ковкость, твёрдость, магнитные свойства.
Металлы — твёрдые при обычных условиях вещества (кроме ртути, которая становится твёрдой и ковкой при низких температурах).
Металлы пластичны и тягучи, кроме хрупких висмута и марганца. Из меди, алюминия, олова, а также золота изготавливают тончайшие листы — фольгу. Золотая фольга может иметь толщину около 100 нм! Такую фольгу используют для золочения предметов интерьера, стен и потолков, изделий из гипса, дерева, металла, стекла и пластика.
Все металлы имеют металлический блеск, большинство из них серебристо-белого или серого цвета. Из-за того, что стронций, золото и медь поглощают в большей степени близкие к фиолетовому цвету короткие волны и отражают длинные волны светового спектра, эти металлы окрашены в светло-жёлтый и медный цвет. Очень тонкие листки серебра и золота имеют совершенно необычный вид — они представляют собой голубовато-зелёную фольгу, а мелкие порошки металлов кажутся тёмно–серыми и даже чёрными. И только порошки магния и алюминия сохраняют серебристо-белый цвет.
В технике металлы принято классифицировать по различным физическим свойствам:
Металлы принято делить на чёрные (железо и его сплавы) и цветные (остальные металлы и сплавы). Соответственно называются и отрасли металлургической промышленности: чёрная и цветная металлургия.
Важнейшими продуктами цветной металлургии являются титан, вольфрам, молибден и другие металлы, которые могут использоваться в качестве специальных легирующих добавок для производства сверхтвёрдых, тугоплавких, устойчивых к коррозии сплавов, широко применяемых в машино– и станкостроении, в оборонно–космической отрасли.
Современные композиционные материалы, выполненные на основе керамики или полимеров, становятся сверхпрочными, если укреплены металлическими нитями из молибдена, вольфрама, титана, специальных сталей и т. д.
Химические свойства металлов.
Во всех реакциях простые вещества — металлы проявляют только восстановительные свойства.

- Металлы взаимодействуют с неметаллами, образуя бинарные соединения. По правилам ИЮПАК названия этих соединений образуются в соответствии со схемой:
Так, с очень активными неметаллами (галогенами, серой) металлы образуют соединения, которые молено рассматривать, как соли бескислородных кислот: 2Na + Сl2 = 2NaCl
Если металл проявляет переменные степени окисления, подобная соль имеет состав, который зависит от окислительных свойств неметалла. Например, железо энергично взаимодействует с хлором, образуя хлорид железа(III): 2Fe + 3Сl2 = 2FeCl3
При взаимодействии железа с серой, окислительная способность которой ниже, чем у галогенов, продуктом реакции является сульфид железа(II): Fe + S = FeS
- При взаимодействии металлов с кислородом образуются оксиды или пероксиды:
Оксиды в этом случае имеют основный или амфотерный характер:
2Mg + O2 = 2MgO
4Аl + 3O2 = 2Аl2O3
Эти реакции сопровождаются выделением большого количества теплоты и очень ярким пламенем, поэтому применяются для изготовления сигнальных ракет, фейерверков, салютов и других пиротехнических средств. Поэтому обращение с ними требует строгого соблюдения правил техники безопасности.
Продуктом горения железа в кислороде является смешанный оксид 3Fe + 2O2 = Fe3O4
- Металлы — простые вещества, образованные элементами IA– и IIА–групп, в полном соответствии с названием этих групп взаимодействуют с водой с образованием щёлочи и водорода. В общем виде эти реакции можно записать так:
2М + 2Н2O = 2МОН + Н2↑, где М — щелочной металл
М + 2Н2O = М(ОН)2 + H2↑, где М — Mg или щёлочноземельный металл.
Для характеристики химических свойств металлов важное значение имеет их положение в электрохимическом ряду напряжений:
К, Са, Na, Mg, Al, Zn, Fe, Sn, Pb, (H2) , Cu, Hg, Ag, Au
Вспомните известные вам из курса основной школы два вывода:
- взаимодействие металлов с растворами кислот происходит, если металл находится в ряду напряжений левее водорода;
- взаимодействие металлов с растворами солей происходит, если металл находится в ряду напряжений левее металла соли.
Лабораторный способом получения водорода:
Zn + 2НСl = ZnCl2 + H2↑
Zn 0 + 2H + = Zn 2+ + H2 0
Аналогично протекает реакция металлов и с органическими кислотами:
2СН3СООН + Zn —> (CH3COO)2Zn + Н2↑
2СН3СООН + Zn –> 2СН3СОO – + Zn 2+ + Н2 0
Реакция между цинком и раствором сульфата меди(II) протекает согласно уравнению:
Zn + CuSO4 = ZnSO4 + Сu
Zn 0 + Сu 2+ = Zn 2+ + Сu 0
Подчеркнём, что в этом случае металл может находиться в ряду напряжений и после водорода, но не после металла соли. Например, реакция замещения серебра медью:
Cu + 2AgNO3 = Сu(NО3)2 + 2Ag
Cu 0 + 2Ag + = Cu 2+ + 2Ag 0
В завершение рассмотрим ещё одно характерное не для всех металлов свойство, которое называется металлотермия. Такие активные металлы, как алюминий, кальций, магний, литий, способны взаимодействовать с оксидами других металлов. Для того чтобы началась такая реакция, смесь активного металла и оксида металла (её называют термитной) необходимо поджечь. После этого процесс сопровождается выделением большого количества теплоты и света (отсюда и название процесса). Металлотермию применяют для получения и более ценных металлов: 2Аl + Сr2О3 = Al2O3 + 2Сг
Химия металлов (таблица)

Конспект урока по химии в 11 классе «Металлы». В учебных целях использованы цитаты из пособия «Химия. 11 класс : учеб, для общеобразоват. организаций : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение». Выберите дальнейшее действие:
Химические свойства металлов

Металлы – активные восстановители с положительной степенью окисления. Благодаря химическим свойствам металлы широко используются в промышленности, металлургии, медицине, строительстве.
Активность металлов
В реакциях атомы металлов отдают валентные электроны и окисляются. Чем больше энергетических уровней и меньше электронов имеет атом металла, тем легче ему отдавать электроны и вступать в реакции. Поэтому металлические свойства увеличиваются сверху вниз и справа налево в таблице Менделеева.
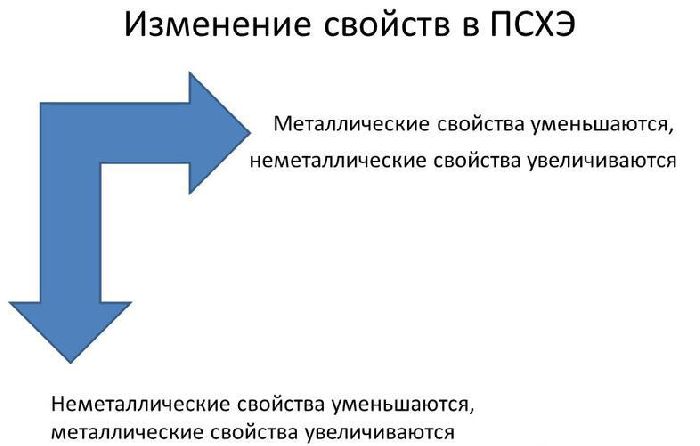
Рис. 1. Изменение металлических свойств в таблице Менделеева.
Активность простых веществ показана в электрохимическом ряду напряжений металлов. Слева от водорода находятся активные металлы (активность увеличивается к левому краю), справа – неактивные.
Наибольшую активность проявляют щелочные металлы, находящиеся в I группе периодической таблицы и стоящие левее водорода в электрохимическом ряду напряжений. Они вступают в реакцию со многими веществами уже при комнатной температуре. За ними идут щелочноземельные металлы, входящие во II группу. Они реагируют с большинством веществ при нагревании. Металлы, находящиеся в электрохимическом ряду от алюминия до водорода (средней активности) требуют дополнительных условий для вступления в реакции.

Рис. 2. Электрохимический ряд напряжений металлов.
Некоторые металлы проявляют амфотерные свойства или двойственность. Металлы, их оксиды и гидроксиды реагируют с кислотами и основаниями. Большинство металлов реагирует только с некоторыми кислотами, замещая водород и образуя соль. Наиболее ярко выраженные двойственные свойства проявляют:
- алюминий;
- свинец;
- цинк;
- железо;
- медь;
- бериллий;
- хром.
Каждый металл способен вытеснять стоящий правее него в электрохимическом ряду другой металл из солей. Металлы, находящиеся слева от водорода, вытесняют его из разбавленных кислот.
Свойства
Особенности взаимодействия металлов с разными веществами представлены в таблице химических свойств металлов.
Реакция
Особенности
Уравнение
Большинство металлов образует оксидные плёнки. Щелочные металлы самовоспламеняются в присутствии кислорода. При этом натрий образует пероксид (Na2O2), остальные металлы I группы – надпероксиды (RO2). При нагревании щелочноземельные металлы самовоспламеняются, металлы средней активности – окисляются. Во взаимодействие с кислородом не вступают золото и платина
При комнатной температуре реагируют щелочные, при нагревании – щелочноземельные. Бериллий не вступает в реакцию. Магнию дополнительно необходимо высокое давление
Только активные металлы. Литий вступает в реакцию при комнатной температуре. Остальные металлы – при нагревании
Металлы

К металлам относится большая часть элементов периодической системы – 82 химических элементов. Какими свойствами они обладают, и чем отличаются от неметаллов?
Общая характеристика
Металлами называют группу элементов, в виде простых веществ, которые обладают металлическими свойствами (пластичность, ковкость, блеск, электронная проводимость и т. д.)
Основное отличие элементов-металлов – они обладают только восстановительными свойствами, а в реакциях могут только окисляться. В соединениях они могут иметь только положительные степени окисления как в элементарных положительно заряженных ионах, так и в сложных ионах, где они образуют положительные центры.
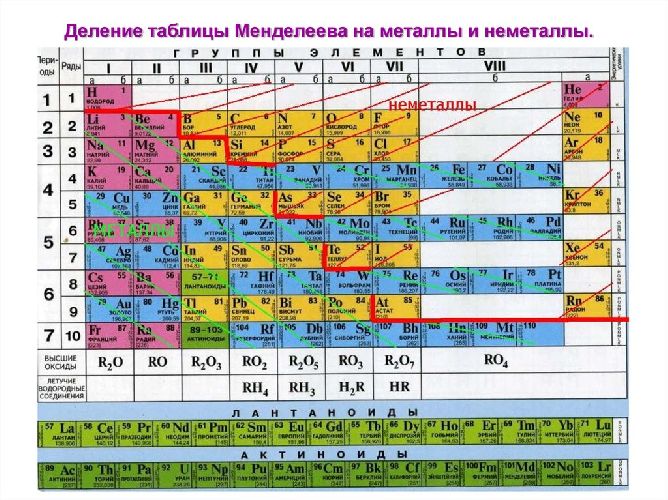
Рис. 1. Список металлов.
Как правило, на внешнем уровне элементов металлов находится небольшое число электронов (1-3), значения электроотрицательности невысокие. К металлам относятся все s-элементы (кроме водорода и гелия), d- и f-элементы, а также p-элементы под чертой бор-астат. Для типичных металлов характерен большой размер атомов, что способствует легкости отдачи валентных электронов. Образующиеся положительные ионы устойчивы, так как имеют завершенную внешнюю электронную оболочку.
Физические и химические свойства
Все металлы, кроме ртути, при нормальных условиях в виде простых веществ находятся в твердом агрегатном состоянии и образуют металлическую кристаллическую решетку.

Рис. 2. Металлы в таблице Д.И. Менделеева.
Таблица «Металлы»
В следующей таблицы представлены группы основных металлов:
| Группа металлов | Металл |
| Щелочные | литий, натрий, калий и т.д. |
| Щелочноземельные | кальций, стронций, барий и т.д. |
| Переходные | уран, титан, железо, платина и т.д. |
| постпереходные | алюминий, свинец, олово и т.д. |
| Тугоплавкие | молибден, вольфрам |
| Цветные | медь, титан, магний и т.д. |
| Благородные | золото, серебро и т.д. |
Металлы пластичны и ковки, особенно если на внешнем электронном уровне атомов по одному электрону: слои атомов перемещаются относительно друг друга без разрушения кристаллической решетки (щелочные металлы, медь, серебро, золото). В атомах непластичных хрупких металлов хрома и марганца – большое число валентных электронов.
Плотность, твердость, температура плавления металлов изменяются в широком диапазоне и зависят от атомной массы, строения атома и геометрии кристаллической решетки. Самый легкий металл – литий (плотность 0,53 г/см 3 ), самый тяжелый – осмий (плотность 22,5 г/см 3 ). Металлы с плотностью больше 5 г/см 3 относят к тяжелым, меньше 5 г/см 3 – к легким металлам.
Самая низкая температура плавления у ртути (-39 градусов по Цельсию), самый тугоплавкий металл – вольфрам (температура плавления 3410 градусов по Цельсию.) Энергия атомизации вольфрама составляет 836 кДж/моль, а температура кипения его 5930 градусов.
Металлы вступают в реакцию как с простыми, так и со сложными веществами. Как типичные восстановители металлы реагируют почти со всеми неметаллами-окислителями (кислород, сера, азот и т. д.):
Также металлы реагируют с такими сложными веществами, как оксиды и гидроксиды, разбавленные растворы кислот, с растворенными в воде щелочами.
В пределах одного и того же периода металлические свойства ослабевают, а неметаллические усиливаются; в пределах одной и той же группы (в главной подгруппе) металлические свойства усиливаются, а неметаллические ослабевают

Рис. 3. Металлы главных подгрупп.
Нахождение металлов и способы их получения
Самый распространенный на земле элемент-металл – алюминий. За ним следуют железо, кальций, натрий.
Некоторые металлы встречаются в природе в самородном состоянии (золото, ртуть, платина), но в основном они находятся в природе в виде оксидов и солей.
Получение металлов происходит с помощью металлургии (получение из руд), пирометаллургии (получение с помощью реакции восстановления при высокой температуре), гидрометаллургии (извлечение из руд в виде растворимых соединений), электрометаллургии (получение металлов электролизом расплавов и растворов их соединений).
Что мы узнали?
Металлы – вещества, которые обладают высокой электро- и теплопроводностью, ковкостью, пластичностью и металлическим блеском. В данной статье по химии 9 класса рассматриваются их физические и химические свойства, формулы класса металлов, а также способы получения.

Свойства металлов начинают изучать на уроках химии в 8–9 классе. В этом материале мы подробно разберем химические свойства этой группы элементов, а в конце статьи вы найдете удобную таблицу-шпаргалку для запоминания.
О чем эта статья:
8 класс, 9 класс, ЕГЭ/ОГЭ
Металлы — это химические элементы, атомы которых способны отдавать электроны с внешнего энергетического уровня, превращаясь в положительные ионы (катионы) и проявляя восстановительные свойства.
В окислительно-восстановительных реакциях металлы способны только отдавать электроны, являясь сильными восстановителями. В роли окислителей выступают простые вещества — неметаллы (кислород, фосфор) и сложные вещества (кислоты, соли и т. д.).
Металлы в природе встречаются в виде простых веществ и соединений. Активность металла в химических реакциях определяют, используя электрохимический ряд, который предложил русский ученый Н. Н. Бекетов. По химической активности выделяют три группы металлов.
Ряд активности металлов
Металлы средней активности
Общие химические свойства металлов
Взаимодействие с неметаллами
Щелочные металлы сравнительно легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
оксид образует только литий
натрий образует пероксид
калий, рубидий и цезий — надпероксид
Остальные металлы с кислородом образуют оксиды:
2Zn + O2 = 2ZnO (при нагревании)
Металлы, которые в ряду активности расположены левее водорода, при контакте с кислородом воздуха образуют ржавчину. Например, так делает железо:
С галогенами металлы образуют галогениды:
Медный порошок реагирует с хлором и бромом (в эфире):
При взаимодействии с водородом образуются гидриды:
Взаимодействие с серой приводит к образованию сульфидов (реакции протекают при нагревании):
Реакции с фосфором протекают до образования фосфидов (при нагревании):
Основной продукт взаимодействия металла с углеродом — карбид (реакции протекают при нагревании).
Из щелочноземельных металлов с углеродом карбиды образуют литий и натрий:
Калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом:
С азотом из металлов IA группы легко реагирует только литий. Реакция протекает при комнатной температуре с образованием нитрида лития:
Взаимодействие с водой
Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется H2. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур. Результат данной реакции — образование оксида.
Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.


Металлы IА группы:
Металлы IIА группы
Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
Zn + CuSO4 = ZnSO4 + Cu
На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
Взаимодействие с органическими веществами
Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.
Взаимодействие металлов с оксидами
Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
Вопросы для самоконтроля
С чем реагируют неактивные металлы?
С чем связаны восстановительные свойства металлов?
Верно ли утверждение, что щелочные и щелочноземельные металлы легко реагируют с водой, образуя щелочи?
Методом электронного баланса расставьте коэффициенты в уравнении реакции по схеме:
Mg + HNO3 → Mg(NO3)2 + NH4NO3 + Н2O
Как металлы реагируют с кислотами?
Подведем итоги
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Напоследок поделимся таблицей, которая поможет запомнить, с чем реагируют металлы, и подготовиться к контрольной работе по химии.
Таблица «Химические свойства металлов»
Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb
Cu, Hg, Ag, Pt, Au
Восстановительная способность металлов в свободном состоянии
Возрастает справа налево
Взаимодействие металлов с кислородом
Быстро окисляются при обычной температуре
Медленно окисляются при обычной температуре или при нагревании
Взаимодействие с водой
Выделяется водород и образуется гидроксид
При нагревании выделяется водород и образуются оксиды
Водород из воды не вытесняют
Взаимодействие с кислотами
Вытесняют водород из разбавленных кислот (кроме HNO3)
Не вытесняют водород из разбавленных кислот
Реагируют с концентрированными азотной и серной кислотами
С кислотами не реагируют, растворяются в царской водке
Взаимодействие с солями
Не могут вытеснять металлы из солей
Более активные металлы (кроме щелочных и щелочноземельных) вытесняют менее активные из их солей
Взаимодействие с оксидами
Для металлов (при высокой температуре) характерно восстановление неметаллов или менее активных металлов из их оксидов
Марки стали – таблица с маркировкой и расшифровкой
Мы проконсультируем вас по любым вопросам!
Любому специалисту, имеющему дело с металлом, знакомо понятие «марки стали». Расшифровка маркировки стальных сплавов дает возможность получить представление об их химическом составе и физических характеристиках. Разобраться в данной маркировке, несмотря на ее кажущуюся сложность, достаточно просто – важно только знать, по какому принципу она составляется.

Редкое производство обходится без стали, поэтому разбираться в его марках крайне важно
Обозначают сплав буквами и цифрами, по которым можно точно определить, какие химические элементы в нем содержатся и в каком количестве. Зная это, а также то, как каждый из таких элементов может влиять на готовый сплав, можно с высокой степенью вероятности определить, какие именно технические характеристики свойственны определенной марке стали.
Виды сталей и особенности их маркировки
Сталь представляет собой сплав железа с углеродом, при этом содержание последнего в ней составляет не более 2,14%. Углерод придает сплаву твердость, но при его избытке металл становится слишком хрупким.
Одним из важнейших параметров, по которому стали делят на различные классы, является химический состав. Среди сталей по данному критерию выделяют легированные и углеродистые, последние подразделяются на мало- (углерода до 0,25%), средне- (0,25–0,6%) и высокоуглеродистые (в них содержится больше 0,6% углерода).

Включая в состав стали легирующие элементы, ей можно придать требуемые характеристики. Именно таким образом, комбинируя вид и количественное содержание добавок, получают марки, обладающие улучшенными механическими свойствами, коррозионной устойчивостью, магнитными и электрическими характеристиками. Конечно, улучшать характеристики сталей можно и при помощи термообработки, но легирующие добавки позволяют делать это более эффективно.
По количественному составу легирующих элементов различают низко-, средне- и высоколегированные сплавы. В первых легирующих элементов не более 2,5%, в среднелегированных – 2,5–10%, в высоколегированных – более 10%.
Классификация сталей осуществляется и по их назначению. Так, выделяют инструментальные и конструкционные виды, марки, отличающиеся особыми физическими свойствами. Инструментальные виды используются для производства штамповых, мерительных, а также режущих инструментов, конструкционные – для выпуска продукции, применяемой в строительстве и сфере машиностроения. Из сплавов, отличающихся особыми физическими свойствами (также называемых прецизионными), изготавливают изделия, которые должны обладать особыми характеристиками (магнитными, прочностными и др.).

Стали противопоставляются друг другу и по особым химическим свойствам. К сплавам данной группы относятся нержавеющие, окалиностойкие, жаропрочные и др. Что характерно, нержавеющие стали могут быть коррозионностойкими и нержавеющими пищевыми – это разные категории.
Кроме полезных элементов, сталь включает и вредные примеси, к основным из которых относятся сера и фосфор. В ней также находятся газы в несвязанном состоянии (кислород и азот), что негативно отражается на ее характеристиках.
Если рассматривать основные вредные примеси, то фосфор увеличивает хрупкость сплава, особенно сильно проявляющуюся при низких температурах (так называемая хладноломкость), а сера вызывает появление трещин в металле, нагретом до высокой температуры (красноломкость). Фосфор, ко всему прочему, значительно уменьшает пластичность нагретого металла. По количественному содержанию этих двух элементов выделяют стали обыкновенного качества (не более 0,06–0,07% серы и фосфора), качественные (до 0,035%), высококачественные (до 0,025%) и особовысококачественные (сера – до 0,015%, фосфор – до 0,02%).
Маркировка сталей также указывает на то, в какой степени из их состава удален кислород. По уровню раскисления выделяют стали:
- спокойного типа, обозначаемые буквосочетанием «СП»;
- полуспокойные – «ПС»;
- кипящие – «КП».
О чем говорит маркировка сталей
Расшифровать марку стали довольно просто, необходимо только владеть определенными сведениями. Конструкционные стали, обладающие обыкновенным качеством и не содержащие легирующих элементов, маркируют буквосочетанием «Ст». По цифре, идущей после букв в названии марки, можно определить, сколько в таком сплаве углерода (исчисляется в десятых долях процента). За цифрами могут идти буквы «КП»: по ним становится ясно, что данный сплав не до конца прошел процесс раскисления в печи, соответственно, он относится к категории кипящего. Если название марки не содержит таких букв, то сталь соответствует категории спокойной.

Конструкционная нелегированная сталь, относящаяся к категории качественных, имеет в своем обозначении две цифры, по ним определяют среднее содержание в ней углерода (исчисляется в сотых долях процента).
Прежде чем приступить к рассмотрению марок тех сталей, которые включают легирующие добавки, следует разобраться в том, как данные добавки обозначаются. Маркировка легированных сталей может включать такие буквенные обозначения:

Обозначение сталей с легирующими элементами
Как сказано выше, классификация сталей с легирующими элементами включает несколько категорий. Маркировка легированных сталей составляется по определенным правилам, знание которых позволяет достаточно просто определить категорию конкретного сплава и основную область его применения. В начальной части названий таких марок находятся цифры (две или одна), показывающие содержание углерода. Две цифры указывают на его среднее содержание в сплаве в сотых долях процента, а одна – в десятых. Есть и стали, не имеющие в начале названия марки цифр. Это означает, что углерод в этих сплавах содержится в пределах 1%.

Буквы, которые можно увидеть за первыми цифрами названия марки, указывают на то, из чего состоит данный сплав. За буквами, дающими информацию о том или ином элементе в его составе, могут стоять или не стоять цифры. Если цифра есть, то по ней определяется (в целых процентах) среднее содержание указанного буквой элемента в составе сплава, а если цифры нет, значит, данный элемент содержится в пределах от 1 до 1,5%.
В конце маркировки отдельных видов сталей может стоять буква «А». Это говорит о том, что перед нами высококачественная сталь. К таким маркам могут относиться и углеродистые стали, и сплавы с легирующими добавками в своем составе. Согласно классификации, к данной категории сталей причисляются те, в которых сера и фосфор составляют не более 0,03%.
Примеры маркировки сталей различных видов
Определение марки стали и причисление сплава к определенному виду – это задача, которая не должна вызывать никаких проблем у специалиста. Не всегда под рукой есть таблица, в которой дается расшифровка названий марок, но разобраться с этим помогут примеры, которые приведены ниже.
Конструкционные стали, не содержащие легирующих элементов, обозначаются буквосочетанием «Ст». Цифры, стоящие следом, – это содержание углерода, исчисляемое в сотых долях процента. Несколько иначе маркируются низколегированные конструкционные стали. К примеру, в стали марки 09Г2С 0,09% углерода, а легирующие добавки (марганец, кремний и др.) содержатся в ней в пределах 2,5%. Очень похожие по своей маркировке 10ХСНД и 15ХСНД отличаются разным количеством углерода, а доля каждого легирующего элемента в них составляет не больше 1%. Именно поэтому после букв, обозначающих каждый легирующий элемент в таком сплаве, не стоит никаких цифр.
20Х, 30Х, 40Х и др. – так маркируются конструкционные легированные стали, преобладающим легирующим элементом в них является хром. Цифра в начале такой марки – это содержание углерода в рассматриваемом сплаве, исчисляемое в сотых долях процента. За буквенным обозначением каждого легирующего элемента может быть проставлена цифра, по которой и определяют его количественное содержание в сплаве. Если ее нет, то указанного элемента в стали содержится не больше 1,5%.
Можно рассмотреть пример обозначения хромокремнемарганцевой стали 30ХГСА. Она, согласно маркировке, состоит из углерода (0,3%), марганца, кремния, а также хрома. Каждого из данных элементов в ней содержится в границах 0,8–1,1%.
Как расшифровать маркировку сталей?
Чтобы расшифровка обозначения различных видов сталей не вызывала затруднений, следует хорошо знать, какими они бывают. Отдельные категории сталей имеют особенную маркировку. Их принято обозначать определенными буквами, что позволяет сразу понять и назначение рассматриваемого металла, и его ориентировочный состав. Рассмотрим некоторые из таких марок и разберемся в их обозначении.

Конструкционные стали, специально предназначенные для изготовления подшипников, можно узнать по букве «Ш», данная литера ставится в самом начале их маркировки. После нее в названии марки идет буквенное обозначение соответствующих легирующих добавок, а также цифры, по которым узнают количественное содержание этих добавок. Так, в сталях марок ШХ4 и ШХ15, кроме железа с углеродом, содержится хром в количестве 0,4 и 1,5%, соответственно.
Буквой «К», которая стоит после первых цифр в названии марки, сообщающих о количественном содержании углерода, обозначают конструкционные нелегированные стали, используемые для производства сосудов и паровых котлов, работающих под высоким давлением (20К, 22К и др.).
Качественные легированные стали, которые обладают улучшенными литейными свойствами, можно узнать по букве «Л», стоящей в самом конце маркировки (35ХМЛ, 40ХЛ и др.).
Некоторую сложность, если не знать особенностей маркировки, может вызвать расшифровка марок строительной стали. Сплавы данной категории обозначают буквой «С», которую ставят в самом начале. Цифры, следующие за ней, указывают на минимальный предел текучести. В таких марках также используются дополнительные буквенные обозначения:
- литера Т – термоупрочненный прокат;
- буква К – сталь, отличающаяся повышенной коррозионной устойчивостью;
- литера Д – сплав, характеризующийся повышенным содержанием меди (С345Т, С390К и др.).
Нелегированные стали, относящиеся к категории инструментальных, обозначают буквой «У», она проставляется в начале их маркировки. Цифра, идущая за данной буквой, выражает количественное содержание углерода в рассматриваемом сплаве. Стали данной категории могут быть качественными и высококачественными (их можно определить по букве «А», она проставляется в конце названия марки). В их маркировке может содержаться буква «Г», что означает повышенное содержание марганца (У7, У8, У8А, У8ГА и др.).
Инструментальные стали, содержащие легирующие элементы в своем составе, маркируются аналогично с легированными конструкционными (ХВГ, 9ХВГ и др.).

Маркировка тех сталей, которые входят в категорию быстрорежущих, начинается с буквы «Р», за которой идут цифры, указывающие на количественное содержание вольфрама. В остальном марки таких сплавов называются по стандартному принципу: буквы, обозначающие элемент, и, соответственно, цифры, отражающие его количественное содержание. В обозначении таких сталей не указывается хром, так как его стандартное содержание в них составляет около 4%, а также углерод, количество которого пропорционально содержанию ванадия. Если количество ванадия превышает 2,5%, то его буквенное обозначение и количественное содержание проставляют в самом конце маркировки (З9, Р18, Р6М5Ф3 и др.).

По-особому маркируются нелегированные стали, относящиеся к категории электротехнических (их еще часто называют чистым техническим железом). Невысокое электрическое сопротивление таких металлов обеспечивается за счет того, что их состав характеризуется минимальным содержанием углерода – менее 0,04%. В обозначении марок таких сталей нет букв, только цифры: 10880, 20880 и др. Первая цифра указывает на классификацию по типу обработки: горячекатаная или кованная – 1, калиброванная – 2. Вторая цифра связана с категорией коэффициента старения: 0 – ненормируемый, 1 – нормируемый. Третья цифра указывает на группу, к которой данная сталь относится по нормируемой характеристике, принятой за основную. По четвертой и пятой цифрам определяется само значение нормируемой характеристики.
Принципы, по которым осуществляется обозначение стальных сплавов, были разработаны еще в советский период, но и по сей день успешно используются не только в России, но также в странах СНГ. Обладая сведениями о той или иной марке стали, можно не только определять ее химический состав, но и эффективно подбирать металлы с требуемыми характеристиками.
Разбираться в данном вопросе важно как специалистам, разрабатывающим и проектирующим различные конструкции из металла, так и тем, кто часто работает с различными сталями и занимается изготовлением из них деталей разного назначения.
Читайте также:
