Химический элемент серебристо белый мягкий очень легкий щелочной металл
л и тий, лития, мн. нет, муж. (от греч. lithios - каменный) (минер., хим.). Химический элемент - серебристобелый, мягкий, очень легкий щелочный металл, не встречающийся в природе в чистом виде, а только в виде солей.
Энциклопедический словарь
(лат. Lithium), Li, химический элемент I группы периодической системы, атомный номер 3, атомная масса 6,941, относится к щелочным металлам. Название от греч. lithos - камень (открыт в минерале петалите). Серибристо-белый, самый легкий из металлов; плотность 0,533 г/см3, tплощадь 180,5 °С. Химически очень активен, окисляется при обычной температуре; реагирует с азотом, образуя нитрид Li3N. Минералы - сподумен, лепидолит и др. Изотоп Li - единственный промышленный источник для производства трития. Литий используют для раскисления, легирования и модифицирования сплавов (напр., аэрона, склерона), как теплоноситель в ядерных реакторах, компонент сплавов на основе Mg и Al, анод в химических источниках тока; некоторые соединения лития входят в состав пластичных смазок, специальных стекол, термостойкой керамики, используются в медицине.
Словарь Ефремовой
м.
Химический элемент, серебристо-белый, мягкий, очень легкий щелочной металл.
Энциклопедия Брокгауза и Ефрона
(Li, атомный вес 7) — был открыт Арфведсоном в 1817 г. при анализе минерала петалита , затем он был найден им в лепидолите и во многих других минералах. Арфведсон указал на сходство Л. со щелочными металлами и назвал его Л. (от λύθος — камень) в знак того, что этот элемент он встретил впервые в минеральном царстве. Подобно калию и натрию, Li имеет обширное распространение в природе, но встречается в небольших количествах. Наиболее богатые минералы содержат не более 9-10% окиси Л. Li 2 O; напр., в монтебразите (фосфорнокислая соль Л. и алюминия) ее находится до 9,8%, в трифилине (фосфорнокислая соль железа, марганца и Л.) от 3,4% до 7,7%, в силикатах: криофиллите до 4,1%, в лепидолите от 1,3% до 5,7% и пр. Л. найден в некоторых метеоритах, в морской воде, во многих реках и минеральных источниках, напр. в Карлсбаде, Мариенбаде, Баден-Бадене и пр., в некоторых растениях, напр. в табаке и пр. Металлический и в свободном состоянии в природе не встречается, подобно калию и натрию. Несмотря на все попытки, Арфведсону не удалось его выделить. В первый раз он был получен Брандесом при действии гальванического тока на окись, но Л. получилось так мало, что нельзя было изучить его свойств; только в 1855 г. Бунзену и Матиссену удалось получить его в достаточном количестве при электролизе хлористого Л., LiCl. Эта соль плавилась в фарфоровом тигле на горелке, и через нее пропускался ток от 5-6 элементов Бунзена. Положительным электродом служила палочка кокса, а отрицательным — тонкая железная проволока. На ней выделялся Li в виде небольших шариков. Так как при этом теряется много хлористого Л., который разбрызгивается во все стороны, то Трост предложил следующий простой способ. Берут высокий чугунный тигель с крышкой, хорошо пригнанной. В ней два отверстия. В одно проходит отрицательный электрод, а в другое металлическая трубка, доходящая до половины тигля; сюда вставляют фарфоровую трубочку, через которую уже и пропускают положительный электрод. При получении Li температура не должна быть высока, так как, по Гюнцу, образовавшийся Li может действовать на LiCl, давая Li 2 Cl. Чтоб понизить температуру плавления LiCl, Гюнц смешивает его с КСl в эквивалентном количестве. Но тогда получается Li с содержанием калия. Что касается получения Li химическим путем, подобно, напр., калию или натрию, то результаты получаются неудовлетворительные. Ни углекислая соль Л., ни водная окись не восстановляются до металла, напр. с углем или железом; углелитиевая соль с магнием дает Li, но реакция идет очень бурно, и Li получается с магнием. Li — металл серебристого цвета, более твердый, чем калий и натрий, но мягче свинца, тянется в проволоку менее прочную, чем свинцовая. Уд. вес около 0,59, так что он легче всех известных твердых тел. Л. плавится около 180°; не летит при красном калении. Теплоемкость по Реньо 0,908 (от 27° до 100 ˚); электропроводность 19 при 20 (для Ag = 100). Спектр Li характеризуется ярко-красной линией Liα. По Бунзену — достаточно 0,000009 мгр. хлористого Л., чтобы эта линия выступила с ясностью. В сухом воздухе или кислороде при обыкновенной температуре или при нагревании до 180° он не изменяется; при 200° же воспламеняется и горит ослепительно ярким светом. Л. разлагает воду при обыкновенной температуре, но при этом он не воспламеняется подобно, напр., натрию. Во влажном воздухе цвет его темнеет. Брошенный в азотную кислоту, он воспламеняется. При нагревании он горит в углекислоте, восстановляет кремнезем и пр. Л. прямо соединяется с хлором, бромом, иодом, с серой, фосфором, азотом. Из кислот соляной, слабой серной выделяет водород; крепкая HJO 4 на него мало действует; с металлами он образует многочисленные сплавы. Соединения Л. Li принадлежит к одноатомным элэментам и дает соединения вида LiX (где Х — одноатомный элемент или группа). По характеру своих соединений Li занимает среднее место между типичными щелочными металлами и щелочноземными; из последних в особенности он схож с магнием. Так, напр., водная окись Л. LiHO, подобно едкому натру или кали, хорошо растворима в воде, углекислая же соль Li 2CO3, как и для кальция, стронция, бария или магния, малорастворима; сернокислая соль Li 2SO4 хорошо растворима, а фосфорнокислая Li 3PO4 плохо и пр. LiHO при накаливании не дает окиси Li 2 O, как NaHO или КНО, но LiNO 3, подобно азотнокислым солям магния, кальция и пр., дает Li2 O, а не LiNO 2 и пр. С кислородом Л. дает два соединения: окись Li 2 O и перекись. Окись Li 2 O получается при горении Л. в кислороде, при прокаливании азотнокислого Л. LiNO 3 или при накаливании смеси углекислого Л. Li 2CO3 с углем. Li 2 O — вещество белого цвета, чрезвычайно прочное: при накаливании с углем, железом, калием оно не разлагается; водород не восстановляет его. Li 2 O при накаливании не действует на платину, в противоположность щелочам. В воде она медленно растворяется с выделением небольшого количества тепла и дает резко щелочной раствор; при этом образуется водная окись LiHO. При выпаривании раствора окиси Л. в пустоте образуется кристаллический гидрат LiHO+H 2 O. На воздухе LiHO притягивает воду; в горячей воде она так же растворима, как и в холодной, не растворяется в смеси спирта с эфиром. Плавится ниже красного каления, и прокаливанием нельзя получить из нее безводную окись Li 2 O. Перекись Л. образуется в некотором количестве при горении Л. в кислороде, при прокаливании Li 2 KO или LiO 3 на воздухе. Она появляется здесь в виде желтого налета. Ей приписывается отчасти разъедание платины при накаливании Li 2O. Хлористый Л. LiCl получается при действии хлора на Li, соляной кислоты на LiHO или LiCO 3 и пр. LiCl очень гигроскопичен; на воздухе он расплывается, в воде хорошо растворяется; 100 ч. воды, напр., при 0° растворяют 63,7 ч. его, при 80° — 115 ч. и пр. При выпаривании (при нагревании) растворов его происходит отчасти разложение с выделением LiHO и НСl, как для MgCl 2. При выпаривании над серной кислотой получается гидрат LiCl+2H 2 O; известна и LiCl+H 2 O. LiCl растворим также в спирту. При красном калении LiCl плавится, при этом кислород воздуха частью разлагает его с выделением хлора и образованием окиси Л., или хлорокиси. Летучесть LiCl при накаливании больше NaCl и меньше КСl. Подобно другим хлористым соединениям щелочных металлов, LiCl дает двойное соединение с хлорной платиной Li 2PtCl6 +2Н 2 O. Оно растворимо в воде, в спирте и в смеси спирта с эфиром. Гюнц указывает на существование Li 2Cl. Бромистый и иодистый Л. LiBr, LiJ получаются при разложении углекислого Л. Li 2CO3 бромистоводородной и иодистоводородной кислотами. Эти соли также очень гигроскопичны и также отчасти разлагаются водой и кислородом, как и LiCl. Из них LiJ наиболее растворим, за ним идет LiBr и LiCl. Напр., 100 ч. воды растворяют при 0° LiJ — 151 ч., а LiBr — 143 ч. Фтористый Л. приготовляется тоже из LiCO 2, в воде он мало растворим, с HF дает соединение LiFHF. Известны соли Л., отвечающие хлорноватой, бромноватой, иодноватой кислотам. Они очень гигроскопичны.
Углекислый Л. Li 2CO3 получается при насыщении раствора LiHO углекислотой, при действии на растворимые соли Л. углекислых щелочей и пр. В последнем случае лучше брать углеаммиачную соль, так как Li 2CO3 очень упорно удерживает следы щелочей. Li 2CO3 плавится при красном калении, частью разлагаясь (по Тросту, до 83%). В воде он мало растворяется (при обыкновенной темпер. 1 литр растворяет около 12-15 грм. соли); при нагревании растворимость уменьшается. В присутствии СО 2 растворимость значительно возрастает; напр., в 1 лит. его тогда растворяется 52,5 гр. Здесь выступает сходство с углекислыми солями щелочноземельных металлов. При кипячении Li 2CO3 разлагает аммиачные соли, подобно магнию; он растворяет мочевую кислоту и применяется в медицине. Двууглекислой соли для Li не известно с точностью, хотя, вероятно, образованием ее и обусловливается большая растворимость Li 2CO3 в воде с СО 2.
Азотнокислый Л. LiNO 3 получается растворением Li 2CO3 в азотной кислоте. Он очень гигроскопичен, легко дает пересыщенные растворы. При испарении растворов LiNO 3 при 15° получаются кристаллы, изоморфные с натровой селитрой. LiNO 3 растворяется в спирту; при накаливании он разлагается до Li 2O.
Сернокислый Л., LiSO 4, получается растворением Li 2CO3 в H 2SO4. В воде он хорошо растворяется, но с повышением темпер. растворимость падает; напр., 100 ч. воды при 0 ˚ раствор. 35,34 ч., при 20° — 34,36, при 100° — 29,24. При медленном испарении растворов сернокислого Л. получаются кристаллы состава LiOH. Сернокислый Л. дает двойные соли с сернокислым калием, аммонием, но не дает соединений, отвечающих квасцам. Кислая сернокислая соль Л. получается при растворении LiSO 4 в крепкой серной кислоте.
Фосфорнокислый Л., Li 3PO4, получается при осаждении LiSO 4 фосфорнонатриевой солью в присутствии некоторого количества NaHO и NH 3 при нагревании. Он получается в виде кристаллов состава 2Li 3PO4+H2 O. 1 ч. безводной соли требует для растворения 2539 ч. воды или 3920 ч. аммиачной воды. В слабой соляной и азотной кисл. соль растворяется; растворимость ее в воде увеличивается в присутствии аммиачных солей, с которыми она дает двойные соединения, и в присутствии СО 2. Другие соли фосфорной кислоты не представляют особого интереса. То же можно сказать про соли борной и хромовой кисл., которые вообще растворимы в воде.
Сернистый Л. Li 2 S получается при восстановлении углем сернолитиевой соли. Li 2 S растворяется в воде, дает кислую соль LiHS, известны также многосернистые соединения Л. С азотом Li соединяется даже при обыкновенной температуре. Гюнц предложил применять Li для получения аргона из воздуха. Что касается отделения и количественного определения Л., то можно сказать следующее. От тяжелых металлов Li отделяется осаждением последних сероводородом или сернистым аммонием; от кальция, стронция и бария - пользуясь растворимостью сернокислого и щавелевокислого Л., от магния — пользуясь растворимостью водной окиси Л. Калий отделяется от него благодаря нерастворимости хлороплатинита калия; что же касается отделения натрия, то пользуются растворимостью в смеси спирта и эфира LiCl или LiNO 3. Для количественного определения применяется сернокислая и фосфорнокислая соль Л. Для полноты остается сказать несколько слов о способах получения на практике соединений Л. из природных материалов. Для этой цели служит главным образом лепидолит. Способов для извлечения оттуда Л. предложено много. Когда дело идет о приготовлении его в большом количестве, очень удобен способ Троста. 10 ч. измельченного лепидолита смешивают с 10 ч. углекислого бария, 5 ч. сернокислого бария и 3 ч. сернокислого калия. Массу сплавляют в тигле; при охлаждении она представляет два слоя: верхний образован сернокислыми солями лития, калия и бария, а нижний состоит из стекла. Так как это стекло очень трудно плавится, можно дать массе только несколько охладиться и слить верхний слой. Обработав массу водой, получают сернокислый Л. в смеси с сернокислыми щелочами; их переводят в углекислые соли (осаждая уксуснокислым барием и прокаливая полученные уксуснокислые соли) и разделяют, пользуясь полной растворимостью Li 2CO3. В этом способе BaSO 4 может быть заменен сернокислым кальцием.
С. Вуколов. Δ.
Во врачебной практике применяется исключительно углекислый и бензойнокислый Л. — белый порошок, который плавится при нагревании, а при охлаждении застывает в кристаллическую массу. Растворяется в 150 ч. горячей или холодной воды. Терапевтическое значение Л. зиждется на его свойстве давать растворимую соль с мочевою кислотою. По способности растворять мочекислые соли Л. превосходит калий и натрий. Указанными свойствами определяется терапевтическое значение этого средства. Употребление Л. приносит пользу при мочекислом диатезе, при подагре, при мочевом песке, при желчной колике и при катаральных состояниях слизистых оболочек. Некоторые врачи предпочитают назначать минеральные воды, богатые содержанием Л. (Bonifaciusquelle в Зальцшлирфе, K ö nigsquelle в Эльстере), так как в таком виде препарат лучше переносится желудком. Углекислый Л. следует прописывать в малых дозах (0,05-0,25 гр.) в большом количестве воды, еще лучше с зельтерскою или содовою водою. Необходимо иметь в виду, что соли Л. оказывают не менее ядовитое действие на сердце, чем соли калия.
Щелочной металл слово из 5 букв
Ответы
Нажмите на слово, чтобы посмотреть альтернативные определения.
Состав слова
первая буква - Л; вторая буква - И; третья буква - Т; четвёртая буква - И; последняя буква - Й
Другие варианты определения
» Какой металл превращается в жидкость при 27 градусах по цельсию
» Щелочной металл, обозначаемый Li
» Химический элемент, серебристо-белый, мягкий, очень лёгкий щелочной металл
» 3-й элемент Менделеева
» Химический элемент, щелочной металл
» Легкий щелочной металл
» Мягкий щелочной металл
» Химический элемент Li
» Третий в менделеевской шеренге
» Самый легковесный металл
» Элемент, что третьим будет
» No3 в таблице Менделеева
» Самый лёгкий из металлов
» Этот щелочной легкоплавкий металл имеет самую низкую плотность при комнатной температуре - почти в два раза меньше плотности воды
» Первый металл в таблице Менделеева
» Самый легкий металл
» Металл для батареек
» Литос по-гречески камень, а какой металл получил шведский химик Арфедсон самым первым из царства камней
» Какой из элементов занимает третье место в таблице Менделеева
» Металл для аккумуляторов
» Самый лёгкий щелочной металл
» Третий обитатель периодической таблицы
» Третий среди химических элементов
» Третья ячейка химической таблицы
» Химический элемент под номером три
» Что за химический элемент "Li"
» Элемент номер три
» Третий химический элемент
» Между гелием и бериллием
» Третий по расчётам Менделеева
» Какой металл на третьем месте
» Третий в таблице Менделеева
» Самый легкоокисляемый металл
» Третий в менделеевской таблице
» Третий согласно Менделееву
» Менделеев его определил третьим по счету
» Менделеев его назначил третьим
» Третий щелочной металл
» Между гелием и бериллием в таблице
» Химический элемент по "фамилии" Li
» Третий в химическом рейтинге
» Металл, который мягче воска и легче дерева
» Третий в периодической таблице
» Третий в химической таблице
» Какой металл плавится при температуре тела
» Третье место в химическом сообществе
» Один из щелочных металлов
» Металл для батареек и аккумуляторов
» Третий по счету щелочной металл
» Этот элемент занял 3-ю ячейку в таблице Менделеева
» 3-й "подопечный" Менделеева
» 3-е место в химическом сообществе
» Третий в ряду химических элементов
» 3-й по счёту химический элемент
» Менделеев поставил его на 3-е место
» 3-й химический элемент
» Третий в таблице химических элементов
» 3-й обитатель периодической таблицы
» Очень лёгкий металл
первая буква - К; вторая буква - А; третья буква - Л; четвёртая буква - И; последняя буква - Й
» Элемент с атомным номером 19
» Химический элемент, мягкий металл серебристо-белого цвета
» Седьмой по распространенности в земной коре химический элемент
» Химический элемент, металл
» Какой металл составляет основу бертолетовой соли
» Мягкий металл серебристо-белого цвета
» Очень лёгкий, мягкий и легкоплавкий металл
» Химический элемент, металл серебристо-белого цвета
» Основа бертолетовой соли
» Элемент номер девятнадцать
» Металл в удобрениях
» Один из трёх базовых элементов, которые необходимы для роста растений наряду с азотом и фосфором
» Металл из поташа
» "К" в таблице Менделеева
» Химический элемент по "фамилии" K
» Предшественник кальция в таблице
» Девятнадцатый в таблице Менделеева
» Металл, составляющий основу бертолетовой соли
» Химический элемент, K
» В таблице Менделеева он под №19
» Какой металл может быть цианистым
» Преемник аргона в таблице
» Последыш аргона в таблице
» Какой из элементов занимает девятнадцатое место в таблице Менделеева
» Идущий следом за аргоном в таблице
» Химический элемент с кодовым именем K
» Девятнадцатый щелочной металл
» В химической таблице он стоит девятнадцатым
» Вслед за аргоном в таблице
» Химический элемент под названием K
» Между аргоном и кальцием
» Предтеча кальцием в таблице
» Химический элемент, обозначаемый буквой K
» Этот металл открыл британский химик Дэви
» 19-й в череде химических элементов
» Щелочной металл № 19
» 19-й по расчётам Менделеева
» 19-я графа химических элементов
» В таблице он после аргона
» 19-я ячейка химической таблицы
» 19-й в химической таблице
» 19-й в периодической таблице
» Следом за аргоном в таблице
» 19-й химический элемент
» 19-е место в химическом сообществе
» После аргона в таблице
» До кальция в таблице
» Марганцово-кислый или цианистый
» 19-й обитатель периодической таблицы
» Что за химический элемент K
» 19-й в таблице химических элементов
» Металл из щелочных
» Металл, плавающий в воде
» Химический элемент №19
первая буква - Б; вторая буква - А; третья буква - Р; четвёртая буква - И; последняя буква - Й
» Химический элемент, мягкий металл серебристого цвета
» В химической таблице он стоит пятьдесят шестым
» Мягкий, ковкий щёлочноземельный металл серебристо-белого цвета. Обладает высокой химической активностью
» Химический элемент, мягкий серебристо-белый химически активный металл
» Серебристо белый металл из группы щелочноземельных
» Мягкий металл золотисто-жёлтого цвета
» Химический элемент, Ba
» Мягкий, ковкий металл
» Радиоактивный элемент щелочноземельный металл
» Сульфат этого металла глотают больные перед обследованием желудочно-кишечного тракта - его следы очень хорошо видны на рентгене
» Пятьдесят шестой согласно Менделееву
» Идущий следом за цезием в таблице
» В таблице он после цезия
» Между цезием и лантаном в таблице
» Следом за цезием в таблице
» Пятьдесят шестой радиоактивный элемент
» В таблице он перед лантаном
» Химический элемент, обозначаемый буквами Ba
» После цезия в таблице
» Перед лантаном в таблице
» 56-й по счёту химический элемент
» Между цезием и лантаном
» Менделеев назначил его 56-м
» 56-й в химической таблице
» 56-й в таблице химических элементов
» В химической таблице он стоит 56-м
» Что за химический элемент Ba
» Химический элемент под номером 56
» "Тяжёлый" химический элемент
первая буква - Ц; вторая буква - Е; третья буква - З; четвёртая буква - И; последняя буква - Й
» Какой химический элемент считают самым взрывным металлом на планете
» Химический элемент Cs
» В таблице он перед барием
» 55-й по счету химический элемент
» Металл из атомных часов
» Мягкий металл, который можно расплавить теплом своих рук
» Следующий за ксеноном
» Идущий за ксеноном
» Химический элемент с самым большим количеством изотопов
» В таблице Менделеева он под 57
» В химической таблице он стоит пятьдесят пятым
» Какой металл можно расплавить теплом ладоней
» Какой металл обладает наибольшим числом изотопов
» Металл, обладающий наибольшим коэффициентом температурного расширения
» Очень мягкий металл
» После ксенона в таблице
» Предтеча бария в таблице
» Преемник ксенона в таблице
» Пятьдесят пятый щелочной металл
» Пятьдесят пятый элемент
» В таблице Менделеева он под №55
» Следом за ксеноном в таблице
» Идущий следом за ксеноном в таблице
» Пятьдесят пятый в таблице химических элементов
» Между ксеноном и барием
» 55-й по расчётам Менделеева
» Щелочной металл № 55
» Менделеев назначил его 55-м
» 55-й среди химических элементов
» 55-й щелочной металл
» В химической таблице он стоит 55-м
» Этот металл является одним из самых химически активных, например с водой он реагирует с сильным взрывом
Мягкий щелочной металл слово из 5 букв
литий
ЛИ́ТИЙ -я; м. [от греч. lithos - камень, минерал] Химический элемент (Li), мягкий, очень лёгкий щелочной металл серебристо-белого цвета (в природе в чистом виде не встречается).
(лат. Lithium), химический элемент I группы периодической системы, относится к щелочным металлам. Название от греч. líthos — камень (открыт в минерале петалите). Серебристо-белый, самый лёгкий из металлов; плотность 0,533 г/см 3 , tпл 180,5°C. Химически очень активен, окисляется при обычной температуре; реагирует с азотом, образуя нитрид Li3N. Минералы — сподумен, лепидолит и др. Изотоп Li — единственный промышленный источник для производства трития. Литий используют для раскисления, легирования и модифицирования сплавов (например, аэрона, склерона), как теплоноситель в ядерных реакторах, компонент сплавов на основе Mg и Al, анод в химических источниках тока; некоторые соединения лития входят в состав пластичных смазок, специальных стёкол, термостойкой керамики, используются в медицине.ЛИ́ТИЙ (лат. Lithium), Li, химический элемент с атомным номером 3, атомная масса 6,941. Химический символ Li читается так же, как и название самого элемента.
Литий встречается в природе в виде двух стабильных нуклидов (см. НУКЛИД) 6 Li (7,52% по массе) и 7 Li (92,48%). В периодической системе Д. И. Менделеева литий расположен во втором периоде, группе IA и принадлежит к числу щелочных металлов (см. ЩЕЛОЧНЫЕ МЕТАЛЛЫ) . Конфигурация электронной оболочки нейтрального атома лития 1s 2 2s 1 . В соединениях литий всегда проявляет степень окисления +1.
Металлический радиус атома лития 0,152 нм, радиус иона Li + 0,078 нм. Энергии последовательной ионизации атома лития 5,39 и 75,6 эВ. Электроотрицательность по Полингу 0,98, самая большая у щелочных металлов.
В виде простого вещества литий — мягкий, пластичный, легкий, серебристый металл.
История открытия и получение
Литий был открыт в 1817 году шведским химиком и минералогом А. Арфведсоном (см. АРФВЕДСОН Юхан Август) сначала в минерале петалите (Li,Na)[Si4AlO10], а затем в сподумене (см. СПОДУМЕН) LiAl[Si2O6] и в лепидолите (см. ЛЕПИДОЛИТ) KLi1.5Al1.5[Si3AlO10](F,OH)2. Свое название получил из-за того, что был обнаружен в «камнях» (греч. Litos — камень). Характерное для соединений лития красное окрашивание пламени впервые наблюдал немецкий химик Х.Г.Гмелин в 1818 году. В этом же году английский химик Г. Дэви (см. ДЭВИ Гемфри) электролизом расплава гидроксида лития получил кусочек металла. Получить свободный металл в достаточных количествах удалось впервые только в 1855 году путем электролиза расплавленного хлорида:
2LiCl = 2Li + Cl2
В настоящее время для получения металлического лития его природные минералы или разлагают серной кислотой (кислотный способ), или спекают с CaO или CaCO3 (щелочной способ), или обрабатывают K2SO4 (солевой способ), а затем выщелачивают водой. В любом случае из полученного раствора выделяют плохо растворимый карбонат лития Li2CO3, который затем переводят в хлорид LiCl. Электролиз расплава хлорида лития проводят в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси). В дальнейшем полученный литий очищают методом вакуумной дистилляции.
Нахождение в природе
Литий довольно широко распространен в земной коре, его содержание в ней составляет 6,5·10 –3 % по массе. Как уже упоминалось, основные минералы, содержащие литий, — это петалит (содержит 3,5—4,9 % Li2O), сподумен (6—7 % Li2O), лепидолит (4—6 % Li2,O) и амблигонит (см. АМБЛИГОНИТ) LiAl [PO4] — 8—10 % Li2,O. В виде примеси литий содержится в ряде породообразующих минералов, а также присутствует в рапе некоторых озер и в минерализованных водах. В морской воде содержится около 2·10 -5 % лития.
Физические и химические свойства
Из металлов литий самый легкий, его плотность 0,534 г/см 3 . Температура плавления 180,5°C, температура кипения 1326°C. При температурах от –193°C до температуры плавления устойчива кубическая объемно центрированная модификация лития с параметром элементарной ячейки а=0,350 нм.
Из-за небольшого радиуса и маленького ионного заряда литий по своим свойствам больше всего напоминает не другие щелочные металлы, а элемент группы IIA магний (см. МАГНИЙ) . Литий химически очень активен. Он способен взаимодействовать с кислородом и азотом воздуха при обычных условиях, поэтому на воздухе он быстро окисляется с образованием темного налета продуктов взаимодействия:
4Li + O2 = 2Li2O,
6Li + N2 = 2Li3N
При контактах с галогенами литий самовоспламеняется при обычных условиях. Подобно магнию, нагретый литий способен гореть в CO2:
4Li + CO2 = C + 2Li2O
Стандартный электродный потенциал Li/Li + имеет наибольшее отрицательное значение (E°298 = –3,05 B) по сравнению со стандартными электродными потенциалами других металлов. Это обусловлено большой энергией гидратации маленького иона Li + , что значительно смещает равновесие в сторону ионизации металла:
Liтвердый <> Li + раствор + e –
Для слабо сольватирующих растворителей значение электродного потенциала лития соответствует его меньшей химической активности в ряду щелочных металлов.
Соединения лития — соли — как правило, бесцветные кристаллические вещества. По химическому поведению соли лития несколько напоминают аналогичные соединения магния или кальция. Плохо растворимы в воде фторид LiF, карбонат Li2CO3, фосфат Li2PO4, хорошо растворим хлорат лития LiClO3 — это, пожалуй, одно из самых хорошо растворимых соединения в неорганической химии (при 18°C в 100 г воды растворяется 313,5 г LiClO3).
Оксид лития Li2O — белое твердое вещество — представляет собой типичный щелочной оксид. Li2O активно реагирует с водой с образованием гидроксида лития LiOH.
Этот гидроксид получают электролизом водных растворов LiCl:
2LiCl + 2H2O = 2LiOH + Cl2 + H2
LiOH — сильное основание, но оно отличается по свойствам от гидроксидов других щелочных металлов. Гидроксид лития уступает им в растворимости. При прокаливании гидроксид лития теряет воду:
2LiOH = Li2O + H2O
Большое значение в синтезе органических и неорганических соединений имеет гидрид лития LiH, который образуется при взаимодействии расплавленного лития с водородом:
2Li + H2 = 2LiH
LiH — ионное соединение, строение кристаллической решетки которого похоже на строение кристаллической решетки хлорида натрия NaCl. Гидрид лития можно использовать в качестве источника водорода для наполнения аэростатов и спасательного снаряжения (надувных лодок и т.п.), так как при его гидролизе образуется большое количество водорода (1 кг LiH дает 2,8 м 3 H2):
LiH + H2O = LiOH + H2
Он также находит применение при синтезе различных гидридов, например, борогидрида лития:
BCl3 + 4LiH = Li[BH4] + 3LiCl.
Литий образует соединения с частично ковалентной связью Li—C, т. е. литийорганические соединения. Например, при реакции иодбензола C6H5I с литием в органических растворителях протекает реакция:
C6H5I + 2Li = C6H5Li + LiI.
Литийорганические соединения широко используются в органическом синтезе и в качестве катализаторов.
Применение
Из лития изготовляют аноды химических источников тока, работающих на основе неводных твердых электролитов. Жидкий литий может служить теплоносителем в ядерных реакторах. С использованием нуклида 6 Li получают радиоактивный тритий 3 1H (Т):
6 3Li + 1 0n = 3 1H + 4 2He.
Литий и его соединения широко применяют в силикатной промышленности для изготовления специальных сортов стекла и покрытия фарфоровых изделий, в черной и цветной металлургии (для раскисления, повышения пластичности и прочности сплавов), для получения пластичных смазок. Соединения лития используются в текстильной промышленности (отбеливание тканей), пищевой (консервирование) и фармацевтической (изготовление косметики).
Биологическая роль
Литий в незначительных количествах присутствует в живых организмах, но по-видимому, не выполняет никаких биологических функций. Установлено его стимулирующее действие на некоторые процессы в растениях, способность повышать их устойчивость к заболеваниям.
В организме среднего человека (масса 70 кг) содержится около 0,7 мг лития. Токсическая доза 90—200 мг.
Особенности обращения с литием
Как и другие щелочные металлы, металлический литий способен вызывать ожоги кожи и слизистых, особенно в присутствии влаги. Поэтому работать с ним можно только в защитной одежде и очках. Хранят литий в герметичной таре под слоем минерального масла. Отходы лития нельзя выбрасывать в мусор, для уничтожения их следует обработать этиловым спиртом:
2С2Н5ОН + 2Li = 2С2Н5ОLi + Н2
Образовавшийся этилат лития затем разлагают водой до спирта и гидроксида лития LiOH.
Энциклопедический словарь . 2009 .
Полезное
Смотреть что такое "литий" в других словарях:
ЛИТИЙ — (лат. lithium, от греч. lithos камень). Металл белого цвета, открытый в 1817 г. в петалите; все соли его растворимы в воде. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. ЛИТИЙ белый металл, самый легкий из всех,… … Словарь иностранных слов русского языка
ЛИТИЙ — (Lithium), Li, химический элемент I группы периодической системы, атомный номер 3, атомная масса 6,941; относится к щелочным металлам, tпл 180,54шC. Литий используют для изготовления анодов для химических источников тока, в производстве меди,… … Современная энциклопедия
Литий — (Lithium), Li, химический элемент I группы периодической системы, атомный номер 3, атомная масса 6,941; относится к щелочным металлам, tпл 180,54°C. Литий используют для изготовления анодов для химических источников тока, в производстве меди,… … Иллюстрированный энциклопедический словарь
ЛИТИЙ — (лат. Lithium) Li, химический элемент I группы периодической системы, атомный номер 3, атомная масса 6,941, относится к щелочным металлам. Название от греч. lithos камень (открыт в минерале петалите). Серибристо белый, самый легкий из металлов;… … Большой Энциклопедический словарь
Литий — Li (от греч. lithos камень * a. lithium; н. Lithium; ф. lithium; и. litio), хим. элемент I группы периодич. системы Менделеева, ат. н. 3, ат. м. 6,941, относится к щелочным металлам. B природе встречаются 2 стабильных изотопа: 6Li (7,42%) … Геологическая энциклопедия
ЛИТИЙ — ЛИТИЙ, хим. элемент, символ Li, порядков. номер 3, серебристо белый металл, ат. в. 6,940 (изотопы 6 и 7), t° пл. 186°; относится к группе щелочн. металлов, имеет наименьший по сравн. с др. металлами уд. в. (0,59). Открыт Арфедзоном… … Большая медицинская энциклопедия
ЛИТИЙ — хим. элемент, символ Li (лат. Lithium), ат. н. 3, ат. м. 6,941; серебристо белый, самый лёгкий металл, принадлежит к щелочным металлам, плотность 534 кг/м3, tпл = 180,5°С; легко режется ножом. Л. химически очень активен, взаимодействует с водой и … Большая политехническая энциклопедия
ЛИТИЙ — (символ Li), редкий серебряного цвета элемент, один из ЩЕЛОЧНЫХ МЕТАЛЛОВ, впервые был обнаружен в 1817 г. Содержится в таких рудах, как лепидолит и сподумен. По химическим свойствам близок к натрию. Самый легкий из всех металлов, используется в… … Научно-технический энциклопедический словарь
ЛИТИЙ — ЛИТИЙ, лития, мн. нет, муж. (от греч. lithios каменный) (минер., хим.). Химический элемент серебристобелый, мягкий, очень легкий щелочный металл, не встречающийся в природе в чистом виде, а только в виде солей. Толковый словарь Ушакова. Д.Н.… … Толковый словарь Ушакова
ЛИТИЙ — (Lithium), Li, хим. элемент I группы периодич. системы элементов, ат. номер 3, ат. масса 6,941, относится к щелочным металлам. Природный Л. состоит из смеси стабильных (7,5%) и (92,5%) с сильно различающимися сечениями захвата тепловых нейтронов… … Физическая энциклопедия
литий — сущ., кол во синонимов: 2 • металл (86) • элемент (159) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
ЩЕЛОЧНЫЕ МЕТАЛЛЫ
ЩЕЛОЧНЫЕ МЕТАЛЛЫ
ПОДГРУППА IА. ЩЕЛОЧНЫЕ МЕТАЛЛЫ
ЛИТИЙ, НАТРИЙ, КАЛИЙ, РУБИДИЙ, ЦЕЗИЙ, ФРАНЦИЙ
Электронное строение щелочных металлов характеризуется наличием на внешней электронной оболочке одного электрона, относительно слабо связанного с ядром. С каждого щелочного металла начинается новый период в периодической таблице. Щелочной металл способен отдавать свой внешний электрон легче, чем любой другой элемент этого периода. Разрез щелочного металла в инертной среде имеет яркий серебристый блеск. Щелочные металлы отличаются невысокой плотностью, хорошей электропроводностью и плавятся при сравнительно низких температурах (табл. 2).
Благодаря высокой активности щелочные металлы в чистом виде не существуют, а встречаются в природе только в виде соединений (исключая франций), например с кислородом (глины и силикаты) или с галогенами (хлорид натрия). Хлориды являются сырьем для получения щелочных металлов в свободном состоянии. Морская вода содержит ЩЕЛОЧНЫЕ МЕТАЛЛЫ3% NaCl и следовые количества других солей. Очевидно, что озера и внутренние моря, а также подземные отложения солей и рассолы содержат галогениды щелочных металлов в больших концентрациях, чем морская вода. Например, содержание солей в водах Большого Соленого озера (шт. Юта, США) составляет 13,827,7%, а в Мертвом море (Израиль) до 31% в зависимости от площади зеркала воды, изменяющейся от времени года. Можно полагать, что незначительное содержание KCl в морской воде по сравнению с NaCl объясняется усвоением иона K+ морскими растениями.
В свободном виде щелочные металлы получают электролизом расплавов таких солей, как NaCl, CaCl2, CaF2 или гидроксидов (NaOH), так как нет более активного металла, способного вытеснить щелочной металл из галогенида. При электролизе галогенидов необходимо изолировать выделяющийся на катоде металл, так как одновременно на аноде выделяется газообразный галоген, активно реагирующий с выделяющимся металлом.
См. также ЩЕЛОЧЕЙ ПРОИЗВОДСТВО
Поскольку у щелочных металлов на внешнем слое всего один электрон, каждый из них является наиболее активным в своем периоде, так, Li самый активный металл в первом периоде из восьми элементов, Na соответственно во втором, а K самый активный металл третьего периода, содержащего 18 элементов (первый переходный период). В подгруппе щелочных металлов (IA) способность отдавать электрон возрастает сверху вниз.
Химические свойства. Все щелочные металлы активно реагируют с кислородом, образуя оксиды или пероксиды, отличаясь в этом друг от друга: Li превращается в Li2O, а другие щелочные металлы в смесь M2O2 и MO2, причем Rb и Cs при этом возгораются. Все щелочные металлы образуют с водородом солеподобные термически стабильные при высоких температурах гидриды состава M+H, являющиеся активными восстановителями; гидриды разлагаются водой с образованием щелочей и водорода и выделением теплоты, вызывающей воспламенение газа, причем скорость этой реакции у лития выше, чем у Na и K.
См. также ВОДОРОД; КИСЛОРОД.
В жидком аммиаке щелочные металлы растворяются, образуя голубые растворы, и (в отличие от реакции с водой) могут быть выделены снова при испарении аммиака или добавлении соответствующей соли (например, NaCl из его аммиачного раствора). При реакции с газообразным аммиаком реакция протекает подобно реакции с водой:
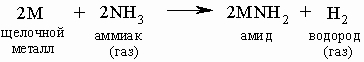
Амиды щелочных металлов проявляют основные свойства подобно гидроксидам. Большинство соединений щелочных металлов, кроме некоторых соединений лития, хорошо растворимы в воде. По атомным размерам и зарядовой плотности литий близок к магнию, поэтому свойства соединений этих элементов похожи. По растворимости и термической устойчивости карбонат лития подобен карбонатам магния и бериллия элементов подгруппы IIA; эти карбонаты разлагаются при относительно невысоких температурах вследствие более прочной связи МО. Соли лития лучше растворимы в органических растворителях (спиртах, эфирах, нефтяных растворителях), чем соли других щелочных металлов. Литий (как и магний) непосредственно реагирует с азотом, образуя Li3N (магний образует Mg3N2), тогда как натрий и другие щелочные металлы могут образовывать нитриды только в жестких условиях. Металлы подгруппы IA реагируют с углеродом, но наиболее легко протекает взаимодействие с литием (очевидно, благодаря его малому радиусу) и наименее легко с цезием. И наоборот, активные щелочные металлы непосредственно реагируют с СО, образуя карбонилы (например, K(CO)x), а менее активные Li и Na только в определенных условиях.
Применение. Щелочные металлы применяются как в промышленности, так и в химических лабораториях, например для синтезов. Литий используется для получения твердых легких сплавов, отличающихся, однако, хрупкостью. Большие количества натрия расходуются для получения сплава Na4Pb, из которого получают тетраэтилсвинец Pb(C2H5)4 антидетонатор бензинового топлива. Литий, натрий и кальций используются как компоненты мягких подшипниковых сплавов. Единственный и поэтому подвижный электрон на внешнем слое делает щелочные металлы прекрасными проводниками тепла и электричества. Сплавы калия и натрия, сохраняющие жидкое состояние в широком интервале температур, применяют как теплообменную жидкость в некоторых типах ядерных реакторов и благодаря высоким температурам в ядерном реакторе используются для производства пара. Металлический натрий в виде подводящих электрических шин используется в электрохимической технологии для передачи токов большой мощности. Гидрид лития LiH является удобным источником водорода, выделяющегося в результате реакции гидрида с водой. Литийалюминийгидрид LiAlH4 и гидрид лития используются в качестве восстановителей в органическом и неорганическом синтезе. Благодаря малому ионному радиусу и соответственно высокой зарядовой плотности литий активен в реакциях с водой, поэтому соединения лития сильно гигроскопичны, и хлорид лития LiCl используется для осушки воздуха при эксплуатации приборов. Гидроксиды щелочных металлов сильные основания, хорошо растворимые в воде; они применяются для создания щелочной среды. Гидроксид натрия как наиболее дешевая щелочь находит широкое применение (только в США ее расходуется в год более 2,26 млн. т).
Литий. Самый легкий металл, имеет два стабильных изотопа с атомной массой 6 и 7; более распространен тяжелый изотоп, его содержание составляет 92,6% от всех атомов лития. Литий был открыт А.Арфведсоном в 1817 и выделен Р.Бунзеном и А.Матисеном в 1855. Он используется в производстве термоядерного оружия (водородная бомба), для увеличения твердости сплавов и в фармацевтике. Соли лития применяют для увеличения твердости и химической стойкости стекла, в технологии щелочных аккумуляторных батарей, для связывания кислорода при сварке.
Натрий. Известен с древности, выделил его Х.Дэви в 1807. Это мягкий металл, широко применяются такие его соединения, как щелочь (гидроксид натрия NaOH), пищевая сода (бикарбонат натрия NaHCO3) и кальцинированная сода (карбонат натрия Na2CO3). Находит применение и металл в виде паров в неярких газоразрядных лампах уличного освещения.
Калий. Известен с древности, выделил его также Х.Дэви в 1807. Соли калия хорошо известны: калиевая селитра (нитрат калия KNO3), поташ (карбонат калия K2CO3), едкое кали (гидроксид калия KOH) и др. Металлический калий также находит различное применение в технологии теплообменных сплавов.
Рубидий был открыт методом спектроскопии Р.Бунзеном в 1861; содержит 27,85% радиоактивного рубидия Rb-87. Рубидий, как и другие металлы подгруппы IA, химически высокоактивен и должен храниться под слоем нефти или керосина во избежание окисления кислородом воздуха. Рубидий находит разнообразное применение, в том числе в технологии фотоэлементов, радиовакуумных приборов и в фармацевтике.
Цезий. Соединения цезия широко распространены в природе, обычно в малых количествах совместно с соединениями других щелочных металлов. Минерал поллуцит силикат содержит 34% оксида цезия Cs2O. Элемент был открыт Р.Бунзеном методом спектроскопии в 1860. Основным применением цезия является производство фотоэлементов и электронных ламп, один из радиоактивных изотопов цезия Cs-137 применяется в лучевой терапии и научных исследованиях.
Франций. Последний член семейства щелочных металлов франций настолько радиоактивен, что его нет в земной коре в более чем следовых количествах. Сведения о франции и его соединениях основаны на исследовании ничтожного его количества, искусственно полученного (на высокоэнергетическом ускорителе) при a-распаде актиния-227. Наиболее долгоживущий изотоп 22387Fr распадается за 21 мин на 22388Ra и b-частицы. Согласно приблизительной оценке, металлический радиус франция составляет 2,7 . Франций обладает большинством свойств, характерных для других щелочных металлов, и отличается высокой электронодонорной активностью. Он образует растворимые соли и гидроксид. Во всех соединениях франций проявляет степень окисления I.
Энциклопедия Кольера. — Открытое общество . 2000 .
Смотреть что такое "ЩЕЛОЧНЫЕ МЕТАЛЛЫ" в других словарях:
ЩЕЛОЧНЫЕ МЕТАЛЛЫ — хим. элементы (щелочные элементы), составляющие гл. подгруппу 1 группы периодич. системы элементов, а также отвечающие им простые вещества металлы. К Щ. м. относятся литий Li (ат. номер 3), натрий Na (11), калий К (19), рубидий Rb (37), це … Физическая энциклопедия
ЩЕЛОЧНЫЕ МЕТАЛЛЫ — ЩЕЛОЧНЫЕ МЕТАЛЛЫ, одновалентные металлы, составляющие первую группу периодической таблицы: литий, НАТРИЙ, РУБИДИЙ, ЦЕЗИЙ и ФРАНЦИЙ. Это мягкие серебристо белые металлы, которые быстро окисляются на воздухе и дают бурную реакцию с водой, при… … Научно-технический энциклопедический словарь
Щелочные металлы — ЩЕЛОЧНЫЕ МЕТАЛЛЫ: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs, франций Fr. Мягкие металлы, легко режутся (кроме Li), Rb, Cs и Fr почти пастообразны при обычных условиях; Li самый лёгкий из всех металлов, Na и K легче воды. Химически очень… … Иллюстрированный энциклопедический словарь
ЩЕЛОЧНЫЕ МЕТАЛЛЫ — химические элементы Li, Na, K, Rb, Cs, Fr. Название от щелочей гидроксидов щелочных металлов … Большой Энциклопедический словарь
ЩЕЛОЧНЫЕ МЕТАЛЛЫ — элементы I группы периодической системы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs), франций (Fr); очень мягкие, пластичные, легкоплавкие и легкие, как правило, серебристо белого цвета; химически очень активны; бурно реагируют с … Российская энциклопедия по охране труда
Щелочные металлы — Группа → 1 ↓ Период 2 3 Литий … Википедия
Щелочные металлы — Alkali metals Щелочные металлы. Металлы первой группы Периодической системы, а именно: литий, натрий, калий, рубидий, цезий и франций. Они образуют строго щелочные гидроксиды, отсюда и их название. (Источник: «Металлы и сплавы. Справочник.» Под… … Словарь металлургических терминов
Щелочные металлы — химические элементы Li, Na, К, Rb, Cs, Fr. Названы так потому, что их гидрооксиды наиболее сильные щелочи. Химически щелочные металлы наиболее активные металлы. Их активность возрастает от Li к Fr … Энциклопедический словарь по металлургии
ЩЕЛОЧНЫЕ МЕТАЛЛЫ — химические элементы Li, Na, К, Rb, Cs, Fr. Названы так потому, что их гидрооксиды наиболее сильные щелочи. Химически щелочные металлы наиболее активные металлы. Их активность возрастает от Li к Fr … Металлургический словарь
Читайте также:
