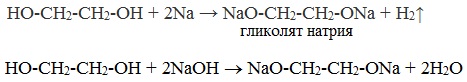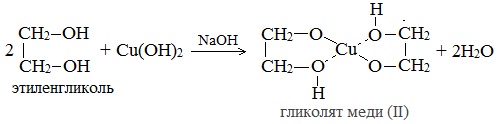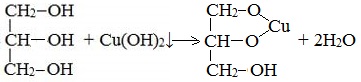Глицерин и металлический натрий
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH - | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | - | - | Н | Н | Н | |
| F - | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | - | Н | Р | Р |
| Cl - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | - | - | - | Н | - | - | Н | - | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | - | Н | ? | Н | Н | ? | М | М | - | Н | ? | ? |
| HSO3 - | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | - | Н | Р | Р |
| HSO4 - | Р | Р | Р | Р | Р | Р | Р | Р | - | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р |
| NO2 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | - | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO - | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р | Р | - | Р | Р | Р | Р | Р | Р | Р | - | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые (
Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую:
Скопируйте эту ссылку, чтобы разместить результат запроса " " на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Внимание, если вы не нашли в базе сайта нужную реакцию, вы можете добавить ее самостоятельно. На данный момент доступна упрощенная авторизация через VK. Здесь вы можете выбрать параметры отображения органических соединений. Эти параметры действуют только для верхнего изображения вещества и не применяются в реакциях.
Корректная работа сайта обеспечена на всех браузерах, кроме Internet Explorer. Если вы пользуетесь Internet Explorer, смените браузер. На сайте есть сноски двух типов: Подсказки - помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация - такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Опыты по химии. Многоатомные спиртыКак и одноатомные спирты, многоатомные спирты реагируют с металлическим натрием. В пробирку с глицерином бросим кусочек натрия. Пробирку слегка подогреем. Реакция идет вначале медленно, затем более энергично. Выделяющийся водород можно поджечь. Реакция протекает очень энергично, выделяется много теплоты, на завершающей стадии реакции происходит обугливание глицерина. Оборудование: химический стакан, пробирка, палочка стеклянная, скальпель, пинцет, фильтровальная бумага. Техника безопасности. Соблюдать правила работы со щелочными металлами. Постановка опыта и текст – к.п.н. Павел Беспалов. Взаимодействие глицерина с кристаллическим перманганатом калия К растертому в тонкий порошок перманганату калия прильем немного глицерина. Через некоторое время над смесью появляется дымок, а затем происходит загорание глицерина. Под действием сильных окислителей глицерин сгорает с образованием углекислого газа и воды. Оборудование: огнезащитная прокладка, фильтровальная бумага, шпатель. Техника безопасности. Соблюдать правила пожарной безопасности. Не допускать попадания перманганата калия на одежду и кожу. Взаимодействие многоатомных спиртов с гидроксидом меди (II) С увеличением числа гидроксильных групп в молекуле вещества возрастает подвижность атомов водорода, т.е. увеличиваются кислотные свойства. Поэтому атомы водорода в многоатомных спиртах могут замещаться не только щелочными металлами, но и менее активными металлами. Получим гидроксид меди (II), путем сливания растворов гидроксида натрия и сульфата меди (II). Прильем полученный осадок к глицерину. Осадок гидроксида меди растворяется и образуется темно-синий раствор глицерата меди (II). Осадок гидроксида меди прильем к раствору этиленгликоля. Также образуется темно-синий раствор. Реакция с гидроксидом меди (II) является качественной реакцией на многоатомные спирты. Оборудование: пробирки, стеклянная палочка. Техника безопасности. Соблюдать правила работы со щелочами и их растворами. Изучение физических свойств глицерина Глицерин – прозрачная, бесцветная, вязкая, сладковатая сиропообразная жидкость. Глицерин хорошо растворим в воде, и смешивается с ней в любых отношениях. Растворы глицерина замерзают при очень низких температурах. Приготовим охлаждающую смесь из поваренной соли и кусочков льда. Опустим в нее две пробирки. В одной из пробирок – вода, в другой – раствор глицерина. Через некоторое время вода замерзает. Раствор глицерина остается жидким. Глицерин и этиленгликоль используются в качестве антифризов в радиаторах автомобилей. Оборудование: пробирки, штатив, кристаллизатор. Техника безопасности. Опыт безопасен. Глицерин и металлический натрийМногоатомные спирты по химическим свойствам сходны с одноатомными спиртами. Однако в химических свойствах многоатомных спиртов есть особенности, обусловленные присутствием в молекуле двух и более гидроксильных групп. Если в многоатомных спиртах ОН-группы находятся при соседних атомах углерода, то вследствие взаимного влияния этих групп (–I-эффект одной ОН-группы по отношению к другой), разрыв связи О-Н происходит легче, чем в одноатомных спиртах. Кислотные свойства1. С щелочными металлами Многоатомные спирты с ОН-группами у соседних атомов углерода (этиленгликоль, глицерин и т.п.) вследствие взаимного влияния атомов (-I-эффект ОН-групп) являются более сильными кислотами, чем одноатомные спирты. Они образуют соли не только в реакциях с активными металлами, но и под действием их гидроксидов. Видеоопыт «Взаимодействие глицерина с металлическим натрием»
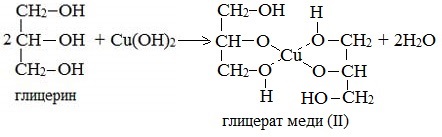
2. С гидроксидом меди(II) — качественная реакция! Наличие нескольких ОН-групп в молекулах многоатомных спиртов обусловливает увеличение подвижности и способности к замещению гидроксильных атомов водорода по сравнению с одноатомными спиртами. Поэтому, в отличие от алканолов, многоатомные спирты взаимодействуют с гидроксидами тяжелых металлов (например, с гидроксидом меди (II) Cu (OH)2). Продуктами этих реакций являются комплексные («хелатные») соединения, в молекулах которых атом тяжелого металла образует как обычные ковалентные связи Ме–О за счет замещения атомов водорода ОН-групп, так и донорно-акцепторные связи Ме←О за счет неподеленных пар атомов кислорода других ОН-групп. При взаимодействии многоатомного спирта с гидроксидом меди (II) в щелочной среде образуется темно-синий раствор (гликолят меди и глицерат меди). Эта реакция является качественной реакцией на многоатомные спирты. Видеоопыт «Взаимодействие многоатомных спиртов с гидроксидом меди (II)» Гликолят меди
Глицерат меди
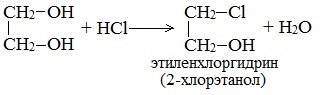
По аналогии с алкоголятами соли двухатомных спиртов называются гликолятами, а трехатомных — глицератами. Многоатомные спирты с несоседними ОН-группами подобны по свойствам одноатомным спиртам (не проявляется взаимное влияние групп ОН). Основные свойства1. С галогенводородными кислотами При взаимодействии этиленгликоля с галогеноводородами (НСl, HBr) одна гидроксильная группа замещается на галоген: Вторая гидроксогруппа замещается труднее, под действием РСl5. 2. Реакция этерификации (с органическими и неорганическими кислотами) Многоатомные спирты взаимодействуют с органическими и неорганическими кислотами с образованием сложных эфиров. С карбоновыми кислотами глицерин образует сложные эфиры – жиры и масла.
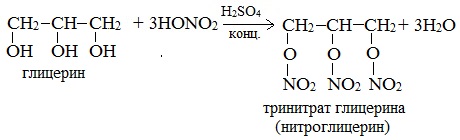
При взаимодействии глицерина с азотной кислотой в присутствии концентрированной серной кислоты образуется нитроглицерин (тринитрат глицерина): Тринитрат глицерина (тривиальное название – нитроглицерин) – тяжелая маслянистая жидкость, известное взрывчатое вещество (взрывается от легкого сотрясения и нагревания). И одновременно лекарственный препарат (спиртовые растворы его не взрываются): 1% спиртовой раствор нитроглицерина применяется в медицине в качестве средства расширяющего сосуды сердца. 3. Окисление Видеоопыт «Взаимодействие глицерина с кристаллическим перманганатом калия» Какая разница между третичным и трехатомным спиртом? Третичным называется спирт, в котором функциональная группа -ОН связана с третичным атомом углерода. Трехатомным называют спирт, в котором имеется три функциональных группы – ОН. Номенклатура жировОбщее название жиров – триацилглицерины (триглицериды). Существует несколько способов назвать молекулу жира. Например, жир, образованный тремя остатками стеариновой кислоты, будет иметь следующие названия:
Физические свойства жировЖиры растворимы в органических растворителях и нерастворимы в воде. С водой жиры не смешиваются. Химические свойства жиров1. Гидролиз (омыление) жиров Жиры подвергаются гидролизу в кислой или щелочной среде или под действием ферментов. 1.1. Кислотный гидролизПод действием кислот жиры гидролизуются до глицерина и карбоновых кислот, которых входили в молекулу жира.
1.2. Щелочной гидролиз — омыление жировПри щелочном гидролизе жиров образуется глицерин и соли карбоновых кислот, входивших в состав жира.
2. Гидрирование (гидрогенизация) ненасыщенных жировГидрогенизация жиров — это процесс присоединения водорода к остаткам непредельных кислот, входящих в состав жира. При этом остатки непредельных кислот переходят в остатки предельных, жидкие растительные жиры превращаются в твёрдые (маргарин).
3. Мыло и синтетические моющие средстваПри щелочном гидролизе жиров образуются мыла – соли высших жирных кислот. Стеарат натрия – твёрдое мыло. Стеарат калия – жидкое мыло. Моющая способность мыла зависит от жесткости воды. Оно хорошо мылится и стирает в мягкой воде, плохо стирает в жёсткой воде и совсем не стирает в морской воде, так как содержащие в ней ионы Ca 2+ и Mg 2+ образуют с высшими кислотами нерастворимые в воде соли.
Поэтому наряду с мылом используют синтетические моющие средства. Их производят из других веществ, например из алкилсульфатов — солей сложных эфиров высших спиртов и серной кислоты. Спирт реагирует с серной кислотой с образованием алкилсульфата .
Далее алкилсульфат гидролизуется щелочью:
Эти соли содержат в молекуле от 12 до 14 углеродных атомов и обладают очень хорошими моющими свойствами. Кальциевые и магниевые соли этих веществ растворимы в воде, а потому такие мыла моют и в жесткой воде. Алкилсульфаты содержатся во многих стиральных порошках. Химические свойства спиртов
Химические реакции гидроксисоединений идут с разрывом одной из связей: либо С–ОН с отщеплением группы ОН, либо связи О–Н с отщеплением водорода. Это реакции замещения, либо реакции отщепления (элиминирования). Свойства спиртов определяются строением связей С–О–Н. Связи С–О и О–Н — ковалентные полярные. При этом на атоме водорода образуется частичный положительный заряд δ+, на атоме углерода также частичный положительный заряд δ+, а на атоме кислорода — частичный отрицательный заряд δ–. Такие связи разрываются по ионному механизму. Разрыв связи О–Н с отрывом иона Н + соответствует кислотным свойствам гидроксисоединения. Разрыв связи С–О соответствует основным свойствам и реакциям нуклеофильного замещения. С разрывом связи О–Н идут реакции окисления, а с разрывом связи С–О — реакции восстановления.
1.1. Взаимодействие с раствором щелочейПри взаимодействии спиртов с растворами щелочей реакция практически не идет, т. к. образующиеся алкоголяты почти полностью гидролизуются водой. Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция практически не идет. 1.2. Взаимодействие с металлами (щелочными и щелочноземельными)Спирты взаимодействуют с активными металлами. При этом образуются алкоголяты. При взаимодействии с металлами спирты ведут себя, как кислоты.
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
|
| Например, при взаимодействии этиленгликоля со свежеосажденным гидроксидом меди (II) образуется ярко-синий раствор гликолята меди: |
2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии спиртов с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
| Например, этанол реагирует с бромоводородом. |

Многоатомные спирты также, как и одноатомные спирты, реагируют с галогеноводородами.
| Например, этиленгликоль реагирует с бромоводородом: |

2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
| Например, при взаимодействии этанола с аммиаком образуется этиламин. |

2.3. Этерификация (образование сложных эфиров)
Одноатомные и многоатомные спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.

| Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты): |

Многоатомные спирты вступают в реакции этерификации с органическими и неорганическими кислотами.
| Например, этиленгликоль реагирует с уксусной кислотой с образованием ацетата этиленгликоля: |

2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
| Например, при взаимодействии этанола с азотной кислотой образуется сложный эфир этилнитрат : |
| Например, глицерин под действием азотной кислоты образует тринитрат глицерина (тринитроглицерин): |
3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.1. Внутримолекулярная дегидратация
При высокой температуре (больше 140 о С) происходит внутримолекулярная дегидратация и образуется соответствующий алкен.
| Например, из этанола под действием концентрированной серной кислоты при температуре выше 140 градусов образуется этилен: |
В качестве катализатора этой реакции также используют оксид алюминия.
| Отщепление воды от несимметричных спиртов проходит в соответствии с правилом Зайцева: водород отщепляется от менее гидрогенизированного атома углерода. |
| Например, в присутствии концентрированной серной кислоты при нагревании выше 140 о С из бутанола-2 в основном образуется бутен-2: |
3.2. Межмолекулярная дегидратация
При низкой температуре (меньше 140 о С) происходит межмолекулярная дегидратация по механизму нуклеофильного замещения: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
| Например, при дегидратации этанола при температуре до 140 о С образуется диэтиловый эфир: |

4. Окисление спиртов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
| Вторичные спирты окисляются в кетоны: в торичные спирты → кетоны |
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
Легкость окисления спиртов уменьшается в ряду:
Продукты окисления многоатомных спиртов зависят от их строения. При окислении оксидом меди многоатомные спирты образуют карбонильные соединения.
4.1. Окисление оксидом меди (II)
Cпирты можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества. Первичные спирты окисляются до альдегидов, вторичные до кетонов, а метанол окисляется до метаналя.
| Например, этанол окисляется оксидом меди до уксусного альдегида |
| Например, пропанол-2 окисляется оксидом меди (II) при нагревании до ацетона |
Третичные спирты окисляются только в жестких условиях.
4.2. Окисление кислородом в присутствии катализатора
Cпирты можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.). Первичные спирты окисляются до альдегидов, вторичные до кетонов, а метанол окисляется до метаналя.
| Например, при окислении пропанола-1 образуется пропаналь |

| Например, пропанол-2 окисляется кислородом при нагревании в присутствии меди до ацетона |
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) первичные спирты окисляются до карбоновых кислот, вторичные спирты окисляются до кетонов, метанол окисляется до углекислого газа.
| При нагревании первичного спирта с перманганатом или дихроматом калия в кислой среде может образоваться также альдегид, если его сразу удаляют из реакционной смеси. |
Третичные спирты окисляются только в жестких условиях (в кислой среде при высокой температуре) под действием сильных окислителей: перманганатов или дихроматов. При этом происходит разрыв углеродной цепи и могут образоваться углекислый газ, карбоновая кислота или кетон, в зависимости от строения спирта.
| Спирт/ Окислитель | KMnO4, кислая среда | KMnO4, H2O, t |
| Метанол СН3-ОН | CO2 | K2CO3 |
| Первичный спирт R-СН2-ОН | R-COOH/ R-CHO | R-COOK/ R-CHO |
| Вторичный спирт R1-СНОН-R2 | R1-СО-R2 | R1-СО-R2 |
| Например, при взаимодействии метанола с перманганатом калия в серной кислоте образуется углекислый газ |

| Например, при взаимодействии этанола с перманганатом калия в серной кислоте образуется уксусная кислота |

| Например, при взаимодействии изопропанола с перманганатом калия в серной кислоте образуется ацетон |

4.4. Горение спиртов
Образуются углекислый газ и вода и выделяется большое количество теплоты.
| Например, уравнение сгорания метанола: |
5. Дегидрирование спиртов
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования. При дегидрировании метанола и первичных спиртов образуются альдегиды, при дегидрировании вторичных спиртов образуются кетоны.
Читайте также:
- К чему снится воровать металл
- Резка металла диском по металлу
- Определите молярную массу эквивалента металла
- Штукатурка металлических перемычек по сетке
- Гардина металлическая с кольцами