Гидриды щелочных металлов химические свойства
ГИДРИДЫ
ГИДРИДЫ, соединения водорода с металлами или менее электроотрицательными, чем водород, неметаллами. Иногда к гидридам относят соед. всех хим. элементов с водородом. Различают простые, или бинарные, гидриды, комплексные (см., напр., Алюмогидриды, Борогидриды металлов)и гидриды интерметаллич. соединений. Для большинства переходных металлов известны также комплексные соед., содержащие атом Н наряду с др. лигандами в координац. сфере металла-комплексообразователя.
Простые гидриды. Известны для всех элементов, кроме благородных газов, платиновых металлов (исключение -Pd), Ag, Au, Cd, Hg, In, Tl. В зависимости от природы связи элемента (Э) с водородом подразделяются на ковалентные, ионные (солеобразные) и металлоподобные (металлические), однако эта классификация условна, т. к. между разл. типами простых гидридов резких границ нет.
К ковалентным относят гидриды неметаллов, Al, Be, Sn, Sb. Гидриды SiH4, GeH4, SnH4, PH3, AsH3, SbH3, H2S, H2Se, H2Te (см. табл. 1) и низшие бороводороды-газы. Ковалентные гидриды обладают высокой реакц. способностью. Эффективный положит. заряд атома Э в молекуле возрастает в пределах одной группы периодич. системы с увеличением его порядкового номера. Элементы Si и Ge образуют высшие гидриды общей ф-лы ЭnН2n + 2 (п 2 и Н2. Все эти гидриды раств. в неполярных или малополярных орг. р-рителях. Ковалентные гидриды-сильные восстановители. Легко вступают в обменные р-ции, напр. с галогенидами металлов. При 100-300 °С (H2S ок. 400 °С) разлагаются практически необратимо до Э и Н2.
Гидриды подгруппы фосфора получают р-цией ЭС13 с Li[AlH4] в эфире при 25 °С; SiH4 и GeH4-взаимод. Мg2Э с водой или с В2Н6 в жидком NH3; H2S, H2Se и Н2Те-кислотным гидролизом сульфидов, селенидов или теллуридов металлов (H2S-также взаимод. Н, и S). Все упомянутые гидриды, особенно AsH3 и РН3, высокотоксичны. Гидриды Ge, Si, As используют для получения полупроводниковых материалов. См. также Мышьяка гидрид, Сероводород, Силаны, Фосфины.
К ионным относят гидриды щелочных и щел.-зем. металлов (кроме Mg). Эти соед.-структурные аналоги соответствующих галогенидов. Представляют собой кристаллы, к-рые в расплавл. состоянии проводят электрич. ток, причем Н2 выделяется на аноде. Не раств. в орг. р-рителях, хорошо раств. в расплавах галогенидов щелочных металлов. Обладают высокой хим. активностью, бурно реагируют с О2 и влагой воздуха. Взаимод. с водой (напр., МН + Н2О -> МОН + Н2) сопровождается выделением тепла. В эфире, диглиме, ТГФ легко (особенно LiH и NaH) реагируют с галогенидами или гидридами В и А1, образуя соотв. борогидриды М[ВН4]n и алюмогидриды М[А1Н4]n. При 700-800°С восстанавливают оксиды до металлов. С СО2 дают соли муравьиной к-ты. Взаимод. с N2, напр. 3СаН2 + + N2->Ca3N2 + ЗН2.
Получают ионные гидриды обычно взаимод. Н2 с расплавом соответствующего металла под давлением. Их используют в кач-ве сильных восстановителей (напр., для получения металлов из их оксидов или галогенидов, удаления окалины с пов-стей изделий из стали и тугоплавких металлов). Многие гидриды-источники Н2, перспективное ракетное топливо. Дейтериды и тритиегидриды - возможное горючее для ядерных реакторов. См. также Лития гидрид.
Гидрид Mg по св-вам и природе хим. связи занимает промежут. положение между ковалентными и ионными гидридами; кристаллы с решеткой типа ТiO2; при высоких давлениях ( ~ 7 МПа) претерпевает полиморфные превращения. С водой и водными р-рами к-т и щелочей MgH2 взаимод. с выделением Н2, однако менее энергично, чем гидриды щелочных и др. щел.-зем. металлов. М. б. получен взаимод. Mg с Н2 при 200-250 °С и давлении 10 МПа (скорость р-ции мала) либо обменной р-цией MgHal2 с МН или М [А1Н4], где М—Li, Na, в среде орг. р-рителя. Легко образуется при гидрировании сплавов Mg, содержащих небольшие добавки РЗЭ и переходных металлов, при 150-180°С и 1-5 МПа, причем р-ция обратима. В связи с этим такие сплавы-перспективные хим. аккумуляторы Н2 для нужд малой энергетики, металлургии и хим. технологии.
К металлоподобным относят гидриды переходных металлов и РЗЭ. Формально такие соед. могут рассматриваться как фазы внедрения водорода в металл. Их образованию всегда предшествует адсорбция Н2 на пов-сти металла.
Адсорбированная молекула диссоциирует на атомы Н, в результате диффузии к-рых в кристаллич. решетку происходит образование т.н. 2 в , как правило, стехиометрич. состава (МН3 для металлов III гр., МН2 для IV гр. и ванадия). Взаимод. Н2 с указанными металлами (кроме Pd) всегда сопровождается перестройкой кристаллич. решетки. Для описания природы хим. связи водорода с металлич. матрицей используют представление о типе связи, промежуточном между ионной и металлической; электроны водорода в большей или меньшей степени участвуют в формировании зоны проводимости гидридов. По-видимому, вклад ионной составляющей связи М + —Н - Наиб. велик для EuH2, YbH2 и тригидридов лантаноидов и минимален для PdH0,6, а также для гидридов Mn, Fe, Co, Ni, существующих при высоких давлениях Н2 и содержащих менее одного атома Н на атом металла.
Металлоподобные гидриды (см. табл. 2)-светло- и темно-серые кристаллы с металлич. блеском, устойчивые на воздухе при комнатной т-ре. С О2, водой и водяным паром реагируют медленно. М.б. получены взаимод. металла с Н2 при обычной т-ре или при нагр.; напр., TiH2 и LaH3 синтезируют при 150-200 °С. Получение гидридов стехиометрич. состава в большинстве случаев сопряжено со значит. трудностями из-за высокой чувствительности гидрироваиия к наличию примесей в металле и особенно О2 и водяных паров в Н2. Металлоподобные гидриды ограниченно применяют в кач-ве источников Н2 высокой чистоты (используемых, напр., в топливных элементах) и для поглощения Н2 из газовых смесей. Гидриды Pd-катализаторы гидрирования, изомеризации, орто- и парапревращения Н2.
Табл. 2.-СВОЙСТВА МЕТАЛЛОПОДОБНЫХ ГИДРИДОВ
Гидриды интерметаллических соединений. Содержат обычно атомы РЗЭ, Mg, Ca, Ti, Al, Fe, Co, Ni, Си. Легко образуются при взаимод. интерметаллидов даже с техн. Н2 (содержащим до 1-2% примесей О2 и водяного пара) при 25-200°С и давлениях Н2 0,1-1 МПа; скорость поглощения Н2 очень велика. Р-ции характеризуются малыми тепловыми эффектами (20-30 кДж на 1 моль Н2, для индивидуальных металлов-100-120 кДж) и не приводят к значит. изменениям в структуре исходной металлич. матрицы; в большинстве случаев происходит лишь увеличение ее объема на 10-30%. Для гидридов этого типа характерна высокая подвижность водорода и большая хим. активность (о св-вах см. также табл. 3).
Данная р-ция характерна для соед., образованных РЗЭ и Mg, а также РЗЭ и Fe, Ni или Со. Так, гидрид РЗЭ, образующийся при гидрогенолизе интерметаллида, содержащего Mg, катализирует как гидрирование Mg, так и дегидрирование MgH2 при 150-180°С: МН2 + nMg + (n + 0,5) Н2 МН3 + nMgH2
Благодаря высокому содержанию Н2, возможности значит. смещения равновесия в ту или др. сторону посредством небольших изменений т-ры и давления Н2, способности поглощать Н2 при низких т-рах и устойчивости к действию О2 и влаги воздуха, гидриды интерметаллич. соединений м.б. использованы как хим. аккумуляторы слабосвязанного водорода. Перспективно их применение как источников топлива для автономных энергосистем, напр. автомобильного транспорта (см. Водородная энергетика), а также для получения высокодисперсных металлич. порошков и катализаторов гетерог. гидрирования.

Табл. 3.-СВОЙСТВА ГИДРИДОВ ИНТЕРМЕТАЛЛИЧЕСКИХ СОЕДИНЕНИЙ
===
Исп. литература для статьи «ГИДРИДЫ» : Гидриды металлов, пер. с англ., М., 1973; Девятых ГГ., Зорин А. Д., Летучие неорганические гидриды особой чистоты, М., 1974; Антонова А. М., Морозова Р. А., Препаративная химия гидридов. К., 1976; Водород в металлах, пер. с англ., т. 2, М., 1981. К.Н. Семененко.
Щелочные металлы
К щелочным металлам относят химические элементы: одновалентные металлы, составляющие Ia группу: литий, натрий, калий, рубидий, цезий и франций.
Эти металлы очень активны, быстро окисляются на воздухе и бурно реагируют с водой. Их хранят под слоем керосина из-за их сильной реакционной способности.

Общая характеристика
От Li к Fr (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств, реакционной способности. Уменьшается электроотрицательность, энергия ионизации, сродство к электрону.

- Li - 2s 1
- Na - 3s 1
- K - 4s 1
- Rb - 5s 1
- Cs - 6s 1
- Fr - 7s 1
Природные соединения
- NaCl - галит (каменная соль)
- KCl - сильвин
- NaCl*KCl - сильвинит

Получение
Получить такие активные металлы электролизом водного раствора - невозможно. Для их получения применяют электролиз расплавов при высоких температурах (естественно - безводных):
NaCl → Na + Cl2↑ (электролиз расплава каменной соли)
Химические свойства
Одной из особенностей щелочных металлов является их реакция с кислородом. Литий в такой реакции преимущественно образует оксид, натрий - пероксид, калий, рубидий и цезий - супероксиды.
K + O2 → KO2 (супероксид калия)
Помните, что металлы никогда не принимают отрицательных степеней окисления. Щелочные металлы одновалентны, и проявляют постоянную степень окисления +1 в различных соединениях: гидриды, галогениды (фториды, хлориды, бромиды и йодиды), нитриды, сульфиды и т.д.
Li + H2 → LiH (в гидридах водород -1)
Na + F2 → NaF (в фторидах фтор -1)
Na + S → Na2S (в сульфидах сера -2)
K + N2 → K3N (в нитридах азот -3)
Щелочные металлы бурно взаимодействуют с водой, при этом часто происходит воспламенение, а иногда - взрыв.
Na + H2O → NaOH + H2↑ (воду можно представить в виде HOH - натрий вытесняет водород)
Иногда в задачах может проскользнуть фраза такого плана: ". в ходе реакции выделился металл, окрашивающий пламя горелки в желтый цвет". Тут вы сразу должны догадаться: речь, скорее всего, про натрий.
Щелочные металлы по-разному окрашивают пламя. Литий окрашивает в алый цвет, натрий - в желтый, калий - в фиолетовый, рубидий - синевато-красный, цезий - синий.

Оксиды щелочных металлов
Имеют общую формулу R2O, например: Na2O, K2O.
Получение оксидов щелочных металлов возможно в ходе реакции с кислородом. Для лития все совсем несложно:
В подобных реакциях у натрия и калия получается соответственно пероксид и супероксид, что приводит к затруднениям. Как из пероксида, так и из супероксида, при желании можно получить оксид:
По свойствам эти оксиды являются основными. Они хорошо реагируют c водой, кислотными оксидами и кислотами:
Li2O + H2O → LiOH (осн. оксид + вода = основание - реакция идет, только если основание растворимо)
Na2O + SO2 → Na2SO3 (обратите внимание - мы сохраняем СО серы +4)
Гидроксиды щелочных металлов
Относятся к щелочам - растворимым основаниям. Наиболее известные представители: NaOH - едкий натр, KOH - едкое кали.
Гидроксиды щелочных металлов получаются в ходе электролиза водных растворов их солей, в реакциях обмена, в реакции щелочных металлов и их оксидов с водой:
KCl + H2O → (электролиз!) KOH + H2 + Cl2 (на катоде выделяется водород, на аноде - хлор)

Проявляют основные свойства. Хорошо реагируют с кислотами, кислотными оксидами и солями, если в ходе реакции выпадает осадок, выделяется газ или образуется слабый электролит (вода).
LiOH + H2SO4 → LiHSO4 + H2O (соотношение 1:1, кислота в избытке - получается кислая соль)
2LiOH + H2SO4 → Li2SO4 + 2H2O (соотношение 2:1, основание в избытке - получается средняя соль)
KOH + SO2 → KHSO3 (соотношение 1:1 - получается кислая соль)
2KOH + SO2 → K2SO3 + H2O (соотношение 2:1 - получается средняя соль)
С амфотерными гидроксидами реакции протекают с образованием комплексных солей (в водном растворе) или с образованием окиселов - смешанных оксидов (при высоких температурах - прокаливании).
NaOH + Al(OH)3 → Na[Al(OH)4] (в водном растворе образуются комплексные соли)
NaOH + Al(OH)3 → NaAlO2 + H2O (при прокаливании образуется окисел - смесь двух оксидов: Al2O3 и Na2O, вода испаряется)
Реакции щелочей с галогенами заслуживают особого внимания. Без нагревания они идут по одной схеме, а при нагревании эта схема меняется:
NaOH + Cl2 → NaClO + NaCl + H2O (без нагревания хлор переходит в СО +1 и -1)
NaOH + Cl2 → NaClO3 + NaCl + H2O (с нагреванием хлор переходит в СО +5 и -1)
В реакциях щелочей с йодом образуется исключительно иодат, так как гипоиодит неустойчив даже при комнатной температуре, не говоря о нагревании. С серой реакция протекает схожим образом:
NaOH + I2 → NaIO3 + NaI + H2O (с нагреванием)

NaOH + S → Na2S + Na2SO3 + H2O (сера переходит в СО -2 и +4)
Уникальным является также взаимодействие щелочей с кислотным оксидом NO2, который соответствует сразу двум кислотам - и азотной, и азотистой.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Щелочные металлы. Химия щелочных металлов и их соединений

Щелочные металлы расположены в главной подгруппе первой группы периодической системы химических элементов Д.И. Менделеева (или просто в 1 группе в длиннопериодной форме ПСХЭ). Это литий Li, натрий Na, калий K, цезий Cs, рубидий Rb и франций Fr.
Электронное строение щелочных металлов и основные свойства
Электронная конфигурация внешнего энергетического уровня щелочных металлов: ns 1 , на внешнем энергетическом уровне находится 1 s-электрон. Следовательно, типичная степень окисления щелочных металлов в соединениях +1.
Рассмотрим некоторые закономерности изменения свойств щелочных металлов.
В ряду Li-Na-K-Rb-Cs-Fr, в соответствии с Периодическим законом, увеличивается атомный радиус , усиливаются металлические свойства , ослабевают неметаллические свойства , уменьшается электроотрица-тельность .

Физические свойства
Все щелочные металлы — вещества мягкие, серебристого цвета. Свежесрезанная поверхность их обладает характерным блеском.

Кристаллическая решетка щелочных металлов в твёрдом состоянии — металлическая. Следовательно, щелочные металлы обладают высокой тепло- и электропроводимостью. Кипят и плавятся при низких температурах. Они имеют также небольшую плотность.

Нахождение в природе
Как правило, щелочные металлы в природе присутствуют в виде минеральных солей: хлоридов, бромидов, йодидов, карбонатов, нитратов и др. Основные минералы , в которых присутствуют щелочные металлы:
Поваренная соль, каменная соль, галит — NaCl — хлорид натрия

Сильвин KCl — хлорид калия

Сильвинит NaCl · KCl

Глауберова соль Na2SO4⋅10Н2О – декагидрат сульфата натрия

Едкое кали KOH — гидроксид калия
Поташ K2CO3 – карбонат калия
Поллуцит — алюмосиликат сложного состава с высоким содержанием цезия:

Способы получения
Литий получают в промышленности электролизом расплава хлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси):
2LiCl = 2Li + Cl2
Натрий получают электролизом расплава хлорида натрия с добавками хлорида кальция:
2NaCl (расплав) → 2Na + Cl2
Электролитом обычно служит смесь NaCl с NaF и КСl (что позволяет проводить процесс при 610–650°С).
Калий получают также электролизом расплавов солей или расплава гидроксида калия. Также распространены методы термохимического восстановления: восстановление калия из расплавов хлоридов или гидроксидов. В качестве восстановителей используют пары натрия, карбид кальция, алюминий, кремний:
KCl + Na = K↑ + NaCl
KOH + Na = K↑ + NaOH
Цезий можно получить нагреванием смеси хлорида цезия и специально подготовленного кальция:
Са + 2CsCl → 2Cs + CaCl2
В промышленности используют преимущественно физико-химические методы выделения чистого цезия: многократную ректификацию в вакууме.
Качественные реакции
Качественная реакция на щелочные металлы — окрашивание пламени солями щелочных металлов .

Цвет пламени:
Li — карминно-красный
Na — жѐлтый
K — фиолетовый
Rb — буро-красный
Cs — фиолетово-красный
Химические свойства
1. Щелочные металлы — сильные восстановители . Поэтому они реагируют почти со всеми неметаллами .
1.1. Щелочные металлы легко реагируют с галогенами с образованием галогенидов:
2K + I2 = 2KI
1.2. Щелочные металлы реагируют с серой с образованием сульфидов:
2Na + S = Na2S
1.3. Щелочные металлы активно реагируют с фосфором и водородом (очень активно). При этом образуются бинарные соединения — фосфиды и гидриды:
3K + P = K3P
2Na + H2 = 2NaH
1.4. С азотом литий реагирует при комнатной температуре с образованием нитрида:
Остальные щелочные металлы реагируют с азотом при нагревании.
1.5. Щелочные металлы реагируют с углеродом с образованием карбидов, преимущественно ацетиленидов:
1.6. При взаимодействии с кислородом каждый щелочной металл проявляет свою индивидуальность: при горении на воздухе литий образует оксид, натрий – преимущественно пероксид, калий и остальные металлы – надпероксид.
Цезий самовозгорается на воздухе, поэтому его хранят в запаянных ампулах. Видеоопыт самовозгорания цезия на воздухе можно посмотреть здесь.
2. Щелочные металлы активно взаимодействуют со сложными веществами:
2.1. Щелочные металлы бурно (со взрывом) реагируют с водой . Взаимодействие щелочных металлов с водой приводит к образованию щелочи и водорода. Литий реагирует бурно, но без взрыва.
Например , калий реагирует с водой очень бурно:
2K 0 + H2 + O = 2 K + OH + H2 0

Видеоопыт: взаимодействие щелочных металлов с водой можно посмотреть здесь.
2.2. Щелочные металлы взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой) со взрывом. При этом образуются соль и водород.
Например , натрий бурно реагирует с соляной кислотой :
2Na + 2HCl = 2NaCl + H2↑
2.3. При взаимодействии щелочных металлов с концентрированной серной кислотой выделяется сероводород.
Например , при взаимодействии натрия с концентрированной серной кислотой образуется сульфат натрия, сероводород и вода:
2.4. Щелочные металлы реагируют с азотной кислотой. При взаимодействии с концентрированной азотной кислотой образуется оксид азота (I):
С разбавленной азотной кислотой образуется молекулярный азот:
При взаимодействии щелочных металлов с очень разбавленной азотной кислотой образуется нитрат аммония:
2.5. Щелочные металлы могут реагировать даже с веществами, которые проявляют очень слабые кислотные свойства . Например, с аммиаком, ацетиленом (и прочими терминальными алкинами), спиртами , фенолом и органическими кислотами .
Например , при взаимодействии лития с аммиаком образуются амиды и водород:
Ацетилен с натрием образует ацетиленид натрия и также водород:
Н ─ C ≡ С ─ Н + 2Na → Na ─ C≡C ─ Na + H2
Фенол с натрием реагирует с образованием фенолята натрия и водорода:
Метанол с натрием образуют метилат натрия и водород:
Уксусная кислота с литием образует ацетат лития и водород:
2СH3COOH + 2Li → 2CH3COOLi + H2↑
Щелочные металлы реагируют с галогеналканами (реакция Вюрца).
Например , хлорметан с натрием образует этан и хлорид натрия:
2.6. В расплаве щелочные металлы могут взаимодействовать с некоторыми солями . Обратите внимание! В растворе щелочные металлы будут взаимодействовать с водой, а не с солями других металлов.
Например , натрий взаимодействует в расплаве с хлоридом алюминия :
3Na + AlCl3 → 3NaCl + Al
Оксиды щелочных металлов
Оксиды щелочных металлов (кроме лития) можно получить только к освенными методами : взаимодействием натрия с окислителями в расплаве:
1. О ксид натрия можно получить взаимодействием натрия с нитратом натрия в расплаве:
2. Взаимодействием натрия с пероксидом натрия :
3. Взаимодействием натрия с расплавом щелочи :
2Na + 2NaOН → 2Na2O + Н2↑
4. Оксид лития можно получить разложением гидроксида лития :
2LiOН → Li2O + Н2O
Химические свойства
Оксиды щелочных металлов — типичные основные оксиды . Вступают в реакции с кислотными и амфотерными оксидами, кислотами, водой.
1. Оксиды щелочных металлов взаимодействуют с кислотными и амфотерными оксидами :
Например , оксид натрия взаимодействует с оксидом фосфора (V):
Оксид натрия взаимодействует с амфотерным оксидом алюминия:
2. Оксиды щелочных металлов взаимодействуют с кислотами с образованием средних и кислых солей (с многоосновными кислотами).
Например , оксид калия взаимодействует с соляной кислотой с образованием хлорида калия и воды:
K2O + 2HCl → 2KCl + H2O
3. Оксиды щелочных металлов активно взаимодействуют с водой с образованием щелочей.
Например , оксид лития взаимодействует с водой с образованием гидроксида лития:
Li2O + H2O → 2LiOH
4. Оксиды щелочных металлов окисляются кислородом (кроме оксида лития): оксид натрия — до пероксида, оксиды калия, рубидия и цезия – до надпероксида.
Пероксиды щелочных металлов
Свойства пероксидов очень похожи на свойства оксидов. Однако пероксиды щелочных металлов, в отличие от оксидов, содержат атомы кислорода со степенью окисления -1. Поэтому они могут могут проявлять как окислительные , так и восстановительные свойства.
1. Пероксиды щелочных металлов взаимодействуют с водой . При этом на холоде протекает обменная реакция, образуются щелочь и пероксид водорода:
При нагревании пероксиды диспропорционируют в воде, образуются щелочь и кислород:
2. Пероксиды диспропорционируют при взаимодействии с кислотными оксидами .
Например , пероксид натрия реагирует с углекислым газом с образованием карбоната натрия и кислорода:
3. При взаимодействии с минеральными кислотами на холоде пероксиды вступают в обменную реакцию. При этом образуются соль и перекись водорода:
При нагревании пероксиды, опять-таки, диспропорционируют:
4. Пероксиды щелочных металлов разлагаются при нагревании, с образованием оксида и кислорода:
5. При взаимодействии с восстановителями пероксиды проявляют окислительные свойства.
Например , пероксид натрия с угарным газом реагирует с образованием карбоната натрия:
Пероксид натрия с сернистым газом также вступает в ОВР с образованием сульфата натрия:
6. При взаимодействии с сильными окислителями пероксиды проявляют свойства восстановителей и окисляются, как правило, до молекулярного кислорода.
Например , при взаимодействии с подкисленным раствором перманганата калия пероксид натрия образует соль и молекулярный кислород:
Гидроксиды щелочных металлов (щелочи)
1. Щелочи получают электролизом растворов хлоридов щелочных метал-лов:
2NaCl + 2H2O → 2NaOH + H2 + Cl2
2. При взаимодействии щелочных металлов, их оксидов, пероксидов, гидридов и некоторых других бинарных соединений с водой также образуются щелочи.
Например , натрий, оксид натрия, гидрид натрия и пероксид натрия при растворении в воде образуют щелочи:
2Na + 2H2O → 2NaOH + H2
Na2O + H2O → 2NaOH
2NaH + 2H2O → 2NaOH + H2
3. Некоторые соли щелочных металлов (карбонаты, сульфаты и др.) при взаимодействии с гидроксидами кальция и бария также образуют щелочи.
Например , карбонат калия с гидроксидом кальция образует карбонат кальция и гидроксид калия:
1. Гидроксиды щелочных металлов реагируют со всеми кислотами (и сильными, и слабыми, и растворимыми, и нерастворимыми). При этом образуются средние или кислые соли, в зависимости от соотношения реагентов.
Например , гидроксид калия с фосфорной кислотой реагирует с образованием фосфатов, гидрофосфатов или дигидрофосфатов:
2. Гидроксиды щелочных металлов реагируют с кислотными оксидами . При этом образуются средние или кислые соли, в зависимости от соотношения реагентов.
Например , гидроксид натрия с углекислым газом реагирует с образованием карбонатов или гидрокарбонатов:
Необычно ведет себя оксид азота (IV) при взаимодействии с щелочами. Дело в том, что этому оксиду соответствуют две кислоты — азотная (HNO3) и азотистая (HNO2). «Своей» одной кислоты у него нет. Поэтому при взаимодействии оксида азота (IV) с щелочами образуются две соли- нитрит и нитрат:
А вот в присутствии окислителя, например, молекулярного кислорода, образуется только одна соль — нитрат, т.к. азот +4 только повышает степень окисления:
3. Гидроксиды щелочных металлов реагируют с амфотерными оксидами и гидроксидами . При этом в расплаве образуются средние соли, а в растворе комплексные соли.
Например , гидроксид натрия с оксидом алюминия реагирует в расплаве с образованием алюминатов:
в растворе образуется комплексная соль — тетрагидроксоалюминат:
Еще пример : гидроксид натрия с гидроксидом алюминия в расплаве образут также комплексную соль:
4. Щелочи также взаимодействуют с кислыми солями. При этом образуются средние соли, или менее кислые соли.
Например : гидроксид калия реагирует с гидрокарбонатом калия с образованием карбоната калия:
5. Щелочи взаимодействуют с простыми веществами-неметаллами (кроме инертных газов, азота, кислорода, водорода и углерода).
При этом кремний окисляется щелочами до силиката и водорода:
Фтор окисляет щелочи. При этом выделяется молекулярный кислород:
Другие галогены, сера и фосфор — диспропорционируют в щелочах:
Сера взаимодействует с щелочами только при нагревании:
6. Щелочи взаимодействуют с амфотерными металлами , кроме железа и хрома . При этом в расплаве образуются соль и водород:
В растворе образуются комплексная соль и водород:
2NaOH + 2Al + 6Н2О = 2Na[Al(OH)4] + 3Н2
7. Гидроксиды щелочных металлов вступают в обменные реакции с растворимыми солями .
С щелочами взаимодействуют соли тяжелых металлов.
Например , хлорид меди (II) реагирует с гидроксидом натрия с образованием хлорида натрия и осадка гидроксида меди (II):
2NaOH + CuCl2 = Cu(OH)2↓+ 2NaCl
Также с щелочами взаимодействуют соли аммония.
Например , при взаимодействии хлорида аммония и гидроксида натрия образуются хлорид натрия, аммиак и вода:
NH4Cl + NaOH = NH3 + H2O + NaCl
8. Гидроксиды всех щелочных металлов плавятся без разложения , гидроксид лития разлагается при нагревании до температуры 600°С:
2LiOH → Li2O + H2O
9. Все гидроксиды щелочных металлов проявляют свойства сильных оснований . В воде практически нацело диссоциируют , образуя щелочную среду и меняя окраску индикаторов.
NaOH ↔ Na + + OH —
10. Гидроксиды щелочных металлов в расплаве подвергаются электролизу . При этом на катоде восстанавливаются сами металлы, а на аноде выделяется молекулярный кислород:
4NaOH → 4Na + O2 + 2H2O
Соли щелочных металлов
Нитраты и нитриты щелочных металлов
Нитраты щелочных металлов при нагревании разлагаются на нитриты и кислород. Исключение — нитрат лития. Он разлагается на оксид лития, оксид азота (IV) и кислород.
Например , нитрат натрия разлагается при нагревании на нитрит натрия и молекулярный кислород:
Нитраты щелочных металлов в реакциях могут выступать в качестве окислителей.
Нитриты щелочных металлов могут быть окислителями или восстановителями.
В щелочной среде нитраты и нитриты — очень мощные окислители.
Например , нитрат натрия с цинком в щелочной среде восстанавливается до аммиака:
Сильные окислители окисляют нитриты до нитратов.
Например , перманганат калия в кислой среде окисляет нитрит натрия до нитрата натрия:
Гидриды - свойства, формулы и применение водородных соединений
Соединения водорода с другими элементами, в которых он выступает как более электроотрицательный элемент, называют гидридами. Но часто так именуют любые химические вещества, образованные водородом с другими элементами. Водород — элемент не из редких, вещества, образованные его взаимодействием с другими элементами, в природе встречаются часто. Человек имеет с ними дело постоянно. Самый знакомый — Н2О, вода, или гидрид кислорода.
Типы и классификация
Вещества, созданные водородом с металлами и неметаллами многобразны. В зависимости от характера полученного соединения, выделяют:
- Простые гидриды — бинарные, в них только 2 элемента, они встречаются чаще всего.
- Со многими переходными металлами (элементы р-подгруппы) водород образует ко́мплексные соединения. Ко́мплексные гидриды металлов (к примеру, боро- или алюмогидриды) вместо атома водорода, имеют алюмогруппу (AlH4) или борогруппу (BH4). Из них натрийборогидрид Na (BH4) и литийалюмогидрид Li (AlH4), будучи сильными восстановителями, нашли применение в лабораторной практике. Кроме этого, Na (BH4) используют для отбеливания бумаги.
- И также есть гидриды интерметаллидов (пример: TiAl или Ti3Al, алюминид титана), в кристаллических решётках которых водород просто растворяется, аккумулируется.
У разных химических элементов строение атомов и молекул отличается. Соответственно, связи в образованных гидридах тоже неодинаковы. Классификация по виду связи определяет полученные вещества, как:
- металлоподобные;
- ионные (солеобразные);
- ковалентные.
Бинарные соединения самые распространённые, есть у всех элементов. Исключения здесь металлы платиновой группы (платиноиды), Au, Ag, Hg, Ti, Cd, In, а также благородные газы. Между этими веществами нет чётко выраженных границ, деление по характеру связи для них немного условно.
Металлические гидриды
К металлическим принадлежат соединения водорода с переходными металлами и редкоземельными элементами. Это, скорее, раствор неметалла в металле, с внедрением атомов в кристаллическую решётку. Характерно для них следующее:

- В основном такие гидриды являются бертоллидами, состав их зависит от способа получения, непостоянен, законам постоянных и кратных отношений не подчиняется.
- В формулах для них указывают предельное содержание водорода.
- В отличие от прочих, они сохраняют исходную металлическую решётку.
- Их вид и физические свойства соответствуют металлам, с которыми они образованы.
- Имеют характе́рный металлический блеск, взаимодействуют с H2O (в жидком или газообразном состоянии), кислородом, при нормальных условиях, но медленно.
- Как и металлы, обладают значительной теплопроводностью и проводимостью.
- При нагревании распадаются на водород и исходный металл.
Образуются в процессе адсорбции водорода на металлической поверхности, диссоциации H2 и диффузного проникновения атомов в металлическую решётку. Поглощение обратимо, но химические связи весьма крепкие.
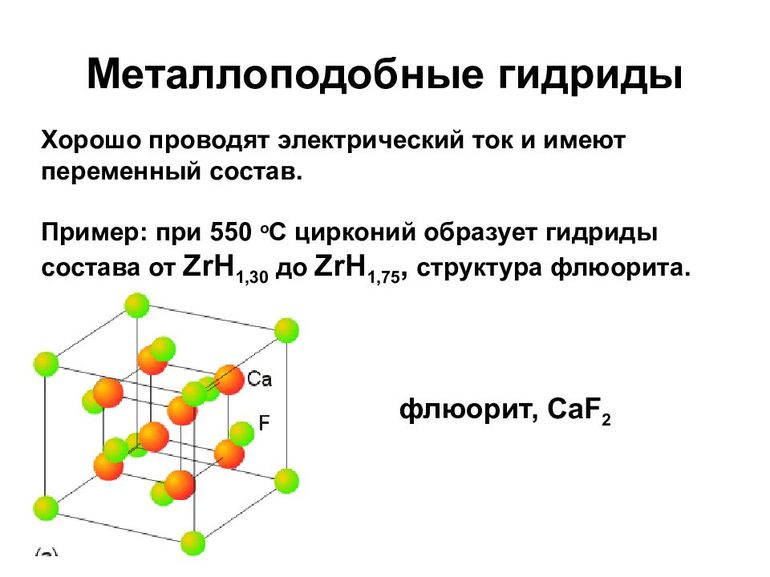
От металлоподобных, через гидриды меди (CuH, водородистая медь), цинка, ZnH2, водородистый цинк и им подобных, осуществляется переход к полимерам.
Это химические вещества со сложной структурой, в которой присутствуют цепи и полиэдры. Твёрдые, устойчивые, с кристаллическим строением (полимерные гидриды лёгких металлов стабильнее всего), данные соединения распадаются при нагреве на составляющие элементы.
От них, через гидриды бора и галлия — к водородным соединениям с неметаллами. В них водород имеет степень окисления +1.
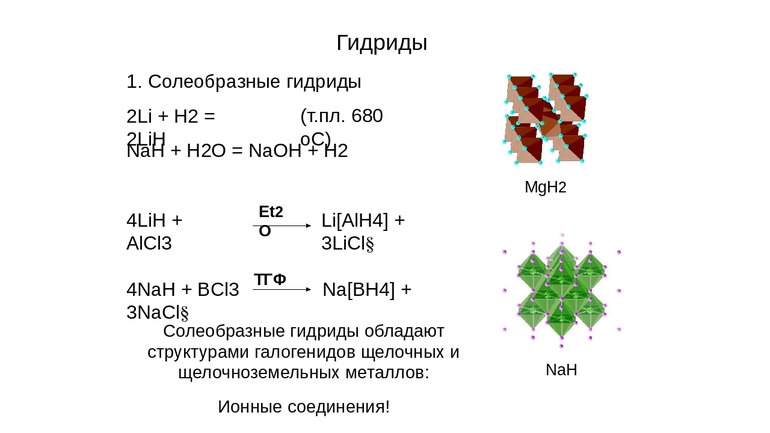
Соединения с ионным типом связи
Их образует водород с металлами 1А и 2А групп, кроме Mg, а также с Al. Они отчасти показывают свойства соответствующих галогенидов, откуда и появилось второе наименование — солеобразные.
Это химические соединения, такие как гидрид натрия (NaH), кальция (CaH2), лития, с формулой LiH, другие. Для них характерно:
- Получают при высокой температуре и под давлением.
- В этих соединениях, проявляющих, как правило, щелочные свойства, у водорода степень окисления -1. С металлами 1А и 2А групп, такими, как Na, Li, Be, K, Rb, Sr он выступает окислителем, подобно галогенам. Например, гидрид натрия, с химической формулой NaH — в этом соединении ион водорода имеет отрицательный заряд.
- Это кристаллические вещества белого цвета, с ионной решёткой, структура подобна строению соответствующего галогенида.
- При нормальных условиях устойчивы.
- Распад на металл и водород при нагреве, минуя этап плавления (исключением является LiH, его температура плавления 688 градусов Цельсия).
- В расплаве — хорошие проводники, при этом на аноде будет выделяться H2.
- Вспыхивают при растирании на воздухе.
- Все являются сильными восстановителями. Применяются для получения чистых металлов из солей и оксидов, для удаления окалины, коррозии.
- Реагируют с оксидом углерода, формируют соли муравьиной кислоты (формиаты).
- Как и соли, могут участвовать в обменных реакциях, гидролизе.
Солеобразными бывают не только бинарные (простые) соединения водорода. Дигидриды, образуемые добавлением групп бора (BH4) или алюминия (AlH4) к металлу, также имеют ионный тип связи.
Окислительная активность водорода небольшая по сравнению с галогенами. Дополнительный электрон он отдаёт с трудом, при нагреве (реакция проходит с поглощением тепла). Это и обусловливает различие между свойствами ионных гидридов и галогенидов.
По химической природе такие соединения ведут себя как основные. Ионные гидриды обладают высокой химической активностью. Они бурно реагируют с кислородом и H2O в парообразном состоянии.
Но выраженный ионный характер — свойство, проявляемое соединениями кальция, натрия, щелочных и щёлочноземельных элементов. На них проще всего и нагляднее можно показать химию взаимодействий этих веществ:
- С водой: 2NaH + H2O = 2NaOH + H2O.
- С кислородом: NaH + O2 = NaO + H2O.
- Реакция разложения: CaH2 = Ca + H2.
- С оксидами углерода: NaH + CO2 = NaCOOH.
- Кремния: 4NaH + 3SiO2 = 2Na2SiO3 + Si + 2H2.
- Металлов: 4NaH + Fe3O4 = 4NaOH + 3Fe.
- Восстановление: 2NaH + 2SO2 = Na2SO4 + H2S.
- С аммиаком: NaH + NH3 = NaNH2 + H2.
- С кислотами: 2NaH + H2SO4 = Na2SO4 + 2H2.
- Со спиртами: KH + HO-R = KOR + H2.
По свойствам и природе связи промежуточное положение между ионными и ковалентными занимает гидрид магния, с формулой MgH2.
Соли и оксиды калия, кальция, меди и других щелочных и щёлочноземельных металлов образуют с гидридом кислорода (водой) ещё один вид соединений — дигидраты. Это соли серной кислоты (сульфаты), галогениды, оксиды плюс 2 присоединённых молекулы H2O. Формула алебастра — Ca5O4 плюс 2H2O, гипс — CaSO4 плюс 2H2O, в природе они не редкость.
Гидросульфид натрия, NaHS, образует не только дигидрат, NaHS плюс 2H2O, но и тригидрат, с присоединением 3H2O.
Когда связь ковалентна
Это соединения, в которых степень окисления водорода +1, как правило, газы, летучие жидкости. Их водород даёт с неметаллами, а также с германием, алюминием, бериллием, оловом, мышьяком, сурьмой — элементами 4, 5, 6 и 7 групп периодической системы. И также ковалентную связь имеют соединения водорода и бора.
Это могут быть вещества простые, бинарные, такие как метан (CH4), силан (формула SiH4). Сложные тоже имеются, с длинными цепями, многоатомные молекулы — они образуются водородом с кремнием, бором, германием.
Многие из них неустойчивы, так гидрид олова (SnH4) распадается уже при комнатной температуре, а гидрид свинца недолго существует и при отрицательных температурах. Самый простой гидрид бора не существует в природных условиях вообще.
Отличительные свойства:

- Все сильные восстановители, степень окисления водорода +1.
- Проявляют кислотные, а также амфотерные свойства.
- Агрегатное состояние — газ или летучая жидкость, исключения тут гидрид кислорода (вода), азота, фтороводород (плавиковая кислота), те, в которых молекулы полярны и возникает водородная связь. Последние существуют, как нелетучая жидкость или в твёрдом состоянии.
- Электронодефицитные виды, получаемые с элементами главной подгруппы 3 группы, например, гидрид алюминия AlH3 или бериллия, химическая формула BeH2, очень активны и образуют многоатомные, длинные полимерные цепи, с больши́м весом. Такие полимеры — твёрдые вещества.
- При нагреве легко и практически необратимо, разлагаются на элемент и водород H2. Требуется температура от 100 до 300 градусов по Цельсию (для гидрида серы H2S — порядка 400 градусов).
- Чаще всего они имеют высокую токсичность.
- Характерна высокая химическая активность, реакционная способность.
- Получить можно непосредственным взаимодействием элементов, разложением металлических соединений водой, кислотой, восстановлением галогенидов гидридами бора, алюминия, щелочных металлов.
- Высшие гидриды германия, кремния, с общей химической формулой EnH2n+2 — это полимеры, их стабильность тем ниже, чем больше атомный вес и количество атомов элемента.
- Принадлежащие к s-подгруппе хорошо растворяются в воде и проявляют кислотные свойства. Прочие — в незначительной мере, свойства у них основные. Все хорошо растворимы в неполярных органических растворителях.
- При взаимодействии с водой (H2O), выделяется чистый водород (H2) и оксид, с общей химической формулой EO2.
Тяжёлые элементы дают соединения с небольшой устойчивостью.
За счёт водородных связей и способности к донорно-акцепторному взаимодействию, вода (H2O), плавиковая кислота (HF), аммиака (NH3), а частично HCl и H2S, хорошие растворители.
Интерметаллические соединения
Химические вещества, образованные двумя или более металлов, такие как FeTi, Ca2Ru, Mg2Ni — это интерметаллические соединения. Они хорошо поглощают водород и соединяясь с ним дают гидриды-интерметаллиды.
Содержат атомы железа, магния, меди, кальция, титана, алюминия, редкоземельные элементы. Их легко получить даже с H2 нехимическим (для технических нужд, до 2% примесей). Применяют для хранения водорода и аккумуляторных батарей.

У гидридов много областей применения. Особенно широко используют NaH. С его помощью удаляют термическую окалину с металлов, производят добавки, повышающие октановое число бензина, катализаторы полимеризации. Он необходим при производстве красителей, моющих средств, в качестве мощного восстановителя применяется в металлургии.
В органической химии комплексные водородные соединения применяют уже более 50 лет, для получения особо чистых химических элементов. В химии алкалоидов также широко используют комплексные гидриды металлов. Без них не обходится производство металлокерамики, дегазаторов, многих фармакологических средств.
Азот с водородом образует аммиак, кислород — воду, сера даёт сероводород, в природе постоянно идёт синтез подобных веществ. С миром химии человек пересекается постоянно. Поэтому знания о наиболее распространёных веществах принесут пользу каждому.
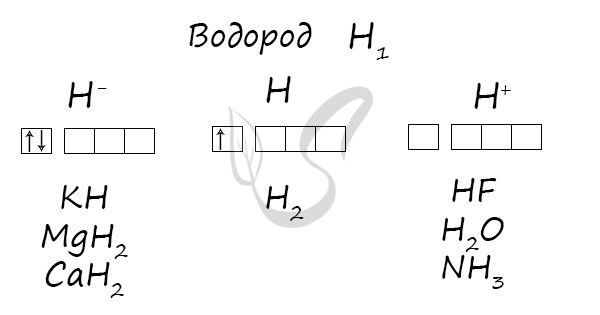
Водород
Водород (лат. hydrogenium = греч. ὕδωρ — вода + γεννάω — рождаю) - самый легкий химический элемент, при обычных условиях - газ без цвета, запаха и вкуса. В соединении с кислородом образует воду.
Водород - самый распространенный элемент Вселенной, входит в состав всего живого и небесных тел (73% массы Солнца).

Степени окисления
Проявляет степени окисления: -1, 0, +1.
- Конверсия с водяным паром при t = 1000 °C

- Вытеснением водорода из кислот
В реакциях водород проявляет себя как восстановитель и окислитель. Как восстановитель реагирует с элементами, электроотрицательность которых выше, чем у водорода:
H2 + F2 → HF (со взрывом в темноте)
H2 + Cl2 → (t) HCl (со взрывом только на свету)

Na + H2 → NaH (гидрид натрия)
- Реакция с металлами
Металлы, стоящие в ряду активности до водорода, вытесняют водород из воды.
Реагирует с основными оксидами - с образованием оснований (реакция идет, если основание растворимо), и с кислотными оксидами - с образованием соответствующих кислот. Не забывайте сохранять степени окисления!
Отмечу здесь реакцию двойного гидролиза, которая заключается в гидролизе одной соли по катиону (CrBr3), а другой - по аниону (Na2CO3).
Cl2 + H2O → HCl + HClO (соляная и хлорноватистая кислоты - без нагревания)
Cl2 + H2O → HCl + HClO3 (соляная и хлорноватая кислоты - при нагревании)

Кристаллогидраты
Кристаллогидраты - кристаллические соединения, содержащие молекулы воды как самостоятельные структурные единицы. Вода, входящая в состав кристаллогидратов, называется кристаллической. Примеры: CaSO4*2H2O, Na2SO4*10H2O.
При нагревании кристаллогидраты теряют воду. Одним из наиболее известных кристаллогидратов является медный купорос: CuSO4*5H2O. Медный купорос имеет характерный голубой цвет, а безводный сульфат меди - белый.

В задачах бывает дана масса медного купороса. Надо помнить о том, что часто в реакции не участвует кристаллическая вода. В таком случае следует вычесть кристаллизационную воду и найти массу безводного сульфата меди.

Пероксид водорода
Представляет собой бесцветную жидкость с металлическим вкусом. Концентрированные растворы пероксида водорода взрывоопасны.
Получают пероксид водорода в реакции с пероксидами и супероксидами металлов.
В разбавленных растворах пероксид водорода легко разлагается:
Также перекись проявляет окислительные свойства:
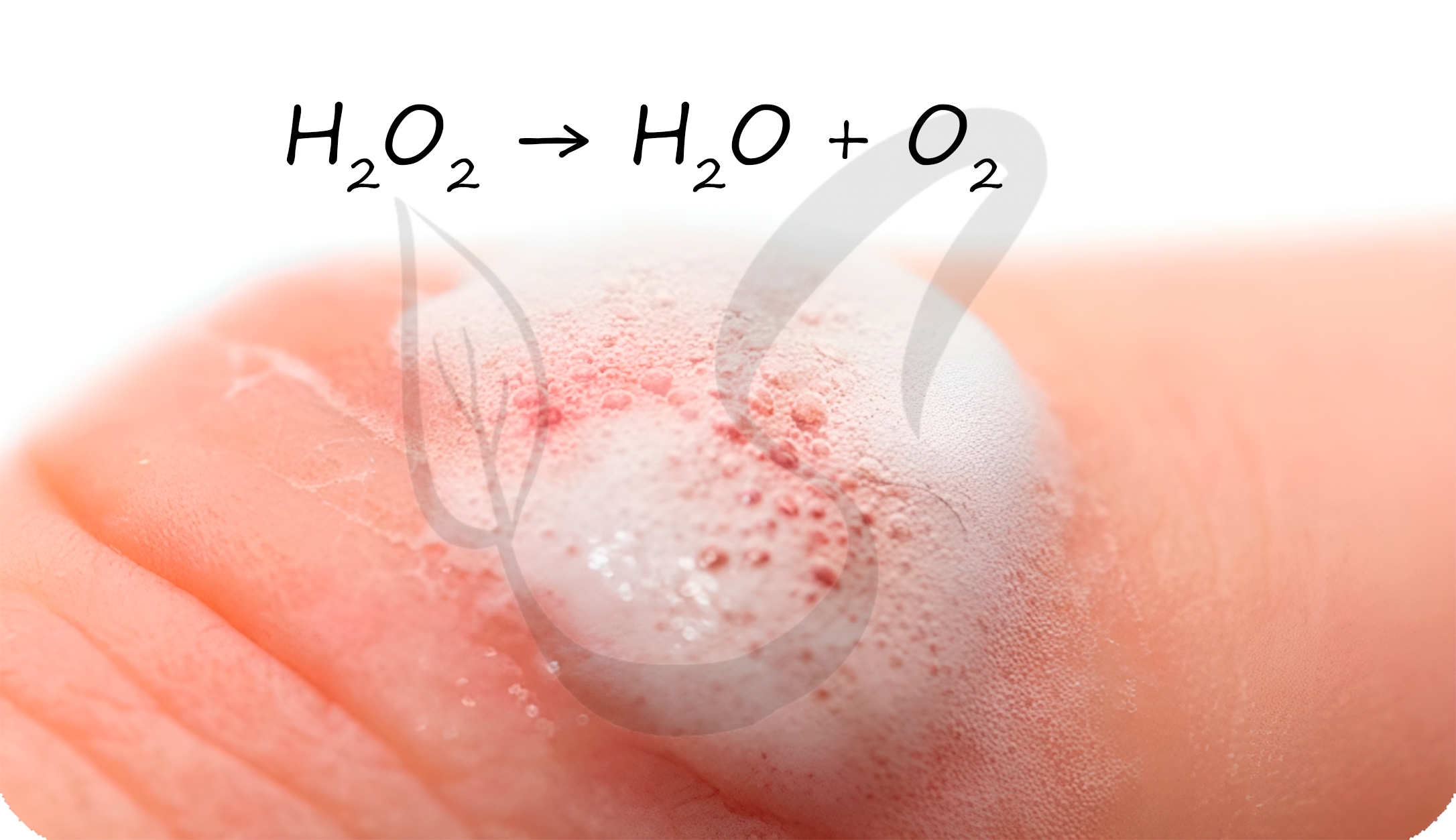
Перекисью водорода обрабатывают раневую поверхность. Выделяющийся при разложении атомарный кислород разрушает бактериальные клетки, предотвращая осложнение в виде бактериальной инфекции.
Читайте также:
