Галлий жидкий металл как ртуть который плавится в руке
Галлий – невероятный металл, который разбивается, как стекло, плавится в руке человека, атакует другие металлы, но не токсичен для людей и действует как инопланетная форма жизни при воздействии серной кислоты и раствора дихромата. Звучит слишком удивительно, чтобы быть правдой, но галлий – это абсолютно реальный химический элемент, который содержится в некоторых гаджетах, которые мы используем каждый день.
Но, что, пожалуй, еще интереснее, ученые проводят массу безумных экспериментов с галлием. Благодаря своим странным свойствам и поведению галлий может творить довольно странные вещи в лаборатории. На видео выше показано, что происходит, когда галлий «атакует» алюминий.
Популярный эксперимент с «бьющимся сердцем галлия» показывает, что галлий может действовать как живое существо, будучи погруженным в серную кислоту и раствор дихромата. Изменяя поверхностное натяжение галлия, ученые могут сделать металл похожим на органическое бьющееся сердце, что показано на видео выше.
Жидкая ложка из галлия – это забавная демонстрация, в которой хорошо используется температура плавления галлия 30 градусов по Цельсию. Ложка галлия перемешивает горячую воду и тут же тает в лужу на дне кружки, что вы можете наблюдать на видео ниже.


@Mircenall, тебя тут постов лишают)
Ну вот что за изверги такие видео делают. Включил первый видос и сразу подумал, что очередные нашуники погибли, а тут просто звук только на один канал идет
В первом видео такая реакция за какое время проходит? Непонятно. Может оно год стояло так.
Почему звук только слева?
Блин, круто звучит, как ругательство "дихромат калия")
Дык про галлий миллиард постов было. Автор, вот честно - чего конкретно нового про него вы внесли? Тип я понимаю это было бы более менее как статья. Пояснение с и физической точки зрения почему так происходит, а не то что все уже знают.
Вывод: галлий нельзя перевозить в алюминиевой лодке
А если скушать его?

Научное открытие

Всё ради получения прибыли


Общий объём всей воды и всей атмосферы нашей планеты

К последним новостям мира науки
Один из крупнейших научных издательских домов Elsevier начал отправлять рецензентам анкеты с вопросами о. гендерной и расовой принадлежности.
Делается это, по словам редакции «для поддержки инклюзивности науки». В частности, инклюзивность решили внезапно поддержать в таких журналах, как Chemical engineering journal и Journal of Alloys and Compounds (само собой, никоим образом не связанных с исследованиями гендерных и расовых вопросов)


Кроме того, забавно видеть от научного издательства постановку вопроса «Каким бы расовым термином вы бы себя определили?»
И далее идёт перечисление «рас»:
Азиаты или жители Океании
Черные
Испанцы или латиноамериканцы
Коренные народы (североамериканские индейцы, южноамериканские индейцы и т.п.)
Ближневосточные или североафриканские жители
Белые
Собственное описание
Толерантность, инклюзивность и всё такое — это, конечно, хорошо, однако расоведение (раздел антропологии, изучающий человеческие расы) выделяет всего четыре расы человека (европеоидная, монголоидная, негроидная, австралоидная) и десятки малых антропологических типов. В списке же намешаны расы, народы, языковые группы и даже возможность самоопределить себя в отдельную расу.
Извините, другой науки у нас для вас нет 🌚
Мечехвосты

Правда ли, что употребление соли вредно?

Один из самых популярных мифов о питании гласит, что соль — это белая смерть, она вредна для здоровья. Мы решили проверить, правда ли это.
(Специально для любителей расширения сознания — речь идет про поваренную соль, которая хлорид натрия)
(Самое важное для ЛЛ: утверждение, что соль вредна, абсолютно некорректно. При этом к проблемам со здоровьем может привести как ее дефицит, так и избыток в суточном рационе)
Информацию о том, насколько соль опасна для нашего организма, можно найти на сайтах медицинских учреждений, например больниц. Об этом пишут СМИ, даже специалисты ООН бьют тревогу. Рассуждения о том, стоит ли полностью отказываться от соли, можно найти на порталах о диетологии и здоровом образе жизни. Стереотип о том, что соль — это яд, настолько распространён, что его можно встретить даже в кино.
1. Дефицит соли
Соль на 97% состоит из хлорида натрия и служит одним из основных источников этих элементов для нашего организма. Натрий — электролит, который играет важную роль в поддержании водно-солевого баланса (логично), а также обеспечивает передачу нервных импульсов.
Сама по себе нехватка натрия в крови — уже достаточно серьёзное заболевание, гипонатриемия. Оно может привести к тяжёлым неврологическим и психическим нарушениям, судорогам, коме и даже смерти. Ещё одна опасность низкого содержания натрия в организме — обезвоживание, которое тоже может привести к тяжёлым последствиям для здоровья. И обезвоживание, и гипонатриемия особенно опасны для людей старшего возраста. Натрий выводится из нашего организма естественным образом с мочой и потом. Именно поэтому спортсмены после тяжёлых тренировок могут ощутить нехватку натрия, один из её симптомов — мышечные спазмы.
В 2016 году специалисты Кокрановской библиотеки изучили результаты различных исследований о взаимосвязи потребления соли, давления и холестерина и выяснили, что диета с пониженным содержанием соли способствует некоторому повышению холестерина и триглицеридов в крови. А это, в свою очередь, может привести к заболеваниям сердца. Кроме того, пищевую соль часто обогащают железом, йодом и фолиевой кислотой, поэтому её употребление может восполнить и нехватку этих веществ в организме.
Американская кардиологическая ассоциация рекомендует потреблять в день 1,5 г натрия — это примерно 3/4 чайных ложки соли. Однако, согласно проведенным ими исследованиям, средний американец съедает примерно полторы, превышая норму в два раза. То же самое обнаружили и диетологи Австралии.
2. Негативные последствия избытка соли
Многочисленные исследования врачей показали, что переедание соли способствует развитию гипертонии, что, в свою очередь, может привести к инфарктам и инсультам. В 2020 году учёные заявили, что увеличение ежедневного употребления натрия всего на 1 г приводит к повышению риска смерти от сердечно-сосудистых заболеваний на 6%. Кровяное давление влияет и на здоровье почек, поэтому сильно солёная пища может отрицательно сказаться и на них.
Впрочем, на этот счёт учёные пока не смогли прийти к единому мнению. Некоторые из них считают, что доказательств влияния потребления соли на кровяное давление недостаточно. В любом случае паниковать и полностью отказываться от соли не стоит: доказано, что употребление в пределах одной-двух чайных ложек точно не способствует повышению давления.
Кроме того, обзор 2014 года показал, что сокращение количества соли в рационе на 2 г способствует снижению систолического артериального давления всего на 3,82 мм ртутного столба. При средних значениях в 125–144 мм ртутного столба такое снижение представляется не особенно значимым.
Между делом учёные выяснили, что одни люди более чувствительны к соли, чем другие. Вероятно, именно им стоит более пристально следить за соблюдением нормы потребления натрия. Но зато и сокращение соли в рационе для них будет более эффективным, чем для тех, кто не так чувствителен. В группу риска, по мнению учёных, входят пожилые люди, гипертоники, афроамериканцы, люди с хроническими заболеваниями почек, те, у кого был низкий вес при рождении.
3. Соль и рак желудка
Некоторые исследования связывают диеты с повышенным содержанием соли с риском развития рака желудка. Так, одно из исследований, проведённых в Японии, с участием более чем 40 000 человек показало, что этот риск выше аж на 30% у тех, кто предпочитает сильно солёную пищу.
При этом учёные пока не пришли к единому мнению, как конкретно соль может вызвать рак. По одной из версий, она способствует размножению бактерий, провоцирующих язвенную болезнь, которая может перерасти в рак. По другой — диета с высоким содержанием соли может вызвать клеточные мутации, которые в конечном счёте и приводят к раку.
4. Остеопороз
Ещё одна опасность избыточного потребления соли — остеопороз. Организм выводит излишки натрия через мочу, а вместе с ней выводится и кальций. Соответственно, чем больше соли необходимо вывести организму, тем больше он вымоет и кальция, что может стать причиной костных нарушений.
5. Контроль количества потребляемой соли
Ограничивать соль в рационе действительно есть смысл, поскольку следить за ее количеством не так просто, особенно если вы употребляете готовые продукты, например соусы. Соль содержится практически во всех продуктах питания, но оценить её количество не всегда можно на глаз.
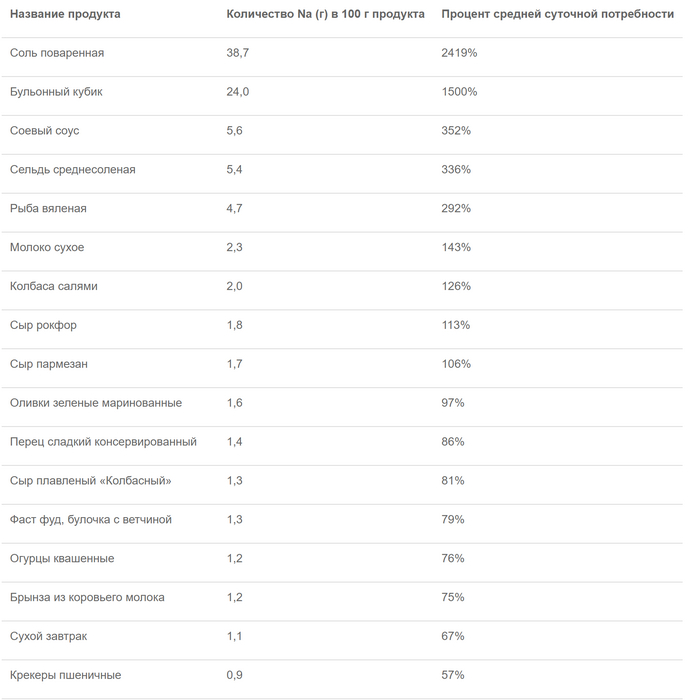
Роспотребнадзор приводит таблицу содержания соли в различных продуктах. По их данным, в 100 г среднесолёной сельди содержится 336% дневной нормы натрия, в 100 г пармезана — 106%, а в таком же количестве оливок — 97%. Таким образом, чтобы не превысить норму, вам не только нужно выбрать в день что-то одно, но и совсем не употреблять соль в других продуктах, что практически невозможно.
Таким образом, избыточное потребление соли может быть опасно для здоровья, хотя учёные до сих пор не смогли прийти к единому мнению на этот счёт. Тем не менее полностью отказываться от неё нельзя, поскольку она — источник натрия, который необходим организму для нормальной жизнедеятельности, а его нехватка может привести к печальным последствиям для здоровья.
Поэтому, как и со многими другими продуктами, с солью всё хорошо в меру, однако утверждать, что её употребление в любых количествах приближает смерть, — несправедливо.

Наш вердикт: полуправда (проверяемый факт или утверждение представляет собой смесь правды и лжи примерно в равных пропорциях)
Ещё нас можно читать в Телеграме, в Фейсбуке и в Вконтакте
В сообществах отсутствуют спам, реклама и пропаганда чего-либо (за исключением здравого смысла).
Аудиоверсии проверок в виде подкастов c «Коммерсантъ FM» доступны в Simplecast, «Яндекс.Подкасты», Apple Podcasts, «ЛитРес», Soundstream и Google.Подкасты.
12 физ. и хим. характеристик металла, что плавится в руках
Металл который плавится в руке: понятие легкоплавкости + характеристика галлия + разбор термодинамических свойств химического элемента + физические/химические свойства металла + его область применения.

Многие из нас видели в интернете фото металла, который плавится в руке. Единственный химический элемент в природе, который может безопасно для здоровья человека, провернуть подобный трюк – галлий.
В сегодняшней статье мы разберем отличительные свойства группы легкоплавких металлов + предоставим характеристику элемента, тающего в руках его владельца.
Понятие легкоплавких металлов/сплавов
Легкоплавкость – понятие растяжимое, особенно это актуально для промышленности. В химии легкоплавкими считаются элементы группы металлов + их сплавы, температура плавления которых ниже порога в 1000 градусов Цельсия.

Если температура плавления металла превышает 1 500 градусов Цельсия – его принято выделять в группу тугоплавких. Диаграмма выше четко дает понять, куда какой металл следует относить.
Обратите внимание: минимальная температура плавления у ртути — 39 градусов. Именно благодаря такому физическому свойству, мы можем наблюдать химический элемент в постоянно жидком состоянии.
Теперь пройдемся по легкоплавким сплавам. В своем большинстве – это сплавы эвтектического типа, пиковая температура плавления которых не превышает 232 градусов по Цельсию. В основе производства легкоплавких сплавов лежат легкоплавкие металлы – олово, висмут, таллий, галлий и другие.

Ученым удалось добиться -78 градусов в качестве минимальной температуры плавления для советского сплава, который состоит на 12% из натрия, 47% калия и 41% цезия. Недостаток сплава — реакция с водой. Ближайший конкурент – амальгама. Токсичный сплав из ртути с таллием, сохраняющий жидкое состояние до температуры -61 градус по Цельсию.
Область применения легкоплавких металлов/сплавов:
- энергетическая промышленность и машиностроение. Основное направление – создание тепловых носителей с жидкометаллического типа;
- литьевая промышленность;
- как основа для датчиков температуры, что актуально в системах пожарной безопасности;
- как основа для разработки термометров;
- как ремонтный материал в вакуумных технологиях;
- припои, предохранители и прочие мелочи в микроэлектронике;
- медицинское направление. То же протезирование;
- как металлическая смазка.
Низкая температура плавления является базовых свойством, которое требуется от легкоплавких металлов и сплавов. Вторичные параметры, которые берутся во внимание в различных областях использования – плотность, прочность на разрыв и инертность в химическом плане.
Галлий: металл, который плавится в руках
Поистине, занимательный химический элемент, который имеется в любом школьном кабинете химии. Благодаря демонстрационной наглядности, галлий считается лучшим вариантом донесения до умов учащихся тепловых свойств химических элементов.

Gallium (Ga) – металл, который плавится в руках при достижении температуры в 29.8 градуса по Цельсию . Учитывая стандартные 36.6 в организме человека, чтобы получить желаемый эффект, достаточно кусочек галлия положить на ладошку и наблюдать как тот медленно по ней растекается в разные стороны.
1) Общая информация по элементу
В периодической системе химических элементов галлий находится на 31 позиции. Его латинское обозначение – «Ga». Металл принадлежит к группе легких металлов, куда также входит алюминий, индий, олово, таллий, свинец и висмут.

Внешне, галлий представляет собой мягкий или хрупкий металл (в зависимости от температуры), имеющий белый + серебристый оттенки. Иногда можно заметить синеватые отблески на поверхности чистого вещества.

Великий Менделеев заранее знал о данном химическом элементе. Впервые он просчитал некоторые свойства галлия еще в 1871 году. Изначальное название, присвоенное химиком, звучало как «экаалюминий».
К предугаданным свойствам галлия Менделеевым относились:
- оксидный тип;
- варианты связи с хлором;
- медленная растворимость при соприкасании с щелочами/кислотами;
- галлий не будет реагировать с кислородом;
- возможность легкоплавкого металла образовывать основные соли;
- химический элемент будет открыт при использовании спектроскопии.
Непосредственное выделение металла в чистом виде пришлось на француза Буабодраном. Открытие приходится на 1875 год. Из-за малого долевого содержания галлия в руде (менее 0.2%), пришлось потратить пару месяцев на получение минимального запаса чистого вещества для полноценного исследования его физических/химических свойств.
| Физика галлия | Химия галлия |
|---|---|
| Наличие нескольких модификаций полиморфного типа. | Низкая химическая активность замедляет протекание химических реакций металла в твердом состоянии. |
| При нормальных условиях кристаллическая решетка имеет орторомбическую структуру. При повышении давления наблюдается образование 2 структур полиморфного типа с кубической и тетрагональной решетками. | На воздухе галлий покрывается оксидной пленкой, которая предохраняет его от дальнейших реакций окисления. |
| Плотность галлия – 5.9 грамма на сантиметр кубический, а в жидком состоянии плотность увеличивается до 6.1 грамма на сантиметр кубический. | В контакте с горячей водой, он вытесняет из нее водород, в результате чего образуется гидроксид галлия. |
| Сопротивление электричеству у галлия в твердом и жидком состояниях одинаковы и равны 0.5 на 10-8 Ом*см при температурном режиме в 0 градусов по Цельсию. | Вступает в реакцию с паром (выше 340 градусов) и образует метагаллиевую кислоту. |
| Вязкость галлия колеблется в зависимости от температурного режима. При температуре в 100 градусов – 1.6 сантипуаз, а при 1000 градусов С – 0.6 сантипуаз. | Может взаимодействовать с кислотами минерального типа – происходит выделение Н и образование солевых веществ. |
| Поверхностное натяжение составляет 0.74 ньютона на метр, а отражательный коэффициент от 71% до 76% при разной длине волн. | Галлий инертен по отношению к водороду, азоту, углероду и кремнию. |
В земной коре металл, который плавится в руках, встречается довольно часто. На 1 тонну земли приходится 19 грамм чистого вещества. В химическом аспекте, галлий – элемент рассеянного типа, располагающий двойной природой по геохимии. Хотя кларки вещества и большие, из-за его сильной склонности к изоморфизму, больших скоплений чистого галлия в природе не найти.

К основным минералам, где сравнительно высокое содержание галлия в чистом виде относят сфалерит (до 0.1%), биотит (до 0.1%) и натролит (до 0.1%). В остальных 10+ минералах, которые также применяются для добычи галлия, долевое содержание чистого вещества менее 0.1%. В морской воде галлий также присутствует, но его содержание крайне мало – всего 30 на 10-6 миллиграммов на литр жидкости.
2) Почему галлий – это металл, который плавится в руке?
Обратимся к тепловым свойствам металла, и полностью разберем их при различных уровнях, хотя ответ на вопрос очевиден уже из базового понятия, температуры плавления, которая приравнивается к 29 градусам по Цельсию.
Термодинамические свойства чистого галлия:
- металл переходит из твердого в жидкое состояние при достижении температуры в 29.8 С или 302 градуса Кельвина;
- металл закипает при достижении температуры в 2 448 градусов Кельвина;
- удельная теплота плавления чистого галлия составляет 5600 Джоулей на моль;
- удельная теплота по испарению составляет 270 000 джоулей на моль;
- молярная теплоемкость составляет 26 джоулей, деленных на Кельвины, перемноженные на моли.
Главными поставщиками галлия на мировой рынок являются государства из Юго-Запада Африки, Российская Федерация и большинство стран СНГ. Галлий – металл, который не только плавится в руке, но и вещество, способное менять плотность при смене температурного режима на основании данного свойства можно провести интересный опыт.

Эксперимент: переводим галлий в жидкое состояние, а далее загоняем его в маленький стеклянный пузырек. По мере охлаждения емкости, металл станет постепенно превращаться в твердую субстанцию. Постепенно образующиеся кристаллы начнут расширяться, за счет чего колба рано или поздно треснет.
Во избежание повреждений со стороны зрителей, демонстрация должна проходить в изолированном пространстве с защитной перегородкой. Если слишком резко переохладить колбу, осколки могут разлететься в разные стороны в радиусе нескольких десятков метров.
Обзор свойств и характеристик плавящегося в руке металла, галлия:
3) Получение галлия + области применения металла в промышленности/быту
В основе добычи чистого вещества лежит галлит – редкий минерал, который является смесью галлия и сульфида меди. Наиболее часто он встречается в совокупности с такими минералами как сфалерит и германит. Странный факт, но в залежах каменных углей иногда реально найти галлит в размере 1.5% от всего объема добычи, что делает такие месторождения крайне важными стратегическими запасами для промышленного производства галлия.
Основные методы получения металлического галлия – это переработка боксита, нефелина и некоторые типы полиметаллических руд/угля.
Алгоритм извлечения галлия из руд:
- Электролиз с участием щелочных жидкостей, которые в свою очередь являются промежуточным продуктом с переработки бокситов в глинозем технического применения.
- Получение концентрированных растворов по методу спекания или через процесс Байера. В первом случае получаем до 70 миллиграмм на литр, а во втором до 160 миллиграмм на литр концентрата.
- Дальнейшая очистка галлия путем карбонизации.
- Обогащенный осадок отправляют в емкость с известью, вследствие чего получаем раствор.
- При помощи электролиза раствора получаем черновой вариант металла.
- Черновой галлий прогоняют через водяной напор.
- Смесь фильтруют при помощи пористых пластинок и греют в вакууме, из-за чего из чернового металла удаляются примеси летучего типа.
- В зависимости от степени чистоты конечного продукта, используют химический, электрохимический, либо физический методы разложения.
Эталонный вариант чистки может предоставить галлий с чистотой в 99.9%. В данном случае используется метод электрохимического рафинирования и восстановление с помощью очищенного водорода.

В промышленном плане у галлия нет широкого распространения. Металл сравнительно дорогой для металлургии + его физические/химические свойства редко где могут пригодиться для массового использования.
Где применяется галлий:
- в соединениях с натрием металл применяют при создании лазеров полупроводникового типа с ультрафиолетовым и синим диапазонами;
- как присадка к германию/кремнию;
- как отражающий элемент для зеркал среднего качества. В чистом виде материал способен отражать порядка 89% света. Достоинства подобных изделий обусловливаются способностью металл к пропуску ультрафиолетовых лучей;
- как компонент в смазочных материалах. Клеи с добавкой жидкого галлия весьма популярны и сегодня;
- как замена ртути в кварцевых термометрах;
- оксид галлия – это стратегически важный объект в производстве лазерных материалов.
Иногда галлий применяют как компонент для светящихся красок, а соли на основе металла являются катализаторами в аналитической химии, медицине и органическом синтезе. Чтобы купить 1 килограмма металла, который плавится в руках, потребуется выложить от 250 до 400 американских долларов в зависимости от степени чистоты химического элемента.
Галлий - металл, который плавится в руке
Если он используется в мобильных телефонах. Получается что в жару, в нем все расплавиться?
В электронике используются соединения галлия

Реакция галлия и алюминия с прекрасной концовкой

Галлий в гифках
Температура плавления галлия всего 29,8°C - он легко плавится от тепла рук

В отличие от ртути, жидкий галлий хорошо смачивает поверхность и оставляет следы (однако совершенно не токсичен)

Галлиевые капельки в воде из-за высокого поверхностного натяжения не сразу слипаются

Если в жидкий галлий поместить твердый кусочек, то через некоторое время вырастет красивый кристалл

Галлий, как типичный металл реагирует с кислотами, образуя бесцветные растворимые соли

Жидкий галлий способен сплавляться с некоторым металлами (например с алюминием). По итогу деталь, содержащая галлий становится чрезвычайно хрупкой

Жидкий галлий при контакте с алюминием ведет себя подобно ртути - образуется кашеподобная амальгама

Алюминий в амальгаме будет взаимодействовать с водой, поскольку галлий препятствует образованию защитной оксидной пленки

Опыт "Сердце" (галлиевая капля заряжается при контакте с раствором электролита (дихромат калия + серная кислота), вследствие чего уменьшается её поверхностное натяжение и она, слегка сплющиваясь под действием силы тяжести, начинает совершать колебания. Аналогичное происходит и с каплей ртути)
Какой металл плавится от температуры тела
Привычным стереотипом является, что металл – это обязательно нечто тяжёлое, прочное, блестящее. Из металлов делают инструменты и механизмы, оружие и украшения. Металлы используют для защиты от непогоды и хранения пищи. Даже в язык проник стереотип — фраза «возьми какую-нибудь железяку» имеет вполне конкретный и ёмкий смысл.
Однако, твёрдые, прочные и жаростойкие далеко не все металлы. И вещества, такие как натрий, галлий, ртуть — находят необычные применения.
Сегодня, поговорим о десяти металлах с самыми низкими температурами плавления.
Олово (231°C)

Химический элемент, занимающий в периодической таблице юбилейное, пятидесятое место известен человечеству с древнейших времён. Первые капли олова (латинское наименование Stannum) первобытные люди заметили в своих кострах ещё за 4 тысячи лет до нашей эры. Немудрено — ведь олово плавится при температуре всего при 231°C. При этом дерево ещё только-только начинает обугливаться и робко гореть.
Литий (180°C)

Этот удивительный металл, открыли только в начале XIX века. Литий (Lithium, элемент №3) довольно легкоплавкий — жидкий метал температуры всего 180°C можно помешивать даже деревянной ложечкой.
Литий отличается очень малой плотностью — вдвое легче воды! Металл относится к группе щелочных и довольно активен химически (поэтому его так долго не могли открыть).
В современном мире литий широко используется для создания удивительных сплавов — твёрдых, лёгких и жаропрочных. Без лития не обходится ни одна современная электронная штучка. Ведь литий является ключевым компонентом компактных и ёмких аккумуляторов. А ещё, именно литий придаёт замечательный алый цвет фейерверкам.
Индий (157°C)

В конце XIX века химикам удалось открыть и выделить в чистом виде элемент, занявший в периодической таблице клетку №49. Индий (Indium) — довольно тяжёлый (почти как железо) металл, плавящийся при 157°C.
Этот материал поразительно мягок и пластичен. Мягче этого металла только тальк! Невероятное свойство сделало индий незаменимым в радиоэлектронике. Тонкие индиевые полоски, нанесённые на стекло, хорошо проводят электрический ток — но при этом совершенно прозрачны. Так делают уже привычные нам плоские экраны на основе «жидких кристаллов» (LCD).
Натрий (97,8°C)

Натрий (Natrium, 11-й элемент) может расплавиться даже в кипятке — 97,8°C. Но мы бы не советовали позволить даже маленькому кусочку натрия упасть в воду (хотя бы и ледяную). Щелочной металл натрий очень активен химически и немедленно реагирует, отделяя от молекул воды водород и превращаясь в сильнейшую щелочь.
При этом выделяется много тепла, которое тут же поджигает освободившийся водород. Взрыв и пожар! Такие материалы как натрий хранят в керосине, что исключает их контакт с водой и влагой воздуха.
Как очень активный элемент, натрий в том или ином виде присутствует вокруг нас в огромных количествах. Взять хотя бы хлорид натрия — обычная поваренная соль.
Продукты компании Coollaboratory
Компанией Coollaboratory был разработан продукт, полностью состоящий из жидких металлов, без твердых частиц и неметаллических добавок.
Жидкий металл Coollaboratory Liquid Pro — теплопроводящий материал с высокой теплопроводностью, внешне напоминающий ртуть, но нетоксичный, характеризуется высокой способностью к смачиванию многих материалов.
Coollaboratory Liquid Ultra в виде пасты легко наносится кисточкой на теплораспределительную крышку процессора.

Coollaboratory Liquid Metal Pad представляет собой теплопроводящую прокладку, которая легко наносится на поверхность и плавится только при нагреве процессора.
Все эти жидкие металлы не могут работать при контакте с алюминием — радиатор должен быть выполнен из меди с никелевым покрытием. Производитель заявляет об уникальных показателях теплопроводности Coollaboratory Liquid Metal. Правда, на этот жидкий металл отзывы неоднозначны, и многие пользователи выказывают сомнения в заявленных характеристиках.
Калий (63,5°C)

Близкий родственник натрия — калий. Элемент №19 (Kalium) также бурно реагирует с водой, образуя щёлочь, и также легкоплавок — 63,5°C. А вот съедобных соединений калия почти нет, и в этом он полная противоположность натрию. Хотя в ограниченно малых количествах организму всё-таки необходим (микроэлемент).
В чистом виде калий практического применения не имеет. Но его многочисленные соединения с древних времён известны как удобрения, моющие средства, важные компоненты многих химических процессов.
Рубидий (39,31°C)

37-й элемент таблицы — рубидий (Rubidium) плавится всего при 39,31°C. Кусочек рубидия может растаять на блюдце как сливочное масло. Это лёгкий металл, его плотность лишь немного превышает плотность воды. Но реагирует с водой рубидий не менее бурно, чем его близкие родственники калий и натрий.
Рубидий удивителен своими химическими свойствами. Сам по себе щелочной металл очень легко вступает в разнообразные химические реакции. Но при этом соли рубидия и его сплавы с другими металлами являются хорошими катализаторами реакций. То есть, значительно ускоряют процесс, при этом совершенно не расходуясь сами по себе. Это делает рубидий ценным материалом для химической промышленности и радиоэлектроники.
Суть понятия самого легкоплавкого металла
Для специалистов больше знакомо понятие «тугоплавкость». Хотя слово «легкоплавки» и является антонимом в языковом аспекте, на практике – это один из пунктов к общей классификации в промышленности. По своей сути, любой элемент, имеющий температуру плавления менее 600 градусов по Цельсию, называют легкоплавким. Некоторые источники ставят планку вхождения в группу еще ниже – до 500 градусов Цельсия.
Классификация металлов по плавкости:
Процесс плавления одинаковый для всех металлических элементов – либо внешнее воздействие, либо внутреннее. В первом случае – это расплавка в печах, а во втором – разогревание через пропуск электрического тока сквозь металл. Иногда используется индукционный нагрев в электромагнитном поле с высокой частотой.
Процесс плавки металла через призму науки:
В зависимости от температуры плавления, выбирают аппараты из сплавов, способных выдержать пиковые значения. Для легкоплавких металлов вопрос решается проще всего.
Второй весомый параметр – температура кипения металла. В 95% случаев она в 2 раза выше температуры плавления. Между собой эти две величины являются прямо пропорциональными + при снижении/увеличения давления на материал, снижается и его показатели плавления с кипением.
10 самых крепких металлов в мире
Цезий (28,5°C)

Очень мягкий серебристый металл буквально плавится в руках. При температуре 28,5°C цезий (Caesium) становится жидкостью и буквально утекает между пальцев. Но не вздумайте провести такой опыт! Из всех щелочных металлов элемент №55 самый химически активный (уступая лишь францию).
На открытом воздухе цезий моментально окисляется, образуя яркое пламя. А при попадании в воду просто взрывается. Цезий ухитряется поджечь даже лёд! Более того, образовавшийся при реакции с водой гидроксид цезия разъедает стекло — и потихоньку грызёт сосуды из золота и даже платины.
А вот в электронике такая активность цезия позволяет делать очень чувствительные фотоэлементы и часы поистине космической точности.
Франций (27°C)

Элемент, занимающий 89-ю ячейку периодической таблицы — франций (Francium) — очень похож на цезий. Франций плавится при 27°C, но до этого неимоверно активный щелочной металл ещё требуется сберечь.
Мало того, что франций бурно реагирует буквально со всем подряд — он ещё и очень радиоактивен! Буквально через полчаса от килограмма франция останется — хорошо если горстка — разнообразных сильно излучающих продуктов деления.
Впрочем, в таких количествах его никто никогда и не видел. Неудивительно, что в природе этот элемент один из самых редко встречающихся. Да и практического применения ему так и не нашлось.
Жидкие металлы в природе
На самом деле ртуть не является единственным в мире жидким металлом. Известны еще галлий, цезий и франций, которые находятся в жидком состоянии до +30° C.

Галлий очень широко применяется, например, в электронике. Кроме того, что он плавится при низких температурах, галлий, и это главное его достоинство, закипает при температуре не ниже 2230° C. Необычайно широкий интервал расплава дает возможность использовать этот элемент в работе атомных реакторов.
Не менее востребованным элементом является цезий, несмотря на то что его в земной коре крайне мало и добыча его затруднена.
А вот радиоактивный элемент франций, период полураспада которого составляет чуть больше 22 минут, образуется при распаде актиния, и до сих пор неизвестно, как он выглядит. Даже ученые о нем знают очень мало, и знания эти накапливаются по крупицам. Научные лаборатории проводят исследования этого элемента на образцах массой в одну десятимиллионную долю грамма, которая каждые двадцать две с небольшим минуты уменьшается вдвое.
То есть при температурах, немногим отличающихся от комнатной, жидкими металлами можно назвать четыре элемента периодической таблицы Менделеева, включая ртуть.
Галлий (26,79°C)

А вот серебристый металл галлий (Gallium — ещё до открытия элемента Д.И. Менделеев заранее оставил ему в таблице клеточку № 31) встречается гораздо чаще и нередко применяется просто для забав. Плавится он почти как цезий, при 26,79°C, но в остальном разительно отличается от своего «нервного» братца.
Внешне и по механическим свойствам галлий очень похож на алюминий. Лёгок, теплопроводен, в чистом виде довольно хрупок. Мгновенно образующаяся на воздухе плотная плёнка окислов так же хорошо защищает его от разрушения.
В чистом виде галлий практически не находит применения. А вот его соли и, особенно, легкоплавкие сплавы нашли широчайшее применение в ядерной физике, радиоэлектронике, измерительной технике.
Сплавы металлов
Чтобы проектировать изделия из сплавов, сначала изучают их свойства. Для изучения в небольших емкостях расплавляют изучаемые металлы в разном соотношении между собой. По итогам строят графики.

Нижняя ось представляет концентрацию компонента А с компонентом В. По вертикали рассматривают температуру. Здесь отмечают значения максимальной температуры, когда весь металл находится в расплавленном состоянии.
При охлаждении один из компонентов начинает образовывать кристаллы. В жидком состоянии находится эвтектика – идеальное соединение металлов в сплаве.
Металловеды выделяют особое соотношение компонентов, при котором температура плавления минимальная. Когда составляют сплавы, то стараются подбирать количество используемых веществ, чтобы получать именно эвтектоидный сплав. Его механические свойства наилучшие из возможных. Кристаллические решетки образуют идеальные гранецентрированные положения атомов.
Изучают процесс кристаллизации путем исследования твердения образцов при охлаждении. Строят специальные графики, где наблюдают, как изменяется скорость охлаждения. Для разных сплавов имеются готовые диаграммы. Отмечая точки начала и конца кристаллизации, определяют состав сплава.

Ртуть (-38,87°C)

Все мы хорошо знакомы со ртутью — даже сегодня, в век электроники, вряд ли найдётся хоть один человек, которому не измеряли бы температуру тела ртутным термометром. Но мало кто задумывается, что очень текучая тяжёлая серебристая жидкость — самый настоящий металл!
Да-да, элемент №80, Hydrargyrum, плавится на самом лютом морозе — температура кристаллизации ртути почти минус сорок градусов (-38,87°C).
Человечество знакомо со ртутью с древнейших времён. Ртуть находит широчайшее применение в технике, химии, металлургии. Этот элемент достоин отдельного, немаленького рассказа — а сегодня он гордо венчает наш рейтинг.
Читайте также:
