Факторы влияющие на скорость коррозии металлов
Извлечения из классической книги
И.Л.Розенфельд, В.П.Персианцева "Ингибиторы атмосферной коррозии", М., "ХИМИЯ", 1985г.
Факторы, влияющие на скорость атмосферной коррозии
Наиболее важными факторами, определяющими скорость атмосферной коррозии являются: влажность атмосферы; состав атмосферы; суммарная длительность пребывания пленки влаги, образовавшейся на поверхности металла; ее химический состав; температура воздуха.
Влажность атмосферы. Абсолютная влажность воздуха (количество водяного пара в единице объема воздуха) при неизменных других условиях определяет толщину адсорбционной пленки, образующейся на поверхности металла. Так, например, толщина слоя влаги, образующейся на поверхности железа при относительной влажности воздуха 55%, составляет 15 молекулярных слоев, а при относительной влажности 100% - 90 – 100 молекулярных слоев.
От относительной влажности зависит и количество воды, которое сконденсируется на поверхности металла при охлаждении изделия, однако и в этом случае при последующем ее испарении коррозия при меньших относительных влажностях, например при 76%, может оказаться выше, чем при 100% влажности. Сказывается эффект саморазмешивания… Малые скорости коррозии наблюдаются лишь при относительных влажностях до 60%. Превышение этой влажности при любом количестве сконденсированной на поверхности металла влаги приводит к резкому возрастанию скорости коррозии. Однако при большом количестве сконденсированной влаги коррозия при 80%-ной относительной влажности выше, чем при 100%.
Количество же сконденсированной на поверхности металла влаги зависит от температурного перепада: чем он выше, тем больше конденсируется воды при заданной влажности.
Количество сконденсированной влаги может изменяться также от присутствия на поверхности металла посторонних веществ. Их влияние сказывается на капиллярной конденсации. Кроме того, они способны стать центрами кристаллизации. Особенно опасны вещества, отличающиеся высокой гигроскопичостью. В их присутствии изменяются значения относительной влажности воздуха, при которой наблюдается резкое возрастание скорости коррозии металлов (Hk - критическая влажность). Так, например, при наличии на поверхности железа аммонийных солей скорость коррозии резко возрастает, а влажность воздуха спускается с 80 до 50% .
Природа продуктов коррозии железа оказывает также сильное влияние на критическую влажность; для железа, покрытого продуктами коррозии, образованными в дистиллированной воде, критическая влажность равна 65%, а для морской воды критическая влажность снижается до 50% [194].
Помимо снижения критической влажности посторонние частицы, осаждающиеся на поверхности металла, могут повышать скорость разрушения металлов вследствие изменения структуры защитных пленок, а также их адгезии с поверхностью металла.
Возникновение поверхностного натяжения между твердыми частицами и продуктами коррозии может приводить к тому, что последние будут прилипать к твердой частичке, а не к поверхности металла, ослабляя этим защитные свойства образующихся продуктов коррозии. Это наблюдается также в том случае, если природа частичек такова, что они могут взаимодействовать с переходящими в раствор ионами металла с образованием растворимых продуктов коррозии вместо нерастворимых гидроокисей металлов.
Отсюда следует весьма важный вывод: возникшие по каким-либо причинам продукты коррозии даже в виде мелких очагов должны быть возможно быстрее удалены, чтобы они не способствовали дальнейшему развитию коррозии. Следует также избегать попадания посторонних частиц на поверхность изделия.
Состав атмосферы. Агрессивные свойства атмосферы по отношению к металлам определяются не только влажностью, но и теми загрязнениями, которые в нее попадают. Самыми неблагоприятными видами загрязнений являются сернистый газ и хлористый натрий. Первый попадает в атмосферу вместе с продуктами, образующимися при сжигании сернистого топлива, второй – за счет соли, уносимой ветром с поверхности океанов и морей.
Сернистый газ. С некоторой критической концентрации сернистый газ сильно увеличивает скорость коррозии таких металлов, как железо, алюминий, цинк, медь и другие. При постоянной концентрации сернистого газа в атмосфере скорость коррозии металлов возрастает с повышением относительной влажности атмосферы. Возрастание скорости коррозии металлов наблюдается и в том случае, когда в атмосфере нет сернистого газа, но поверхность металла предварительно подвергалась его воздействию. Коррозия при этом протекает так, как будто атмосфера содержит сернистый газ . такой отрицательный эффект связан с тем, что сернистый газ в присутствии адсорбированной влаги на металле образует кристаллогидраты, которые не удаляются с поверхности металла даже при откачке и способствуют возникновению и развитию коррозионного процесса. Наиболее опасными в промышленной атмосфере являются оседания на поверхности конструкции частичек угольной пыли.
Хлористый натрий. Хлористый натрий, подобно сернистому газу, весьма заметно усиливает коррозию ряда металлов в атмосферных условиях. Основной причиной ускорения коррозии хлористым натрием является образование в его присутствии растворимых продуктов коррозии вместо нерастворимых гидроокисей, возникающих под чистой пленкой влаги. Кроме того, ионы хлора препятствуют образованию пассивирующих пленок. Агрессивное действие хлористого натрия в условиях атмосферы следует также связывать с его способностью адсорбировать влагу из относительно сухих атмосфер. Уже при относительной влажности воздуха, равной 70%, хлористый атрий адсорбирует влагу, что сопровождается сильным увеличением скорости коррозии.
Из других загрязнений воздуха наиболее агрессивными являются хлор, аммиак, сероводород и углекислый газ… Не останавливаясь подробно на рассмотрении влияния этих загрязнений атмосферы на механизм и скорость коррозионных процессов, отметим то общее, что есть в действии этих соединений, а также их некоторые отличительные особенности.
Отличительной особенностью хлора является его агрессивность как во влажных, так и в относительно сухих атмосферах (Н = 42%). При высоких относительных влажностях наступает резкое возрастание скорости коррозии. Последнее связано с тем, что хлор является сильным катодным деполяризатором при высоких относительных влажностях. Кроме того, в результате образования хлористых соединений он сдвигает критическую влажность к более низким значениям.
Коррозионная активность сероводорода, подобно сернистому газу, наступает лишь при достижении определенного значения относительной влажности атмосферы. В сухой атмосфере в присутствии сероводорода коррозия цинка, кадмия, олова, алюминия, сурьмы, висмута, хрома, железа, чугуна, легированных сталей, кобальта и никеля ничтожна. Общим для рассматриваемых видов загрязнений является их более низкая (в большинстве случаев) агрессивность по сравнению с сернистым газом и хлористым натрием. Аммиак сам по себе для железа и сплавов на его основе не опасен. Однако для медных сплавов он представляет большую опасность, вызывая коррозионное растрескивание.
Продолжительность пребывания пленки влаги на поверхности металла. в атмосферах, не загрязненных заметными количествами специфических коррозионно-активных примесей, процесс атмосферной коррозии возникает и развивается лишь в том случае, если на поверхности металла присутствует пленка влаги определенной толщины (10-20 молекулярных слоев), приобретающая свойства электролита. Продолжительность развития коррозионного процесса и количество металла, превратившегося в продукты коррозии, зависит от длительности пребывания пленки электролита на поверхности металла. Чем дольше не высыхает пленка, образовавшаяся на металле, или чем чаще она возобновляется, тем дольше протекает процесс коррозии, а следовательно, при всех прочих равных условиях тем большему коррозионному разрушению подвергается металл.
Существенное значение длительности общего времени пребывания пленки влаги для коррозионного разрушения подтверждается также тем, что, например, в Батуми, где выпадает максимальное по Союзу количество осадков (число дней с росой – 68) и где, казалось бы, коррозия должна быть наибольшей, она оказывается ниже, чем, скажем, в приморских условиях Мурманска, где количество осадков значительно меньше число дней с росой – 25). Это объясняется тем, что в Батуми, где много солнечных дней, условия для удаления пленки с поверхности металла более благоприятны, чем в Мурманске. Поэтому общее время контакта металла с электролитом в Батуми значительно меньше, чем в Мурманске, а следовательно, и коррозия там меньше. Этим же эффектом можно объяснить, почему сильнее корродирует та сторона образца или конструкции, которая обращена к земле, а не та, на которую непосредственно выпадают атмосферные осадки.
Температура воздуха. Скорость коррозии с температурой обычно возрастает, поскольку с ростом температуры увеличивается кинетика электрохимических реакций, обусловливающих коррозионный процесс.
При атмосферной коррозии, протекающей . в видимых слоях электролитов, чаще всего с катодным ограничением, температура изменяет скорость процесса главным образом благодаря изменению кинетики катодной реакции восстановления кислорода, скорость которой определяется скоростью диффузии кислорода к электроду.
Поскольку коэффициент диффузии кислорода с температурой растет (коэффициент диффузии изменяется по закону D = RT / (6p r h),
где R – постоянная Больцмана; r – радиус диффундирующей частицы; h – вязкость среды), а толщина диффузионного слоя уменьшается (вследствие усиления саморазмешивания, обусловленного конвекцией), то повышение температуры должно привести к росту предельного диффузионного тока и, следовательно, скорости коррозии. Необходимо, однако, иметь в виду, что при коррозии металлов в атмосфере с изменением температуры меняется длительность контакта электролита с металлом. Поэтому общий коррозионный эффект зависит от изменения кинетики электродных реакций и от изменения времени пребывания электролита на поверхности металла.
Ввиду наличия двух факторов, действующих в прямо противоположном направлении (длительность контакта металла с электролитом уменьшается с повышением температуры, а скорость реакций, обусловливающих коррозионный процесс, увеличивается), зависимость скорости атмосферной коррозии от температуры является весьма сложной и ее не всегда легко предсказать. Если эффекты, возникающие от длительного пребывания металла в контакте с электролитом, превышают эффекты, возникающие за счет более интенсивного протекания процесса при более высокой температуре, то коррозия в районах, характеризующихся относительно низкой температурой, может быть больше, чем в районах, отличающихся высокими температурами. Однако высокие температуры, сочетающиеся с длительным пребыванием металла в контакте с электролитом, что, например, наблюдается во влажном тропическом климате, способствуют усиленной коррозии
Скорость коррозии металлов. Методы оценки коррозионных процессов
Скорость коррозии – многофакторный параметр, который зависит как от внешних условий среды, так и от внутренних свойств материала. В нормативно-технической документации существуют определенные ограничения по допустимым значениям разрушения металла при эксплуатации оборудования и строительных конструкций для обеспечения их безаварийной работы. В проектировании не существует универсального метода определения скорости коррозии. Это связано со сложностью учета всех факторов. Наиболее надежным методом является изучение истории эксплуатации объекта.
Критерии
Вам будет интересно: Процессы изобарный, изохорный, изотермический и адиабатный для идеального газа

В настоящее время в проектировании техники используют несколько показателей скорости коррозии:
- По прямому способу оценки: уменьшение массы металлической детали на единицу поверхности – весовой показатель (измеряется в граммах на 1 м2 за 1 час); глубина повреждений (или проницаемость коррозионного процесса), мм/год; количество выделяющейся газовой фазы продуктов коррозии; продолжительность времени, в течение которого появляется первое коррозионное повреждение; число центров коррозии на единицу площади поверхности, появившихся за определенный срок.
- По косвенной оценке: сила тока электрохимической коррозии; электрическое сопротивление; изменение физико-механических характеристик.
Вам будет интересно: Такие обычные люди, или значение «почему бы и нет»
Первый показатель по прямому методу оценки является наиболее распространенным.
Расчетные формулы
В общем случае весовые потери, определяющие скорость коррозии металла, находят по следующей формуле:
где q – уменьшение массы металла, г;
S – площадь поверхности, с которой произошел перенос материала, м2;
t – период времени, ч.
Для листового проката и изготовленных из него обечаек определяют глубинный показатель (мм/год):
m – глубина проникновения коррозии в металл.
Между первым и вторым показателями, описанными выше, существует следующая зависимость:
где ρ – плотность материала.
Основные факторы, влияющие на скорость коррозии
Вам будет интересно: Шуточные номинации для учителей на выпускной
На скорость разрушения металла влияют следующие группы факторов:
- внутренние, связанные с физико-химической природой материала (фазовая структура, химический состав, шероховатость поверхности детали, остаточные и рабочие напряжения в материале и другие);
- внешние (окружающие условия, скорость движения коррозионно-активной среды, температура, состав атмосферы, наличие ингибиторов или стимуляторов и другие);
- механические (развитие коррозионных трещин, разрушение металла под действием циклических нагрузок, кавитационная и фреттинг-коррозия);
- конструктивные особенности (выбор марки металла, наличие зазоров между деталями, требования к шероховатости).
Физико-химические свойства
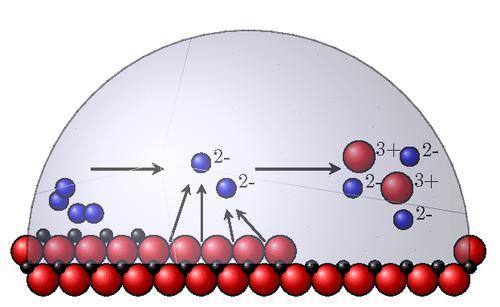
Наибольшее значение среди внутренних факторов коррозии имеют следующие:
- Термодинамическая устойчивость. Для ее определения в водных растворах применяют справочные диаграммы Пурбе, по оси абсцисс которых откладывается pH среды, а по оси ординат – окислительно-восстановительный потенциал. Сдвиг потенциала в положительную сторону означает большую устойчивость материала. Ориентировочно она определяется как нормальный равновесный потенциал металла. В реальности материалы корродируют с различной скоростью.
- Положение атома в периодической таблице химических элементов. Металлы, наиболее подверженные коррозии, – это щелочные и щелочноземельные. Скорость коррозии снижается при увеличении атомного номера.
- Кристаллическая структура. Она оказывает неоднозначное влияние на разрушение. Крупнозернистая структура сама по себе не приводит к росту коррозии, но благоприятна для развития межкристаллитного избирательного разрушения границ зерна. Металлы и сплавы с однородным распределением фаз корродируют равномерно, а с неоднородным – по очаговому механизму. Взаимное расположение фаз выполняет функцию анода и катода в агрессивной среде.
- Энергетическая неоднородность атомов в кристаллической решетке. Атомы с наибольшей энергией расположены в углах граней микронеровностей и являются активными центрами растворения при химической коррозии. Поэтому тщательная механическая обработка металлических деталей (шлифовка, полировка, доводка) повышает коррозионностойкость. Данный эффект объясняется также формированием более плотных и сплошных оксидных пленок на гладких поверхностях.
Влияние кислотности среды
Вам будет интересно: Копать или капать? Как правильно написать?

В процессе химической коррозии концентрация ионов водорода оказывает влияние на следующие моменты:
- растворимость продуктов коррозии;
- формирование защитных оксидных пленок;
- скорость разрушения металла.
При рН в интервале значений 4-10 единиц (кислый раствор) коррозия железа зависит от интенсивности проникновения кислорода к поверхности объекта. В щелочных растворах скорость коррозии сначала уменьшается из-за пассивации поверхности, а затем, при рН>13 увеличивается в результате растворения защитной оксидной пленки.
Для каждого вида металла существует своя зависимость интенсивности разрушения от кислотности раствора. Благородные металлы (Pt, Ag, Au) устойчивы к коррозии в кислой среде. Zn, Al быстро разрушаются как в кислотах, так и в щелочах. Ni и Cd устойчивы к щелочам, но легко корродируют в кислотах.
Состав и концентрация нейтральных растворов

Скорость коррозии в нейтральных растворах зависит в большей степени от свойств соли и ее концентрации:
- При гидролизе солей в коррозионной среде образуются ионы, которые действуют как активаторы или замедлители (ингибиторы) разрушения металла.
- Те соединения, которые увеличивают pH, повышают также скорость деструктивного процесса (например, кальцинированная сода), а те, которые снижают кислотность, – уменьшают ее (хлористый аммоний).
- При наличии хлоридов и сульфатов в растворе разрушение активизируется до достижения некоторой концентрации солей (что объясняется усилением анодного процесса под влиянием ионов хлора и серы), а затем постепенно снижается из-за уменьшения растворимости кислорода.
Некоторые виды солей способны образовывать труднорастворимую пленку (например, фосфорнокислое железо). Это способствует защите металла от дальнейшего разрушения. Данное свойство используется при применении нейтрализаторов ржавчины.
Замедлители коррозии
Замедлители (или ингибиторы) коррозии различаются по механизму действия на окислительно-восстановительный процесс:
- Анодные. Благодаря им образуется пассивная пленка. К данной группе относятся соединения на основе хроматов и бихроматов, нитратов и нитритов. Последний тип ингибиторов применяется для межоперационной защиты деталей. При использовании анодных замедлителей коррозии необходимо предварительно определить их минимальную защитную концентрацию, так как добавление в небольших количествах может привести к увеличению скорости разрушения.
- Катодные. Механизм их действия основан на снижении концентрации кислорода и соответственно, замедлении катодного процесса.
- Экранирующие. Данные ингибиторы изолируют поверхность металла с помощью образования нерастворимых соединений, отлагающихся в виде защитного слоя.
К последней группе относятся нейтрализаторы ржавчины, которые используются также для очистки от окислов. В их состав, как правило, входит ортофосфорная кислота. Под ее влиянием происходит фосфатирование металла – образование прочного защитного слоя нерастворимых фосфатов. Нейтрализаторы наносят пульверизатором или валиком. Через 25-30 минут поверхность приобретает бело-серый цвет. После высыхания состава наносят лакокрасочные материалы.
Механическое воздействие

Повышению коррозии в агрессивной среде способствуют такие типы механического воздействия, как:
- Внутренние (при формовании или термообработке) и внешние (под воздействием приложенной извне нагрузки) напряжения. В результате возникает электрохимическая неоднородность, происходит снижение термодинамической устойчивости материала и формируется коррозионное растрескивание. Особенно быстро происходит разрушение при растягивающих нагрузках (трещины образуются в перпендикулярных плоскостях) в присутствии анионов окислителей, например, NaCl. Типичным примером устройств, подверженных такому типу разрушения, являются детали паровых котлов.
- Знакопеременное динамическое воздействие, вибрации (коррозионная усталость). Происходит интенсивное снижение предела усталости, образуются множественные микротрещины, которые затем сливаются в одну крупную. Число циклов до разрушения в большей степени зависит от химического и фазового состава металлов и сплавов. Такой коррозии подвержены оси насосов, рессоры, лопатки турбин и другие элементы оборудования.
- Трение деталей. Быстрое корродирование обусловлено механическим износом защитных пленок на поверхности детали и химическим взаимодействием со средой. В жидкости скорость разрушения ниже, чем на воздухе.
- Кавитационное ударное воздействие. Кавитация возникает при нарушении сплошности потока жидкости в результате образования вакуумных пузырей, которые схлопываются и создают пульсирующее воздействие. В результате возникают глубокие повреждения локального характера. Данный тип коррозии часто наблюдается в химических аппаратах.
Конструктивные факторы

При конструировании элементов, работающих в агрессивных условиях, необходимо учитывать, что скорость коррозии возрастает в следующих случаях:
- при контакте разнородных металлов (чем больше разница электродного потенциала между ними, тем выше сила тока электрохимического процесса разрушения);
- при наличии концентраторов механических напряжений (канавки, пазы, отверстия и другие);
- при низкой чистоте обработанной поверхности, так как при этом возникают локальные короткозамкнутые гальванические пары;
- при значительной разнице температуры отдельных частей аппарата (образуются термогальванические элементы);
- при наличии застойных зон (щели, зазоры);
- при формировании остаточных напряжений, особенно в сварных соединениях (для их устранения необходимо предусмотреть термическую обработку – отжиг).
Методы оценки

Существует несколько способов оценки скорости разрушения металлов в агрессивных средах:
Привет студент
Коррозией называется разрушение металла под химическим действием окружающей среды.
Металлы встречаются в природе преимущественно в виде соединений с неметаллическими элементами, например, железо — в виде Fe2О3 и др., алюминий — А12О3, медь — Cu2S и т. д.
Для получения металла в чистом виде необходима затрата энергии, так как металлургическими процессами нарушается равновесное состояние между металлом и веществами, с которыми он связан в естественном состоянии.
Полученные в результате металлургических процессов металлы под действием атмосферных условий (газов и влаги) снова стремятся перейти в устойчивые соединения с другими веществами, иначе говоря, корродируют.
В настоящее время коррозия выводит из строя ежегодно около 1 % находящегося в пользовании металла.
В изделиях и сооружениях в результате коррозии может происходить последовательное разрушение поверхности, образование раковин и приобретение металлом губчатого строения. Разработка современной теории коррозии основана на исследованиях Г. В. Акимова, Н. А. Изгарышева, Н. Д. Томашева и др.
ВИДЫ КОРРОЗИИ
Различают два основных вида коррозии металла: химическую и электрохимическую.
Химической коррозией называются процессы разрушения металла в сухих газах или в жидкостях, не проводящих электрического тока (масло, бензин).
Такого рода коррозия имеет, например, место при окислении металла в термических печах, при разъедании топочных связей и пр. Степень химической коррозии сильно возрастает с повышением температуры; в виде примера можно указать на цвета побежалости.
Скорость разрушения металла при химической коррозии определяется степенью сродства металла с кислородом и свойствами образующейся при этом пленки (ее плотностью, отсутствием в ней пор, прочностью прикрепления пленки к металлу).
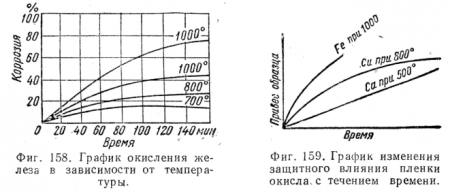
На фиг. 158 приведен график окисления железа в зависимости от температуры.
Опыт показывает, что пленка окисла обнаруживает защитные свойства, если объем окисла больше объема окисленного металла; так, для Са, Сu и Fe отношение объема окисла к объему окисленного металла соответственно равно 0,78; 1,70 и 2,06. Защитные свойства пленки окислов меди и железа можно видеть на фиг. 159; из графика видно, что для Са пленка не обнаруживает защитных свойств.
Переменный нагрев и охлаждение металла увеличивают скорость коррозии, так как колебания температуры нарушают цельность пленки.
Химическая коррозия может разрушать металл не только с поверхности, но и между кристаллическими зернами, проникая в глубь металла. В последнем случае коррозия называется межкристаллитной.
Электрохимической коррозией называется разрушение металла при соприкосновении с жидкостями, проводящими электрический ток. Происходящие здесь явления аналогичны тем, которые имеют место в гальваническом элементе.
Металлическая пластинка, погруженная в жидкость, проводящую ток, выделяет частицы, заряженные положительно, — ионы, а сама заряжается отрицательно — электронами. Между пластинкой и жидкостью устанавливается электростатическое равновесие.
Количество ионов, выделяемое различными металлами, различно, следовательно, различны и их потенциалы.
При соединении погруженных в жидкость пластинок из разнородных металлов проводником, находящимся вне жидкости, по последнему потечет ток (фиг. 160) электронов от А к В; одновременно и в жидкости возникает ток ионов от А к В. На поверхности пластинки В ионы нейтрализуются электронами, притекшими по проводнику.
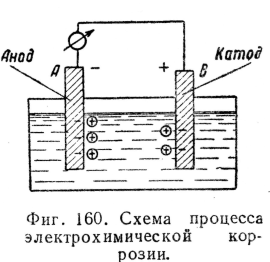
Включенный в цепь гальванометр покажет течение электричества в цепи.
В результате происходит разрушение пластинки А (анода).
В гальванической паре разрушается тот металл, который выделяет большее количество положительно заряженных ионов и, следовательно, сам получает более высокий отрицательный заряд. Для сравнения электроположительных свойств металлов их электродные потенциалы измеряются в одинаковых условиях по отношению к потенциалу водородного электрода, принятому равным нулю.
По мере убывания положительного заряда в паре с водородным электродом пли, как принято говорить, по мере убывания электроположительных свойств, металлы располагаются в ряд, называемый рядом напряжений: Au, Pt, Hg, Ag, Сu, Bi, Sb, (H2), Pb, Sn, Ni, Co, Cd, Fe, Cr, Zn, Mn, Al, Mg, Be, Na, K. Li.
Этот ряд составлен при условии, что определение электродных потенциалов производилось при нормальной концентрации раствора (в растворе, содержащем 1 г-эквивалент ионов данного металла на 1 л при 18° С).
Всякий металл, занимающий в этом ряду более правое положение, будет разрушаться в контакте с занимающими более левое положение и тем сильнее, чем дальше эти металлы находятся друг от друга в ряду.
В зависимости от электролита порядок расположения указанных металлов в ряде напряжений может быть и другой, а следовательно, может измениться и относительная способность к корродированию.
Скорость разъедания характеризуется силой тока между ними.
Величина этого тока может уменьшаться и коррозия замедляется, вследствие поляризации электродов и, в первую очередь, катода, на котором в процессе коррозии накапливаются электроны. Деполяризация катода (удаление электронов) может происходить двумя путями: а) путем выделения водорода на катоде с поглощением при этом электронов; такой процесс деполяризации имеет место в кислой среде; б) путем снятия с катода электронов газообразным кислородом, находящимся в растворе с образованием при этом гидроксил-ионов по уравнению
такого вида деполяризация характерна для нейтральных растворов.
Поляризация уменьшает электродвижущую силу пары и способна даже изменить знак потенциала. Поэтому интенсивность процесса разрушения металла при электрохимической коррозии зависит также и от степени поляризации электродов: чем больше поляризация, тем слабее коррозия и наоборот.
Различают следующие виды электрохимической коррозии: гальванокоррозйю и коррозию под влиянием блуждающих токов.
Гальваиокоррозией называется процесс разрушения металла при соприкосновении разнородных металлов в присутствии электролита; в качестве примера можно указать на разрушение железа паровых котлов, образующих гальваническую пару с топочной медью. Во многих случаях процесс гальванокоррозии обусловливается неоднородностью структуры металла или сплава. В качестве примера можно указать на разрушение перлита; здесь отрицательно заряженным является феррит (по отношению к цементиту), подвергающийся разрушению в присутствии влаги. Коррозию, возникающую в результате неоднородности структуры, т. е. вследствие наличия микроэлементов, называют микрокоррозией или структурной коррозией.
Распространенное мнение, что микрокоррозии подвергаются только сплавы, нельзя считать вполне правильным, так как неоднородность структуры может иметь место и в чистом металле, например, вследствие наклепа. Кроме того, некоторая возможность микрокоррозии чистого металла может вызываться неодинаковостью потенциалов в различных точках поверхности металла, которая никогда не бывает абсолютно однородной.
Однако очевидно, что чистые металлы могут подвергаться микрокоррозии в меньшей мере по сравнению со сложным по структуре сплавом и что микрокоррозия проявляется тем меньше, чем меньше неоднородность поверхности металла.
Вызывающие микрокоррозию токи весьма малы: величина их может быть равна приблизительно 10 - 6 —10 - 7 а/см 2 . Малая величина этих токов компенсируется продолжительностью их действия.
В районах, обслуживаемых электрическими железными дорогами, токи, возвращающиеся из сети на станцию через рельсы, могут частично ответвляться, проходя по металлу предметов, находящихся в почве (водопроводных труб, каркасов железобетонных сооружений и пр.). В этом случае почва, содержащая растворы солей, играет роль электролита; разрушению подвергается металл, являющийся анодом. Такой вид коррозии называют коррозией под влиянием блуждающих токов.
Факторы, влияющие на скорость коррозии
Внутренние факторы. К внутренним факторам, влияющим на скорость коррозии, относятся химический состав, структура, внутренние напряжения и состояние поверхности металла. Чистые металлы при прочих равных условиях менее подвержены коррозии, чем сплавы.
Менее других подвержены коррозии сплавы, имеющие структуру твердого раствора.
Внутренние напряжения материала способствуют коррозии его; наклепанный материал разъедается больше, чем материал с нормальной структурой. Наличие внутренних напряжений и наклеп способствуют образованию гальванопар.
Чем ровнее поверхность металла, тем меньше он корродирует; при повреждении поверхности металл начинает корродировать быстрее. Причиной этого является то обстоятельство, что гладкая поверхность лучше покрывается защитной пленкой.
Внешние факторы. К внешним факторам, влияющим на скорость коррозии, относятся действие на металл окружающей среды: воды, кислот, щелочей, солей и газов, а также температура окружающей среды.
Коррозионная усталость металла
Коррозионной усталостью металла называется разрушение металла, находящегося под одновременным воздействием циклических напряжений и факторов, вызывающих коррозию.
Причиной быстрого разрушения металла является, с одной стороны, разрушение пленки окисла и, следовательно, неиспользование ее защитных свойств, а с другой — поверхностное разрушение металла, вызываемое коррозией, способствующее возникновению трещин усталости. Под влиянием коррозии предел усталости металла снижается в некоторых случаях на 65% против нормальной величины.
Электрохимическая коррозия
Электрохимическая коррозия относится к наиболее часто встречающимся процессам постепенного разрушения металла.
Как мы знаем, наше окружение наполнено электричеством.
В зависимости от среды, меняются показатели проводимости. Не отличается то, что при контакте с такой средой сталь начинает постепенно портиться.
У процесса есть несколько важных отличий.
В первую очередь – неодновременное протекание восстановления окислительного процесса и ионизации атомов металла.
На интенсивность распространения при этом влияет такой параметр, как электродный потенциал металла.
Главная причина электрохимической коррозии в том, что большинство металлов проявляют термодинамическую неустойчивость.
Примеры распространения коррозии такого типа встречаются в воде, почве, на открытом воздухе.
Она часто становится причиной потери прочности и постепенного разрушения металла на днище судов, трубопроводов, опор ЛЭП и других объектов.
Если говорить о типах электрохимической коррозии, то называют 3 разновидности:
- щелевые поражения;
- питтинги;
- межкристаллическое повреждение.
Повреждаться могут разные типы металлов в зависимости от их расположения. Ржавчина появляется при контакте со стоячей и текущей водой, в местах соединения разных металлов, а также на сварных швах.
Какие механизмы отвечают за протекание электрохимической коррозии
Такое повреждение металла проводится двумя механизмами – гомогенным и гетерогенным. Рассмотрим каждый из них подробно.
- Гомогенный. Первоначально затрагивается поверхностный слой металлического изделия. Постепенно металл начинает растворяться под действием актов – катодного или анодного. На протяжении определенного времени происходит миграция катода и анода. Со временем процесс ускоряется. Особенность гомогенного механизма в том, что затрагивает как твердые, так и жидкие металлы. Меняется только скорость течения.
- Гетерогенный. У большинства твердых металлов не наблюдается гомогенной поверхности. Это связано с тем, что в самом материале состав кристаллической решетки может отличаться. Также как и в описанном выше случае, формируется анодный и катодный процессы, металл начинает постепенно разрушаться.
У такого вида процесса есть несколько особенностей.
В первую очередь – четкое деление на катодный и анодный процесс. Один из основных факторов, влияющих на их скорость протекания относительно друг друга – это время.

Схема электрохимической коррозии
В зависимости от типа металла, коррозия может быть локализована на отдельных участках. Также наблюдается растворение поверхностного слоя на анодах, что позволяет поражению затронуть обширные площади.
Здесь появляется еще одна особенность протекания процесса – формирование гальванических элементов. Это происходит из-за специфики структуры поверхности, на которой присутствуют микроэлектроды.
Из-за чего начинает развиваться коррозия
После того, как мы рассмотрели суть электрохимической коррозии, пришло время обратить внимание на причины распространения коррозии.
Среди них три распространенные:
- Сплав имеет неоднородную структуру. В большинстве сплавов поверхность негомогенная, потому что в кристаллической решетке присутствуют посторонние включения. Ухудшает ситуацию и присутствие пор макро и микротипа. Это приводит к тому, что продукты коррозии также начинают образовываться неравномерно.
- Неоднородная среда, в которой находится металл. Чтобы коррозия протекла быстрее, важен фактор доступа окислителя. Электрохимическая реакция может быть ускорена.
- Отличие физических условий. Коррозия усиливается в том случае, если происходит облучение, в среде присутствуют блуждающие тока. Негативно влияет и температура, особенно при перепадах. В таком случае разница между холодными и теплыми местами становится причиной появления анода.
Именно по причине различия в критических факторах, скорость электрохимической коррозии может сильно меняться.
Главные внутренние факторы протекания электрохимической коррозии
На интенсивность распространения коррозийного поражения влияют две группы факторов – внешние и внутренние.
Текущее состояние поверхности металла
Когда поверхность металла неровная, коррозийный процесс протекает намного интенсивнее. Если на поверхности присутствуют небольшие выступы, они начинают накапливать воду.
Это может негативно повлиять на интенсивность распространения.
Чтобы не допустить такого фактора, важно использовать отшлифованный или отполированный металл.
Когда сталь гладкая, вода не так сильно повреждает ее, потому что постепенно происходит формирование равномерной пленки по всей поверхности.
Также хорошим средством для уменьшения поражения становится применение пассивирования, а также ряд других способов.
Степень термодинамической стойкости металла
Разные виды материалов отличаются разными показателями термодинамической устойчивости.
Наиболее стойкие разновидности материала не разрушаются при помещении в агрессивную среду.
Чтобы понять, есть ли у металла склонность к коррозии под действием термодинамических факторов, измеряют потенциал анодного и катодного процесса, а также изобарно-изотермического.
Именно такой фактор оказывает большое влияние на потенциальное воздействие среды на постепенное развитие коррозии.
К сожалению, у большинства представленных в продаже марок металлов стойкость невысокая. Есть и неустойчивые разновидности, у которых этот риск нивелируется благодаря склонности к образованию пассивных пленок на поверхности.
Кристаллографическая структура
Оказывает прямое воздействие на металл.
Как известно, атомы в кристаллической решетке располагаются по-разному. Лучше защищены те разновидности, у которых атомы упакованы неплотно.
Особенности решетки также учитывают при планировании защиты материала методом создания на нем специальных пленок. И пленка и сам основной материал должны четко соответствовать по составу друг другу или быть максимально приближенными.
В этом случае исключается появление напряжения, которое негативно отражается на текущем состоянии заготовки. Если контакт с агрессивной средой все-таки происходит, материал начинает разрушаться слой за слоем.
Гетерогенность
Этот фактор рассматривается в непосредственной связи с величиной зерна металла.
Если в сплаве есть выраженные анодные включения, они сильно влияют на ускорение протекания коррозии.
Катодные включения не столь опасны, потому что на интенсивности процесса не отражаются. Величина зерна как фактор риска рассматривается не так часто и этим показателем можно пренебречь.
Не стоит сбрасывать со счетов и механические факторы
Важно понимать, что многие конструкции из металла используются под постоянным напряжением.
К этой категории относится повышенное внутреннее напряжение, когда сильно увеличивается риск деформации.
Негативно влияют на качество металла также воздействие истирания, периодические контакты с другими металлическими изделиями.
Такой фактор оказывает значительное влияние на интенсивность распространения повреждения.
Даже если само сырье первоначально обладало стойкостью к потенциальным повреждениям, в таком случае она уменьшится – формируемые пленки просто не будут закрепляться на поверхности.
Потому лучше сразу исключить это условие электрохимической коррозии – постараться не использовать металлоконструкции под пиковыми сильными нагрузками, не допускать возникновения трения и соприкосновения между собой стальных деталей.
Основные внешние факторы электрохимической коррозии
Кроме внутренних, на металл также влияют и внешние факторы.
Они могут не только ускорять, но и замедлять процесс, а также влиять на характер его протекания.
К ним относятся следующие:
- Температура. Температура сильно влияет на то, как себя ведет металл в разных условиях. От нее сильно зависит то, насколько быстро будут растворяться вторичные продукты коррозии. Среди других особенностей – запуск и стимуляция диффузионных процессов в металле, создание перенапряжения на электродах и другие проявления. Когда металлическое изделие помещается в растворы с кислородной деполяризацией, по мере прогрева электролита диффузия окислителя ускоряется. На фоне этого наблюдается сильное снижение перенапряжения ионизации кислорода.
Если деталь помещается в растворы неокисляющихся кислот, наблюдается коррозия с водородной деполяризацией.
Повышение температуры уменьшает скорость распространения повреждений, потому что сильно снижается перенапряжение водорода.
Отдельно стоит отметить ситуацию, когда металл уже покрывается специальной защитной пленкой. В этом случае сам тип пленки будет влиять на то, как именно она поведет себя при контакте с разными видами внешних угроз, в том числе, с повышением температуры.
Нагрев и охлаждение могут отразиться на состоянии катодов и анодов через их внутренние процессы.
В некоторых случаях полярность электродов значительно меняется.
Как мы уже отмечали выше, проблемы могу возникать из-за того, что разные участки детали нагреты до отличающихся друг от друга температур.
В этом случае стремительно увеличивается количество термогальванических пар, стимулирующих распространение коррозии на новые участки.
- Уровень рН раствора, в который помещен металл. Такой показатель как рН указывает, насколько в растворе будут активными ионы водорода, и как быстро коррозия будет распространяться по материалу. Это опасно, потому что может непредсказуемо менять потенциал катодных процессов, формирование окисных пленок. Также создается значительное перенапряжение реакции на электродах. Рекомендуется не допускать контакта металла со средами, у которых показатель рН высокий.
Если по каким-то причинам металлическая заготовка оказалась помещена в раствор, большое значение будет иметь скорость, с которой он движется, а также само наличие внутренних колебаний.
Заранее определить точное воздействие будет сложно по той причине, что всегда непросто предсказать, как поведут себя нейтральные электролиты.
Cчитается, что при смешении электролита, меняются показатели диффузии кислорода, что значительно отражается на процессе протекания коррозии.
Можно уделять меньше внимания скорости движения электролита в том случае, если вы имеете дело со средами повышенной кислотности.
На них подобное поражение оказывает минимум влияния.
Чем отличаются анодный и катодный процессы
Если вы внимательно проследите за тем, как работает гальванический элемент, то увидите, что в нем протекают сразу два связанных друг с другом процесса – анодный и катодный.
Рассмотрим их более подробно.
Анодный процесс
В химии показывается формулой Fe → Fe2+ + 2e. Она показывает, что постепенно запускается окисление, ионы металла начинают переход в раствор.
Катодный процесс
Может протекать по-разному.
В частности, переизбыток электронов решается ассимиляцией атомами электролита и его молекул. На фоне этого происходит восстановительная реакция непосредственно на самом катоде.
Формула будет зависеть от того, в каких условиях протекает реакция.
Так при наличии водородной деполяризации можно записать процесс как 2 H+ + 2e → H2.
Важно понимать, что оба процесса сильно связаны друг с другом под влиянием кинетического фактора.
С течением времени может происходить взаимное замедление или ускорение анодного или катодного процесса. При этом сам анод всегда будет оставаться тем местом, на котором формируется коррозия металла.
Во время анализа протекания процесса коррозии часто обращают внимание на электропроводящие фазы и момент после их соприкосновения.
Обычно одна фаза имеет положительный заряд, в то время как другая – отрицательный. Это приводит к появлению разности потенциалов.
Таким образом возникает ДЭС или как его часто называют ученые – двойной электрический слой с ассиметричным расположением частиц в местах, где фазы разделяются.

Опасным для металла становится скачок потенциалов. Он может стимулироваться двумя центральными причинами:
- Большая накопленная энергия гидратации. В таком случае наблюдается отрыв ионов металла и постепенное перетекание их в раствор. На поверхности в результате остается аналогичное число электронов, заряд становится отрицательным. Далее, в соответствии с законами физики, наблюдается перетекание катионов из раствора, формируется ДЭС на границе, как мы уже описывали выше.
- Разряжение катионов электролита. В результате металл начинает стремительно принимать положительный заряд. ДЭС появляется из-за активности анионов раствора в контакте с катионами электролита.
Что происходит в том случае, если поверхностный слой металла совсем не имеет определенного заряда?
В таком случае ДЭС наблюдаться не будет, возникнет явление нулевого заряда.
Его потенциал будет отличаться в зависимости от того, с каким металлом вам приходится работать.
Описанный процесс значительно отражается на том, как протекает коррозия и как быстро она захватывает все новые и новые участки металла.
В современной науке нет средств, которые могли бы точно измерить величину скачка потенциала, значит и процесс формирования электродвижущей силы оказывается на таким интенсивным.
Если рассматривать вопросы, связанные с процессом поляризации, можно написать отдельную статью на эту тему.
Потому далее мы рассмотрим другой важный показатель – поляризацию.
Поляризация и ее влияние на скорость протекания коррозии
Процесс поляризации связан с интенсивностью распространения электрохимической коррозии.
Этот показатель отражает, насколько сильное перенапряжение наблюдается на определенном участке.
Принято выделять три вида поляризации:
- Электрохимическая. Чаще всего наблюдается в ситуации, когда катодный и анодный процессы начинают замедляться.
- Фазовая. Возникает в том случае, если на поверхности материала формируется новая фаза.
- Концентрационная. Этот процесс появляется в том случае, если есть очень малые показатели скорости отвода продуктов коррозии, а также подхода деполяризатора.
Особенности поляризации также стоит учитывать в том случае, если вы заинтересованы в дополнительной защите металлов от постепенного разрушения.
Обеспечиваем эффективную защиту от коррозии
Наша компания предлагает заказчикам защиту металлоконструкций разных типов от коррозии.
В пользу работы с нами говорит сразу несколько факторов:
- Опыт работы с 2007 года, есть постоянные заказчики.
- Большие производственные площади. Три цеха для горячего цинкования, мощность 120 тысяч тонн в год.
- Универсальность. Работаем со множеством видов изделий благодаря установленной на предприятии самой глубокой ванны в ЦФО – 3,43 метра.
Мы используем в процессе проверенное европейское оборудование. Даем гарантию соответствия качества товаров требованиям ГОСТ 9.307-89.
Чтобы получить дополнительные консультации и ответы на интересующие вас вопросы, звоните нам или оставляйте заявку на сайте.
Химическая коррозия
Химическая коррозия металлов – это опасное явление, способное привести к их полному разрушению. Процесс напрямую связан со способностью материала вступать во взаимодействие со средой, представляющей повышенную химическую опасность.
Среди важных свойств протекания химической коррозии металла – параллельный процесс окисления и восстановления. Ученые не отмечают прямой связи с электрическим током, который потенциально может образовываться или воздействовать на участвующие в реакции материалы.
Если рассматривать первопричину распространения такого процесса, то мы быстро придем к выводу – она кроется в термической нестабильности металлов разных типов.
Они склонные под воздействием окислительных компонентов среды быстро переходить в устойчивое состояние и зачастую это происходит полностью непроизвольно.
Процесс окисления и восстановления при протекании химической коррозии происходит на фоне уменьшения потенциала системы. При этом нужно учитывать знаки изменения потенциала, чтобы предсказать риск произвольного запуска такого процесса и его интенсивного протекания внутри материала.
Ученые определяют основным критерием, который стимулирует самопроизвольный процесс, такой показатель, как изобарно-изотермический потенциал G.
Когда реакция начинает протекать произвольно, он значительно убывает. При этом скорость уменьшения может меняться в зависимости от типа материалов, условий коррозионной среды и ряда других ключевых параметров.
Основные виды химической коррозии
Ученые выделяют два основных типа химической коррозии. Газовая протекает при контакте поверхности металла с газами. Она усиливается по мере изменения температуры среды.
Также химическая коррозия способна активно протекать в жидкостях-электролитах, если для этого формируются необходимые внешние условия.
Рассмотрим особенности обоих описанных процессов более подробно, чтобы понять, как можно создать дополнительную защиту от них.
Газовая коррозия металлов
Научная статистика показывает, что газовая коррозия металлов протекает наиболее часто. При рассмотрении химической порчи она значительно более распространена, чем жидкостное ржавение при контакте с электролитами.
Важный фактор здесь – высокая температура. Если металл сильно нагрет и на него начинает воздействовать газ, происходит разрушение.
Так как уровень температур должен быть достаточно высок, а при обычном использовании создать условия для протекания такой химической коррозии довольно сложно, процесс часто наблюдается в металлургии.
Из-за этого страдает оборудование, используемое при штамповке, ковке, горячей прокатке и других процессах. Без дополнительной защиты длительность использования подобной техники станет значительно меньше.
Опасность представляет и контакт металла с кислородом. Формула реакции, которая запускается в таком случае, выглядит следующим образом: Ме + 1/2О2 – МеО.
Эта реакция имеет четкое окислительное направление, потому напрямую связана с показателями парциального кислородного давления. Стоит обратить внимание на то, что реакция может быть равновесной, смещенной к образованию оксида, либо протекающей в обратном направлении.
Очень важно понимать, с какой газовой смесью контактирует металл в той области, где вы его используете. Хорошее понимание парциального давления кислорода в смеси даст нам температурный интервал.
Именно в нем будет запускаться окислительный процесс, приводящий к разрушению материала или значительному ухудшению уровня его качества.
Факторы скорости протекания газовой химической коррозии
По мере исследования особенностей процесса протекания химической коррозии, ученые смогли определить важные факторы, которые влияют на ее скорость и другие особенности. К ним относятся такие, как:
- Температура среды, в которую погружен металл.
- Состав сплава и другие особенности металла.
- Особенности газовой среды, ее состав, преобладающие элементы.
- Длительность контактирования материала с коррозийной средой.
- Появляющийся продукт коррозии.
Как и в случае с другими типами коррозийных поражений, большое значение имеет тип и особенности создающейся на поверхности оксидной пленки.
Особенности формирования оксидных пленок при газовой коррозии
Весь процесс формирования оксидной пленки на поверхности металла можно разделить на две крупные стадии:
Абсорбирование молекул кислорода на поверхности металлического изделия
Это происходит на тех участках, которые находятся в непосредственном контакте с атмосферой. Заметно появление ионной связи – атом кислорода забирает у металла по два электрода.
Можно предположить, что формирование очень сильной и стабильной связи при протекании такой реакции связано с попаданием кислорода в особое поле атомов металла.
Когда поверхность материала будет полностью наполнена окислителем, окажется сформирована мономолекулярная пленка. Она имеет склонность к утолщению со временем. Это уменьшает дальнейший контакт с кислородом, но сам опасный коррозийный процесс уже оказывается запущен.
Формирование химического соединения
Это явление характерно для ситуации, в которой происходит активное взаимодействие металла и газа. Из-за воздействия окислительных компонентов сплав начинает активно терять валентные электроны. Стремительно формируются и накапливаются продукты коррозии.
Дальнейшее протекание процесса будет во многом характеризоваться особенностями оксидной пленки. Так если она отличается повышенным уровнем защиты, сам коррозийный процесс будет замедляться.
Виды оксидных пленок
Когда химическая коррозия происходит под действием температуры и газовой среды, могут сформироваться три вида пленок:
- Тонкие. Со стороны заметить их будет невозможно. Они одни из самых не прочных, могут легко стираться под действием механического давления.
- Средние. Могут быть замечены, потому что со стороны металл слегка меняет цвет.
- Толстые. Хорошо заметны невооруженным глазом.
Чтобы не допустить протекание опасных процессов разрушения материала, важно сделать пленку защитной.
Факторы формирования защитной пленки
Оксидная пленка способна оказывать выраженное защитное воздействие на материал. Но для этого требуется, чтобы она соответствовала нескольким важным требованиям:
- Сплошность. На поверхности пленка распределяется ровным слоем, без пор и участков, которые не затронуты ею.
- Хорошее сцепление с поверхностью материала. Это требуется для удержания подобного защитного барьера на месте и исключения ухудшения его свойств.
- Химическая инертность. Пленка будет защищать металл только в том случае, если она вступает в химические реакции с окружающей средой. В противном случае, есть большая опасность, что весь защитный эффект окажется сведен к нулю.
Так как материал будет использоваться на протяжении длительного времени и сложно предсказать, что станет воздействовать на него, большое значение имеет стойкость к износу и повышенный уровень твердости.
Не менее важен и тот факт, чтобы пленка не была пористой и рыхлой. Когда она плохо контактируется с поверхностью, риск протекания разрушающих процессов становится значительно выше.
При изучении различных свойств оксидных пленок, ученые особенно пристально рассматривают сплошность. Отмечается, что на нее влияет молекулярный объем. Его показатели должны быть выше атомного объема металла.
Сплошность не ставится на первое место при определении защитных свойств оксидной пленки только для небольшой группы металлов. В их числе щелочно-земельные и щелочные.
При проведении работ по защите от химической коррозии, большое внимание уделяется методу замера толщины. Анализ характеристик происходит на разных стадиях формирования. Большое значение имеют получаемые показатели скорости окисления металла и характер протекания подобного процесса.
Когда окислы оказываются сформированными, специалисты рекомендуют проверить, какую пленку они создали на поверхности, обладает ли она нужными защитными свойствами.
Химическая коррозия в жидкостях-неэлектролитах
Хотя газовая коррозия считается наиболее распространенной, порчу металла при контакте с различными жидкостями-электролитами также не стоит сбрасывать со счетов. Большую опасность представляет контакт материала с веществами, способными проводить электричество.
Их делят на две крупные группы – органические и неорганические. Электролитов, представляющих большую опасность для металла, много – от расплавленной серы и бензола до жидкого брома, спирта, керосина, нефти и других.
Большое значение при протекании химической реакции играет чистота электролита. Когда он полностью чист, взаимодействия не наблюдается. Но стоит только попасть в состав небольшому количеству примесей, реакция начинает развиваться особенно стремительно.
Еще один дополнительный фактор риска – присутствие влаги. Тогда к опасности химической коррозии также прибавляется и угроза электрохимической.
Стадии протекания коррозии в жидкостях-неэлектролитах
Если рассматривать весь процесс более подробно и анализировать, что влияет на скорость химической коррозии, можно выделить несколько стадий ее протекания:
- Контакт окислителя с поверхностью материала.
- Запуск процесса хемосорбции реагента на поверхности.
- Протекание реакции металла и окислителя, формирование оксидной пленки.
Условия среды, состав сплава и самого электролита могут повлиять на протекание нескольких основных процессов. К ним относятся такие, как десорбция оксидов с металлом и диффузия оксидов в неэлектролит. Но оба процесса также могут и не наблюдаться.
Чтобы не допустить запуска коррозии в жидкостях-электролитах, стоит позаботиться о нанесении на поверхность специальных защитных составов. Важно, чтобы на протяжении всего времени использования изделия они полностью сохраняли свою целостность.
Факторы протекания химической коррозии
Большое значение при рассмотрении процесса химической коррозии металлов имеет определение факторов, оказывающих на нее влияние. К ним относятся такие, как:
Температура
Все окислительные процессы протекают быстрее, если температура сильно увеличивается.
Температурный режим
В особой группе риска оказываются металлические изделия, которые на протяжении определенного времени начинают охлаждаться и нагреваться попеременно. В таком случае сильно страдает защитная пленка. Она начинает трескаться, в местах, где это происходит, металл контактирует со средой, запускается повторное окисление. Новая пленка также формируется на фоне постепенного отслоения старой.
Состав среды
Это относится как к газам, так и к электролитам в жидком виде. Как уже было отмечено выше, даже небольшие загрязнения жидкости могут привести к тому, что скорость коррозийного повреждения станет значительно выше.
Состав сплава
В сплав металла добавляют различные компоненты, которые могут, как затормозить, так и ускорить окисление. К примеру, сильными замедлителями признаны такие добавки, как титан, медь и кобальт. Хорошо влияют на уменьшение скорости протекания процесса хром и алюминий.
Тип обработки поверхности
Ученые во время исследований показали, что гладкая поверхность отличается заметно более высокой устойчивостью к окислению, процесс протекает медленнее. Если же на поверхности металла много бугров, есть выраженные дефекты, стоит готовиться к более быстрому протеканию.
Структура материала
Уравнение химической коррозии показывает, что значительное замедление коррозийного процесса характерно для металлов с аустенитной структурой.
Подведем итоги
В этой статье мы рассмотрели виды химической коррозии и то, чем она отличается от электрохимической. При условии соблюдения ряда требований, удается заметно уменьшить риск разрушения металла. К ним относятся такие, как:
- Контроль формирования защитной оксидной пленки.
- Исключение контакта определенных материалов с агрессивными средами.
- Использование дополнительных защитных покрытий.
- Отслеживание состава газовой смеси или электролита.
- Применение металлов с компонентами сплава, замедляющими реакцию.
Соблюдение перечисленных требований позволит значительно увеличить длительность использования вашего металлического изделия.
Читайте также:
