Европейская фармакопея тяжелые металлы
Фармацевтические субстанции — лекарственные средства в виде одного или нескольких обладающих фармакологической активностью действующих веществ вне зависимости от природы происхождения, предназначенные для производства, изготовления лекарственных препаратов и определяющие их эффективность.
Требования данной статьи распространяются преимущественно на фармацевтические субстанции химического и минерального происхождения. Для субстанций, представляющих собой стандартизованную смесь биологически активных веществ растительного или животного происхождения возможны отклонения от данных требований или дополнительные требования, указанные в фармакопейных статьях.
Требования данной статьи распространяются также на вспомогательные вещества, используемые при производстве/изготовлении лекарственных препаратов.
В качестве названия фармакопейной статьи на фармацевтическую субстанцию используется общепринятое название. Многие субстанции представляют собой соли органических кислот и органических оснований (например, Кеторолака трометамол, или Амлодипипа бесилат, или Доксазозина мезилат), органических кислот и неорганических оснований (например. Диклофенак натрия), неорганических кислот и органических оснований (например, Кетамина гидрохлорид). Названия фармакопейных
Во вводной части фармакопейной статьи на субстанцию приводят химическое название по номенклатуре IUPAC, структурную формулу, брутто -формулу и относительную молекулярную массу
Вводимые показатели контроля качества и пределы нормирования должны соответствовать назначению субстанции (например, для производства/изготовления стерильных лекарственных препаратов, или стерильных неиньекционных лекарственных препаратов, или нестерильных лекарственных препаратов, или нестерильных лекарственных препаратов для местного и наружного применения и т.д.).
Испытания по показателям контроля качества фармацевтической субстанции проводят согласно соответствующим общим фармакопейным статьям (ОФС).
Описание.
Указывают характеристики физического состояния и цвет субстанции. Не следует включать описание вкуса. В необходимых случаях приводят информацию о запахе, гигроскопичности и полиморфизме.
Для твердых субстанций необходимо указание формы вещества: «кристаллический», «мелкокристаллический» или «аморфный порошок». Характеристика кристалличности субстанции является одним из важных параметров, от которого зависит качество твердых дозированных лекарственных препаратов.
В некоторых случаях может быть указан численный диапазон размера частиц, а также введено исследование формы кристаллов. Такие испытания выносят в отдельные разделы.
Оценка полиморфизма субстанции обязательна в тех случаях, когда полиморфная модификация определяет фармакологическую активность лекарственного препарата и его фармако-технологические свойства.
Растворимость.
Для определения растворимости следует использовать растворители, охватывающие широкую шкалу полярности, например: вода, спирт 96 %, гексан и др. Не рекомендуется использование легкокипящих и легковоспламеняющихся (например, диэтиловый эфир) или очень токсичных (например, бензол) растворителей.
Подлинность.
Для установления подлинности субстанции рекомендуются физико-химические и химические методы — инфракрасная спектрометрия, абсорбционная спектрофотометрия, ЯМР-спектроскопия, тонкослойная, газовая и высокоэффективная жидкостная хроматография (ТСХ, ГХ и ВЭЖХ) и качественные (в первую очередь специфические) химические реакции. Метод ИК-спектрометрии является приоритетным при идентификации субстанций.
Температура плавления.
Испытание обычно применяют для характеристики твердых веществ.
Температура затвердевания. Температура кипения (температурные пределы перегонки), Плотность, Вязкость, Показатель преломления.
Данные испытания вводят для характеристики жидких субстанций.
Удельное вращение.
Вводят для характеристики оптически активных веществ.
Удельный показатель поглощения.
Данный показатель может являться дополнительной характеристикой подлинности и чистоты субстанции.
Прозрачность раствора, Цветность раствора.
Данные испытания обязательно вводят для субстанций, используемых для приготовления парентеральных, глазных, назальных и ушных лекарственных средств. Испытание обычно проводят в водных растворах субстанции, но возможно использование органических и смешанных растворителей. Концентрация испытуемых растворов должна быть приближена к концентрации производимого/изготавливаемого из этой субстанции лекарственного препарата.
Определение цветности раствора особенно важно для оценки качества белых, почти белых или белых с оттенком субстанций.
Если субстанция окрашена, показатель «Цветность раствора» в нормативную документацию включать не следует. Это испытание, если необходимо, можно заменить регламентацией оптической плотности при определенных длинах волн.
pH и Кислотность или Щелочность.
Для проведения данного испытания могут использоваться два подхода: измерение pH или кислотно-основное индикаторное титрование (кислотность или щелочность). Испытание обычно проводят в водных растворах субстанции, но в отдельных случаях возможно использование и смешанных растворителей. Допустимый интервал pH обычно должен быть не более 2.
Концентрация испытуемого раствора при определении pH должна быть приближена к концентрации изготавливаемого из субстанции лекарственного препарата.
Родственные примеси
Данное испытание контролирует продукты деструкции фармацевтической субстанции и технологические примеси, обусловленные технологией производства. Примеси могут быть идентифицированные (соединения с установленным химическим строением) и неидентифицированные (соединения, строение которых не установлено). Пределы содержания родственных примесей в фармацевтических субстанциях приводят с учетом параметров их безопасности. Пределы контроля, идентификации и квалификации родственных примесей для фармацевтических субстанций (в зависимости от максимальной суточной дозы лекарственного препарата) приведены в табл. 1 и 2.
Таблица 1. Пределы контроля, идентификации и квалификации родственных примесей в фармацевтических субстанциях
* предел, выше которою примесь должна контролироваться
** предел, выше которого примесь должна быть идентифицирована
***предел, выше которого должна быть установлена биологическая безопасность примеси
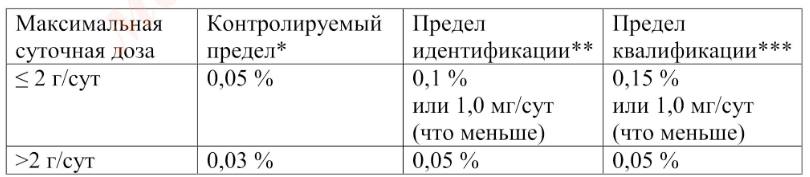
Приведенные пределы учитываются при нормировании родственных примесей в фармацевтических субстанциях.
Таблица 2. Пределы контроля, идентификации и квалификации родственных примесей в пептидах, полученных синтетическим путём
Для контроля родственных соединений обычно используют хроматографические и, реже, спектроскопические методы. Обязательно вводится идентификация и количественное определение токсичных примесей с использованием стандартных образцов.
Неорганические анионы (хлориды, сульфаты и др.).
Выбор контролируемых анионов определяется технологией получения субстанции. При этом контролируемые анионы могут быть нетоксичными (например, хлориды, сульфаты и т.д.).
Контроль анионов не вводят, если они входят в состав субстанции (например, субстанция является гидрохлоридом или сульфатом).
Неорганические катионы (железо, медь и др.).
Это испытание вводят, если контроль содержания отдельных катионов является существенным для качества субстанции; их содержание должно быть обосновано.
Контроль катионов не вводят, если они входят в состав субстанции (например, вещество является натриевой солыо).
Потеря в массе при высушивании или Вода.
Испытание вводят для контроля содержания летучих веществ и/или влаги в субстанции. Введение одного из этих испытаний, как правило, обязательно. Отсутствие их должно быть обосновано. Если нет других указаний в фармакопейной статье и субстанция не является кристаллогидратом (кристаллосольватом), потеря в массе при высушивании или содержание воды, как правило, не должно превышать 0,5 %. Результаты определения по этим показателям учитывают при оценке результатов количественного определения.
Если субстанция является кристаллогидратом (кристаллосольватом), регламентируют верхний и нижний пределы.
Сульфатная зола.
Как правило, сульфатная зола не должна превышать 0,1 %. Отсутствие этого испытания в фармакопейной статье или повышенное содержание сульфатной золы требует соответствующего обоснования.
Тяжелые металлы.
Устанавливаемые пределы содержания тяжелых металлов в фармацевтических субстанциях определяются максимальной суточной дозой препарата, произведенного из данной субстанции, и длительностью его возможною применения (согласно Инструкции по медицинскому применению) (табл. 3).
Мышьяк.
Данное испытание вводят в том случае, когда или исходное сырье может содержать мышьяк, например, для сырья природного происхождения, или возможно загрязнение им в процессе получения субстанции. Содержание мышьяка, как правило, не должно превышать 0,0001 %.
Таблица 3. Критерии для нормирования допустимого содержания тяжелых металлов
| Суточная доза, г/день | Длительность лечения, дни | Введение показателя «Тяжелые металлы» и устанавливаемый предел, ppm |
| >0.5 | Вводится показатель «Тяжелые металлы», предел — 20 | |
| >0,5 | >30 | Вводится показатель «Тяжелые металлы», предел — 10 |
| < 0.5 | >30 | Вводится показатель «Тяжелые металлы». Если субстанция предназначена для производства парентеральных препаратов, то предел — 10, в других случаях — 20. |
| < 0,5 | < 30 | Показатель «Тяжелые металлы» не вводится |
Остаточные органические растворители.
В фармацевтических субстанциях определяют остаточные количества органических растворителей 1 касса токсичности, если обосновано их применение, независимо от стадии, на которой они используются.
Для растворителей 2 класса токсичности, используемых не на последней стадии производства фармацевтических субстанций, в нормативной документации должен быть предусмотрен контроль их остаточного содержания, либо должно быть приведено обоснование отсутствия контроля их остаточного содержания; если растворители 2 класса токсичности используются на последней стадии, каждый из них должен быть определен количественно.
В фармацевтических субстанциях контроль растворителей 3 класса токсичности необходим, если они используются на последней стадии производства. Для определения остаточных количеств растворителей 3 класса токсичности, если их содержание не превышает 0,5 %, допускается применение неспецифического метода «Потеря в массе при высушивании»; при наличии растворителей 3 класса, если их содержание превышает 0,5 %, каждый из них должен быть определен количественно.
Испытания на бактериальные эндотоксины, пирогенность, аномальную токсичность, гистамин и/или депрессорные вещества не распространяются на вспомогательные вещества.
Бактериальные эндотоксины или Пирогенность.
Данные испытания проводят для субстанций, предназначенных для приготовления лекарственных форм для парентерального применения. Субстанции должны выдерживать тест на бактериальные эндотоксины или пирогенность без проведения предварительной стерилизации.
Если доказано, что субстанция не обладает пирогенными свойствами и в процессе производства не может быть загрязнена пирогенными примесями ые бактериальной природы, то следует проводить испытание на «Бактериальные эндотоксины».
Включение показателей «Пирогенность» и «Бактериальные эндотоксины» на альтернативной основе нецелесообразно ввиду различной чувствительности методов.
Аномальная токсичность
Испытанию на аномальную токсичность подлежат субстанции, получаемые из крови, органов, тканей человека или животного, растительного сырья, микроорганизмов и продуктов их жизнедеятельности, предназначенные для производства лекарственных препаратов для парентерального применения.
Гистамин и/или Депрессорные вещества
Испытанию на гистамин и депрессорные вещества подлежат субстанции, которые используются для приготовления лекарственных препаратов, предназначенных только для внутрисосудистого введения, и если в их составе могут быть изначально или приобретаются в процессе производства примеси, обладающие депрессорным действием (субстанции микробиологического или животного происхождения).
Микробиологическая чистота.
Уровень микробиологической чистоты субстанции должен обеспечивать уровень чистоты лекарственного препарата при его производстве/изготовлении из этой субстанции.
Стерильность.
Данное испытание вводят для субстанций, используемых в производстве готовых стерильных лекарственных средств, которые не подвергаются процедуре стерилизации.
Количественное определение.
Для количественною определения действующего вещества субстанции используют физико-химические и химические методы анализа.
Физико-химические и химические методы анализа для определения содержания действующего вещества в субстанции следует применять в сочетании с современными физико-химическими методами анализа, используемыми для идентификации субстанции и контроля примесей (ИК-спектрофотометрия, ВЭЖХ, ГХ и др.).
В случае солей обычно достаточно анализа только одного из ионов — предпочтительно фармакологически активного.
Содержание действующего вещества дается в пересчете на сухое вещество, если определяется потеря в массе при высушивании, в пересчете на безводное вещество, если определяется вода, в пересчете на безводное и свободное от остаточных органических растворителей вещество, если определяется вода» и остаточные органические растворители.
Упаковка и хранение.
Упаковка и условия хранения должны обеспечивать качество субстанции в течение установленного срока годности.
Маркировка.
Должна включать торговое и международное непатентованное наименование, информацию о назначении субстанции, наименование производителя, количество, условия хранения, меры предосторожности (при необходимости), дату изготовления, номер серии, срок годности и условия хранения.
Срок годности.
Срок годности субстанций определяется временем, в течение которого она соответствует требованиям нормативной документации. Срок годности субстанции может быть установлен хранением при обычных условиях или методом «ускоренного старения» при повышенной температуре.
Стандартные образцы.
Современные методы анализа предусматривают использование стандартных образцов. В качестве стандартных образцов при анализе фармацевтических субстанций следует использовать фармакопейные стандартные образцы, аттестованные уполномоченным фармакопейным органом. При их отсутствии для идентификации и оценки содержания действующего вещества должны использоваться первичные стандартные образцы.
Фармацевтические субстанции (ОФС.1.1.0006.15)
Государственная фармакопея 13 издание том 1,2,3 (ГФ XIII online)
Государственная фармакопея 13 издание том 1 (ГФ XIII, ГФ 13 том 1) онлайн

Введение. Перечни ОФС и ФС
- Перечень общих фармакопейных статей, впервые вводимых в действие
- Перечень фармакопейных статей, впервые вводимых в действие
- Перечень общих фармакопейных статей, действие которых прекращено
1. Общие фармакопейные статьи
1.1. Общие статьи (ГФ 13)
1.2. Методы анализа (ГФ 13)
1.2.1. Методы физического и физико-химического анализа
- 1.2.1.1. Спектроскопические методы анализа
- 1.2.1.19.1. Амперометрическое титрование (ОФС.1.2.1.19.0001.15)
- 1.2.1.19.2. Потенциометрическое титрование (ОФС.1.2.1.19.0002.15)
1.2.2. Методы химического анализа
- 1.2.2.2.1. Алюминий (ОФС.1.2.2.2.0001.15)
- 1.2.2.2.2. Аммоний (ОФС.1.2.2.2.0002.15)
- 1.2.2.2.3. Кальций (ОФС.1.2.2.2.0003.15)
- 1.2.2.2.4. Мышьяк (ОФС.1.2.2.2.0004.15)
- 1.2.2.2.5. Ртуть (ОФС.1.2.2.2.0005.15)
- 1.2.2.2.6. Селен (ОФС.1.2.2.2.0006.15)
- 1.2.2.2.7. Сульфаты (ОФС.1.2.2.2.0007.15)
- 1.2.2.2.8. Фосфаты (ОФС.1.2.2.2.0008.15)
- 1.2.2.2.9. Хлориды (ОФС.1.2.2.2.0009.15)
- 1.2.2.2.10. Цинк (ОФС.1.2.2.2.0010.15)
- 1.2.2.2.11. Железо (ОФС.1.2.2.2.0011.15)
- 1.2.2.2.12. Тяжелые металлы (ОФС.1.2.2.2.0012.15)
- 1.2.2.2.13. Зола общая (ОФС.1.2.2.2.0013.15)
- 1.2.2.2.14. Сульфатная зола (ОФС.1.2.2.2.0014.15)
1.2.3.Методы количественного определения
1.2.4.Методы биологического анализа
1.3.Реактивы (ГФ 13)
Государственная фармакопея 13 издание том 2 (ГФ XIII, ГФ 13 том 2) онлайн
1.4. Лекарственные формы и методы их анализа (ГФ 13)
1.4.1. Лекарственные формы
1.4.2. Фармацевтико-технологические испытания лекарственных форм
1.5. Лекарственное растительное сырье и методы его анализа (ГФ 13)
1.5.1. Морфологические группы лекарственного растительного сырья
1.5.2. Лекарственные средства растительного происхождения
1.5.3. Методы анализа лекарственного растительного сырья
1.7. Группы иммунобиологических лекарственных препаратов и методы их анализа (ГФ 13)
1.7.1. Группы иммунобиологических лекарственных препаратов
1.7.2. Методы анализа иммунобиологических лекарственных препаратов
1.8. Лекарственные препараты из крови и плазмы крови человека и животных и методы их анализа (ГФ 14)
1.8.1. Группы лекарственных препаратов из крови и плазмы крови человека и животных
1.8.2. Методы анализа лекарственных препаратов, полученных из крови и плазмы крови человека и животных
1.11. Радиофармацевтические лекарственные средства
Государственная фармакопея 13 издание том 3 (ГФ XIII, ГФ 13 том 3) онлайн
2. Фармакопейные статьи
2.1. Фармацевтические субстанции синтетического происхождения (ГФ 13)
2.2. Фармацевтические субстанции минерального происхождения (ГФ 13)
2.5. Лекарственное растительное сырье (ГФ 13)
3. Лекарственные препараты
3.3. Биологические лекарственные препараты (ГФ 13)
3.3.1. Иммунобиологические лекарственные препараты
3.3.2. Лекарственные препараты, полученные из крови и плазмы крови человека
Сравнительный анализ содержания тяжелых металлов и мышьяка в различных лекарственных формах растительных препаратов российского фармацевтического рынка Текст научной статьи по специальности «Фундаментальная медицина»
ЛЕКАРСТВЕННЫЕ РАСТИТЕЛЬНЫЕ ПРЕПАРАТЫ / ЛЕКАРСТВЕННОЕ РАСТИТЕЛЬНОЕ СЫРЬЕ / ЭКСТРАКТЫ / НАСТОЙКИ / СОДЕРЖАНИЕ ТЯЖЕЛЫХ МЕТАЛЛОВ / НОРМИРОВАНИЕ / МЫШЬЯК / КАДМИЙ / СВИНЕЦ / РТУТЬ / ЭЛЕМЕНТНЫЕ ТОКСИКАНТЫ / МАСС-СПЕКТРОМЕТРИЯ С ИНДУКТИВНО-СВЯЗАННОЙ ПЛАЗМОЙ / HERBAL MEDICINAL PRODUCTS / HERBAL SUBSTANCES / EXTRACTS / TINCTURES / HEAVY METAL CONTENT / SETTING LIMITS / ARSENIC / CADMIUM / LEAD / MERCURY / ELEMENTAL TOXICANTS / INDUCTIVELY COUPLED PLASMA MASS SPECTROMETRY
Аннотация научной статьи по фундаментальной медицине, автор научной работы — Щукин В.М., Кузьмина Н.Е., Швецова Ю.Н., Лутцева А.И.
Введение в Государственную фармакопею Российской Федерации (ГФ РФ) требований по раздельному определению мышьяка , кадмия , ртути и свинца, а также современных способов пробоподготовки требует актуализации существующих норм по содержанию элементных токсикантов в лекарственном растительном сырье (ЛРС) и лекарственных растительных препаратах (ЛРП) на его основе.Цель работы: анализ данных по содержанию элементных токсикантов , полученных при проведении экспертизы качества ЛРП (трав, сборов, экстрактов и настоек) с помощью современных методов анализа и пробоподготовки, а также сравнение полученных результатов с отечественными и зарубежными данными научной и специальной литературы.Материалы и методы: собственные экспериментальные данные по содержанию нормируемых тяжелых металлов и мышьяка в различных лекарственных формах лекарственных растительных препаратов , полученные методом масс-спектрометрии с индуктивно-связанной плазмой с использованием в качестве пробоподготовки разложения в закрытых сосудах, сравнивались с данными других авторов.Результаты: установлено, что содержание свинца, кадмия и ртути во всех исследованных образцах не превышает установленных в ГФ РФ норм и соответствует проанализированным данным литературы. Содержание мышьяка в ряде ЛРП превышает российские нормативы, но удовлетворяет менее жестким нормам Европейской фармакопеи и Фармакопеи США для ЛРС. Изучена зависимость содержания элементных токсикантов от места сбора и морфологических частей растений. Отмечена особенность накопления отдельных элементов различными видами лекарственных растений. Определено содержание нормируемых элементов в экстрактах и настойках . Сделано предположение, что различие содержания элементных токсикантов в отечественных и зарубежных требованиях связано со способом получения экспериментальных данных, которые являются основой нормирования .Выводы: проведенные исследования позволяют сделать выводы о пригодности существующих норм содержания элементных токсикантов в ЛРП. Обоснована необходимость пересмотра существующих требований по содержанию мышьяка в ЛРП.
Похожие темы научных работ по фундаментальной медицине , автор научной работы — Щукин В.М., Кузьмина Н.Е., Швецова Ю.Н., Лутцева А.И.
Сравнительный анализ отечественного и зарубежного подходов к нормированию мышьяка в лекарственном растительном сырье
Comparative Analysis of Heavy Metal and Arsenic Content in Various Herbal Dosage Forms Marketed in Russia
The inclusion of requirements for independent determination of arsenic , cadmium , mercury , and lead , and the current sample preparation techniques into the State Pharmacopoeia of the Russian Federation (Ph. Rus.) requires the revision of the existing limits for elemental toxicants in herbal substances and herbal medicinal products produced from them.The aim of the study was to analyse the data on elemental toxicant content obtained during quality control of herbal substances (herbs, medicinal herb mixtures, extracts , and tinctures ) using current test methods and sample preparation techniques, and to compare the obtained results with the Russian and foreign scientific and specialist literature.Materials and methods: the internal data on the content of critical heavy metals and arsenic in different dosage forms of herbal medicinal products , which were obtained by inductively coupled plasma mass spectrometry after sample preparation by decomposition in closed vessels, were compared with literature data. Results: it was demonstrated that the content of lead , cadmium , and mercury in all the test samples did not exceed the Ph. Rus. limits and was consistent with the analysed literature. The arsenic content in some herbal medicinal products was higher than the established Ph. Rus. limits, but complied with the less stringent Ph. Eur. and USP requirements for herbal substances . The authors investigated the link between the content of elemental toxicants and the place of collection and the part of the plant being tested. It was shown that different types of medicinal plants had a tendency to accumulate particular elements. The authors determined the content of the elements to be controlled in extracts and tinctures . The differences in the Russian and foreign requirements for the content of elemental toxicants may be attributed to the method of obtaining experimental data that form the basis for the setting of limits.Conclusions: the results of the study confirm the validity of the existing limits for elemental toxicants in herbal medicinal products . The authors demonstrated the need to revise the existing limits for arsenic in herbal medicinal products .
Текст научной работы на тему «Сравнительный анализ содержания тяжелых металлов и мышьяка в различных лекарственных формах растительных препаратов российского фармацевтического рынка»
Сравнительный анализ содержания тяжелых металлов и мышьяка в различных лекарственных формах растительных препаратов российского фармацевтического рынка
В. М. Щукин*, Н. Е. Кузьмина, Ю. Н. Швецова, А. И. Лутцева
Федеральное государственное бюджетное учреждение «Научный центр экспертизы средств медицинского применения» Министерства здравоохранения Российской Федерации, Петровский бульвар, д. 8, стр. 2, Москва, 127051, Российская Федерация
Резюме. Введение в Государственную фармакопею Российской Федерации (ГФ РФ) требований по раздельному определению мышьяка, кадмия, ртути и свинца, а также современных способов пробоподготовки требует актуализации существующих норм по содержанию элементных токсикантов в лекарственном растительном сырье (ЛРС) и лекарственных растительных препаратах (ЛРП) на его основе. Цель работы: анализ данных по содержанию элементных токсикантов, полученных при проведении экспертизы качества ЛРП (трав, сборов, экстрактов и настоек) с помощью современных методов анализа и пробоподготовки, а также сравнение полученных результатов с отечественными и зарубежными данными научной и специальной литературы. Материалы и методы: собственные экспериментальные данные по содержанию нормируемых тяжелых металлов и мышьяка в различных лекарственных формах лекарственных растительных препаратов, полученные методом масс-спектрометрии с индуктивно-связанной плазмой с использованием в качестве пробоподготовки разложения в закрытых сосудах, сравнивались с данными других авторов. Результаты: установлено, что содержание свинца, кадмия и ртути во всех исследованных образцах не превышает установленных в ГФ РФ норм и соответствует проанализированным данным литературы. Содержание мышьяка в ряде ЛРП превышает российские нормативы, но удовлетворяет менее жестким нормам Европейской фармакопеи и Фармакопеи США для ЛРС. Изучена зависимость содержания элементных токсикантов от места сбора и морфологических частей растений. Отмечена особенность накопления отдельных элементов различными видами лекарственных растений. Определено содержание нормируемых элементов в экстрактах и настойках. Сделано предположение, что различие содержания элементных токсикантов в отечественных и зарубежных требованиях связано со способом получения экспериментальных данных, которые являются основой нормирования. Выводы: проведенные исследования позволяют сделать выводы о пригодности существующих норм содержания элементных токсикантов в ЛРП. Обоснована необходимость пересмотра существующих требований по содержанию мышьяка в ЛРП.
Ключевые слова: лекарственные растительные препараты; лекарственное растительное сырье; экстракты; настойки; содержание тяжелых металлов; нормирование; мышьяк; кадмий; свинец; ртуть; элементные токсиканты; масс-спектрометрия с индуктивно-связанной плазмой
Comparative Analysis of Heavy Metal and Arsenic Content in Various Herbal Dosage Forms Marketed in Russia
V. M. Shchukin*, N. E. Kuz'mina, Yu. N. Shvetsova, A. I. Luttseva
Scientific Centre for Expert Evaluation of Medicinal Products, 8/2 Petrovsky Blvd, Moscow 127051, Russian Federation
Abstract. The inclusion of requirements for independent determination of arsenic, cadmium, mercury, and lead, and the current sample preparation techniques into the State Pharmacopoeia of the Russian Federation (Ph. Rus.) requires the revision of the existing limits for elemental toxicants in herbal substances and herbal medicinal products produced from them. The aim of the study was to analyse the data on elemental toxicant content obtained during quality control of herbal substances (herbs, medicinal herb mixtures, extracts, and tinctures) using current test methods and sample preparation techniques, and to compare the obtained results with the Russian and foreign scientific and specialist literature. Materials and methods: the internal data on the content of critical heavy metals and arsenic in different dosage forms of herbal medicinal products, which were obtained by inductively coupled plasma mass spectrometry after sample preparation by decomposition in closed vessels, were compared with literature data. Results: it was demonstrated that the content of lead, cadmium, and mercury in all the test samples did not exceed the Ph. Rus. limits and was consistent with the analysed literature. The arsenic content in some herbal medicinal products was higher than the established Ph. Rus. limits, but complied with the less stringent Ph. Eur. and USP requirements for herbal substances. The authors investigated the link between the content of elemental toxicants and the place of collection and the part of the plant being tested. It was shown that different types of medicinal plants had a tendency to accumulate particular elements. The authors determined the content of the elements to be controlled in extracts and tinctures. The differences in the Russian and foreign requirements for the
content of elemental toxicants may be attributed to the method of obtaining experimental data that form the basis for the setting of limits. Conclusions: the results of the study confirm the validity of the existing limits for elemental toxicants in herbal medicinal products. The authors demonstrated the need to revise the existing limits for arsenic in herbal medicinal products. Key words: herbal medicinal products; herbal substances; extracts; tinctures; heavy metal content; setting limits; arsenic; cadmium; lead; mercury; elemental toxicants; inductively coupled plasma mass spectrometry
В XX веке синтетические лекарственные средства заметно потеснили в лечебной и в профилактической практике исторически применяемые лекарственные препараты на растительной основе. Многим синтетическим сильнодействующим препаратам присущи различные нежелательные, даже опасные побочные эффекты, в то время как для лекарственных растительных препаратов (ЛРП) характерны достаточно высокая безопасность при заметной эффективности, простота приготовления и возможность длительного применения. Таким образом, в настоящее время возрождается интерес к лечебно-профилактическим лекарственным растительным препаратам и наблюдается тенденция роста рынка ЛРП как в национальном, так и в общемировом масштабе [1—3].
Одним из важнейших факторов риска применения ЛРП является потенциальная возможность загрязнения лекарственного растительного сырья (ЛРС), используемого для производства ЛРП, элементными токсикантами: мышьяком, кадмием, ртутью и свинцом (в качестве сырья в Российской Федерации в основном используются дикорастущие растения) [4, 5]. Совершенствование методов элементного анализа и рост объема экспериментальных данных, полученных в ходе изучения антропогенного воздействия на ЛРС, привели к изменению требований нормативной документации, регламентирующей контроль качества ЛРС и ЛРП по показателю «содержание тяжелых металлов и мышьяка» [6]. В первую очередь это касается замены методик суммарного определения содержания элементов в ЛРС и ЛРП калориметрическим методом на методики их селективного определения спектральными методами (атомно-абсорб-ционной спектроскопией, атомно-эмиссионной спектрометрией с индуктивно-связанной плазмой (ИСП-АЭС), масс-спектрометрией с индуктивно-связанной плазмой (ИСП-МС)). Шагом вперед
стало включение в отечественную фармакопею способа микроволнового разложения образцов в закрытых сосудах в качестве метода пробопод-готовки для арбитражного контроля1. Данный метод пробоподготовки ЛРП включен в Европейскую фармакопею (Ph. Eur.)2, Фармакопею США (USP)3 и проект фармакопеи ЕАЭС4. Государственной фармакопеей Российской Федерации (ГФ РФ) XIII изд. (ОФС.1.5.3.0009.15) были впервые введены нормы по предельной допустимой концентрации (ПДК) мышьяка, кадмия, свинца и ртути в ЛРС и ЛРП без учета лекарственной формы ЛРП, вида и морфологической части ЛРС, используемого для их получения.
В связи с этим актуально проведение сравнительного анализа содержания тяжелых металлов и мышьяка в различных лекарственных формах ЛРП, определенного современными фармакопейными методами с использованием процедуры про-боподготовки, исключающей искажение результатов измерения. Такой анализ важен для критической оценки приведенных в ГФ РФ XIV изд. норм по содержанию элементных токсикантов в ЛРП6.
Цель работы — анализ собственных экспериментальных данных по содержанию нормируемых тяжелых металлов и мышьяка в различных лекарственных формах лекарственных растительных препаратов и сравнение их с данными литературы.
1 ОФС.1.5.3.0009.15. Определение содержания тяжелых металлов и мышьяка в лекарственном растительном сырье и лекарственных растительных препаратах. Государственная фармакопея Российской Федерации XIII изд. Т. 2. 2015.
2 Heavy metals analysis in herbal drugs and herbal drug preparations. General Chapter 2427. European Pharmacopoeia, 9th ed., Supplement 9.2. 2017.
3 Articles of Botanical Origin. General Chapters 561. United State Pharmacopeia, 40th ed. 2017.
4 ОФС.2.4.27. Тяжелые металлы и мышьяк в лекарственном растительном сырье и лекарственных растительных препаратах (проект). Фармакопея Евразийского экономического союза.
5 ГОСТ 26929-94. Сырье и продукты пищевые. Подготовка проб. Минерализация для определения содержания токсичных элементов. М.: Издательство стандартов; 1994.
6 ОФС.1.5.3.009.15. Определение содержания тяжелых металлов и мышьяка в лекарственном растительном сырье и лекарственных растительных препаратах. Государственная фармакопея Российской Федерации XIV изд. Т. 2. 2018.
Читайте также:
