Электронное строение и физические свойства металлов
Если провести в Периодической таблице Д.И. Менделеева символическую линию из верхнего левого угла в нижний правый угол, то все элементы, находящиеся ниже этой линии, будут металлами.
Металлы можно охарактеризовать при помощи нескольких свойств, которые будут общими для всех элементов. К таким характеристикам следует отнести высокую электрическую проводимость и теплопроводность, пластичность, благодаря которой металлы можно подвергать ковке, прокатке, штамповке или вытягиванию в проволоку, металлический блеск и непрозрачность.
В зависимости от температуры кипения все металлы подразделяют на тугоплавкие (Tкип> 1000 o С) и легкоплавкие (Tкип< 1000 o С). Примером тугоплавких металлов может быть – Au, Cu, Ni, W, легкоплавких – Hg, K, Al, Zn.
Электронное строение металлов и их особенности
Атомы металлов, также как, и неметаллов состоят из положительно заряженного ядра внутри которого находятся протоны и нейтроны, а по орбитам вокруг него движутся электроны. Однако, по сравнению с неметаллами, атомные радиусы металлов намного больше. Это связано с тем, что валентные электроны атомов металлов (электроны внешнего энергетического уровня) расположены на значительном удалении от ядра и, как следствие, связаны с ним слабее. По этой причине металлы характеризуются низкими потенциалами ионизации и легко отдают электроны (являются восстановителями в ОВР) при образовании химической связи.
Все металлы за исключением ртути представляют собой твердые вещества с атомной кристаллической решеткой. Рассмотрим строение металлов в кристаллическом состоянии. В атомах металлов имеются «свободные» электроны (электронный газ), которые могут перемещаться по кристаллу даже под действием слабых электрических полей, что обусловливает высокую электропроводимость металлов.
Среди металлов присутствуют s-, p-, d- и f-элементы. Так, s- элементы – это металлы I и II групп Периодической системы (ns 1 , ns 2 ), р- элементы – металлы, расположенные в группах III – VI (ns 2 np 1-4 ). Металлы d-элементы имеют большее число валентных электронов по сравнению с металлами s- и p-элементами. Общая электронная конфигурация валентных электронов металлов d-элементов – (n-1)d 1-10 ns 2 . Начиная с 6 периода появляются металлы f-элементы, которые объединены в семейства по 14 элементов (за счет сходных химических свойств) и носят особые названия лантаноидов и актиноидов. Общая электронная конфигурация валентных электронов металлов f-элементов – (n-2)f 1-14 (n-1)d 0-1 ns 2 .
Примеры решения задач
| Задание | При взаимодействии 6,0 г металла с водой выделилось 3,36 л водорода (н.у.). Определите этот металл, если он в своих соединениях двухвалентен. |
| Решение | Запишем уравнение реакции растворения металла в воде. Поскольку металл двухвалентен, его реакция с водой будет описываться уравнением следующего вида: |
Согласно уравнению реакции:
N (Ме) =n (Н2) = 3,36/22,4 = 0,15 моль.
Найдем относительную атомную массу металла:
Ar(Ме) = m / n= 6,0/0,15 = 40 г/моль
Следовательно, этот металл — кальций.
| Задание | При действии на смесь меди и железа массой 20 г избытком соляной кислоты выделилось 5,6 л газа (н.у.). Определить массовые доли металлов в смеси. |
| Решение | Известно, что медь не растворяется в соляной кислоте, поскольку стоит в ряду активности металлов после водорода, т.е. выделение водорода происходит только в результате взаимодействия хлороводородной кислоты с железом. |
Запишем уравнение реакции:
Найдем количество вещества водорода:
Согласно уравнению реакции n(H2) : n(Fe) = 1:1, т.е.n(H2) = n(Fe) = 0,25 моль. Тогда масса железа будет равна (молярная масса – 56 г/моль):
Физические свойства металлов

Физические свойства металлов отличают их от неметаллов. Все металлы, кроме ртути, – твёрдые кристаллические вещества, являющиеся восстановителями в окислительно-восстановительных реакциях.
Положение в таблице Менделеева
Металлы занимают I-II группы и побочные подгруппы III-VIII групп. Металлические свойства, т.е. способность отдавать валентные электроны или окисляться, увеличиваются сверху вниз по мере увеличения количества энергетических уровней. Слева направо металлические свойства ослабевают, поэтому наиболее активные металлы находятся в I-II группах, главных подгруппах. Это щелочные и щелочноземельные металлы.
Определить степень активности металлов можно по электрохимическому ряду напряжений. Металлы, стоящие до водорода, наиболее активны. После водорода стоят слабоактивные металлы, не вступающие в реакцию с большинством веществ.
Строение
Вне зависимости от активности все металлы имеют общее строение. Атомы в простом металле расположены не хаотично, как в аморфных веществах, а упорядоченно – в виде кристаллической решётки. Удерживает атомы в одном положении металлическая связь.
Такой вид связи осуществляется за счёт положительно заряженных ионов, находящихся в узлах кристаллической ячейки (единицы решётки), и отрицательно заряженных свободных электронов, которые образуют так называемый электронный газ. Электроны отделились от атомов, превратив их в ионы, и стали перемещаться в решётке хаотично, скрепляя ионы вместе. Без электронов решётка бы распалась за счёт отторжения одинаково заряженных ионов.
Различают три типа кристаллической решётки. Кубическая объемно-центрированная состоит из 9 ионов и характерна хрому, железу, вольфраму. Кубическая гранецентрированная включает 14 ионов и свойственная свинцу, алюминию, серебру. Из 17 ионов состоит гексагональная плотноупакованная решётка цинка, титана, магния.
Свойства
Строение кристаллической решётки определяет основные физические и химические свойства металлов. Металлы блестят, плавятся, проводят тепло и электричество. Промышленность и металлургия нашли применение физическим свойствам металлов в изготовлении деталей, фольги, корпусов машин, зеркал, бытовой и промышленной химии. Особенности металлов и их использование представлены в таблице физических свойств металлов.
Свойства
Особенности
Примеры
Применение
Способность отражать солнечный свет
Наиболее блестящими металлами являются Hg, Ag, Pd
Лёгкие – имеют плотность меньше 5 г/см 3
Na, K, Ba, Mg, Al. Самый лёгкий металл – литий с плотностью 0,533 г/см 3
Изготовление облицовки, деталей самолётов
Тяжёлые – имеют плотность больше 5 г/см 3
Sn, Fe, Zn, Au, Pb, Hg. Самый тяжёлый – осмий с плотностью 22,5 г/см 3
Использование в сплавах
Способность изменять форму без разрушений (можно раскатать в тонкую фольгу)
Наиболее пластичные – Au, Cu, Ag. Хрупкие – Zn, Sn, Bi, Mn
Формовка, сгибание труб, изготовление проволоки
Мягкие – режутся ножом
Изготовление мыла, стекла, удобрений
Твёрдые – сравнимы по твёрдости с алмазом
Самый твёрдый – хром, режет стекло
Изготовление несущих конструкций
Легкоплавкие – температура плавления ниже 1000°С
Hg (38,9°С), Ga (29,78°С), Cs (28,5°С), Zn (419,5°C)
Производство радиотехники, жести
Тугоплавкие – температура плавления выше 1000°С
Cr (1890°С), Mo (2620°С), V (1900°С). Наиболее тугоплавкий – вольфрам (3420°С)
Изготовление ламп накаливания
Способность передавать тепло другим телам
Лучше всего проводят ток и тепло Ag, Cu, Au, Al
Приготовление пищи в металлической посуде
Способность проводить электрический ток за счёт свободных электронов
Передача электричества по проводам
Что мы узнали?
Из урока 9 класса узнали о физических свойствах металлов. Кратко рассмотрели положение металлов в периодической таблице и особенности строения кристаллической решётки. Благодаря строению металлы обладают пластичностью, твёрдостью, способностью плавиться, проводить электрический ток и тепло. Свойства металлов неоднородны. Различают лёгкие и тяжёлые металлы, лёгкоплавкие и тугоплавкие, мягкие и твёрдые. Физические свойства используются для изготовления сплавов, электрических проводов, посуды, мыла, стекла, конструкций различной формы.
Занятие 1. Электронное строение и классификация металлов
Металлы, или вещества, находящиеся в металлическом состоянии, обладают электронным строением, характеризующимся наличием незаполненных подуровней в валентной зоне. Валентные электроны не связаны с определенными атомами, а принадлежат всему металлическому телу, образуя электронный газ, окружающий каркас из положительно заряженных ионов.
Металлическая связь между атомами ненаправленная. Каждый атом стремится окружить себя как можно большим числом соседних атомов, следствием чегоявляется высокая компактность металлов.
Электроны, образующие электронный газ, называют электронами проводимости, поскольку они легко перемещаются во внешнем электрическом поле, создаваяэлектрический ток.
Незаполненность валентных энергетических зон металлов определяет их высокую электропроводность,теплопроводность, металлический блеск и др. Все металлыимеют положительный температурный коэффициент электрического сопротивления, т. е. при Т→0 К R → 0 (у полупроводников и неметаллов при Т→0 К R→∞).
По ряду характерных признаков металлы делят на две группы: черные и цветные. К черным относят железо и его сплавы (стали, чугуны). Остальные металлы и сплавы на их основе – цветные.
Нередко к металлам железной группы относят Ni, Co и Мn.
Металлы с температурой плавления выше 1800 0 С называют тугоплавкими. К ним принадлежи Тi, Zг. Сг, V, Nb, Mo, Wи др.
Металлы с низкой температурой плавления (Hg, Sn, Bi, Cd, Pb, Zn, Sb и др.) относят к легкоплавким.
К легким относят металлы с низкой плотностью. К ним принадлежат нашедшие широкое техническое применение Mg, Be, Al, Ti.
Металлы (Ag, Au, Os, Ir, Pt, Rh, Pd и др.) составляют группу благородных. Они химически инертны.К благородным металлам часто относят медь, обладающую химической стойкостью в сухой атмосфере.
К редкоземельным металлам (РЗМ) относят металлы группы лантана – лантаноиды(Се, Рг, Nd и др.) и сходные с ними Y и Sc.
Металлы актиноидной (урановой) группы составляют используемые в атомной технике актиноиды (Th, Pa, U и др.).
Li, Na, К и др. (их используют в качестве теплоносителей в быстрых ядерных реакторах с высоко энергетической активной зоной) составляют группу щелочноземельных металлов.
Ряд металлов (Fe, Ni, Co, Gd), в связи с особенностями их электронного строения, обладает ферромагнетизмом –способностью сильно намагничиваться во внешнем магнитном поле. Основные свойства ферромагнетиков определяются доменной структурой их кристаллов. Домен –это область кристалла размером 10 -4 . 10 -6 м, которая при отсутствии внешнего магнитного поля спонтанно (самопроизвольно) намагничена до насыщения. Магнитные моменты отдельных доменов направлены различно, поэтому полный магнитный момент ферромагнетика равен нулю.
Занятие 2. Кристаллическое строение металлови дефекты кристаллических структур
Большинство металлов имеют кристаллическую решетку. Положительно заряженные ионы, образующие каркас металлического тела, совершают непрерывные тепловые колебания около точек, закономерно расположенных в определенных местах пространства. Эти точки являются узлами воображаемой пространственной кристаллической решетки.
Наименьший объем кристалла, при трансляции которого по координатным осями воспроизводится вся кристаллическая решетка, называется элементарной кристаллической ячейкой.Ячейка характеризуется параметрами а, Ь и с – периодами кристаллической решетки (расстояниями между атомами, расположенными на ребрах ячейки, направленных по осям х, у и z соответственно) и углами между координатными осями – a (между осями х и z), β (между у и z), γ (между x и у).
Различают простые и сложные кристаллические решетки. В элементарной ячейке простой решетки атомы (ионы) расположены только в вершинах образующего ячейку многогранника. В сложных – они могут находиться также внутри многогранника или на его гранях.
Металлы имеют сложные кристаллические решетки. В большинстве случаев – это кубическая объемно-центрированная (ОЦК), кубическая гранецентрированная (ГЦК) и гексагональная плотноупакованная (ГПУ).
В элементарной ячейке ОЦК атомы находятся в вершинах куба и внутри него, в точке пересечения пространственных диагоналей. В ячейке ГЦК атомы расположены в вершинах куба и в центре каждой грани. В ячейке ГПУ атомы находятся в вершинах правильной шестигранной призмы, в центре каждого ее основания и, кроме того, три атома заключены внутри призмы.
Размеры элементарной ячейки определяются размерами образующих ее атомов. При этом полагают, что атомы, представляемые в виде жестких шаров, касаются друг друга в направлениях ячейки с наиболее плотным их расположением.
Во многих случаях в разных температурных интервалах один и тот же металл обладает различными кристаллическими решетками. Такое явление носит название полиморфизм или аллотропия.
Важными характеристиками кристаллической решетки являются коэффициент компактности, координационное число, базис.
Коэффициент компактности – это отношение объема принадлежащих кристаллической ячейке атомов к объему всей ячейки. Следует иметь в виду, что в кристаллической решетке часть атомов, составляющих ячейку, относится не только к данной ячейке, но и к ячейкам, находящимся по соседству. Например, атом, расположенный в вершине кубической ячейки (простая кубическая, ОЦК, ГЦК) принадлежит еще семи соседним ячейкам, т.е. данной ячейке принадлежит лишь 1/8 атома.
Коэффициент компактности простой кубической решетки равен 52 %, ОЦК – 68 %, ГЦК – 74 % (столь же компактна решетка ГПУ). Остальное пространство занято порами. В ячейке ГЦК в центре расположена крупная октаэдрическая пора с радиусом, равным 0,41 радиуса атома. В ячейке ОЦК больших пор нет. Поры, расположенные на ребрах ячейки, имеют радиус, равный 0,16 радиуса атома.
Координационное число – это число атомов, находящихся в кристаллической решетке на равном наименьшем расстоянии от данного атома. Каждый атом простой кубической решетки имеет 6 ближайших соседей, расположенных на расстоянии длины ребра куба (на расстоянии периода решетки). Координационное число такой решетки обозначают К6. В ОЦК решетке у каждого атома 8 ближайших соседей и координационное число равно 8 (К8). В ГЦК и ГПУ решетках каждый атом имеет 12 ближайших соседей. Соответственно координационные числа К12 и Г12.
Чем выше координационное число, тем плотнее пространственная кристаллическая решетка материала.
Базис кристаллической решетки – это таблица координат атомов, принадлежащих элементарной ячейке, рассматриваемой в пространственных координатных осях. Базис простой кубической решетки (0,0,0), ОЦК – (0,0,0; 1/2,1/2,1/2), ГЦК – (0,0,0; 1/2,0,1/2; 0,1/2,1/2; 1/2,1/2,0).
Пространственное положение кристаллографических плоскостей (плоскостей, проходящих через определенные группы атомов кристаллической решетки), а также кристаллографических направлений характеризуется кристаллографическими индексами.
Индексы плоскости – это три целых числа, заключенных в круглые скобки и представляющих собой приведенные к целым числам значения обратных величин отрезков, отсекаемых плоскостью на осях х, у, z.За единицы длины принимают параметры решетки а, b, с. Например, плоскость, включающая пространственные диагонали куба, имеет индексы (101). Если плоскость отсекает отрицательные отрезки, то знак минус ставится над соответствующим индексом. Кристаллографические индексы отражают положение не только данной плоскости, но целого семейства плоскостей, ей параллельных.
Индексы направлений – это три числа, заключенных в квадратные скобки и представляющих собой приведенные к целым значениям координаты любой точки направления после его параллельного переноса в начало координат. За единицы принимают параметры кристаллической решетки. Например, направление совпадающее с пространственной диагональю куба, имеет индексы [111]. Если направление имеет отрицательные координаты, то над соответствующим индексом ставится знак минус.
В различных направлениях кристаллической решетки плотность расположения атомов различна, что влечет за собой различие в свойствах кристалла в зависимости от направления, в котором это свойство измерено – анизотропию. В поликристаллических телах в пределах отдельных зерен наблюдается явление анизотропии. Однако, поскольку ориентация кристаллической решетки в различных зернах различна, в целом по куску материала свойства усредняются. Поэтому реальные металлы являются изотропными,т.е. телами с примерно одинаковыми свойствами по всем направлениям. Поскольку их изотропность является не истиной, а усредненной, то их принято называть квазиизотропами. Если каким-либо способом, например давлением, сориентировать кристаллические решетки в зернах одинаково (создать текстуру деформации), то такое поликристаллическое тело станет анизотропным.
Реальные кристаллы всегда содержат дефекты – искажения правильного расположения атомов в пространстве. Различают точечные, линейные, поверхностные и объемные дефекты.
Точечные дефекты по размерам сравнимы с межатомными расстояниями. К ним относятся вакансии (отсутствие атома в узле кристаллической решетки), межузельные или дислоцированные атомы (атом находится в межузельном пространстве кристаллической решетки) и примесные атомы. Среди последних различают атомы замещения (чужеродный атом занимает место в узле кристаллической решетки) и атомы внедрения (чужеродный атом находится в межузельном пространстве решетки).
Линейные дефекты по размерам в двух направлениях сравнимы с межатомными расстояниями, а в третьем простираются на многие тысячи периодов кристаллической решетки. Важнейшими видами линейных несовершенств являются краевые (линейные) и винтовые дислокации.
Образование краевых дислокаций вызвано присутствием в кристаллической решетке неполных кристаллографических плоскостей. Такие полуплоскости, не имеющие продолжения в нижней или верхней частях кристаллической решетки, называются экстраплоскостями. Краевая дислокация представляет собой область упругих искажений, проходящих вдоль края экстраплоскости. Различают положительные и отрицательные дислокации. Положительная дислокация (ее отмечают знаком ┴.) возникает, если экстраплоскость находится в верхней части кристалла, если в нижней – отрицательная (ее отмечают знаком ┬).
Винтовая дислокация – это область упругих искажений кристаллической решетки, проходящая вдоль линии, вокруг которой атомные плоскости изогнуты по винтовой поверхности. В зависимости от направления изгиба различают правые и левые винтовые дислокации.
Дислокации (краевые и винтовые) не могут обрываться внутри кристалла. Они выходят на границы кристалла, прерываются другими дислокациями или образуют дислокационные петли.
Поверхностные дефекты малы только в одном направлении. Они представляют собой упругие искажения кристаллической решетки по границам зерен или их фрагментов (блоков мозаичной структуры). Различают большеугловые (высокоугловые) и малоугловые (низкоугловые) границы.
Большеугловые границы представляют собой области в несколько периодов кристаллической решетки, на протяжении которых решетка одной кристаллографической ориентации переходит в решетку другой ориентации. Такое строение имеют межзеренные границы.
Малоугловые границы представляют собой цепочки дислокаций (дислокационные стенки), отделяющие одну часть кристаллической решетки от другой (один блок мозаичной структуры от другого). Плотность расположения дислокаций зависит от угла между кристаллографическими плоскостями в соседних блоках. Чем угол больше (в пределах до нескольких угловых градусов), тем чаще расположены дислокации.
Объемные дефекты представляют собой искажения решетки, вызванные наличием пор, трещин, раковин и других макронарушений непрерывности кристаллической решетки.
Лекция 1. Общая характеристика металлов
1. Особенности строения атомов металлов. Положение металлов в ПС.
2. Строение простых веществ-металлов. Металлическая связь и металлическая кристаллическая решетка.
3. Физические свойства металлов.
4. Химические свойства металлов.
5. Нахождение в природе и общие способы получения металлов.
6. Понятие про коррозию.
1. Внешний электронный уровень элементов, которые относят к металлам заполнен электронами менее чем наполовину (обычно 1-2). Обычно это s-электроны. К типичным металлам (т.е. проявляющим металлические свойства в максимальной степени) относят s-элементы (элементы 1 и 2 группы, главных подгрупп), т.е. те у которых только начинается заполнение нового слоя. Причем металлические свойства усиливаются с увеличением радиуса атомов (числа электронных слоев). К металлам относят также все d элементы (т.е. те у которых идет заполнение d-подуровня предпоследнего слоя), они расположены в побочных подгруппах во всех группах. d элементы называют переходными металлами, нетипичными. К металлам относятся и f- элементы (лантаноиды и актиноиды, которые располагают обычно отдельными строками внизу таблицы
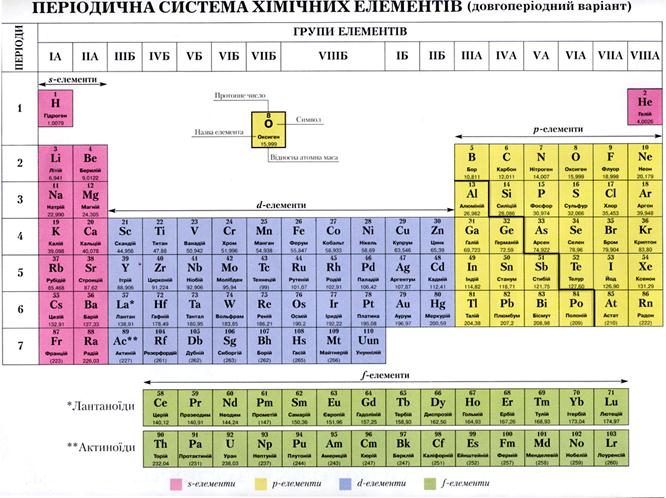
2. Металлы имеют кристаллическое, т.е. упорядоченное строение. Часть атомов в кристаллической решетке ионизирована, т.е. потеряла электроны внешнего электронного слоя и свободные электроны равномерно распределены по всему кристаллу. Они присоединяются к ионам металла и те превращаются в атомы, а другие атомы металла в это время теряют свои электроны и превращаются в ионы. Т.е. происходит своеобразный обмен электронами. Валентные электроны находятся одновременно во владении всех атомов и ионов металла (т.е. притягиваются к ним) и называются «электронным газом. Такая связь между атомами в кристалле металла называется металлической. И кристаллическая решетка металлов тоже называется металлической. Металлы имеют немолекулярное строение. Металлическая связь нелокализована между определенными атомами.
3. Общие физические свойства металлов обусловлены сходством в строении кристаллической решетки и одинаковом типе химической связи.
Эта связь достаточно прочная, поэтому металлы при н.у. находятся в твердом агрегатном состоянии. Исключение – ртуть Hg с температурой плавления (-39металлы легкоплавкие (менее 100 ) и другие щелочные металлы, магний, алюминий… Есть и тугоплавкие(более 100 ), а также хром, молибден, медь, титан, железо…
Металлическая кристаллическая решетка плотная и поэтому все металлы непрозрачные и отражают падающий свет (белый цвет, металлический блеск). Исключением являются золото и медь, которые поглощают часть спектра и имеют желтый цвет.
Все металлы могут проводить электрический ток. Это свойство обусловлено наличием подвижных электронов в кристаллической решетке. При обычных условиях самой высокой электропроводностью обладают металлы подгруппы меди: Ag, Cu, Au и алюминий. Эти металлы используются как проводники в электротехнике и радиоэлектронике. Высокое сопротивление имеют вольфрам, никель, хром. Из них изготавливают нагревательные элементы электроприборов.
Металлы проводят не только электрический ток, но и тепло. Металлы, хорошо проводящие электрический ток, имеют высокую теплопроводность. Это тоже связано с возможностью электронов перемещаться и переносить тепловую энергию.
Все металлы в той или другой степени пластичны (т.е. они необратимо деформируются при механических нагрузках), их можно ковать. Самым пластичным является золото, из него можно получить нить в 500 раз тоньше человеческого волоса, т.е. практически невидимую. Мягкими являются также и щелочные металлы. Очень твердыми металлами считаются хром и вольфрам. А сурьма при комнатной температуре настолько хрупкая, что ее можно растереть в порошок. Пластическая деформация объясняется тем, что у металлов не происходит разрыва химических связей в металлической кристаллической решетке, ионы и атомы просто смещаются относительно друг друга.
Все металлы не растворимы в воде, но растворяются друг в друге. Такие растворы называют сплавами.
По плотности металлы делят на легкие (меньше 5 г/см 3 ) и тяжелые. К легким металлам относятся щелочные и щелочноземельные металлы, титан, алюминий. К тяжелым относятся цинк, железо, медь, ртуть, свинец, золото. Самым тяжелым является осмий (22,6 г/см 3 ).
4. Общие химические свойства металлов тоже определяются общими чертами в их строении. Все они завершают внешний электронный слой отдавая валентные электроны. Следовательно, в химических реакциях простые вещества - металлы всегда являются восстановителями.
Чем легче атомы отдают электроны, тем более сильным восстановителем является металл. Но надо помнить, что ионы металлов способны принимать электроны, т.е. проявлять окислительную способность. Причем чем легче атом теряет электроны, тем хуже принимает их соответствующий ион. Т.е. например, натрий активный восстановитель, но ион натрия окислительной активности не проявляет. Малоактивный атом меди неохотно теряет свои электроны, а ион меди является достаточно сильным окислителем.
Окислителями металлов могут выступать разные вещества, но в природе и технике важнейшими считают газообразный кислород и ион водорода, который присутствует в воде и растворах кислот. Рассмотрите внимательно таблицу.
| Li | K | Ca | Na | Mg | Al | Mn | Zn | Cr | Fe | Ni | Sn | Pb | H2 | Cu | Hg | Ag | Pt | Au | |
| Восстановительная способность металлов в свободном состоянии | |||||||||||||||||||
| Взаимодействие с кислородом воздуха | Быстро окисляется при обычной температуре | Медленно окисляется при обычной температуре или при нагревании | Не окисляются | ||||||||||||||||
| Взаимодействие с водой | При обычной температуре выделяется H2 и образуется гидроксид | При нагревании выделяется водород, и образуются оксиды | Не вытесняют водород из воды | ||||||||||||||||
| Взаимодействие с кислотами | Вытесняют водород из разбавленных кислот ( кроме HNO3) | Не вытесняют водород из разбавленных кислот | |||||||||||||||||
| Реагируют с HNO3 и конц. H2SO4 | Растворяются только в «царской водке» | ||||||||||||||||||
| Нахождение в природе | Только в соединениях | В соединениях и в свободном виде | Главным образом в свободном виде | ||||||||||||||||
| Способы получения | Электролиз расплавов | Восстановление углём, СО, активными металлами, электролиз водных растворов | |||||||||||||||||
| Окислительная способность ионов металлов | Li | K | Ca | Na | Mg | Al 3 | Mn | Zn | Cr | Fe | Ni | Sn | Pb | H | Cu | H Hg | Ag | Pt | Au |
Окисление металлов: Zn + O2 → ZnO
Взаимодействие активных металлов с водой: K + H2O → KOH + H2
Взаимодействие металлов с кислотами: Mn + HCl → MnCl2+ H2
Взаимодействие металлов с другими окислителями: Fe + CuSO4 → FeSO4 + Cu
5. Те металлы, которые могут окисляться ионами водорода из природной воды (обычно подкисленной взаимодействием с различными кислотными оксидами) или кислородом воздуха в свободном виде, т.е. в виде простого вещества в природе не могут существовать. Значит, в свободном состоянии обычно встречаются «благородные металлы» золото, серебро и платина. Некоторые малоактивные металлы тоже могут встречаться, но такие месторождения – редкие, и к настоящему времени хозяйственного значения не имеют. Но именно это было причиной, по которой первыми металлами известными человечеству были медь, ртуть, свинец, олово… Неблагородные металлы в природе встречаются в виде соединений. Для активных металлов это соли: хлориды, сульфаты, фосфаты, карбонаты. Причем, чем ниже растворимость этих соединений, тем больше вероятность их встретить. Менее активные металлы встречаются в виде оксидов или в виде сульфидов. Причем до железа – преимущественно оксиды, а после – преимущественно сульфиды.
Естественно, что и способы получения металлов тоже зависят от их активности. Получение благородных металлов обычно заключается в отделении их от пустой породы. Существует много методов для этого, они описаны в художественной и специальной литературе. Получение металлов из их соединений можно назвать одним словом: «восстановление». Т.е. химическая суть этих процессов – заставить ионы металла принять электроны. Что можно использовать как восстановитель? Какие вещества легко расстаются со своими электронами? Правильно, металлы! Значит активные металлы можно использовать для получения менее активных из их оксидов. Например:
Mg + SnO2 → MgO + Sn
Такие способы получения металлов в зависимости от восстановителя называются магнийтермия, кальцийтермия, натрийтермия…
Хорошим восстановителем является и водород:
Но у этих восстановителей (и водорода и активных металлов) есть существенный недостаток – высокая стоимость. Ведь в природе они в свободном виде не встречаются, а их получение требует больших затрат. Поэтому такие восстановители используют только если это экономически обосновано, т.е. для получения редких и дорогих металлов. А металлы, которые надо получать в очень большом количестве (железо), восстанавливают более дешевыми восстановителем – углеродом. Его применяют в виде кокса, а ранее использовали древесный уголь.
А если металл находится в природе не в виде оксида, а в виде сульфида, то руду предварительно подвергают обжигу, а уже потом восстанавливают образовавшийся оксид. Например:
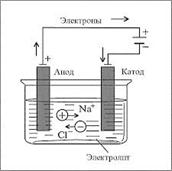
А как восстанавливают самые активные металлы? Где найти такой сильный восстановитель? Таким активным восстановителем будет электрический ток. Процесс называют электролизом. Оксид металла или его хлорид расплавляют и через расплав пропускают электрический ток. Например:
Что такое металлы и их строение
Определение металлов можно дать с позиций химии, физики и техники.
В химии металлы — это химические элементы, находящиеся в левой части периодической системы элементов Д. И. Менделеева, которые обладают особым механизмом взаимодействия валентных электронов (ионов) с ядром как в самих металлах, так и при вступлении в химические реакции с другими элементами, в том числе с металлами.
Физика характеризует металлы как твердые тела, обладающие цветом, блеском, способностью к плавкости (расплавлению) и затвердеванию (кристаллизации), тепло- и электропроводностью, магнитными и другими свойствами.
В технике металлы — это конструкционные материалы, обладающие высокой обрабатываемостью (ковкостью, штампуемостью, обрабатываемостью резанием, паяемостью, свариваемостью и др.), прочностью, твердостью, ударной вязкостью и рядом других ценных свойств, благодаря которым они находят широкое применение.
Русский ученый М. В. Ломоносов (1711 — 1765), исследуя металлы и неметаллы в своем труде «Первые основания металлургии или рудных дел», дал металлам определение: «Металлом называется светлое тело, которое ковать можно. Таких тел находим только шесть: золото, серебро, медь, олово, железо и свинец». Это определение М. В. Ломоносов дал в 1773 г., когда известны были только шесть металлов.
Из металлов, добываемых из недр земли, получают большую группу конструкционных материалов, применяемых в различных отраслях промышленности. В природе одни металлы встречаются в чистом, самородном виде, другие — в виде оксидов (соединений металла с кислородом), нитридов и сульфидов, из которых состоят различные руды этих металлов.
Самыми распространенными металлами, применяемыми в качестве конструкционных материалов, являются железо, алюминий, медь и сплавы на основе этих металлов.
К металлам относятся более 80 элементов периодической системы Менделеева. Все эти металлы подразделяются на две большие группы: черные металлы и цветные металлы.
Характерными признаками черных металлов являются темно-серый цвет, блеск, высокие плотность и температура плавления, твердость, прочность, вязкость и полиморфизм (аллотропия). По физикохимическим свойствам черные металлы подразделяют на пять групп:
- железистые (железо, кобальт, никель, марганец);
- тугоплавкие (вольфрам, рений, тантал, молибден, ниобий, ванадий, хром, титан и др.);
- урановые — актиниды (уран, торий, плутоний и др.);
- редкоземельные — лантаниды (лантан, церий, иттрий, скандий и др.);
- щелочно-земельные (литий, натрий, калий, кальций и др.).
Из этих пяти групп черных металлов особенно широкое применение в промышленном производстве находят железистые и тугоплавкие металлы.
Железистые металлы, кроме марганца, называют еще ферромагнетиками. Ферромагнетики способны намагничиваться и притягивать металлы своей группы.
К тугоплавким относятся металлы, которые имеют температуру плавления выше температуры плавления железа (1 539 °С): титан — 1 667 °С, ванадий — 1 902 °С, хром — 1 903 °С, молибден — 2 615 °С, ниобий — 2 460 °С, тантал — 2 980 °С, вольфрам — 3 410 °С. Тугоплавкие металлы в основном применяются как легирующие элементы в производстве жаропрочных, жаростойких, теплостойких и специальных сплавов, в том числе твердых сплавов и высоколегированных сталей.
2. Строение металлов
Атомно-кристаллическая структура металлов. Как известно, все вещества состоят из атомов, в том числе и металлы. Каждый металл (химический элемент) может находиться в газообразном, жидком или твердом агрегатных состояниях. Каждое агрегатное состояние будет иметь свои особенности, отличные друг от друга. В газообразном металле расстояние между атомами велико, силы взаимодействия малы и атомы хаотично перемещаются в пространстве; газ стремится к расширению в сторону большего объема. При понижении температуры и давления вещество переходит в жидкое состояние. Свойства жидкого вещества резко отличаются от свойств газообразного. В жидком металле атомы сохраняют лишь так называемый ближний порядок атомов, т. е. в объеме расположено небольшое количество атомов, а не атомы всего объема. При понижении температуры жидкий металл переходит в твердое состояние, которое имеет строгую закономерность расположения атомов.
Если условно провести вертикальные и горизонтальные линии связи через центры атомов, можно увидеть, что у металлов в твердом состоянии атомы расположены в строго определенном порядке и представляют собой множество раз повторяющиеся элементарные геометрические фигуры — параллелепипеды (рис. 1). Наименьшую геометрическую фигуру называют элементарной ячейкой. Элементарные ячейки, расположенные на горизонтальных и вертикальных кристаллографических плоскостях (рис. 2), образуют пространственную кристаллическую решетку.
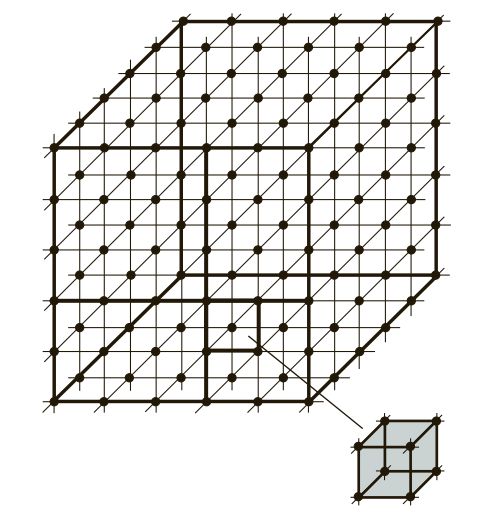
Рис. 1. Схема расположения элементарных геометрических ячеек в атомных решетках металлов и сплавов
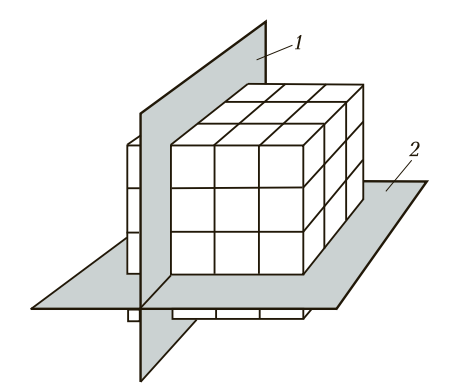
Рис. 2. Расположение кристаллографических плоскостей: 1 и 2 — соответственно горизонтальная и вертикальная кристаллографические плоскости
Элементарные кристаллические решетки характеризуют следующие основные параметры: расстояние между атомами по осям координат (по линиям связи), углы между линиями связи, координационное число — число атомов, находящихся на наиболее близком и равном расстоянии от любого атома в решетке. Форму элементарной ячейки рассматривают по кристаллографическим плоскостям в трех измерениях.
Таким образом, любой металл можно представить не как однородную цельную массу, а как массу, сложенную из множества элементарных ячеек. Блок элементарных атомных кристаллических ячеек образует атомно-кристаллическую ячейку (решетку). Если выделить эту элементарную ячейку, то в зависимости от металла получим следующие типы кристаллических ячеек (рис. 3): куб (К), объемно-центрированный куб (ОЦК), гранецентрированный куб (ГЦК), гексагональная плотноупакованная ячейка (ГПУ), гексагональная простая ячейка (Г) и др.
Простая кубическая ячейка (рис. 3, а) характерна для неметаллов, которые обладают наибольшими плотностью и удельным весом, и имеет восемь атомов, которые расположены в каждой вершине куба.
Объемно-центрированная кубическая ячейка (рис. 3, б ) состоит из восьми атомов, которые расположены по одному атому в каждой вершине куба, и одного, находящегося в центре куба на равных расстояниях от его граней. Эту форму атомной кристаллической ячейки имеют железо модификации Fe-α, ванадий, вольфрам, молибден, тантал и хром, т. е. в основном черные металлы.
Гранецентрированная кубическая ячейка (рис. 3, в) имеет 14 атомов — по одному атому в каждой вершине куба (восемь атомов) и по одному атому в центре каждой грани (шесть атомов). Гранецентрированную кубическую ячейку имеют алюминий, железо модификации Fe-γ, золото, кобальт, медь, никель, платина и серебро, в основном это цветные металлы и часть черных металлов.
Гексагональная плотноупакованная ячейка (рис. 3, г) состоит из 17 атомов. Форма геометрического тела, которую образуют эти атомы, является шестигранной призмой. При этом по шесть атомов расположены в каждой вершине верхнего и нижнего оснований, по одному атому в центре этих оснований и три атома в центре одной их трех граней (через грань). Гексагональную плотноупакованную ячейку имеют бериллий, кадмий, магний, ванадий, тантал.
Простая гексагональная ячейка (рис. 3, д) состоит из 12 атомов, которые расположены в вершинах верхнего и нижнего оснований шестигранной призмы. Такую кристаллическую ячейку имеют ртуть и цинк.
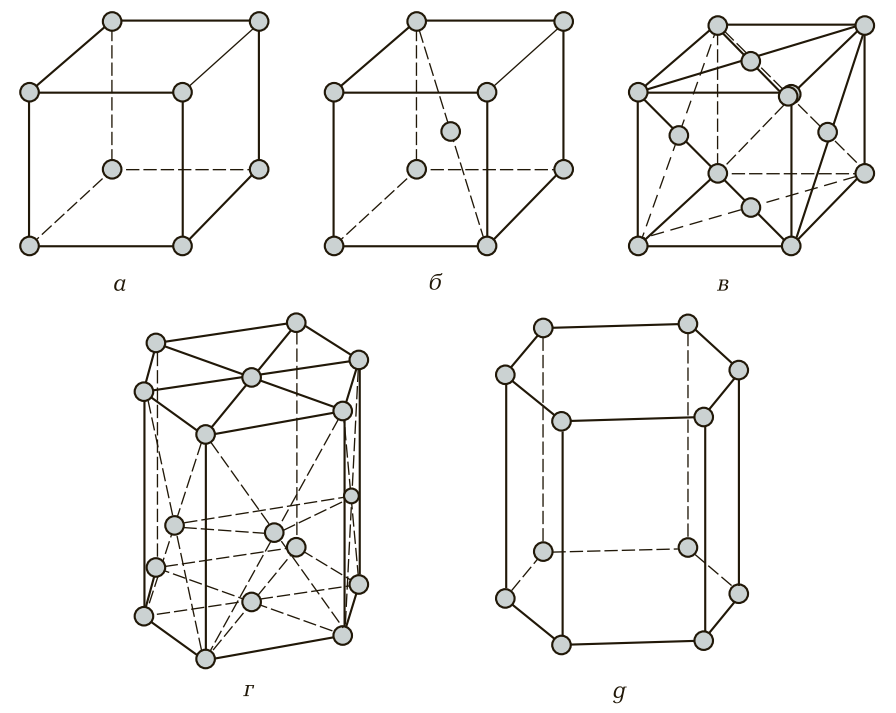
Рис. 3. Геометрические формы элементарных кристаллических ячеек: а — куб; б — объемно-центрированный куб; в — гранецентрированный куб; г — гексагональная плотноупакованная ячейка; д — гексагональная простая ячейка
Связь между атомами в кристаллической решетке и между решетками осуществляется за счет так называемой металлической связи. От прочности этой связи зависят прочность и твердость металлов. Чем выше эта связь, тем бо´льшую прочность и твердость имеют металлы. Механизм связи между атомами в решетке и между решетками имеет сложную физико-химическую природу.
В практике идеальное расположение кристаллических решеток обычно не наблюдается. Кристаллы, образуемые кристаллическими решетками, имеют искаженную геометрическую форму и различную величину.
Анизотропия металлов. Анизотропия (от гр. anisos — неравный и tropos — направление) — неодинаковость физических свойств среды (тела) в различных направлениях. Анизотропия предполагает зависимость свойств металлов от направления по плоскостям атомно-кристаллических решеток. Чем больше в плоскости атомов, тем выше свойства металлов. В горизонтальных плоскостях в любой форме атомно-кристаллических решеток больше, чем в вертикальных плоскостях. Следовательно, прочность металлов, испытанная в горизонтальном направлении, выше, чем в вертикальном. Анизотропия проявляется в процессе обработки конструкционных материалов давлением (проката, волочения, штамповки и других технологических способов получения заготовок и изделий).
На рис. 2 кристаллографические плоскости совпадают с линиями связи, проходящими через атомы металла. Форма элементарной кристаллической ячейки, расстояние между атомами и прочность металлической связи определяют физические, механические и технологические свойства металлов. Если исследуемый металл рассматривать по трем кристаллографическими плоскостям, по линиям связи между атомами, то можно заметить, что свойства по этим трем измерениям будут различны. Число атомов в этих плоскостях неодинаково. Металлическая связь между горизонтально и вертикально расположенными атомами также неодинакова. Это, в свою очередь, приводит к различной прочности металлов в продольном и поперечном направлениях. Например, предел прочности меди в продольном направлении будет в 2 раза больше, чем в поперечном.
Все металлы анизотропны, так как они состоят из кристаллов. Кристаллическое строение металлов обусловливает пластическую деформацию, т. е. изменение внешней формы и размеров под действием нагрузок без разрушения. Способность металлов и сплавов пластически деформироваться положена в основу их обработки давлением (прокатка, волочение, ковка, штамповка и прессование). При обработке давлением, например прокатке (рис. 4, а), происходит перемещение одного слоя атомных решеток по другому по кристаллографическим плоскостям (рис. 4, б).
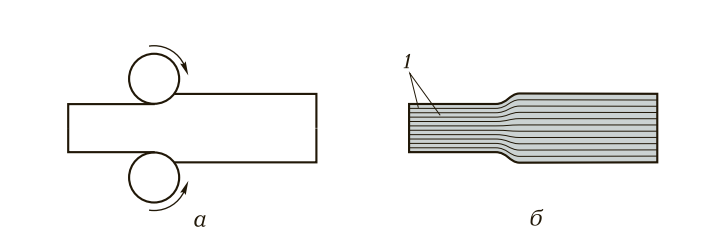
Рис. 4. Схема деформации металлов и сплавов (прокатка): а — деформация; б — скольжение металлов по кристаллографическим плоскостям в процессе деформации; 1 — кристаллографические плоскости
В процессе деформации металла при прокатке происходит не только изменение поперечных и продольных размеров заготовок, но и изменение микроструктуры металла.
Зерна под действием давления прокатных валков искажаются, приобретая продолговатую или пластинчатую форму, а затем преобразуются в волокна. Изменение микроструктуры металла в процессе деформации условно показано на рис. 5.
Процесс кристаллизации. Рассмотрим, как происходит образование кристаллов у чистых металлов. Установлено, что процесс кристаллизации металлов из жидкого состояния в твердое идет в две стадии:
- образование центров кристаллизации;
- рост кристаллов вокруг этих центров (рис. 6).
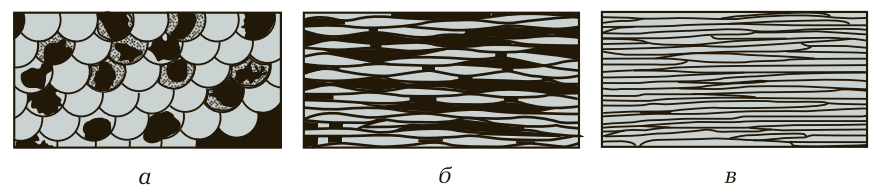
Рис. 5. Изменение микроструктуры металла в процессе деформации: а — микроструктура металла до деформации; б — микроструктура металла после первой операции деформации; в — микроструктура металла после окончательной деформации
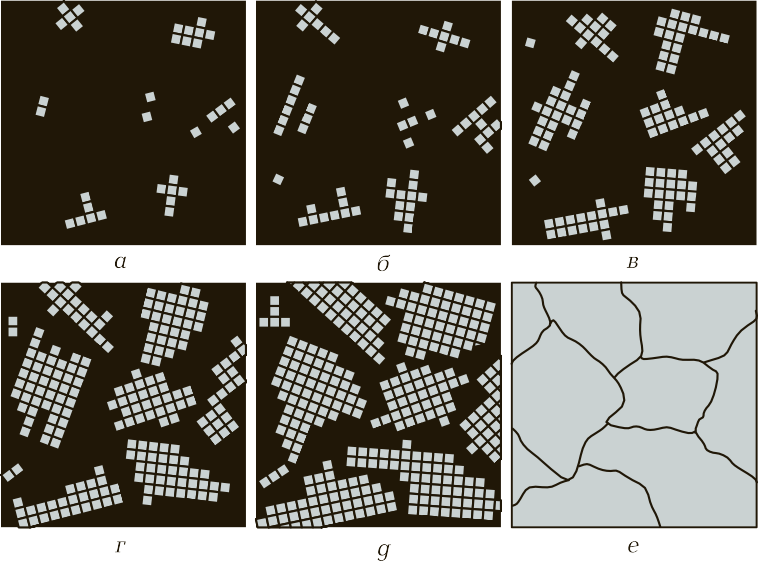
Рис. 6. Процесс кристаллизации металлов и сплавов: а — е — последовательные этапы процесса
Далее вновь появляются новые центры, и происходит рост твердой фазы вокруг первичных и вторичных центров. Процесс происходит до того момента, пока образованные таким образом кристаллы не будут соприкасаться друг с другом и не будет наличия жидкой фазы металла (см. рис. 6, г — е). Когда образование кристалла идет в жидкой фазе (в расплавленном металле), он будет иметь правильную форму, т. е. состоять из определенных геометрических фигур правильной формы. Когда кристаллы начинают соприкасаться друг с другом, а процесс затвердевания еще не закончен, тогда происходят искажения формы зерен. В практике замечено, что когда идет быстрое охлаждение, образуются мелкие зерна — мелкозернистая структура. При медленном охлаждении появление новых центров кристаллизации замедляется, но происходит рост зерна вокруг первичных центров кристаллизации. В этом случае металл будет иметь крупнозернистую структуру.
Процесс образования кристаллов в жидком состоянии и перехода металла в твердое состояние называется первичной кристаллизацией. Величина и форма зерна влияет на механические свойства металлов. Чем зерна мельче и чем правильнее их форма, тем большую твердость и прочность будет иметь металл. Чем зерна больше и чем искаженнее их форма, тем ниже твердость и прочность металла.
Аллотропия металлов. Такие металлы, как железо, кобальт, никель и др., обладают способностью изменять кристаллическую решетку при нагревании в твердом состоянии. Процесс изменения кристаллических решеток в твердом состоянии называется вторичной кристаллизацией, или аллотропией, а состояние вещества (металла) при наличии нескольких кристаллических решеток при изменении параметров (давления, температуры) — аллотропическими модификациями, или полиморфизмом. Такие металлы, как железо, молибден, вольфрам, литий в твердом состоянии при нормальной температуре имеют объемно-центрированную кубическую ячейку; алюминий, медь, серебро в твердом состоянии при нормальной температуре имеют форму гранецентрированной кубической ячейки.
На рис. 7 представлены кривые нагрева и охлаждения металла (на примере марганца). Аллотропные состояния (модификации), имеющие те или иные кубические ячейки, обозначаются греческими буквами. Первоначальное аллотропное состояние при нормальной температуре обозначается буквой α, при дальнейших повышении температуры и перекристаллизации металла — буквами β, γ, δ и т. д. При охлаждении металлов и сплавов процесс аллотропного превращения происходит в обратном порядке, как правило при тех же температурах.
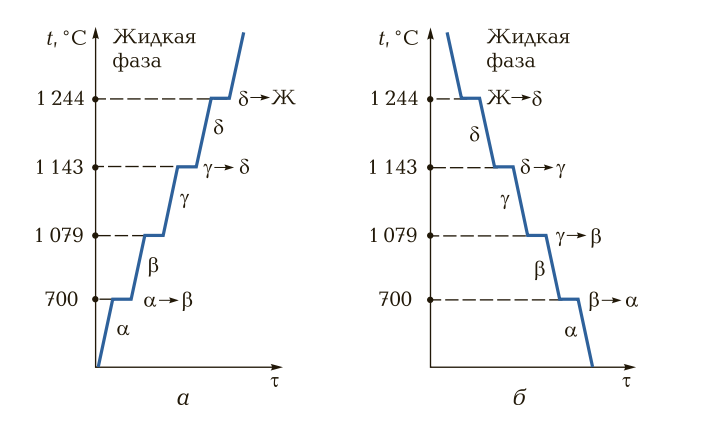
Рис. 7. Кривые нагрева (а) и охлаждения (б) марганца: t — температура; τ — время
Читайте также:
