Электронная конфигурация атома металла
Элементы в периодической таблице химических элементов Менделеева
Первоначально элементы в Периодической таблице химических элементов Д.И. Менделеева были расположены в соответствии с их атомными массами и химическими свойствами, но на самом деле оказалось, что решающую роль играет не масса атома, а заряд ядра и, соответственно, число электронов в нейтральном атоме.
Наиболее устойчивое состояние электрона в атоме химического элемента соответствует минимуму его энергии, а любое другое состояние называется возбужденным, в нем электрон может самопроизвольно переходить на уровень с более низкой энергией.
Рассмотрим, как распределяются электроны в атоме по орбиталям, т.е. электронную конфигурацию многоэлектронного атома в основном состоянии. Для построения электронной конфигурации пользуются следующими принципами заполнения орбиталей электронами:
— принцип (запрет) Паули – в атоме не может быть двух электронов с одинаковым набором всех 4-х квантовых чисел;
— принцип наименьшей энергии (правила Клечковского) – орбитали заполняют электронами в порядке возрастания энергии орбиталей (рис. 1).
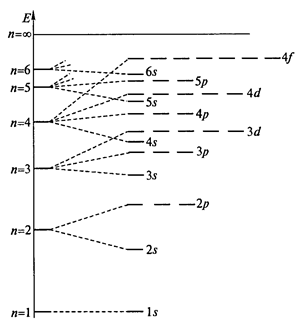
Рис. 1. Распределение орбиталей водородоподобного атома по энергиям; n – главное квантовое число.
Энергия орбитали зависит от суммы (n + l). Орбитали заполняются электронами в порядке возрастания суммы (n + l) для этих ортиталей. Так, для подуровней 3d и 4s суммы (n + l) будут равны 5 и 4, соответственно, вследствие чего, первой будет заполняться 4s орбиталь. Если сумма (n + l) одинакова для двух орбиталей, то первой заполняется орбиталь с меньшим значением n. Так, для 3d и 4p орбиталей сумма (n + l) будет равна 5 для каждой орбитали, но первой заполняется 3d орбиталь. В соответствии с этими правилами порядок заполнения орбиталей будет следующим:
Семейство элемента определяется по орбитали, заполняемой электронами в последнюю очередь, в соответствии с энергией. Однако, нельзя записывать электронные формулы в соответствии с энергетическим рядом.
41Nb 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 3 5s 2 правильная запись электронной конфигурации
41Nb 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 3 неверная запись электронной конфигурации
Для первых пяти d – элементов валентными (т.е., электроны, отвечающие за образование химической связи) являются сумма электронов на d и s, заполненных электронами в последнюю очередь. Для p – элементов валентными являются сумма электронов, находящихся на s и p подуровнях. Для s-элементов валентыми являются электроны, находящиеся на s подуровне внешнего энергетического уровня.
— правило Хунда – при одном значении l электроны заполняют орбитали таким образом, чтобы суммарный спин был максимальным (рис. 2)
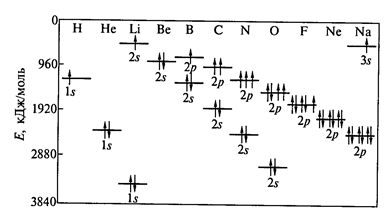
Рис. 2. Изменение энергии у 1s -, 2s – 2p – орбиталей атомов 2-го периода Периодической системы.
Примеры построения электронных конфигураций атомов
Примеры построения электронных конфигураций атомов приведены в таблице 1.
Строение атомов металлов и их особенности
Если провести в Периодической таблице Д.И. Менделеева символическую линию из верхнего левого угла в нижний правый угол, то все элементы, находящиеся ниже этой линии, будут металлами.
Металлы можно охарактеризовать при помощи нескольких свойств, которые будут общими для всех элементов. К таким характеристикам следует отнести высокую электрическую проводимость и теплопроводность, пластичность, благодаря которой металлы можно подвергать ковке, прокатке, штамповке или вытягиванию в проволоку, металлический блеск и непрозрачность.
В зависимости от температуры кипения все металлы подразделяют на тугоплавкие (Tкип> 1000 o С) и легкоплавкие (Tкип< 1000 o С). Примером тугоплавких металлов может быть – Au, Cu, Ni, W, легкоплавких – Hg, K, Al, Zn.
Электронное строение металлов и их особенности
Атомы металлов, также как, и неметаллов состоят из положительно заряженного ядра внутри которого находятся протоны и нейтроны, а по орбитам вокруг него движутся электроны. Однако, по сравнению с неметаллами, атомные радиусы металлов намного больше. Это связано с тем, что валентные электроны атомов металлов (электроны внешнего энергетического уровня) расположены на значительном удалении от ядра и, как следствие, связаны с ним слабее. По этой причине металлы характеризуются низкими потенциалами ионизации и легко отдают электроны (являются восстановителями в ОВР) при образовании химической связи.
Все металлы за исключением ртути представляют собой твердые вещества с атомной кристаллической решеткой. Рассмотрим строение металлов в кристаллическом состоянии. В атомах металлов имеются «свободные» электроны (электронный газ), которые могут перемещаться по кристаллу даже под действием слабых электрических полей, что обусловливает высокую электропроводимость металлов.
Среди металлов присутствуют s-, p-, d- и f-элементы. Так, s- элементы – это металлы I и II групп Периодической системы (ns 1 , ns 2 ), р- элементы – металлы, расположенные в группах III – VI (ns 2 np 1-4 ). Металлы d-элементы имеют большее число валентных электронов по сравнению с металлами s- и p-элементами. Общая электронная конфигурация валентных электронов металлов d-элементов – (n-1)d 1-10 ns 2 . Начиная с 6 периода появляются металлы f-элементы, которые объединены в семейства по 14 элементов (за счет сходных химических свойств) и носят особые названия лантаноидов и актиноидов. Общая электронная конфигурация валентных электронов металлов f-элементов – (n-2)f 1-14 (n-1)d 0-1 ns 2 .
Примеры решения задач
| Задание | При взаимодействии 6,0 г металла с водой выделилось 3,36 л водорода (н.у.). Определите этот металл, если он в своих соединениях двухвалентен. |
| Решение | Запишем уравнение реакции растворения металла в воде. Поскольку металл двухвалентен, его реакция с водой будет описываться уравнением следующего вида: |
Согласно уравнению реакции:
N (Ме) =n (Н2) = 3,36/22,4 = 0,15 моль.
Найдем относительную атомную массу металла:
Ar(Ме) = m / n= 6,0/0,15 = 40 г/моль
Следовательно, этот металл — кальций.
| Задание | При действии на смесь меди и железа массой 20 г избытком соляной кислоты выделилось 5,6 л газа (н.у.). Определить массовые доли металлов в смеси. |
| Решение | Известно, что медь не растворяется в соляной кислоте, поскольку стоит в ряду активности металлов после водорода, т.е. выделение водорода происходит только в результате взаимодействия хлороводородной кислоты с железом. |
Запишем уравнение реакции:
Найдем количество вещества водорода:
Согласно уравнению реакции n(H2) : n(Fe) = 1:1, т.е.n(H2) = n(Fe) = 0,25 моль. Тогда масса железа будет равна (молярная масса – 56 г/моль):
Атомы и электроны
Мы приступаем к изучению химии - мира молекул и атомов. В этой статье мы рассмотрим базисные понятия и разберемся с электронными формулами элементов.
Атом (греч. а - отриц. частица + tomos - отдел, греч. atomos - неделимый) - электронейтральная частица вещества микроскопических размеров и массы, состоящая из положительно заряженного ядра (протонов) и отрицательно заряженных электронов (электронные орбитали).
Описываемая модель атома называется "планетарной" и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом

Протон (греч. protos - первый) - положительно заряженная (+1) элементарная частица, вместе с нейтронами образует ядра атомов элементов. Нейтрон (лат. neuter - ни тот, ни другой) - нейтральная (0) элементарная частица, присутствующая в ядрах всех химических элементов, кроме водорода.
Электрон (греч. elektron - янтарь) - стабильная элементарная частица с отрицательным электрическим зарядом (-1), заряд атома - порядковый номер в таблице Менделеева - равен числу электронов (и, соответственно, протонов).
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20) в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.

Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило: порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим электроны занимают различные энергетические уровни.
Состоит из s-подуровня: одной "1s" ячейки, в которой помещаются 2 электрона (заполненный электронами - 1s 2 )
Состоит из s-подуровня: одной "s" ячейки (2s 2 ) и p-подуровня: трех "p" ячеек (2p 6 ), на которых помещается 6 электронов
Состоит из s-подуровня: одной "s" ячейки (3s 2 ), p-подуровня: трех "p" ячеек (3p 6 ) и d-подуровня: пяти "d" ячеек (3d 10 ), в которых помещается 10 электронов
Состоит из s-подуровня: одной "s" ячейки (4s 2 ), p-подуровня: трех "p" ячеек (4p 6 ), d-подуровня: пяти "d" ячеек (4d 10 ) и f-подуровня: семи "f" ячеек (4f 14 ), на которых помещается 14 электронов

Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а также узнаете об исключении, которое только подтверждает данные правила.
Подуровни: "s", "p" и "d", которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или атомным орбиталям, движутся электроны, создавая определенный "рисунок".
S-орбиталь похожа на сферу, p-орбиталь напоминает песочные часы, d-орбиталь - клеверный лист.

Правила заполнения электронных орбиталей и примеры
- Сперва следует заполнить орбитали с наименьшей энергией, и только после переходить к энергетически более высоким
- На орбитали (в одной "ячейке") не может располагаться более двух электронов
- Орбитали заполняются электронами так: сначала в каждую ячейку помещают по одному электрону, после чего орбитали дополняются еще одним электроном с противоположным направлением
- Порядок заполнения орбиталей: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Без практики теория мертва, так что приступает к тренировке. Нам нужно составить электронную конфигурацию атомов углерода и серы. Для начала определим их порядковый номер, который подскажет нам число их электронов. У углерода - 6, у серы - 16.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.

Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил. А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся одним электроном дополнили первую ячейку.
- Углерод - 1s 2 2s 2 2p 2
- Серы - 1s 2 2s 2 2p 6 3s 2 3p 4
Внешний уровень и валентные электроны
- Углерод - 2s 2 2p 2 (4 валентных электрона)
- Сера -3s 2 3p 4 (6 валентных электронов)
Неспаренные валентные электроны способны к образованию химической связи. Их число соответствует количеству связей, которые данный атом может образовать с другими атомами. Таким образом неспаренные валентные электроны тесно связаны с валентностью - способностью атомов образовывать определенное число химических связей.

- Углерод - 2s 2 2p 2 (2 неспаренных валентных электрона)
- Сера -3s 2 3p 4 (2 неспаренных валентных электрона)
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных электронов. Ниже будет дано наглядное объяснение этой задаче.

- Магний - 1s 2 2s 2 2p 6 3s 2
- Скандий - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 1
Химические элементы
Химический элемент - совокупность атомов с одним и тем же зарядом ядра, числом протонов в ядре и электронов в электронной оболочке. Закономерную связь химических элементов отражает периодическая таблица Д.И. Менделеева.

- Обозначение химического элемента
- Русское наименование
- Порядковый номер = заряд атома = число электронов = число протонов
- Атомная масса
- Распределение электронов по энергетическим уровням
- Электронная конфигурация внешнего уровня
Надо заметить, что на экзамене часто из карточки элемента скрывают распределение электронов и конфигурацию внешнего уровня. Тем не менее, если вы успешно освоили предыдущую тему, то для вас не составит труда написать электронную конфигурацию атома зная его порядковый номер в таблице Д.И. Менделеева (номер уж точно не тронут!))
Протоны, нейтроны и электроны
Вы уже знаете, что порядковый номер элемента в периодической таблице Д.И. Менделеева равен числу протонов, а число протонов равно числу электронов.

Для того чтобы найти число нейтронов в атоме алюминия, необходимо вычесть из атомной массы число протонов:
Получается, что в атоме алюминия 14 нейтронов. Посчитайте число нейтронов, электронов и протонов самостоятельно для атомов бериллия, кислорода, меди. Решение вы найдете ниже.

Если вы поняли суть и научились считать протоны, нейтроны и электроны, самое время приступать к следующей теме.
Изотопы
Изотопы (греч. isos - одинаковый + topos - место) - общее название разновидностей одного и того же химического элемента, имеющих одинаковый заряд ядра (число протонов), но разное число нейтронов.
Вероятно, вы не задумывались, но вся таблица Д.И. Менделеева и представленные в ней химические элементы - это самые распространенные на земле изотопы.
Лучше всего объяснить, что такое изотопы наглядным примером. Широко известны три изотопа водорода: протий, дейтерий и тритий.

В таблице Д.И. Менделеева представлен самый распространенный из трех - протий. Он содержит 1 протон и 1 электрон, нейтроны отсутствуют. У дейтерия 1 протон, 1 нейтрон и 1 электрон. У трития 1 протон, 2 нейтрона, 1 электрон.
Теперь очевидно, что изотопы - атомы одного и того же химического элемента, различающиеся числом нейтронов.
Рассмотрим пример с изотопами лития. Самостоятельно посчитайте количество нейтронов у каждого изотопа. Найдите тот, который включен в таблицу Д.И. Менделеева.

Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Читайте также:
