Электролиты при диссоциации которых образуются катионы металла и анионы кислотного остатка
Кислотами называются электролиты, при диссоциации которых образуются катионы водорода и анионы кислотных остатков.
Многоосновные кислоты средней силы и слабые диссоциируют ступенчато:
H2S⇄ H+S – (первая ступень)
HS – ⇄S 2 – (вторая ступень)
Основанияминазываются электролиты, при диссоциации которых образуются катионы металлов и анионы гидроксогрупп
Если основание содержит несколько групп OH - , то может происходить ступенчатая диссоциация:
Ca(OH)2 ⇄Ca(OH) + +OH - (первая ступень)
Ca(OH) + ⇄Ca 2+ + OH - (вторая ступень)
Уравнения полной диссоциации имеют вид:
Соляминазываются электролиты, при диссоциации которых образуются катионы металлов и анионы кислотных остатков.
Диссоциация кислых солей происходит по ступеням:
2 H2P⇄H + + HP(вторая ступень)
HP⇄H + + P (третья ступень)
Основные соли характерны для многовалентных металлов и диссоциируют с образованием основных и кислотных остатков.
Диссоциация ионов основных остатков на ионы металла и гидроксогруппы почти не имеет места.
Контрольные вопросы:
1. Какие в-ва называют электролитами, а какие – неэлектролитами? Приведите примеры
2. Дайте определение явления электролитической диссоциации. Кто автор теории электролитической диссоциации?
3. Как диссоциируют в-ва с ионной связью?
4. Как диссоциируют в-ва с ковалентной связью?
5. Какая величина характеризует способность электролита к диссоциации?
6. Чем отличается диссоциация сильных электролитов от диссоциации слабых?
7. Какие в-ва в свете теории электролитической диссоциации называют кислотами? Основаниями? Солями
Тема. 1.5: Классификация неорганических соединений и их свойств
Перечень изучаемых вопросов:
Кислоты и их свойства. Кислоты как электролиты, их классификация по различным признакам. Химические свойства кислот в свете теории электролитической диссоциации. Особенности взаимодействия концентрированной серной и азотной кислот с металлами. Основные способы получения кислоты.
Основания и их свойства. Основания как электролиты, их классификация по различным признакам. Химические свойства оснований в свете теории электролитической диссоциации. Разложение нерастворимых в воде оснований. Основные способы получения оснований.
Оксиды и их свойства. Солеобразующие и несолеобразующие оксиды. Основные, амфотерные и кислотные оксиды. Зависимость характера оксида от степени окисления образующего его металла. Химические свойства оксидов. Получение оксидов.
Соли и их свойства. Соли как электролиты. Соли средние, кислые и оснóвные. Химически свойства солей в свете теории электролитической диссоциации. Способы получения солей. Гидролиз солей.
Кислотаминазываются сложные вещества, состоящие из атомов водорода и кислотных остатков.
| № п/п | Названия кислот | Формула | Название солей |
| Фтороводородная | НF | фториды | |
| Хлороводородная | HCl | хлориды | |
| Бромоводородная | HBr | бромиды | |
| Йодоводородная | HJ | йодиды | |
| Сероводородная | H2S | сульфиды | |
| Серная | H2SO4 | сульфаты | |
| Сернистая | H2SO3 | сульфиты | |
| Азотная | HNO3 | нитраты | |
| Азотистая | HNO2 | нитриты | |
| Угольная | H2CO3 | карбонаты | |
| Ортофосфорная | H3PO4 | фосфаты | |
| Кремневая | H2SiO3 | силикаты | |
| Марганцевая | HMnO4 | перманганаты | |
| Марганцовистая | H2MnO4 | ||
| Хлорноватистая | HClO | гипохлориты | |
| Хлорноватая | HClO3 | хлораты | |
| Хлорная | HClO4 | перхлораты | |
| Борная | H3BO3 | бораты | |
| Уксусная | CH3COOH | ацетаты |
Классификация кислот
По химическому составу кислоты делятся на:
Бескислородные:
| Н F | Фтороводородная |
| HCl | Хлороводородная |
| HBr | Бромоводородная |
| HJ | Йодоводородная |
| H2S | Сероводородная |
Кислородсодержащие:
| H2SO4 | Серная |
| H2SO3 | Сернистая |
| HNO3 | Азотная |
| HNO2 | Азотистая |
| H2CO3 | Угольная |
По основности кислоты делятся:
Одноосновные: НCl, HNO3, HBr, диссоциирующие в одну ступень
Трёхосновные: H3 PO4, H3BO3, диссоциирующие в три ступени
По степени диссоциации (силе) кислоты делятся:
Способы получения кислот:
Взаимодействием кислотных оксидов с водой
Взаимодействием водорода с неметаллами (растворением в воде)
Взаимодействием кислот с солями
Химические свойства кислота:
Изменяют окраску индикаторов: метилоранж - красный цвет, синий лакмус - красный цвет.
Кислоты реагируют с металлами (см. ряд активности металлов)
Кислоты реагируют с основными оксидами
NaOH + HCl = NaCl + H2O
Некоторые кислоты при нагревании разлагаются
Основанияминазываются сложные вещества, в состав которых входят атомы металлов, соединённые с гидроксогруппами (одной или несколькими).
| Основания | ||
| Растворимые | Нерастворимые | Амфотерные |
Способы получения оснований:
1)Взаимодействием активных металлов с водой
2)Взаимодействиемоксидов металлов с водой
3)Электролизом водных растворов NaCl
Химические свойства оснований:
1) Основания взаимодействуют с кислотами
2) Основания при нагревании разлагаются
голубой осадок черный осадок
3) Основания (щёлочи) взаимодействуют с растворами солей
2NaOH + CuСl2 = Cu (OH)2 ↓ + 2NaCl
4) Основания (щёлочи) взаимодействуют с кислотными оксидами
5) Индикатор фенолфталеин в щелочной среде имеет малиновую окраску
6) Щёлочи реагируют с жирами с образованием мыла.
Оксиды - это сложные вещества, молекулы которых состоят из двух элементов, одним из которых является кислород.
Оксидыделятся на несолеобразующие и солеобразующие.
Несолеобразующие: СО, NO, N2O, SiO
Cолеобразующие:
Основные,которым соответствуют основания - Na2O, CaO, MgO, FeO, Fe2O3, BaO, CrO.
Способы получения оксидов:
Разложением сложных веществ.
Химические свойства оксидов:
а) Кислотные оксиды взаимодействуют с основаниями
б) Кислотные оксиды взаимодействуют с Н2О с образованием кислот
в) Кислотные оксиды взаимодействуют с основными оксидами
г) Кислотные оксиды взаимодействуют с солями
д) Основные оксиды взаимодействуют с кислотами
е) Основные оксиды взаимодействуют с водой
Примечание: Амфотерные оксиды могут реагировать с кислотами и щелочами
Солиэто сложные вещества, в состав которых входят атомы металлов соединённые с кислотными остатками.
| Соли | |||
| Средние | Кислые | Основные | Двойные |
Название кислых солей - название средней соли с приставкой гидро -, дигидро -.NaHCO3 - гидрокарбонат натрия, NaH2PO4 -дигидрофосфат натрия
Название основных солей - название средней соли с приставкой гидроксо - , дигидроксо -. MgOHCl – хлорид гидроксомагния, Al(OH)2NO3 – нитрат дигидроксоалюминия,СаОНNO3 – нитрат гидроксокальция.
Химические свойства солей:
1) Соли взаимодействуют с металлами ( см. ряд активности металлов). Вытесняющий металл должен быть активнее.
ZnCl2 + 2Na = 2NaCl + Zn
2) Соли взаимодействуют с солями.
3) Соли взаимодействуют со щелочами.
4) Соли взаимодействуют с кислотами.
5) Некоторые соли при нагревании разлагаются
Гидролиз солей.
Обменная реакция ионов соли с ионами воды, приводящая к образованию слабого электролита, называется гидролизом соли.
Для большинства солей гидролиз является обратимым процессом, и только тогда когда продукты гидролиза уходят из сферы реакции, процесс протекает необратимо.
Урок №8. Диссоциация кислот, оснований и солей
С помощью теории электролитической диссоциации дают определения и описывают свойства кислот, оснований и солей.
Диссоциация кислот
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода (H + )
Многоосновные кислоты диссоциируют ступенчато:
Н 3 РО 4 ↔ Н + + Н 2 РО - 4 (первая ступень) – дигидроортофосфат ион
Н 2 РО - 4 ↔ Н + + НРO 2- 4 (вторая ступень) – гидроортофосфат ион
НРО 2- 4 ↔ Н + + PО З- 4 (третья ступень) – ортофосфат ион
Диссоциация многоосновной кислоты протекает главным образом по первой ступени, в меньшей степени по второй и лишь в незначительной степени - по третьей.
Диссоциация оснований
Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы (OH - )
Щёлочи – это основания, растворимые в воде (основания щелочных и щелочноземельных металлов) : LiOH, NaОН, КОН, RbОН, СsОН, FrОН и Са(ОН) 2 , Sr(ОН) 2 , Ва(ОН) 2 , Rа(ОН) 2 , а также NН 4 ОН
Примеры уравнений диссоциации щелочей:
Многокислотные основания диссоциируют ступенчато:
Ba(ОН) 2 → Bа(ОН) + + OH - (первая ступень)
Ba(OH) + ↔ Ba 2+ +OH - (вторая ступень)
Диссоциация амфотерных оснований (амфолитов)
Амфолиты - это электролиты, которые при диссоциации одновременно образуют катионы водорода (H + ) и гидроксид-ионы (OH - )
Диссоциацию амфотерного гидроксида цинка Zn(ОН) 2 можно выразить уравнением:
2ОН - + Zn 2+ + 2Н 2 О ↔ Zn(ОН) 2 + 2Н 2 О ↔ [Zn(ОН) 4 ] 2- + 2Н +
Диссоциация солей
Солями называются электролиты, при диссоциации которых образуются катионы металлов, а также катион аммония (NH + 4 ) и анионы кислотных остатков.
Диссоциация средних солей
Кислые и основные соли диссоциируют ступенчато.
Диссоциация кислых солей
У кислых солей вначале отщепляются ионы металлов, а затем катионы водорода.
Диссоциация основных солей
У основных солей вначале отщепляются кислотные остатки, а затем гидроксид-ионы.
MgOHCl → MgOH + + Cl -
MgOH + ↔ Mg 2+ + OH -
ЗАДАНИЕ ДЛЯ ЗАКРЕПЛЕНИЯ
Используя таблицу растворимости солей, кислот, оснований напишите уравнения диссоциации следующих веществ: HF, Mg(OH) 2 , CaCl 2 , Zn(NO 3 ) 2 , Ba(OH) 2 , K 2 SO 4 , H 2 SiO 3 , FeI 3 , NiCl 2 , H 3 PO 4 , Ca(OH) 2 , Na 2 CO 3 , Na 3 PO 4 , HNO 3 , KOH, Ba(OH) 2 , H 2 SO 3 , Ca(NO 3 ) 2 , Ca 3 (PO 4 ) 2 , H 2 S, NaOH, HBr
Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей (средних)

Катионами называют положительно заряженные ионы.
Анионами называют отрицательно заряженные ионы.
В процессе развития химии понятия «кислота» и «основание» претерпели серьёзные изменения. С точки зрения теории электролитической диссоциации кислотами называют электролиты, при диссоциации которых образуются ионы водорода H + , а основаниями — электролиты, при диссоциации которых образуются гидроксид-ионы OH – . Эти определения в химической литературе известны как определения кислот и оснований по Аррениусу.
В общем виде диссоциацию кислот представляют так:
где A – — кислотный остаток.
Такие свойства кислот, как взаимодействие с металлами, основаниями, основными и амфотерными оксидами, способность изменять окраску индикаторов, кислый вкус и т. д., обусловлены наличием в растворах кислот ионов H + . Число катионов водорода, которые образуются при диссоциации кислоты, называют её основностью. Так, например, HCl является одноосновной кислотой, H2SO4 — двухосновной, а H3PO4 — трёхосновной.
Многоосновные кислоты диссоциируют ступенчато, например:
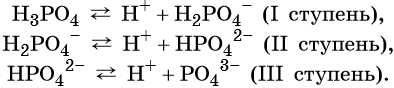
От образовавшегося на первой ступени кислотного остатка H2PO4 – последующий отрыв иона H + происходит гораздо труднее из-за наличия отрицательного заряда на анионе, поэтому вторая ступень диссоциации протекает гораздо труднее, чем первая. На третьей ступени протон должен отщепляться от аниона HPO4 2– , поэтому третья ступень протекает лишь на 0,001%.
В общем виде диссоциацию основания можно представить так:
где M + — некий катион.
Такие свойства оснований, как взаимодействие с кислотами, кислотными оксидами, амфотерными гидроксидами и способность изменять окраску индикаторов, обусловлены наличием в растворах OH – -ионов.
Число гидроксильных групп, которые образуются при диссоциации основания, называют его кислотностью. Например, NaOH — однокислотное основание, Ba(OH)2 — двухкислотное и т. д.
Многокислотные основания диссоциируют ступенчато, например:
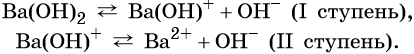
Большинство оснований в воде растворимо мало. Растворимые в воде основания называют щелочами.
Прочность связи М—ОН возрастает с увеличением заряда иона металла и увеличением его радиуса. Поэтому сила оснований, образуемых элементами в пределах одного и того же периода, уменьшается с возрастанием порядкового номера. Если один и тот же элемент образует несколько оснований, то степень диссоциации уменьшается с увеличением степени окисления металла. Поэтому, например, у Fe(OH)2 степень основной диссоциации больше, чем у Fe(OH)3.
Электролиты, при диссоциации которых одновременно могут образовываться катионы водорода и гидроксид-ионы, называют амфотерными. К ним относят воду, гидроксиды цинка, хрома и некоторые другие вещества. Их полный перечень приведён в уроке 6, а их свойства рассмотрены в уроке 16.
Солями называют электролиты, при диссоциации которых образуются катионы металлов (а также катион аммония NH4 + ) и анионы кислотных остатков.
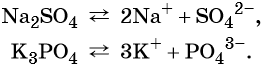
Химические свойства солей будут описаны в уроке 18.
Тренировочные задания
1. К электролитам средней силы относится
2. К сильным электролитам относится
3. Сульфат-ион в значительном количестве образуется при диссоциации в водном растворе вещества, формула которого
4. При разбавлении раствора электролита степень диссоциации
1) остается неизменной
2) понижается
3) повышается
4) с начала повышается, потом понижается
5. Степень диссоциации при нагревании раствора слабого электролита
6. Только сильные электролиты перечислены в ряду:
7. Водные растворы глюкозы и сульфата калия соответственно являются:
1) с ильным и слабым электролитом
2) неэлектролитом и сильным электролитом
3) слабым и сильным электролитом
4) слабым электролитом и неэлектролитом
8. Степень диссоциации электролитов средней силы
1) больше 0,6
2) больше 0,3
3) лежит в пределах 0,03—0,3
4) менее 0,03
9. Степень диссоциации сильных электролитов
10. Степень диссоциации слабых электролитов
11. Электролитами являются оба вещества:
1) фосфорная кислота и глюкоза
2) хлорид натрия и сульфат натрия
3) фруктоза и хлорид калия
4) ацетон и сульфат натрия
12. В водном растворе фосфорной кислоты H3PO4 наименьшая концентрация частиц
13. Электролиты расположены в порядке увеличения степени диссоциации в ряду
14. Электролиты расположены в порядке уменьшения степени диссоциации в ряду
15. Практически необратимо диссоциирует в водном растворе
1) уксусная кислота
2) бромоводородная кислота
3) фосфорная кислота
4) гидроксид кальция
16. Электролитом, более сильным по сравнению с азотистой кислотой, будет
1) уксусная кислота
2) сернистая кислота
3) фосфорная кислота
4) гидроксид натрия
17. Ступенчатая диссоциация характерна для
1) фосфорной кислоты
2) соляной кислоты
3) гидроксида натрия
4) нитрата натрия
18. Только слабые электролиты представлены в ряду
1) сульфат натрия и азотная кислота
2) уксусная кислота, сероводородная кислота
3) сульфат натрия, глюкоза
4) хлорид натрия, ацетон
19. Каждое из двух веществ является сильным электролитом
1) нитрат кальция, фосфат натрия
2) азотная кислота, азотистая кислота
3) гидроксид бария, сернистая кислота
4) уксусная кислота, фосфат калия
20. Оба вещества являются электролитами средней силы
1) гидроксид натрия, хлорид калия
2) фосфорная кислота, азотистая кислота
3) хлорид натрия, уксусная кислота
4) глюкоза, ацетат калия
Диссоциация оснований, кислот, солей

В данном видеофрагменте учащиеся знакомятся с уравнениями диссоциации электролитов: оснований, кислот и солей. Все приведенные уравнения диссоциации объясняются и акцентируется внимание на наиболее сложных моментах, подчеркивается общность свойств электролитов. Это поможет сконцентрировать внимание учащихся по этой теме.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Диссоциация оснований, кислот, солей"
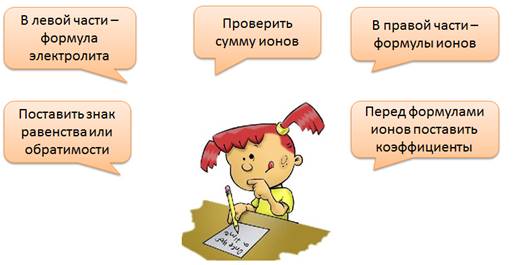
При составлении уравнений электролитической диссоциации следует поступать следующим образом: в левой части уравнения записать формулу электролита, затем поставить знак равенства или обратимости в зависимости от силы электролита. В правой части записать формулы образующихся положительно и отрицательно заряженных ионов, указав значения и знаки их зарядов. Перед формулами ионов поставить коэффициенты, затем проверить сумму положительных и отрицательных ионов, она должна быть равна нулю.
Кислоты – это электролиты, при диссоциации которых образуются катионы водорода и анионы кислотного остатка.
Сильные кислоты диссоциируют полностью по одной ступени:
HCl = H + + Cl -
H2SO4 = 2H + + SO4 2-
При диссоциации сильных кислот ставится знак равенства, а при диссоциации слабых кислот вместо знака равенства ставится знак обратимости.
HNO2 ⇆ H + + NO2 -
Многоосновные слабые кислоты диссоциируют ступенчато. На каждой стадии отщепляется ион водорода. Например, диссоциация фосфорной кислоты идет в 3 ступени:
1) H3PO4 ⇆ H + + H2PO4 -
2) H2PO4 - ⇆ H + + HPO4 2-
3) HPO4 2- ⇆ H + + PO4 3-
Следует учитывать, что диссоциация, в данном случае, по второй ступени протекает намного слабее, чем по первой, а диссоциация по третьей ступени при обычных условиях почти не происходит.
Как видно, все кислоты при диссоциации образуют катионы водорода, поэтому они имеют кислый вкус и изменяют окраску индикаторов: лакмус и метилоранж становятся красными.
Основания – это электролиты, при диссоциации которых образуются катионы металла и в качестве анионов гидроксид-ионы.
Сильные электролиты – щёлочи – диссоциируют полностью по первой ступени.
NaOH = Na + + OH -
Ca(OH)2 = Ca 2+ + 2OH -
Многоосновные слабые основания диссоциируют ступенчато и вместо знака равенства ставится знак обратимости. Например, гидроксид меди (II) диссоциирует по двум ступеням:
1) Cu(OH)2 ⇆ CuOH + + OH -
2) CuOH + ⇆ Cu 2+ + OH -
Т.к. при диссоциации оснований образуются гидроксид-ионы, то они будут иметь схожие свойства, такие как мыльность на ощупь, изменение окраски индикаторов: лакмус становится синим, метилоранж – жёлтым, фенолфталеин – малиновым.
Соли – это электролиты, при диссоциации которых образуются катионы металлов (или аммония) и анионы кислотного остатка.
Соли диссоциируют по одной ступени, в отличие от кислот и оснований.
NaCl = Na + + Cl -
Al2(SO4)3 = 2Al 3+ + 3SO4 2-
Свойства солей определяются как катионами металла, так и анионами кислотного остатка. Например, соли аммония имеют общие свойства, обусловленные наличием иона аммония (NH4 + ), так и различные, обусловленные анионами кислотного остатка. Общие свойства сульфатов – солей серной кислоты – обусловлены наличием сульфат-ионов, а специфические свойства обусловлены различными катионами.
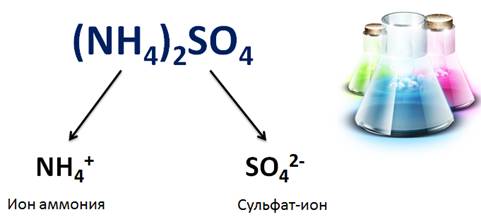
Кислые соли, в отличие от средних, диссоциируют ступенчато: первая ступень сопровождается диссоциацией катиона металла и аниона кислотного остатка, содержащего ион водорода, вторая ступень – это отщепление иона водорода и кислотного остатка.
Диссоциация кислот, оснований и солей в водных растворах
I . Кислоты – это электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода.
Многоосновные кислоты диссоциируют ступенчато:
I ступень: К а I = 7.3 ×10 -10
II ступень: К а II = 1.8 ×10 -13
III ступень: К а III = 1.6 ×10 -14
К а I ; К а II ; К а III называются константами диссоциации по I, II и III ступеням.
= 7.3 ×10 -10 ; = 1.8 ×10 -13
Общий ион H + , придает окраску индикаторам.
II. Основания – это электролиты, при диссоциации которых в качестве анионов образуются только гидроксид - ионы ОН − .
NaOH Na + + ОН −
Многокислотные основания диссоциируют ступенчато:
I Iступень: ,
I I Iступень: ,
Где К в I ; К в II ; К в III - константы диссоциации по I, II и III ступеням.
Анионы ОН − придают окраску индикаторам.
III . Соли –это электролиты, при диссоциации которых образуются катионы металла и анионы кислотного остатка.
Средние соли: NaCl Na + + Cl -
Основные соли: BaOHCl BaOH + + Cl - ; BaOH + Ba 2+ + ОН −
Общих ионов нет, индикаторы не изменяют окраску.
Процесс электролитической диссоциации веществ в водных растворах количественно характеризуется двумя величинами:
1. степенью электролитической диссоциации - a,
2. константой диссоциации - Кдис.
I . Степень диссоциации (a ) – это отношение числа молекул, распавшихся на ионы к общему числу молекул электролита.
Факторы, влияющие на степень диссоциации:
1. Природа растворенного вещества, тип связи (чем полярнее связь, тем легче идет диссоциация).
2. Природа растворителя (чем больше величина диэлектрической проницаемости ε, тем легче идет диссоциация).
3. Концентрация (при разбавлении a увеличивается; a = ).
4. Температура (с увеличением температуры a растет до определенной величины, затем уменьшается).
5. Влияние одноименного иона (вводимый в систему одноименный ион подавляет диссоциацию слабого электролита).
По величине степени диссоциации электролиты делятся на:
1. Сильные, у которых α > 30% : соли, некоторые кислоты - HClO4, H2SO4, HNO3, HI, HBr, HCl, гидроксиды щелочных металлов, гидроксиды щелочно-зельных металлов: кальция, стронция и бария.
3. Слабые, у которых a2O, HCN, NH4OH.
II . Константа диссоциации (Кдис) – это константа равновесия процесса диссоциации.
Рассмотрим равновесие в растворе слабого электролита.
KA « K + + A -
Пусть концентрация слабого электролита в растворе С моль/л, a- степень диссоциации. Тогда концентрация недиссоциированных молекул [KA]= с(1-a), а концентрация каждого из ионов [K + ]=[ A - ]= сa. Выражение для константы диссоциации имеет вид:
Это уравнение представляет собой закон разбавления Оствальда. Оно позволяет определять степень диссоциации при разных концентрациях электролита, если известна его константа диссоциации; а также константу диссоциации электролита, если известна его степень диссоциации при какой-либо концентрации.
Читайте также:
