Электролиты образующие при диссоциации катионы металла и анионы
Тренировочные упражнения по теме «Электролиты и неэлектролиты. Катионы и анионы. Электролитическая диссоциация кислот, щёлочей и солей (средних)» в формате ОГЭ по химии (тренажер задания 13 ОГЭ по химии).
Теория по теме (теория для решения задания 13 ОГЭ по химии):
При полной диссоциации 1 моль каких двух из представленных веществ образуется 2 моль катионов и 1 моль анионов?
1) карбонат аммония
2) бромид кальция
3) сульфит калия
4) фосфат натрия
5) нитрат меди(II)
Ответ: 13
При полной диссоциации 1 моль каких двух из представленных веществ образуется 3 моль ионов?
Ответ: 15
При внесении в воду каких двух из представленных веществ образуются хлорид-анионы?
Ответ: 23
1) карбонат аммония
2) бромид лития
3) сульфат марганца(II)
4) фосфат калия
5) нитрат бария
Из предложенного перечня веществ выберите два слабых электролита.
Ответ: 34
Из предложенного перечня веществ выберите два неэлектролита.
1) хлорид калия
2) оксид углерода(II)
3) фосфор белый
4) соляная кислота
5) гидроксид калия
При полной диссоциации 1 моль каких из представленных веществ образуется 4 моль ионов?
1) сульфат алюминия
2) бромид алюминия
3) сульфат магния
4) фосфат натрия
5) нитрат кальция
Ответ: 24
Водный раствор каких двух из представленных веществ не проводит электрический ток?
1) поваренная соль
2) серная кислота
3) сахар
4) питьевая сода
5) этиловый спирт
Ответ: 35
Из предложенного перечня выберите два вещества, которые относятся к электролитам.
Из предложенного перечня выберите два вещества, при полной диссоциации 1 моль которых образуется 2 моль катионов
1) хлорид алюминия
2) нитрат кальция
3) хлорид магния
4) карбонат калия
5) серная кислота
Ответ: 45
При полной диссоциации 1 моль каких двух из представленных веществ образуется 2 моль ионов?
Ответ: 12
1) сульфат железа(III)
2) бромид меди(II)
3) нитрат хрома(III)
4) гидроксид кальция
5) хлорид аммония
При полной диссоциации 1 моль каких двух из представленных веществ образуется 2 моль анионов?
1) карбонат аммония
2) нитрат кальция
3) фосфат натрия
4) хлорид меди(II)
5) сульфат железа(II)
При полной диссоциации 1 моль каких двух из представленных веществ образуется 5 моль ионов?
1) хлорид алюминия
2) сульфат алюминия
3) нитрат кальция
4) гидроксид натрия
5) сульфат железа(III)
Ответ: 25
Укажите, какие ионы и в каком количестве образуются в растворе при полной диссоциации 1 моль нитрата железа(III).
1) 1 моль Fe 3+
2) 2 моль Fe 3+
3) 3 моль Fe 3+
4) 1 моль NO3 –
5) 3 моль NO3 –
1) сульфат алюминия
2) бромид меди(II)
3) фторид калия
4) фосфат натрия
5) нитрат бария
Укажите, какие ионы и в каком количестве образуются в растворе при полной диссоциации 1 моль сульфата железа(II).
1) 2 моль Fe 2+
2) 1 моль Fe 2+
3) 1 моль SO3 2–
4) 2 моль SO4 2–
5) 1 моль SO4 2–
При полной диссоциации 1 моль каких двух из представленных веществ образуется 2 моль катионов?
1) хлорид магния
2) сульфид калия
3) сульфат цинка
4) карбонат натрия
5) нитрат меди(II)
1) сульфат алюминия
2) бромид кальция
3) сульфит калия
4) фосфат натрия
5) нитрат стронция
Укажите, какие ионы и в каком количестве образуются в растворе при полной диссоциации 1 моль хлорида железа(III).
1) 1 моль Fe 3+
2) 1 моль Fe 2+
3) 3 моль Fe 3+
4) 1 моль Cl –
5) 3 моль Cl –
При полной диссоциации 1 моль каких двух из представленных веществ в качестве катионов образуются только ионы водорода?
При полной диссоциации 1 моль каких двух из представленных веществ образуется 4 моль ионов?
1) сульфат хрома(III)
2) бромид меди(II)
3) нитрат железа(III)
4) гидроксид кальция
5) иодид алюминия
Укажите, какие ионы и в каком количестве образуются в растворе при полной диссоциации 1 моль нитрата железа(II).
1) 1 моль Fe 2+
2) 2 моль Fe 2+
3) 1 моль Fe 3+
4) 1 моль NO3 –
5) 2 моль NO3 –
Из предложенного перечня выберите два вещества, при полной диссоциации 1 моль которых образуется 2 моль анионов.
1) нитрат цинка
2) сульфат магния
3) хлорид бария
4) карбонат натрия
5) нитрат алюминия
Из предложенного перечня веществ выберите два сильных электролита.
1) сульфат магния
2) хлорид меди(II)
3) нитрат калия
4) сульфат алюминия
5) карбонат натрия
Укажите, какие ионы и в каком количестве образуются в растворе при полной диссоциации 1 моль хлорида железа(II).
1) 1 моль Fe 2+
2) 2 моль Fe 2+
3) 1 моль Fe 3+
4) 1 моль Cl –
5) 2 моль Cl –
1) силикат калия
2) сульфат железа(III)
3) сульфат железа(II)
4) хлорид железа(II)
5) сульфат меди(II)
Из предложенного перечня выберите два вещества, растворы которых не проводят электрический ток.
1) серная кислота
2) глюкоза
3) нитрат кальция
4) гидроксид натрия
5) этиловый спирт
1) сульфат аммония
2) нитрат калия
3) фосфат натрия
4) хлорид меди(II)
5) сульфат железа(III)
Укажите, какие ионы и в каком количестве образуются в растворе при полной диссоциации 1 моль сульфида калия.
1) 1 моль K +
2) 2 моль K +
3) 1 моль SO4 2–
4) 2 моль SO3 2–
5) 1 моль S 2–
Укажите, какие ионы и в каком количестве образуются в растворе при полной диссоциации 1 моль сульфата алюминия.
1) 1 моль Al 3+
2) 2 моль Al 3+
3) 3 моль Al 3+
4) 1 моль SO4 2–
5) 3 моль SO4 2–
1) хлорид алюминия
2) сульфат цинка
3) нитрат магния
4) гидроксид бария
5) фосфат калия
При полной диссоциации 1 моль каких из представленных веществ образуется 2 моль анионов?
1) сульфат алюминия
2) бромид магния
3) сульфид лития
4) фосфат натрия
5) нитрат стронция
1) карбонат аммония
2) нитрат кальция
3) нитрит натрия
4) хлорид меди(II)
5) сульфат железа(II)
1) сульфат алюминия
2) сульфат цинка
3) нитрат магния
4) карбонат аммония
5) фосфат калия
Ответ: 14
1) сероводородная кислота
2) углекислый газ
3) хлорид лития
4) азотная кислота
5) этиловый спирт
Укажите, какие ионы и в каком количестве образуются в растворе при полной диссоциации 1 моль сульфата меди(II).
1) 1 моль Cu 2+
2) 2 моль Cu 2+
3) 1 моль SO3 2–
4) 1 моль SO4 2–
5) 2 моль SO4 2–
Укажите, какие ионы и в каком количестве образуются в растворе при полной диссоциации 1 моль сульфата железа(III).
1) 1 моль Fe 3+
2) 2 моль Fe 3+
3) 3 моль Fe 3+
4) 1 моль SO4 2–
5) 3 моль SO4 2–
Из предложенного перечня выберите два вещества, при полной диссоциации 1 моль которых образуется 3 моль ионов?
1) карбонат натрия
2) нитрат калия
3) гидроксид лития
4) хлорид магния
5) сульфат алюминия
1) гидроксид калия
2) нитрат кальция
3) сульфит натрия
4) хлорид магния
5) азотная кислота
1) хлорид железа(III)
2) сульфат натрия
3) карбонат лития
4) хлорид натрия
5) нитрат калия
При полной диссоциации 1 моль каких двух из представленных веществ образуется 2 моль анионов и 1 моль катионов?
1) хлорид цинка
2) карбонат натрия
3) сульфит калия
4) сульфат магния
5) нитрат бария
При полной диссоциации 1 моль каких двух из представленных веществ образуется 3 моль анионов?
Из предложенного перечня веществ выберите два электролита.
1) глюкоза
2) оксид кремния
3) нитрат меди(II)
4) оксид углерода(II)
5) хлорид аммония
Укажите, какие ионы и в каком количестве образуются в растворе при полной диссоциации 1 моль сульфита натрия.
1) 1 моль Na +
2) 2 моль Na +
3) 1 моль SO4 2–
4) 1 моль SO3 2–
5) 2 моль S 2–
При диссоциации каких двух из представленных веществ образуется 1 моль катионов и 3 моль анионов?
Из предложенного перечня выберите два неэлектролита.
1) хлорид магния
2) сульфат цинка
3) нитрат кальция
4) гидроксид натрия
5) фосфат калия
При полной диссоциации 1 моль каких двух из представленных веществ образуется 1 моль катионов и 1 моль анионов?
1) сульфат магния
2) нитрат кальция
3) фосфат натрия
4) фторид калия
5) хлорид железа(II)
Укажите, какие ионы и в каком количестве образуются в растворе при полной диссоциации 1 моль сульфата калия.
1) 1 моль K +
2) 2 моль K +
3) 1 моль S 2–
4) 1 моль SO3 2–
5) 1 моль SO4 2–
1) сульфат лития
2) нитрат кальция
3) гидроксид натрия
4) фторид аммония
5) хлорид железа(II)
1) иодид алюминия
2) сульфат натрия
3) нитрат магния
4) гидроксид бария
5) фосфат калия
Укажите, какие ионы и в каком количестве образуются в растворе при полной диссоциации 1 моль нитрата алюминия.
1) 1 моль Al 3+
2) 3 моль Al 3+
3) 1 моль NO3 –
4) 2 моль NO3 –
5) 3 моль NO3 –
1) карбонат натрия
2) сульфат цинка
3) нитрат кальция
4) гидроксид натрия
5) фосфат калия
Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей (средних)

Катионами называют положительно заряженные ионы.
Анионами называют отрицательно заряженные ионы.
В процессе развития химии понятия «кислота» и «основание» претерпели серьёзные изменения. С точки зрения теории электролитической диссоциации кислотами называют электролиты, при диссоциации которых образуются ионы водорода H + , а основаниями — электролиты, при диссоциации которых образуются гидроксид-ионы OH – . Эти определения в химической литературе известны как определения кислот и оснований по Аррениусу.
В общем виде диссоциацию кислот представляют так:
где A – — кислотный остаток.
Такие свойства кислот, как взаимодействие с металлами, основаниями, основными и амфотерными оксидами, способность изменять окраску индикаторов, кислый вкус и т. д., обусловлены наличием в растворах кислот ионов H + . Число катионов водорода, которые образуются при диссоциации кислоты, называют её основностью. Так, например, HCl является одноосновной кислотой, H2SO4 — двухосновной, а H3PO4 — трёхосновной.
Многоосновные кислоты диссоциируют ступенчато, например:
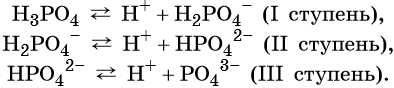
От образовавшегося на первой ступени кислотного остатка H2PO4 – последующий отрыв иона H + происходит гораздо труднее из-за наличия отрицательного заряда на анионе, поэтому вторая ступень диссоциации протекает гораздо труднее, чем первая. На третьей ступени протон должен отщепляться от аниона HPO4 2– , поэтому третья ступень протекает лишь на 0,001%.
В общем виде диссоциацию основания можно представить так:
где M + — некий катион.
Такие свойства оснований, как взаимодействие с кислотами, кислотными оксидами, амфотерными гидроксидами и способность изменять окраску индикаторов, обусловлены наличием в растворах OH – -ионов.
Число гидроксильных групп, которые образуются при диссоциации основания, называют его кислотностью. Например, NaOH — однокислотное основание, Ba(OH)2 — двухкислотное и т. д.
Многокислотные основания диссоциируют ступенчато, например:
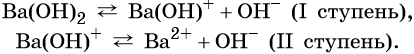
Большинство оснований в воде растворимо мало. Растворимые в воде основания называют щелочами.
Прочность связи М—ОН возрастает с увеличением заряда иона металла и увеличением его радиуса. Поэтому сила оснований, образуемых элементами в пределах одного и того же периода, уменьшается с возрастанием порядкового номера. Если один и тот же элемент образует несколько оснований, то степень диссоциации уменьшается с увеличением степени окисления металла. Поэтому, например, у Fe(OH)2 степень основной диссоциации больше, чем у Fe(OH)3.
Электролиты, при диссоциации которых одновременно могут образовываться катионы водорода и гидроксид-ионы, называют амфотерными. К ним относят воду, гидроксиды цинка, хрома и некоторые другие вещества. Их полный перечень приведён в уроке 6, а их свойства рассмотрены в уроке 16.
Солями называют электролиты, при диссоциации которых образуются катионы металлов (а также катион аммония NH4 + ) и анионы кислотных остатков.
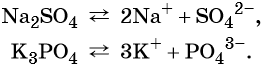
Химические свойства солей будут описаны в уроке 18.
Тренировочные задания
1. К электролитам средней силы относится
2. К сильным электролитам относится
3. Сульфат-ион в значительном количестве образуется при диссоциации в водном растворе вещества, формула которого
4. При разбавлении раствора электролита степень диссоциации
1) остается неизменной
2) понижается
3) повышается
4) с начала повышается, потом понижается
5. Степень диссоциации при нагревании раствора слабого электролита
6. Только сильные электролиты перечислены в ряду:
7. Водные растворы глюкозы и сульфата калия соответственно являются:
1) с ильным и слабым электролитом
2) неэлектролитом и сильным электролитом
3) слабым и сильным электролитом
4) слабым электролитом и неэлектролитом
8. Степень диссоциации электролитов средней силы
1) больше 0,6
2) больше 0,3
3) лежит в пределах 0,03—0,3
4) менее 0,03
9. Степень диссоциации сильных электролитов
10. Степень диссоциации слабых электролитов
11. Электролитами являются оба вещества:
1) фосфорная кислота и глюкоза
2) хлорид натрия и сульфат натрия
3) фруктоза и хлорид калия
4) ацетон и сульфат натрия
12. В водном растворе фосфорной кислоты H3PO4 наименьшая концентрация частиц
13. Электролиты расположены в порядке увеличения степени диссоциации в ряду
14. Электролиты расположены в порядке уменьшения степени диссоциации в ряду
15. Практически необратимо диссоциирует в водном растворе
1) уксусная кислота
2) бромоводородная кислота
3) фосфорная кислота
4) гидроксид кальция
16. Электролитом, более сильным по сравнению с азотистой кислотой, будет
1) уксусная кислота
2) сернистая кислота
3) фосфорная кислота
4) гидроксид натрия
17. Ступенчатая диссоциация характерна для
1) фосфорной кислоты
2) соляной кислоты
3) гидроксида натрия
4) нитрата натрия
18. Только слабые электролиты представлены в ряду
1) сульфат натрия и азотная кислота
2) уксусная кислота, сероводородная кислота
3) сульфат натрия, глюкоза
4) хлорид натрия, ацетон
19. Каждое из двух веществ является сильным электролитом
1) нитрат кальция, фосфат натрия
2) азотная кислота, азотистая кислота
3) гидроксид бария, сернистая кислота
4) уксусная кислота, фосфат калия
20. Оба вещества являются электролитами средней силы
1) гидроксид натрия, хлорид калия
2) фосфорная кислота, азотистая кислота
3) хлорид натрия, уксусная кислота
4) глюкоза, ацетат калия
Электролитическая диссоциация
Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Примеры решения задач
Задачи для самостоятельного решения
Степень диссоциации
Вещества, которые в растворах или расплавах полностью или частично распадаются на ионы, называются электролитами.
Степень диссоциации α — это отношение числа молекул, распавшихся на ионы N′ к общему числу растворенных молекул N:
α = N′/N
Степень диссоциации выражают в процентах или в долях единицы. Если α =0, то диссоциация отсутствует и вещество не является электролитом. В случае если α =1, то электролит полностью распадается на ионы.
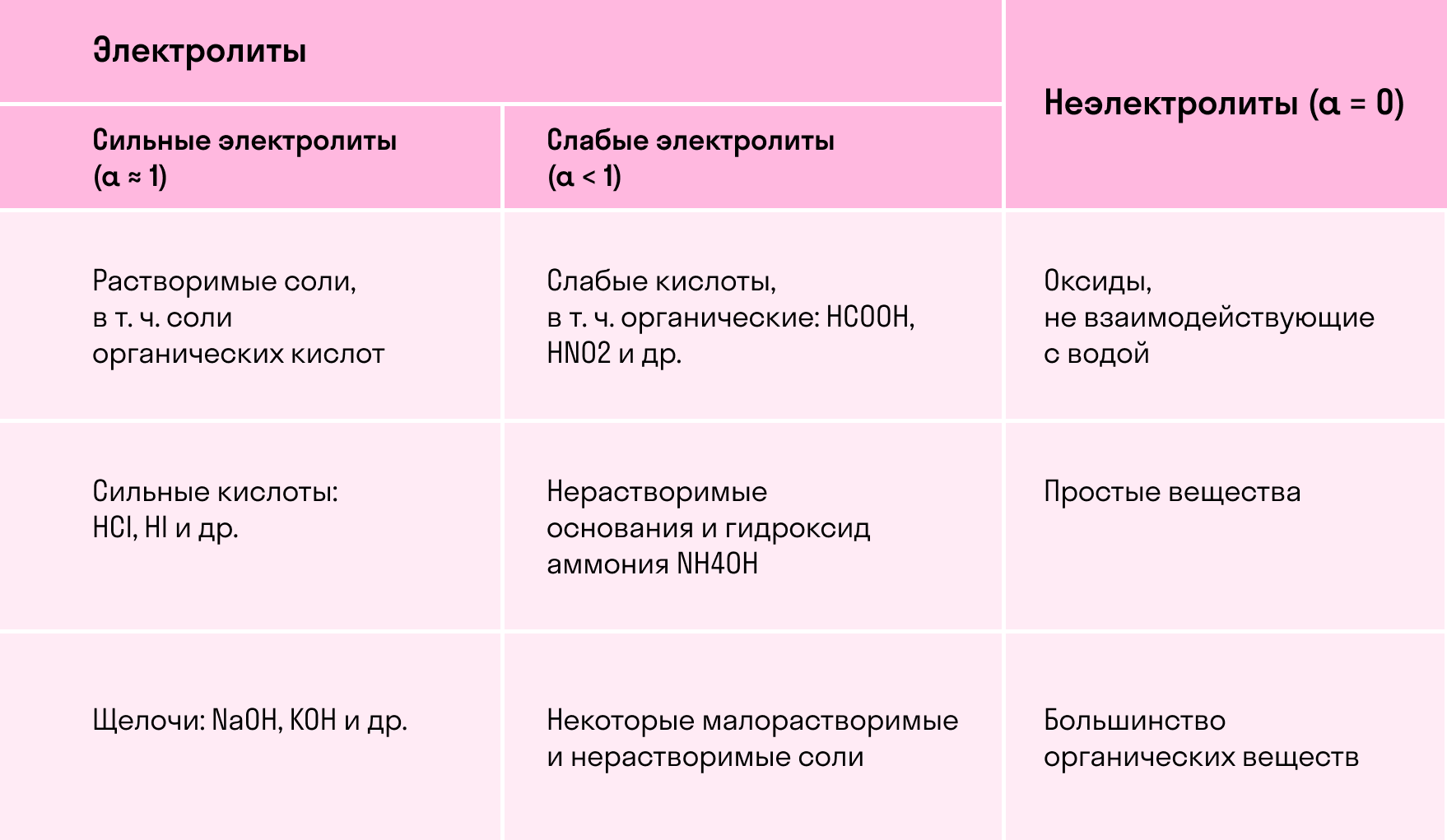
Классификация электролитов
Согласно современным представлениям теории растворов все электролиты делятся на два класса: ассоциированные (слабые) и неассоциированные (сильные) . Неассоциированные электролиты в разбавленных растворах практически полностью диссоциированы на ионы. Для этого класса электролитов a близко к единице (к 100 %). Неассоциированными электролитами являются, например, HCl, NaOH, K2SO4 в разбавленных водных растворах.
Ассоциированные электролиты подразделяются на три типа:
- Слабые электролиты существуют в растворах как в виде ионов, так и в виде недиссоциированных молекул. Примерами ассоциированных электролитов этой группы являются, в частности, Н2S, Н2SO3, СН3СOОН в водных растворах.
- Ионные ассоциаты образуются в растворах путем ассоциации простых ионов за счет электростатического взаимодействия. Ионные ассоциаты возникают в концентрированных растворах хорошо растворимых электролитов. В результате в растворе находятся как простые ионы, так и ионные ассоциаты. Например, в концентрированном водном растворе КCl образуются простые ионы К + , Cl — , а также возможно образование ионных пар (К + Cl — ), ионных тройников (K2Cl + , KCl2 — ) и ионных квадруполей (K2Cl2, KCl3 2- , K3Cl 2+ ).
- Комплексные соединения (как ионные, так и молекулярные), внутренняя сфера которых ступенчато диссоциирует на ионные и (или) молекулярные частицы.
Примеры комплексных ионов: [Cu(NH3)4] 2+ , [Fe(CN)6] 3+ , [Cr(H2O)3Cl2] + .
При таком подходе один и тот же электролит может относиться к различным типам в зависимости от концентрации раствора, вида растворителя и температуры. Подтверждением этому являются данные, приведенные в таблице.
Таблица. Характеристика растворов KI в различных растворителях
Приближенно, для качественных рассуждений можно пользоваться устаревшим делением электролитов на сильные и слабые. Выделение группы электролитов “средней силы” не имеет смысла. Эти электролиты являются ассоциированными. К слабым электролитам обычно относят электролиты, степень диссоцииации которых мала α
Таким образом, к сильным электролитам относятся разбавленные водные растворы почти всех хорошо растворимых в воде солей, многие разбавленные водные растворы минеральных кислот (НСl, HBr, НNО3, НСlO4 и др.), разбавленные водные растворы гидроксидов щелочных металлов. К слабым электролитам принадлежат все органические кислоты в водных растворах, некоторые водные растворы неорганических кислот, например, H2S, HCN, H2CO3, HNO2, HСlO и др. К слабым электролитам относится и вода.
Диссоциация электролитов
Уравнение реакции диссоциации сильного электролита можно представить следующим образом. Между правой и левой частями уравнения реакции диссоциации сильного электролита ставится стрелка или знак равенства:
HCl → H + + Cl —
Допускается также ставить знак обратимости, однако в этом случае указывается направление, в котором смещается равновесие диссоциации, или указывается, что α≈1. Например:
NaOH → Na + + OH —
Диссоциация кислых и основных солей в разбавленных водных растворах протекает следующим образом:
NaHSO3 → Na + + HSO3 —
Анион кислой соли будет диссоциировать в незначительной степени, поскольку является ассоциированным электролитом:
HSO3 — → H + + SO3 2-
Аналогичным образом происходит диссоциация основных солей:
Mg(OH)Cl → MgOH + + Cl —
Катион основной соли подвергается дальнейшей диссоциации как слабый электролит:
MgOH + → Mg 2+ + OH —
Двойные соли в разбавленных водных растворах рассматриваются как неассоциированные электролиты:
Комплексные соединения в разбавленных водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы:
В свою очередь, комплексный ион в незначительной степени подвергается дальнейшей диссоциации:
[Fe(CN)6] 3- → Fe 3+ + 6CN —
Константа диссоциации
При растворении слабого электролита К А в растворе установится равновесие:
КА ↔ К + + А —
которое количественно описывается величиной константы равновесия Кд, называемой константой диссоциации :
Kд = [К + ] · [А — ] /[КА] (2)
Константа диссоциации характеризует способность электролита диссоциировать на ионы. Чем больше константа диссоциации, тем больше ионов в растворе слабого электролита. Например, в растворе азотистой кислоты HNO2 ионов Н + больше, чем в растворе синильной кислоты HCN, поскольку К(HNO2) = 4,6·10 — 4 , а К(HCN) = 4,9·10 — 10 .
Для слабых I-I электролитов (HCN, HNO2, CH3COOH) величина константы диссоциации Кд связана со степенью диссоциации α и концентрацией электролита c уравнением Оствальда:
Кд = (α 2· с)/(1-α) (3)
Для практических расчетов при условии, что α
Кд = α 2· с (4)
Поскольку процесс диссоциации слабого электролита обратим, то к нему применим принцип Ле Шателье. В частности, добавление CH3COONa к водному раствору CH3COOH вызовет подавление собственной диссоциации уксусной кислоты и уменьшение концентрации протонов. Таким образом, добавление в раствор ассоциированного электролита веществ, содержащих одноименные ионы, уменьшает его степень диссоциации.
Следует отметить, что константа диссоциации слабого электролита связана с изменением энергии Гиббса в процессе диссоциации этого электролита соотношением:
ΔGT 0 = — RTlnKд (5)
Уравнение (5) используется для расчета констант диссоциации слабых электролитов по термодинамическим данным.
Примеры решения задач
Задача 1. Определите концентрацию ионов калия и фосфат-ионов в 0,025 М растворе K3PO4.
Решение. K3PO4 – сильный электролит и в водном растворе диссоциирует полностью:
Следовательно, концентрации ионов К + и РО4 3- равны соответственно 0,075М и 0,025М.
Задача 2. Определите степень диссоциации αд и концентрацию ионов ОН — (моль/л) в 0,03 М растворе NH3·H2О при 298 К, если при указанной температуре Кд(NH3·H2О) = 1,76× 10 — 5 .
Решение. Уравнение диссоциации электролита:
Концентрации ионов: [NH4 + ] = α С ; [OH — ] = α С , где С – исходная концентрация NH 3 ·H 2 О моль/л. Следовательно:
Kд = αС · αС /(1 — αС)
Кд ≈ α 2 С
Константа диссоциации зависит от температуры и от природы растворителя, но не зависит от концентрации растворов NH 3 ·H 2 О . Закон разбавления Оствальда выражает зависимость α слабого электролита от концентрации.
α = √( Кд / С) = √(1,76× 10 — 5 / 0,03) = 0,024 или 2,4 %
[OH — ] = αС, откуда [OH — ] = 2,4·10 — 2 ·0,03 = 7,2·10 -4 моль/л.
Задача 3. Определите константу диссоциации уксусной кислоты, если степень диссоциации CH3CОOH в 0,002 М растворе равна 9,4 %.
Решение. Уравнение диссоциации кислоты:
CH3CОOH → СН3СОО — + Н + .
α = [Н + ] / Сисх(CH3CОOH)
откуда [Н + ] = 9,4·10 — 2 ·0,002 = 1,88·10 -4 М.
Kд = [Н + ] 2 / Сисх(CH3CОOH)
Константу диссоциации можно также найти по формуле: Кд ≈ α 2 С .
Задача 4. Константа диссоциации HNO2 при 298К равна 4,6× 10 — 4 . Найдите концентрацию азотистой кислоты, при которой степень диссоциации HNO2 равна 5 %.
Решение.
Кд = α 2 С , откуда получаем С исх (HNO 2 ) = 4,6·10 — 4 /(5·10 — 2 ) 2 = 0,184 М.
Задача 5. На основе справочных данных рассчитайте константу диссоциации муравьиной кислоты при 298 К.
Решение. Уравнение диссоциации муравьиной кислоты
В “Кратком справочнике физико–химических величин” под редакцией А.А. Равделя и А.М. Пономаревой приведены значения энергий Гиббса образований ионов в растворе, а также гипотетически недиссоциированных молекул. Значения энергий Гиббса для муравьиной кислоты и ионов Н + и СООН — в водном растворе приведены ниже:
Вещество, ион НСООН Н + СООН — ΔGT 0 , кДж/моль — 373,0 0 — 351,5 Изменение энергии Гиббса процесса диссоциации равно:
ΔGT 0 = — 351,5- (- 373,0) = 21,5 кДж/моль.
Для расчета константы диссоциации используем уравнение (5). Из этого уравнения получаем:
lnKд = — Δ GT 0 /RT= — 21500/(8,31 298) = — 8,68
Откуда находим: Kд = 1,7× 10 — 4 .
Задачи для самостоятельного решения
1. К сильным электролитам в разбавленных водных растворах относятся:
13.2. К слабым электролитам в водных растворах относятся:
3. Определите концентрацию ионов NH4 + в 0,03 М растворе (NH4)2Fe(SO4)2;
4. Определите концентрацию ионов водорода в 6 мас.% растворе H2SO4, плотность которого составляет 1,038 г/мл. Принять степень диссоциации кислоты по первой и второй ступеням равной 100 %.
5. Определите концентрацию гидроксид-ионов в 0,15 М растворе Ba(OH)2.
6. Степень диссоциации муравьиной кислоты в 0,1 М растворе равна 4 %. Рассчитайте Концентрацию ионов водорода в этом растворе и константу диссоциации НСООН.
7. Степень диссоциации муравьиной кислоты в водном растворе увеличится при:
а) уменьшении концентрации HCOOH;
б) увеличении концентрации HCOOH;
в) добавлении в раствор муравьиной кислоты HCOONa;
г) добавлении в раствор муравьиной кислоты НCl.
8. Константа диссоциации хлорноватистой кислоты равна 5× 10 — 8 . Определите концентрацию HClO, при которой степень диссоциации HClO равна 0,5 %, и концентрацию ионов Н + в этом растворе.
0,002М; 1× 10 — 5 М.
9. Вычислите объем воды, который необходимо добавить к 50 мл 0,02 М раствора NH3·H2О, чтобы степень диссоциации NH3·H2О увеличилась в 10 раз, если Кд(NH4OH) = 1,76·10 — 5 .
10. Определите степень диссоциации азотистой кислоты в 0,25 М растворе при 298 К, если при указанной температуре Кд(HNO2) = 4,6× 10 — 4 .
Теория электролитической диссоциации
![]()
Электролиты – это вещества, растворы и расплавы которых проводят электрический ток.Электрический ток – это упорядоченное движение заряженных частиц под действием электрического поля. Таким образом, в растворах или расплавах электролитов есть заряженные частицы. В растворах электролитов, как правило, электрическая проводимость обусловлена наличием ионов.
Ионы – это заряженные частицы (атомы или группы атомов). Разделяют положительно заряженные ионы (катионы) и отрицательно заряженные ионы (анионы).
Электролитическая диссоциация — это процесс распада электролита на ионы при его растворении или плавлении.
Разделяют вещества — электролиты и неэлектролиты. К неэлектролитам относятся вещества с прочной ковалентной неполярной связью (простые вещества), все оксиды (которые химически не взаимодействуют с водой), большинство органических веществ (кроме полярных соединений — карбоновых кислот, их солей, фенолов) — альдегиды, кетоны, углеводороды, углеводы.
К электролитам относят некоторые вещества с ковалентной полярной связью и вещества с ионной кристаллической решеткой.
В чем же суть процесса электролитической диссоциации?
Поместим в пробирку несколько кристаллов хлорида натрия и добавим воду. Через некоторое время кристаллы растворятся. Что произошло?
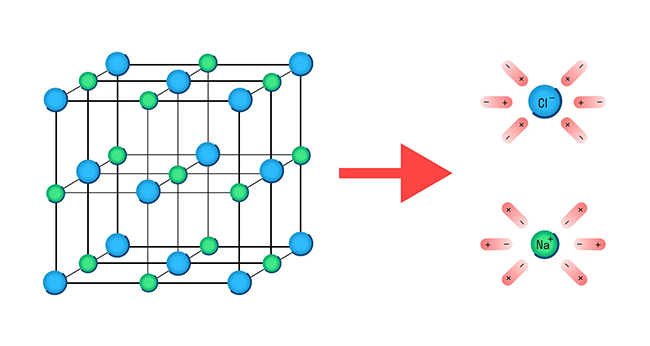
Хлорид натрия – вещество с ионной кристаллической решеткой. Кристалл NaCl состоит из ионов Na + и Cl — . В воде этот кристалл распадается на структурные единицы-ионы. При этом распадаются ионные химические связи и некоторые водородные связи между молекулами воды. Попавшие в воду ионы Na + и Cl — вступают во взаимодействие с молекулами воды. В случае хлорид-ионов можно говорить про электростатическое притяжение дипольных (полярных) молекул воды к аниону хлора, а в случае катионов натрия оно приближается по своей природе к донорно-акцепторному (когда электронная пара атома кислорода помещается на вакантные орбитали иона натрия). Окруженные молекулами воды ионы покрываются гидратной оболочкой. Диссоциация хлорида натрия описывается уравнением:NaCl = Na + + Cl –
![Диссоциация хлорида натрия]()
При растворении в воде соединений с ковалентной полярной связью, молекулы воды, окружив полярную молекулу, сначала растягивают связь в ней, увеличивая её полярность, затем разрывают её на ионы, которые гидратируются и равномерно распределяются в растворе. Например, соляная ксилота диссоциирует на ионы так: HCl = H + + Cl — .
![Диссоциация соляной кислоты]()
При расплавлении, когда происходит нагревание кристалла, ионы начинают совершать интенсивные колебания в узлах кристаллической решётки, в результате чего она разрушается, образуется расплав, который состоит из ионов.
Процесс электролитической диссоциации характеризуется величиной степени диссоциации молекул вещества:
Степень диссоциации — это отношение числа продиссоциировавших (распавшихся) молекул к общему числу молекул электролита. Т.е., какая доля молекул исходного вещества распадается в растворе или расплаве на ионы.
Nпродисс — это число продиссоциировавших молекул,
Nисх — это исходное число молекул.
По степени диссоциации электролиты делят на делят на сильные и слабые.
Сильные электролиты (α≈1):
1. Все растворимые соли (в том числе соли органических кислот — ацетат калия CH3COOK, формиат натрия HCOONa и др.)
2. Сильные кислоты: HCl, HI, HBr, HNO3, H2SO4 (по первой ступени), HClO4 и др.;
3. Щелочи: NaOH, KOH, LiOH, RbOH, CsOH; Ca(OH)2, Sr(OH)2, Ba(OH)2.
Сильные электролиты распадаются на ионы практически полностью в водных растворах, но только в ненасыщенных. В насыщенных растворах даже сильные электролиты могут распадаться только частично. Т.е. степень диссоциации сильных электролитов α приблизительно равна 1 только для ненасыщенных растворов веществ. В насыщенных или концентрированны растворах степень диссоциации сильных электролитов может быть меньше или равна 1: α≤1.
Слабые электролиты (α <1):
1. Слабые кислоты, в т.ч. органические;
2. Нерастворимые основания и гидроксид аммония NH4OH;
3. Нерастворимые и некоторые малорастворимые соли (в зависимости от растворимости).
Неэлектролиты:
1. Оксиды, не взаимодействующие с водой (взаимодействующие с водой оксиды при растворении в воде вступают в химическую реакцию с образованием гидроксидов);
2. Простые вещества;
3. Большинство органических веществ со слабополярными или неполярными связями (альдегиды, кетоны, углеводороды и т.д.).
![Электролиты]()
Как диссоциируют вещества? По степени диссоциации различают сильные и слабые электролиты.
Сильные электролиты диссоциируют полностью (в насыщенных растворах), в одну ступень, все молекулы распадаются на ионы, практически необратимо. Обратите внимание — при диссоциации в растворе образуются только устойчивые ионы. Самые распространенные ионы можно найти в таблице растворимости — это ваша официальная шпаргалка на любом экзамене. Степень диссоциации сильных электролитов примерно равна 1. Например, при диссоциации фосфата натрия образуются ионы Na + и PO4 3– :
Диссоциация слабых электролитов : многоосновных кислот и многокислотных оснований происходит ступенчато и обратимо. Т.е. при диссоциации слабых электролитов распадается на ионы только очень небольшая часть исходных частиц. Например, угольная кислота:
HCO3 – ↔ H + + CO3 2–
Гидроксид магния диссоциирует также в 2 ступени:
Mg(OH)2 ⇄ Mg(OH) + OH –
Mg(OH) + ⇄ Mg 2+ + OH –
Кислые соли диссоциируют также ступенчато, сначала разрываются ионные связи, затем — ковалентные полярные. Например, гидрокабонат калия и гидроксохлорид магния:
KHCO3 ⇄ K + + HCO3 – (α=1)
Mg(OH)Cl ⇄ MgOH + + Cl – (α=1)
MgOH + ⇄ Mg 2+ + OH – (α
Степень диссоциации слабых электролитов намного меньше 1: α
Основные положения теории электролитической диссоциации, таким образом:
1. При растворении в воде электролиты диссоциируют (распадаются) на ионы.
2. Причина диссоциации электролиты в воде – это его гидратация, т.е. взаимодействие с молекулами воды и разрыв химической связи в нем.
3. Под действием внешнего электрического поля положительно заряженные ионы двигаюися к положительно заряженному электроду — катоду, их называют катионами. Отрицательно заряженные электроны двигаются к отрицательному электроду – аноду. Их называют анионами.
4. Электролитическая диссоциация происходит обратимо для слабых электролитов, и практически необратимо для сильных электролитов.
5. Электролиты могут в разной степени диссоциировать на ионы — в зависимости от внешних условий, концентрации и природы электролита.
6. Химические свойства ионов отличаются от свойств простых веществ. Химические свойства растворов электролитов определяются свойствами тех ионов, которые из него образуются при диссоциации.
Примеры .
1. При неполной диссоциации 1 моль соли общее количество положительных и отрицательных ионов в растворе составило 3,4 моль. Формула соли – а) K2S б) Ba(ClO3)2 в) NH4NO3 г) Fe(NO3)3
Решение: для начала определим силу электролитов. Это легко можно сделать по таблице растворимости. Все соли, приведенные в ответах — растворимые, т.е. сильные электролиты. Далее, запишем уравнения электролитической диссоциации и по уравнению определим максимально число ионов в каждом растворе:
а) K2S ⇄ 2K + + S 2– , при полном распаде 1 моль соли образуется 3 моль ионов, больше 3 моль ионов не получится никак;
б) Ba(ClO3)2 ⇄ Ba 2+ + 2ClO3 – , опять при распаде 1 моль соли образуется 3 моль ионов, больше 3 моль ионов не образуется никак;
в) NH4NO3 ⇄ NH4 + + NO3 – , при распаде 1 моль нитрата аммония образуется 2 моль ионов максимально, больше 2 моль ионов не образуется никак;
г) Fe(NO3)3 ⇄ Fe 3+ + 3NO3 – , при полном распаде 1 моль нитрата железа (III) образуется 4 моль ионов. Следовательно, при неполном распаде 1 моль нитрата железа возможно образование меньшего числа ионов (неполный распад возможен в насыщенном растворе соли). Следовательно, вариант 4 нам подходит.
![]()
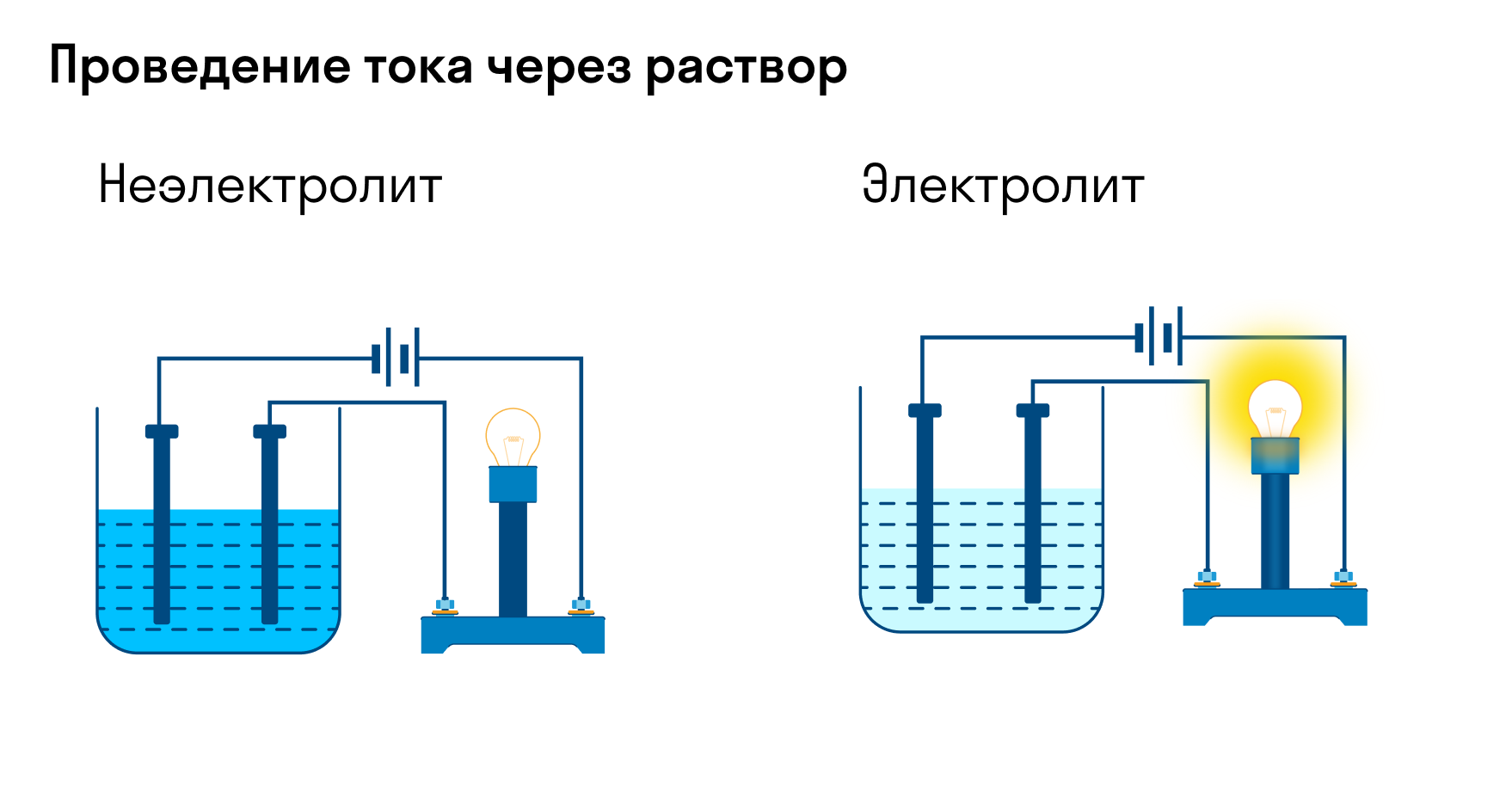
Раствор хлорида натрия хорошо проводит электрический ток, но в сухом виде кристаллики поваренной соли ток не проводят. Почему? На этот вопрос отвечает теория электролитической диссоциации, которую мы сейчас рассмотрим. Впервые ее описал шведский ученый Сванте Аррениус. Электролитическую диссоциацию изучают в рамках курса химии за 9 класс.
О чем эта статья:
Что такое электролитическая диссоциация
Как известно, электрический ток — это направленное движение свободных электронов или ионов, т. е. заряженных частиц. В растворах электролитов, проводящих ток, за это отвечают свободные ионы.
В 1882 году шведский химик С. Аррениус при изучении свойств растворов электролитов обратил внимание, что они содержат больше частиц, чем было в сухом веществе. Например, в растворе хлорида натрия 2 моля частиц, а NaCl в сухом виде содержит лишь 1 моль.
Это позволило ученому сделать вывод, что при растворении таких веществ в воде в них появляются свободные ионы. Так были заложены основы теории электролитической диссоциации (ТЭД) — в химии она стала одним из важнейших открытий.
Электролитическая диссоциация — это процесс, в ходе которого молекулы электролитов взаимодействуют с водой или другим растворителем и распадаются на ионы. Она может иметь обратимый или необратимый характер. Обратный процесс называется моляризацией.
Благодаря диссоциации растворы электролитов обретают способность проводить ток. Сванте Аррениус не смог объяснить, почему разные вещества сильно отличаются по электропроводности, но это сделал Д. И. Менделеев. Он подробно описал процесс распада электролита на ионы, который объясняется его взаимодействием с молекулами воды (или другого растворителя).
Схема электролитической диссоциации: KA ⇄ K + (катион) + A - (анион).
Уравнение диссоциации на примере хлорида натрия: NaCl ⇄ Na + + Cl - .
Иногда можно встретить выражение «теория электрической диссоциации», но так говорить не стоит. В этом случае можно подумать, что распад молекул на ионы обусловлен действием электротока. На самом деле процесс диссоциации не зависит от того, проходит ток в данный момент через раствор или нет. Все, что нужно — это контакт электролита с водой (растворителем).
Механизм электролитической диссоциации
При контакте с водой или другими растворителями диссоциации подвержены все вещества с ионной связью. Также распадаться на ионы могут вещества с ковалентной полярной связью, которая под действием воды переходит в ионную, а после разрушается.
Механизм диссоциации электролитов удобно рассматривать на примере хлорида натрия NaCl. Его кристаллическая решетка образована катионами натрия Na + и анионами хлора Cl - , которые удерживаются вместе благодаря ионной связи. При растворении в воде каждый кристалл хлорида натрия окружают ее молекулы.
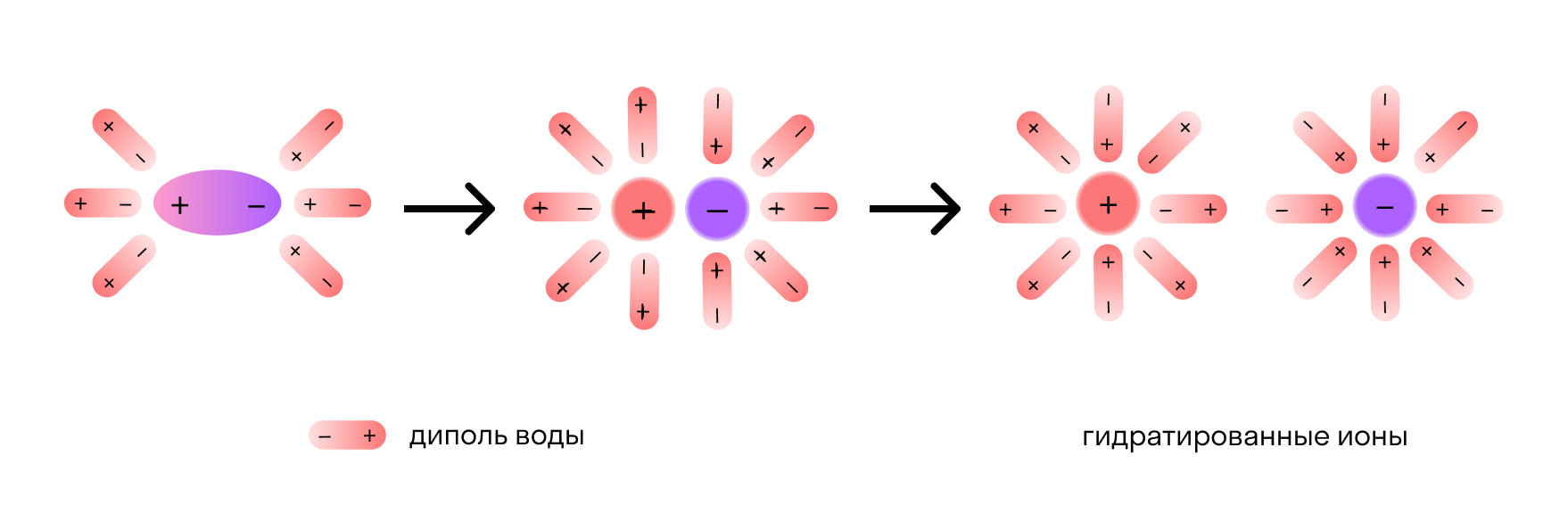
Отметим, что молекулы воды — это диполи. На одном конце они несут атомы водорода с частичным положительным зарядом, а на другом — атомы кислорода с частичным отрицательным. Соответственно, атомы кислорода притягиваются к катионам натрия, а атомы водорода — к анионам хлора. Эта сила электростатического притяжения ослабляет и в итоге разрывает ионную связь между натрием и хлором. Вещество диссоциирует на ионы.
![Диссоциация хлорида натрия]()
После распада хлорида натрия образовавшиеся ионы Na + и Cl - окружают молекулы воды, создавая гидратную оболочку. Ионы с такой оболочкой называют гидратированными.
Если вместо воды был использован другой растворитель — например, этанол, его молекулы создают сольватную оболочку. В этом случае ионы называются сольватированными.
Сущность процесса электролитической диссоциации передает схема:
![Сущность процесса электролитической диссоциации]()
Электролиты и неэлектролиты
Хотя электролитическая диссоциация происходит независимо от действия электротока, между этими явлениями есть связь. Чем выше способность вещества распадаться на ионы при взаимодействии с растворителем, тем лучше оно проводит электроток. По такому критерию известный физико-химик М. Фарадей выделил электролиты и неэлектролиты.
Электролиты — это вещества, которые после диссоциации на ионы в растворах и расплавах проводят электроток. Обычно в их молекулах ионные или полярные ковалентные связи.
Неэлектролиты — это вещества, которые не распадаются на ионы в растворах и расплавах, а значит, не обладают проводимостью в растворенном виде. Для них характерны ковалентные неполярные или слабополярные связи.
![Различие между электролитами и неэлектролитами]()
Степень диссоциации
В зависимости от того, сколько молекул диссоциировало на ионы, вещество может быть сильным или слабым электролитом. Этот показатель называется степенью диссоциации, его измеряют от 0 до 1 либо в процентах.
Степень диссоциации — это отношение количества распавшихся на ионы молей вещества к исходному количеству молей.
Если в растворе на ионы распадаются все 100% электролита, .
По силе электролиты делятся на следующие группы:
![Таблица степеней диссоциации]()
Молекулы сильных электролитов необратимо распадаются на ионы, поэтому в уравнениях нужно ставить знак =. Реакции со слабыми электролитами обратимы, поэтому ставится знак ⇄.
Ступенчатая диссоциация
В отдельных случаях вещества расщепляются на ионы в несколько этапов или ступеней. Например, такая реакция характерна для основных и кислых солей, многоосновных кислот. Ступенчатая диссоциация может включать два этапа и более, при этом на первой ступени концентрация ионов всегда больше, чем на последующих.
Пример 1
Ортофосфорная кислота диссоциирует в 3 ступени. На первой из них наблюдается максимальная концентрация дигидрофосфат-ионов, а на последней остается минимальное количество фосфат-ионов (диссоциация почти не идет). Данная кислота не относится к сильным электролитам, поэтому реакция обратима.
Пример 2
Кислая соль Ca(HCO3)2 диссоциирует в 3 ступени. Поскольку это сильный электролит, на первом этапе реакция необратима. На втором этапе распадается на ионы слабый кислотный остаток HCO3 - и слабый электролит, поэтому реакция обратима.
Как диссоциируют разные группы веществ
Диссоциация кислот
Приводит к образованию катионов водорода H + и отрицательно заряженных кислотных остатков:
Многоосновные кислоты диссоциируют ступенчато:
AlOHCl2 = AlOH 2+ + 2Cl -
AlOH 2+ ⇄ Al 3+ + OH -
Диссоциация оснований
Происходит с образованием гидроксильных групп OH - и положительно заряженных ионов металла. Сильные электролиты в растворах диссоциируют полностью, а слабые — ступенчато и обратимо.
Сильные основания:
Слабые основания:
CuOH + ⇄ Cu 2+ + OH -
Диссоциация солей
Ведет к образованию катионов металлов (или катиона аммония) и отрицательно заряженных кислотных остатков.
Средние соли в растворах полностью распадаются в одну ступень.
Кислые соли распадаются ступенчато. На первом этапе отделяются катионы металла, а на втором — катионы водорода.
Основные соли также диссоциируют в две ступени. На первой отделяются кислотные остатки, а за ними — гидроксильные группы OH - .
MgOHBr = MgOH + + Br -
MgOH + ⇄ Mg 2+ + OH -
Молекулярное, полное и сокращенное ионные уравнения
С помощью молекулярных уравнений можно показать состав вещества с разложением его на молекулы. Полные ионные уравнения отражают реакцию диссоциации, т. е. расщепление молекул на ионы. Но в таком виде расписывают только сильные электролиты.
Не раскладывают на ионы:
Рассмотрим это на примере взаимодействия между нитратом свинца и серной кислотой.
Сульфат свинца PbSO4 мы не будем раскладывать на ионы, поскольку это слабый электролит.
Полное ионное уравнение: Pb 2+ + 2NO3 - + 2H + + SO4 2- → 2H + + 2NO3 - + PbSO4↓
Сократить это выражение очень просто — нужно убрать из обеих частей одинаковые ионы, которые не изменились в ходе реакции.
Сокращенное ионное уравнение: Pb 2+ + SO4 2- → PbSO4↓
Как составить уравнение диссоциации
В левой части пишем молекулярную формулу вещества, а в правой — формулы образовавшихся катионов и анионов. Между ними ставим знак =, если это сильный электролит, или знак ⇄ — если средний или слабый. После этого нужно проставить коэффициенты перед ионами и проверить сумму катионов и анионов (она всегда равна 0).
![Алгоритм составления уравнения диссоциации]()
Основные положения теории электролитической диссоциации
Итак, мы разобрались, что такое диссоциация в химии, а сейчас повторим ключевые моменты:
При взаимодействии с водой или другими растворителями в электролитах разрывается химическая связь между частицами и они распадаются на ионы — происходит электролитическая диссоциация.
Под действием электротока катионы перемещаются к положительно заряженному электроду, анионы — к отрицательно заряженному. Раствор электролита обладает проводимостью.
Степень диссоциации зависит от типа электролита и от внешних условий. Для сильных электролитов она необратима, для слабых — это обратимая реакция.
Химические свойства электролитов соответствуют свойствам ионов, которые образовались при диссоциации.
Вопросы для самопроверки
Чем электролиты отличаются от неэлектролитов? Приведите примеры тех и других веществ.
Согласно теории диссоциации что является причиной распада электролитов на ионы?
Что такое степень диссоциации и как она измеряется?
В каких случаях электролитическая диссоциация кислот бывает ступенчатой?
При каких условиях в уравнении диссоциации ставится знак =, а при каких — знак ⇄?
Читайте также: