Цвет пламени щелочноземельных металлов
С детства мы знаем, что существуют металлы и неметаллы. Металлы – это твердые вещества, обладающие металлическим блеском, проводящие электрический ток и тепло. Они ковкие, благодаря чему металлические изделия можно использовать во вторичном производстве. Но, оказывается, как химические элементы, металлы сильно отличаются друг от друга. Существуют такие металлы, которые нельзя брать в руки и мочить, потому что это может привести к травмам и серьезным ожогам. О таких металлах поговорим в этой статье.
План урока:
Представители щелочных металлов
Щелочные металлы – это группа высокоактивных металлов. Название происходит от продукта взаимодействия этих веществ с водой, в результате которой образуется щелочь (сложное химическое соединение). Найти в природе такие металлы, сделать из них изделие или просто хранить в виде слитка невозможно. Эти металлы сразу окисляются кислородом воздуха.
К щелочным металлам относятся: литий, натрий, калий, рубидий, цезий, франций.
Строение атомов щелочных металлов
В таблице Менделеева щелочные металлы расположены в первой группе. Такое положение не случайно, а отражает строение атома и химические свойства.
Химические свойства элементов напрямую зависят от строения атома. Атом любого элемента состоят из ядра, имеющего положительный заряд и электронов, образующих энергетически облака вокруг ядра.
Ядро и электроны притягиваются за счет электростатического напряжения. Соответственно, чем меньше у электрона силы сопротивления, тем ближе он будет к ядру. Электроны с большей энергией способны отдаляться на периферию атома.
По мере смены периодом, количество электронов и энергетических уровней будет увеличиваться. Общий параметр атомов всех щелочных металлов является 1 электрон на внешнем энергетическом уровне.
Изменение химических свойств щелочных металлов
По мере продвижения от первого до последнего периода, в атомах щелочных металлов происходит увеличение количества атомов и электронных облаков. Чем дальше атом оказался от ядра, тем меньше притяжение между ними. За счет этого, отдаленный (последний) электрон проще отсоединить от атома. Легкость отщепления электронов определяет реакционную способность. Отщепление электрона приводит к окислению собственного атома и восстановлению окислителя.
Таким образом, восстановительные свойства щелочных металлов увеличиваются сверху вниз в группе. Самый активный металл – цезий.
Внешний вид и физические свойства щелочных металлов
Щелочные металлы обладают всеми характерными свойствами: серебристый цвет (исключение: цезий – золотистого цвета) металлический блеск, электро- и теплопроводность, ковкость, пластичность.
Особенным качеством является мягкость и легкость за счет низкой плотности вещества. Эти металлы можно резать ножом, разминать руками (в перчатках) и ломать.
Нахождение в природе щелочных металлов
Из-за высокой реакционной активности, щелочные металлы не встречаются в природе в виде самородков или чистых залежей. Обнаружить их можно в составе солей. Многие природные минералы содержат ион щелочного металла в своей структуре.
Таблица. Минералы, в состав которых входят ионы щелочных металлов
Как видно из таблицы, чем выше активность элемента, тем ниже его встречаемость в природе. Элемент последнего периода первой группы – франций – вообще не встречается в природе даже в составе минералов. Этот элемент является радиоактивным и является промежуточным продуктом распада Урана-235. Его общее содержание в земной коре оценивается в 380 граммов.
Обнаружение ионов металлов в соединениях
Самый простой способ определения иона металла – окраска пламени. Для соли каждого металла характерен свой цвет:
- Литий – красный,
- Калий – фиолетовый,
- Натрий – желтый,
- Рубидий – розовый,
- Цезий – синий.
Соли франция такой проверке не подвергаются.
Для такой проверки важно, чтобы в пламени не было других примесей, меняющий цвет, иначе проверка будет недостоверна.
Качественные реакции
Обнаружение катионов лития
Обнаружить ионы металлов в соли можно с помощью качественной реакции.
Для обнаружения катионов лития используют фосфорную кислоту. Получившийся белый фосфат лития растворим только в концентрированной азотной кислоте и солях аммония:
В растворимых солях литий можно обнаружить с помощью фторида аммония. При реакции образуется белый нерастворимый осадок фторида лития:
Обнаружение катиона натрия
Ионы натрия можно обнаружить реакцией с комплексной солью гексагидроксостибатом (V). При низких температурах и в нейтральной среде образуется мелкокристаллическая белая соль натрия:
Эту реакцию проводят на предметном стекле. За образованием и формой кристаллов наблюдают под микроскопом или бинокуляром.
Обнаружение катиона калия
В кислой и нейтральной среде ионы калия образуют двойную комплексную соль с гексанитрокабальтатом натрия (III). Эта соль нерастворима в воде и имеет желтый цвет:
Особенность реакции в ее медленном течении. Реакционную смесь оставляют на несколько часов. Для ускорения реакции можно тереть стеклянной палочкой по стенке пробирки. Это приводит к формированию статического электричества, что усиливает притяжение ионов друг к другу.
Еще одним способом обнаружения катионов калия служит реакция с гидротартратом натрия NaHC4H4O6. В этом случае образуется соль белого цвета. Реакцию можно ускорить потиранием стеклянной палочной о поверхность пробирки:
Обнаружение катионов рубидия, цезия
Катионы рубидия и цезия – высокоактивные ионы, поэтому не обнаруживаются качественными реакциями. Все соединения прозрачные и хорошо растворимы в воде. Основными способами их обнаружения в составе соли служит осаждение органическими ароматическими растворами. Способа разделения цезия и рубидия из смеси в настоящее время нет.
Обнаружение ионов франция
Как радиоактивный металл, франций не входит в состав обычных солей. Его обнаружение проводится методом спектрометрии и радиационных приборов.
Химические свойства щелочных металлов
Все металлы являются восстановителями, поэтому они вступают в реакцию с различными окислителями. К таким относятся простые неметаллы и сложные соединения, обладающие окислительными свойствами.
Реакция с простыми неметаллами
Щелочные металлы активно вступают в реакции с галогенами. При этом образуется соответствующий галогенид. С серой, фосфором и водородом с образованием сульфидов, гидридов, фосфидов реагируют только при нагревании:
В реакции с кислородом щелочные металлы образуют пероксиды (кроме лития), повторное окисление которых приводит к образованию оксидов:
Специальных условий для окисления металлов кислородом не требуется, поэтому щелочные металлы хранят под слоем парафина, вазелина или масла без доступа кислорода.
Взаимодействие с водой
Реакция щелочных металлов с водой происходит с выделением большого количества тепла. Выделяющийся в ходе реакции водород может воспламеняться, что в некоторых случаях приводит к взрыву.
Взаимодействие с сильными кислотами
В реакциях щелочных металлов с кислотами образуются соответствующие соли. Особенных проявлений свойств щелочных металлов здесь нет:
Специфические химические свойства лития
В некоторых реакциях литий проявляет отличные от остальных щелочных металлов свойства. Например, это единственный металл, реагирующий с азотом без нагревания:
Нитрид лития подвергается необратимому гидролизу.
В реакции с лития с кислородом образуется оксид лития:
Получение щелочных металлов
Получить щелочные металлы в чистом виде можно только электролизом расплавов их солей:
катод (–) (Na + ): Na + + е = Na 0 ,
анод (–) (Cl – ): Cl – – е = Cl 0 , 2Cl 0 = Cl2;
Если использовать раствор соли, катионы металла будут сразу вступать в реакцию с образованием щелочей:
катод (–) (Na + ; Н + ): H + + е = H 0 , 2H 0 = H2
анод (+) (Cl – ; OН – ): Cl – – е = Cl 0 , 2Cl 0 = Cl2;
Применение соединений щелочных металлов
Основные области применения данных солей – медицина, кулинария, строительство, химическая промышленность.
Наиболее используемый щелочной металл – натрий. Он служит катализатором синтеза металлов, служит теплоносителем в атомных реакторах.
Хлорид натрия – соединение, используемое в каждом доме. Это безопасная соль, используемая в кулинарии. Так же, хлорид натрия применяется в медицине для приготовления физиологических растворов.
Литий и его щелочи служат основой изготовления щелочных батареек. Длительное время это был единственный способ создания портативных энергоносителей.
Калий и натрий используются для изготовления мыла в качестве омыляющего компонента.
Соли калия используются в сельском хозяйстве в качестве удобрения.
Калий, рубидий и натрий используются в атомной промышленности и атомной энергетике. Эти металлы служат катализаторами многих реакций.
Литий добавляется во многие сплавы для улучшения металлических свойств.
Соединения лития, рубидия и цезия используют при изготовлении цветных стекол.
Франций пока не имеет практического применения в связи с высокой радиоактивностью.
Щелочные металлы. Химия щелочных металлов и их соединений

Щелочные металлы расположены в главной подгруппе первой группы периодической системы химических элементов Д.И. Менделеева (или просто в 1 группе в длиннопериодной форме ПСХЭ). Это литий Li, натрий Na, калий K, цезий Cs, рубидий Rb и франций Fr.
Электронное строение щелочных металлов и основные свойства
Электронная конфигурация внешнего энергетического уровня щелочных металлов: ns 1 , на внешнем энергетическом уровне находится 1 s-электрон. Следовательно, типичная степень окисления щелочных металлов в соединениях +1.
Рассмотрим некоторые закономерности изменения свойств щелочных металлов.
В ряду Li-Na-K-Rb-Cs-Fr, в соответствии с Периодическим законом, увеличивается атомный радиус , усиливаются металлические свойства , ослабевают неметаллические свойства , уменьшается электроотрица-тельность .

Физические свойства
Все щелочные металлы — вещества мягкие, серебристого цвета. Свежесрезанная поверхность их обладает характерным блеском.

Кристаллическая решетка щелочных металлов в твёрдом состоянии — металлическая. Следовательно, щелочные металлы обладают высокой тепло- и электропроводимостью. Кипят и плавятся при низких температурах. Они имеют также небольшую плотность.

Нахождение в природе
Как правило, щелочные металлы в природе присутствуют в виде минеральных солей: хлоридов, бромидов, йодидов, карбонатов, нитратов и др. Основные минералы , в которых присутствуют щелочные металлы:
Поваренная соль, каменная соль, галит — NaCl — хлорид натрия

Сильвин KCl — хлорид калия

Сильвинит NaCl · KCl

Глауберова соль Na2SO4⋅10Н2О – декагидрат сульфата натрия

Едкое кали KOH — гидроксид калия
Поташ K2CO3 – карбонат калия
Поллуцит — алюмосиликат сложного состава с высоким содержанием цезия:

Способы получения
Литий получают в промышленности электролизом расплава хлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси):
2LiCl = 2Li + Cl2
Натрий получают электролизом расплава хлорида натрия с добавками хлорида кальция:
2NaCl (расплав) → 2Na + Cl2
Электролитом обычно служит смесь NaCl с NaF и КСl (что позволяет проводить процесс при 610–650°С).
Калий получают также электролизом расплавов солей или расплава гидроксида калия. Также распространены методы термохимического восстановления: восстановление калия из расплавов хлоридов или гидроксидов. В качестве восстановителей используют пары натрия, карбид кальция, алюминий, кремний:
KCl + Na = K↑ + NaCl
KOH + Na = K↑ + NaOH
Цезий можно получить нагреванием смеси хлорида цезия и специально подготовленного кальция:
Са + 2CsCl → 2Cs + CaCl2
В промышленности используют преимущественно физико-химические методы выделения чистого цезия: многократную ректификацию в вакууме.
Качественные реакции
Качественная реакция на щелочные металлы — окрашивание пламени солями щелочных металлов .

Цвет пламени:
Li — карминно-красный
Na — жѐлтый
K — фиолетовый
Rb — буро-красный
Cs — фиолетово-красный
Химические свойства
1. Щелочные металлы — сильные восстановители . Поэтому они реагируют почти со всеми неметаллами .
1.1. Щелочные металлы легко реагируют с галогенами с образованием галогенидов:
2K + I2 = 2KI
1.2. Щелочные металлы реагируют с серой с образованием сульфидов:
2Na + S = Na2S
1.3. Щелочные металлы активно реагируют с фосфором и водородом (очень активно). При этом образуются бинарные соединения — фосфиды и гидриды:
3K + P = K3P
2Na + H2 = 2NaH
1.4. С азотом литий реагирует при комнатной температуре с образованием нитрида:
Остальные щелочные металлы реагируют с азотом при нагревании.
1.5. Щелочные металлы реагируют с углеродом с образованием карбидов, преимущественно ацетиленидов:
1.6. При взаимодействии с кислородом каждый щелочной металл проявляет свою индивидуальность: при горении на воздухе литий образует оксид, натрий – преимущественно пероксид, калий и остальные металлы – надпероксид.
Цезий самовозгорается на воздухе, поэтому его хранят в запаянных ампулах. Видеоопыт самовозгорания цезия на воздухе можно посмотреть здесь.
2. Щелочные металлы активно взаимодействуют со сложными веществами:
2.1. Щелочные металлы бурно (со взрывом) реагируют с водой . Взаимодействие щелочных металлов с водой приводит к образованию щелочи и водорода. Литий реагирует бурно, но без взрыва.
Например , калий реагирует с водой очень бурно:
2K 0 + H2 + O = 2 K + OH + H2 0

Видеоопыт: взаимодействие щелочных металлов с водой можно посмотреть здесь.
2.2. Щелочные металлы взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой) со взрывом. При этом образуются соль и водород.
Например , натрий бурно реагирует с соляной кислотой :
2Na + 2HCl = 2NaCl + H2↑
2.3. При взаимодействии щелочных металлов с концентрированной серной кислотой выделяется сероводород.
Например , при взаимодействии натрия с концентрированной серной кислотой образуется сульфат натрия, сероводород и вода:
2.4. Щелочные металлы реагируют с азотной кислотой. При взаимодействии с концентрированной азотной кислотой образуется оксид азота (I):
С разбавленной азотной кислотой образуется молекулярный азот:
При взаимодействии щелочных металлов с очень разбавленной азотной кислотой образуется нитрат аммония:
2.5. Щелочные металлы могут реагировать даже с веществами, которые проявляют очень слабые кислотные свойства . Например, с аммиаком, ацетиленом (и прочими терминальными алкинами), спиртами , фенолом и органическими кислотами .
Например , при взаимодействии лития с аммиаком образуются амиды и водород:
Ацетилен с натрием образует ацетиленид натрия и также водород:
Н ─ C ≡ С ─ Н + 2Na → Na ─ C≡C ─ Na + H2
Фенол с натрием реагирует с образованием фенолята натрия и водорода:
Метанол с натрием образуют метилат натрия и водород:
Уксусная кислота с литием образует ацетат лития и водород:
2СH3COOH + 2Li → 2CH3COOLi + H2↑
Щелочные металлы реагируют с галогеналканами (реакция Вюрца).
Например , хлорметан с натрием образует этан и хлорид натрия:
2.6. В расплаве щелочные металлы могут взаимодействовать с некоторыми солями . Обратите внимание! В растворе щелочные металлы будут взаимодействовать с водой, а не с солями других металлов.
Например , натрий взаимодействует в расплаве с хлоридом алюминия :
3Na + AlCl3 → 3NaCl + Al
Оксиды щелочных металлов
Оксиды щелочных металлов (кроме лития) можно получить только к освенными методами : взаимодействием натрия с окислителями в расплаве:
1. О ксид натрия можно получить взаимодействием натрия с нитратом натрия в расплаве:
2. Взаимодействием натрия с пероксидом натрия :
3. Взаимодействием натрия с расплавом щелочи :
2Na + 2NaOН → 2Na2O + Н2↑
4. Оксид лития можно получить разложением гидроксида лития :
2LiOН → Li2O + Н2O
Химические свойства
Оксиды щелочных металлов — типичные основные оксиды . Вступают в реакции с кислотными и амфотерными оксидами, кислотами, водой.
1. Оксиды щелочных металлов взаимодействуют с кислотными и амфотерными оксидами :
Например , оксид натрия взаимодействует с оксидом фосфора (V):
Оксид натрия взаимодействует с амфотерным оксидом алюминия:
2. Оксиды щелочных металлов взаимодействуют с кислотами с образованием средних и кислых солей (с многоосновными кислотами).
Например , оксид калия взаимодействует с соляной кислотой с образованием хлорида калия и воды:
K2O + 2HCl → 2KCl + H2O
3. Оксиды щелочных металлов активно взаимодействуют с водой с образованием щелочей.
Например , оксид лития взаимодействует с водой с образованием гидроксида лития:
Li2O + H2O → 2LiOH
4. Оксиды щелочных металлов окисляются кислородом (кроме оксида лития): оксид натрия — до пероксида, оксиды калия, рубидия и цезия – до надпероксида.
Пероксиды щелочных металлов
Свойства пероксидов очень похожи на свойства оксидов. Однако пероксиды щелочных металлов, в отличие от оксидов, содержат атомы кислорода со степенью окисления -1. Поэтому они могут могут проявлять как окислительные , так и восстановительные свойства.
1. Пероксиды щелочных металлов взаимодействуют с водой . При этом на холоде протекает обменная реакция, образуются щелочь и пероксид водорода:
При нагревании пероксиды диспропорционируют в воде, образуются щелочь и кислород:
2. Пероксиды диспропорционируют при взаимодействии с кислотными оксидами .
Например , пероксид натрия реагирует с углекислым газом с образованием карбоната натрия и кислорода:
3. При взаимодействии с минеральными кислотами на холоде пероксиды вступают в обменную реакцию. При этом образуются соль и перекись водорода:
При нагревании пероксиды, опять-таки, диспропорционируют:
4. Пероксиды щелочных металлов разлагаются при нагревании, с образованием оксида и кислорода:
5. При взаимодействии с восстановителями пероксиды проявляют окислительные свойства.
Например , пероксид натрия с угарным газом реагирует с образованием карбоната натрия:
Пероксид натрия с сернистым газом также вступает в ОВР с образованием сульфата натрия:
6. При взаимодействии с сильными окислителями пероксиды проявляют свойства восстановителей и окисляются, как правило, до молекулярного кислорода.
Например , при взаимодействии с подкисленным раствором перманганата калия пероксид натрия образует соль и молекулярный кислород:
Гидроксиды щелочных металлов (щелочи)
1. Щелочи получают электролизом растворов хлоридов щелочных метал-лов:
2NaCl + 2H2O → 2NaOH + H2 + Cl2
2. При взаимодействии щелочных металлов, их оксидов, пероксидов, гидридов и некоторых других бинарных соединений с водой также образуются щелочи.
Например , натрий, оксид натрия, гидрид натрия и пероксид натрия при растворении в воде образуют щелочи:
2Na + 2H2O → 2NaOH + H2
Na2O + H2O → 2NaOH
2NaH + 2H2O → 2NaOH + H2
3. Некоторые соли щелочных металлов (карбонаты, сульфаты и др.) при взаимодействии с гидроксидами кальция и бария также образуют щелочи.
Например , карбонат калия с гидроксидом кальция образует карбонат кальция и гидроксид калия:
1. Гидроксиды щелочных металлов реагируют со всеми кислотами (и сильными, и слабыми, и растворимыми, и нерастворимыми). При этом образуются средние или кислые соли, в зависимости от соотношения реагентов.
Например , гидроксид калия с фосфорной кислотой реагирует с образованием фосфатов, гидрофосфатов или дигидрофосфатов:
2. Гидроксиды щелочных металлов реагируют с кислотными оксидами . При этом образуются средние или кислые соли, в зависимости от соотношения реагентов.
Например , гидроксид натрия с углекислым газом реагирует с образованием карбонатов или гидрокарбонатов:
Необычно ведет себя оксид азота (IV) при взаимодействии с щелочами. Дело в том, что этому оксиду соответствуют две кислоты — азотная (HNO3) и азотистая (HNO2). «Своей» одной кислоты у него нет. Поэтому при взаимодействии оксида азота (IV) с щелочами образуются две соли- нитрит и нитрат:
А вот в присутствии окислителя, например, молекулярного кислорода, образуется только одна соль — нитрат, т.к. азот +4 только повышает степень окисления:
3. Гидроксиды щелочных металлов реагируют с амфотерными оксидами и гидроксидами . При этом в расплаве образуются средние соли, а в растворе комплексные соли.
Например , гидроксид натрия с оксидом алюминия реагирует в расплаве с образованием алюминатов:
в растворе образуется комплексная соль — тетрагидроксоалюминат:
Еще пример : гидроксид натрия с гидроксидом алюминия в расплаве образут также комплексную соль:
4. Щелочи также взаимодействуют с кислыми солями. При этом образуются средние соли, или менее кислые соли.
Например : гидроксид калия реагирует с гидрокарбонатом калия с образованием карбоната калия:
5. Щелочи взаимодействуют с простыми веществами-неметаллами (кроме инертных газов, азота, кислорода, водорода и углерода).
При этом кремний окисляется щелочами до силиката и водорода:
Фтор окисляет щелочи. При этом выделяется молекулярный кислород:
Другие галогены, сера и фосфор — диспропорционируют в щелочах:
Сера взаимодействует с щелочами только при нагревании:
6. Щелочи взаимодействуют с амфотерными металлами , кроме железа и хрома . При этом в расплаве образуются соль и водород:
В растворе образуются комплексная соль и водород:
2NaOH + 2Al + 6Н2О = 2Na[Al(OH)4] + 3Н2
7. Гидроксиды щелочных металлов вступают в обменные реакции с растворимыми солями .
С щелочами взаимодействуют соли тяжелых металлов.
Например , хлорид меди (II) реагирует с гидроксидом натрия с образованием хлорида натрия и осадка гидроксида меди (II):
2NaOH + CuCl2 = Cu(OH)2↓+ 2NaCl
Также с щелочами взаимодействуют соли аммония.
Например , при взаимодействии хлорида аммония и гидроксида натрия образуются хлорид натрия, аммиак и вода:
NH4Cl + NaOH = NH3 + H2O + NaCl
8. Гидроксиды всех щелочных металлов плавятся без разложения , гидроксид лития разлагается при нагревании до температуры 600°С:
2LiOH → Li2O + H2O
9. Все гидроксиды щелочных металлов проявляют свойства сильных оснований . В воде практически нацело диссоциируют , образуя щелочную среду и меняя окраску индикаторов.
NaOH ↔ Na + + OH —
10. Гидроксиды щелочных металлов в расплаве подвергаются электролизу . При этом на катоде восстанавливаются сами металлы, а на аноде выделяется молекулярный кислород:
4NaOH → 4Na + O2 + 2H2O
Соли щелочных металлов
Нитраты и нитриты щелочных металлов
Нитраты щелочных металлов при нагревании разлагаются на нитриты и кислород. Исключение — нитрат лития. Он разлагается на оксид лития, оксид азота (IV) и кислород.
Например , нитрат натрия разлагается при нагревании на нитрит натрия и молекулярный кислород:
Нитраты щелочных металлов в реакциях могут выступать в качестве окислителей.
Нитриты щелочных металлов могут быть окислителями или восстановителями.
В щелочной среде нитраты и нитриты — очень мощные окислители.
Например , нитрат натрия с цинком в щелочной среде восстанавливается до аммиака:
Сильные окислители окисляют нитриты до нитратов.
Например , перманганат калия в кислой среде окисляет нитрит натрия до нитрата натрия:
§ 3. Щелочноземельные металлы
Элементы подгруппы кальция носят название щелочноземельных металлов. Происхождение этого названия связано с тем, что их окислы («земли» алхимиков) сообщают воде щелочную реакцию.
На долю кальция приходится 1,5% от общего числа атомов земной коры, тогда как содержание в ней радия очень мало (8·10 –12 %). Промежуточные элементы – стронций (0,008%) и барий (0,005%) стоят ближе к кальцию.
Помимо различных силикатных пород, Са, Sr и Ва встречаются главным образом в виде своих труднорастворимых углекислых и сернокислых солей, каковы минералы:
BaSO4 – тяжелый шппат
Углекислый кальций в виде известняка и мела иногда разует целые горные хребты. Значительно реже встречается кристаллизованная форма СаСО3 – мрамор. Для сернокислого кальция наиболее типично нахождение в виде гипса (CaSO4 ·2H2 O), месторождения которого нередко обладают громадной мощностью. Кроме перечисленных выше, важным минералом кальция является флюорит (СаF2 ).
Для стронция и бария сернокислые минералы более распространены, чем углекислые. Радий в природе связан с урановыми рудами (причем на 1000 кг урана руда содержит лишь 0,3 г радия).
Промышленное применение находят почти исключительно соединения рассматриваемых элементов, характерные свойства которых и определяют области их использования. Химия радия и его соединений изучена еще очень неполно. В общем, по химическим свойствам он похож на барий.
В свободном состоянии элементы подгруппы кальция могут быть получены электролизом их расплавленных солей. Они представляют собой серебристо–белые металлы. Кальций довольно тверд, стронций и особенно барий значительно мягче. Некоторые константы щелочноземельных металлов сопоставлены в приводимой таблице.
Летучие соединения щелочноземельных металлов окрашивают пламя в характерные цвета: Са – в оранжево–красный, Sr (и Ra)–в карминово–красный, Ва – в желтовато–зеленый. Этим пользуются при химических анализах для открытия рассматриваемых элементов.
На воздухе кальций и его аналоги тотчас покрываются желтоватой пленкой, в которой наряду с нормальными окислами (ЭО) частично содержатся также перекиси (ЭО2 ) и нитриды (Э3 N2 ). В ряду напряжений щелочноземельные металлы располагаются левее магния и поэтому легко вытесняют водород не только из разбавленных кислот, но и из воды. При переходе от Са к Ra энергичность взаимодействия усиливается. Во всех своих устойчивых соединениях рассматриваемые элементы двухвалентны.
С металлоидами щелочноземельные металлы соединяются весьма энергично и с значительным выделением тепла, как это видно из рис. 178. Особенно интересны гидриды ЭН2 , образующиеся при нагревании кальция и его аналогов з токе сухого водорода.
Соединения эти имеют типичный ионный характер, причем анионом является отрицательно заряженный водород (Н – ). Водой они энергично разлагаются по схеме:
С таким химически инертным в свободном состоянии элементом, как азот, щелочноземельные металлы соединяются уже при сравнительно слабом нагревании. При накаливании они соединяются также с углеродом, образуя карбиды типа ЭС2 .
Окиси кальция и его аналогов (ЭО) представляют собой белые тугоплавкие вещества, энергично присоединяющие воду с образованием белых гидроокисей [Э(ОН)2 ]. Последние являются сильными основаниями, довольно хорошо растворимыми в воде. По ряду Са—Sr—Ва основной характер гидроокисей усиливается.
Параллельно с этим и весьма быстро растет их растворимость.
1) Свойства окисей и их гидратов изменяются довольно закономерно не только для самих щелочноземельных металлов, но и по всему ряду Be–Ва. Обусловлено это последовательным увеличением радиусов ионов Э 2+ при сохранении ими однотипной электронной структуры (инертного газа).
Для вторых констант диссоциации Mg(OH)2 , Ca(OH)2 и Ва(ОН)2 были получены значения, равные соответственно 0,003, 0,03 и 0,23.
Окись кальция (негашеная известь, или «кипелка») и продукт ее взаимодействия с водой –Са(ОН)2 (гашеная известь, или «пушонка») находят широкое применение в строительном деле. С химической стороны «гашение» извести заключается в протекающем выделением тепла присоединении к СаО воды по схеме:
Гидроокись кальция является наиболее дешевым и поэтому чаще всего используемым в технике сильным основанием. Раствор Ва(ОН)2 («баритовая вода») применяется для открытия СО2 .
Наряду с нормальными окислами для элементов подгруппы Са известны белые перекиси типа ЭО2 . Практическое значение из них имеет только перекись б а р и я. (ВаО2 ), применяемая, в частности, как исходный продукт для получения перекиси водорода. Последнее основано на обратимости реакции:
Так как сама Н2 О2 является кислотой очень слабой, равновесие этой реакции практически полностью смещается влево под действием даже таких кислот, как угольная [вследствие нейтрализации Ва(ОН)2 ].
Технически ВаО2 получают нагреванием ВаО в токе воздуха до 600 °С При этом происходит присоединение кислорода по реакции:
Дальнейшее нагревание выше 800°С ведет, наоборот, к распаду ВаО2 на окись бария и кислород. Поэтому сжигание металлического бария сопровождается образованием только его окиси.
При взаимодействии с кислотами окислы и гидроокиси щелочноземельных металлов легко образуют соответствующие соли. Последние, как правило, бесцветны. Из производных обычных минеральных кислот соли с анионами Cl – , Br – , J – и NO3 – хорошо растворимы; напротив, с анионами F – , SO4 2– , CO3 2– и PO4 3– малорастворимы в воде. В противоположность ионам Са 2+ и Sr 2+ ион Ba 2+ сильно ядовит. Многие соли рассматриваемых элементов находят разнообразное практическое использование.
2) Растворимость важнейших солей (а также гидроокисей) Са, Sr и Ва при обычных условиях сопоставлена на рис. 179, из которого видно, что для отдельных анионов по ряду Са–Sr–Ва она изменяется различно.Это обстоятельство важно для аналитической химии. В частности, резкое различие растворимости хромовокислых солей дает возможность отделять Ва от Sr и Са. Крайне малой растворимостью щавелевокислого кальция пользуются для открытия следов этого элемента (например, в обычной питьевой воде).
Галогениды щелочноземельных металлов по своим свойствам делятся на две довольно резко обособленные группы. К одной относятся фториды, к другой – производные остальных галоидов,
Фториды почти нерастворимы не только в воде, но и в разбавленных кислотах. Кристаллогидраты для них неизвестны. Хлориды, бромиды и иодиды хорошо растворимы в воде и из растворов выделяются в виде кристаллогидратов.
Азотнокислый барий кристаллизуется при обычных условиях без воды. Напротив, нитраты Са и Sr выделяются в виде; кристаллогидратов. Последние легко растворимы в воде, тогда как растворимость Ва(NO3 )3 и Ra(NO3 )2 значительно меньше. Нитрат кальция широко применяется в качестве азотсодержащего минерального удобрения. Нитраты стронция и бария служат в пиротехнике для изготовления составов, сгорающих красным (Sr)j или зеленым (Ва) пламенем.
Сернокислые соли Sr и Ва кристаллизуются без воды выше 66°С в безводном состоянии выделяется из раствора и сульфат кальция, ниже указанной температуры осаждается гипс – CaSO4 ·2H2 O. В воде рассматриваемые сульфаты труднорастворимы, причем по ряду Са–Ra растворимость быстро уменьшается.
Нагревание до 150°С обусловливает переход гипса в более бедный водой гидрат 2CaSO4 ·H2 O. При замешивании теста из порошка этого гидрата с водой (60–80% от его веса) происходит обратное присоединение последней, сопровождающееся отвердеванием всей массы вследствие ее закристаллизовывания. На этом основано применение гипса для изготовления слепков с различных предметов, а также в качестве вяжущего строительного материала.
3) Обжиг гипса для получения вяжущего материала проводят обычно при температурах не выше 180 °С. Полученный продукт поступает в продажу под названием жженого (штукатурного) гипса, или алебастра. Обжиг выше 350°С ведет к образованию растворимой формы безводного CaSO4 , а выше; 500 °С – его нерастворимой формы, которая вновь воду уже не присоединяет и поэтому в качестве вяжущего материала использована быть не может («мертвый гипс»).
Образующиеся при еще более сильном обжиге (900–1200 °С) основные соли состава xCaSO4 ·yCaO (гидравлический гипс), будучи замешаны с водой, вновь дают затвердевающую массу. Ее твердение вызывается присоединением воды и кристаллизацией материала, причем образующиеся кристаллы тесна переплетаются и срастаются друг с другом, что обусловливает большую мехамическую прочность затвердевшей массы. Последняя вместе с тем весьма стойка по отношению к действию воды, изменениям температуры и т. д. Гидравлический гипс применяется для изготовления ступенек, подоконников и т. п. и в качестве вяжущего материала. Он был известен египтянам еще за 2000 лет до н. э. и широко использовался ими при возведении различных построек.
Углекислые соли щелочноземельных металлов практически нерастворимы в воде. При накаливании они отщепляют СО2 и переходят в соответствующие окиси. По ряду Са–Sr––Ва термическая устойчивость карбонатов быстро возрастает. Наиболее практически важным из 'них является карбонат кальция.
Применение отдельных природных разновидностей СаСО3 весьма различно. Известняк служит исходным сырьем для получения важнейших строительных материалов – извести и цемента.
Мел используется в качестве минеральной краски, как основа составов для полировки и т. д. Мрамор является прекрасным материалом для скульптурных работ, изготовления электрических распределительных щитов и т. д.
Ежегодная мировая выработка извести из известняка исчисляется десятками миллионов тонн. Термическая диссоциация СаСОз идет со значительным поглощением тепла:
СаСОз + 43 ккал = > СаО + СО2
Зависимость равновесия этой реакции от температуры видна из следующих данных:
Технически обжиг известняка чаще всего осуществляется в шахтных печах (рис. 180). Важным побочным продуктом производства является углекислый газ.
Известь находит широкое применение в ряде отраслей промышленности. Значительные ее количества потребляются также сельским хозяйством. Важнейшей и с наиболее давних времен известной человечеству областью применения извести является, однако, использование ее (под названием «известкового раствора») в качестве вяжущего строительного материала для скрепления друг с другом камней, кирпичей и т. п. Обычно приготовляют смесь извести с песком (1 часть на 3–4 части песка) и водой вколичестведостаточном для получения тестообразной массы. Последняя постепенно твердеет вследствие кристаллизации гидроокиси кальция и образования кристаллического СаСОз (за счет углекислоты воздуха) по реакции:
Одновременно идет образование также силикатов кальция (за счет SiO2 песка). Ввиду выделения воды при твердении известкового раствора в построенных с его помощью зданиях долгое время сохраняется сырость.
Значительные преимущества перед известью имеет другой вяжущий строительный материал – цемент. Помимо того, что его применением устраняется долговременная сырость зданий, цемент характеризуется способностью затвердевать не только на воздухе, но и под водой. Затвердевание его идет, кроме того, значительно быстрее, чем в случае известкового раствора. Выработка цемента по СССР составила в 1962 г. 57,3 млн. т (против 5,7 млн. г в 1940 г. и 1,5 млн. т в 1913 г.).
Цемент представляет собой зеленовато–серый порошок, состоящий в основном из смеси различных силикатов и алюминатов кальция, преимущественно Ca3 SiO5 , Ca2 SiO4 и Са3 (АlO3 )2 . Будучи замешан с водой, он дает отвердевающую массу. Переход последней из тестообразного в твердое состояние носит название «схватывания» и осуществляется обычно в течение нескольких часов. С химической стороны процесс схватывания цемента обусловлен главным образом гидратацией его составных частей.
4) При производстве цемента смесь тонко измельченных известняка и богатой SiO2 глины обжигают до начала спекания (1400–1600 °С) в специальных вращающихся печах (рис. 181). Последние представляют собой слегка наклонные, выложенные внутри огнеупорным кирпичом стальные трубы диаметром 2–3 м и длиной в несколько десятков метров. Печь лежит на роликах и приводится мотором в медленное вращение. В ее верхнюю часть непрерывновводится исходная смесь, которая при постепенном продвижении вниз все более разогревается за счет тепла сгорающих в печи газов (или каменноугольной пыли). Обожженный продукт (цементный клинкер) после остывания тщательно перемалывается.
5) Состав цементов выражают обычно в виде весового процентного содержания входящих в них окислов (в основном CaO, SiO2 , Al2 O3 и Fe2 O3 ). Первый из них играет в цементе роль основания, остальные – роль кислотных ангидридов, весовое отношение СаО / (SiO2 + Al2 O3 +Fe2 O3 ) носит название гидромодуля цемента и хорошо характеризует его качества. Числовая величина гидромодуля обычного (силикатного) цемента колеблется около двух. Приблизительные типичные результаты его анализа приводятся ниже (% по весу):
6) Схватывание цемента обусловлено в основном реакциями по схемам:
После первоначального схватывания твердость цемента в течение длительного времени продолжает возрастать. Основной причиной этого является, по–видимому, распространение процессов гидратации в глубь цементных зерен.
Наряду с рассмотренными выше солями для химии Са, Sr и Ва весьма важны их известные только в растворе кислые карбонаты Э(НСО3 )2 . Они образуются при взаимодействии растворенного в воде углекислого газа с нормальными карбонатами по схеме:
Реакция эта обратима, причем нагревание смещает ее равновесие в сторону распада бикарбоната. Довольно часто из бикарбонатов щелочноземельных металлов в природных водах содержится только Са(НСО3 )2 . Наличие его придает воде приятный освежающий вкус (который отсутствует у дистиллированной воды).
Содержание в природной воде солей двухвалентных металлов часто оценивают, говоря о той или иной ее «жесткости». При этом различают жесткость временную и постоянную. Первая обусловлена присутствием в воде бикарбонатов – Са(НСО3 )2 , реже Mg(HCO3 )2 и иногда также Fe(HCO3 )2 . Временной она названа потому, что может быть устранена простым кипячением воды: бикарбонаты при этом разрушаются и нерастворимые продукты их распада (карбонаты Са и Mg, гидроокись железа) оседают на стенках сосуда в виде накипи. По цвету последней можно оценить содержание Fe(HCO3 )2 в потребляемой воде: если его вовсе нет, накипь имеет белый цвет, при значительном его количестве – красно–бурый.
Постоянная жесткость воды обусловлена присутствием в ней солей двухвалентных металлов, не дающих осадка при кипячении. Наиболее обычны сульфаты и хлориды Са и Mg. Из них особое значение имеет малорастворимый CaSO4 , который оседает в виде очень плотной накипи.
При работе парового котла на жесткой воде его нагреваемая поверхность покрывается накипью. Так как последняя плохо проводит тепло; прежде всего становится неэкономичной сама работа котла: уже слой накипи толщиной в 1 мм повышает расход топлива приблизительно на 5%. С другой стороны, изолированные от воды слоем накипи стенки котла могут нагреться до весьма высоких температур. При этом железо постепенно окисляется и стенки теряют прочность, что может повести к взрыву котла. Так как паросиловое хозяйство существует во многих промышленных предприятиях и на транспорте, вопрос о жесткости воды практически весьма важен.
Жесткая вода оказывается также непригодной для проведения технологических процессов ряда отраслей промышленности. Пользование ею затрудняет стирку белья, мытье волос и другие операции, связанные с потреблением мыла. Обусловлено это нерастворимостью солей двухвалентных металлов и входящих в состаз мыла органических кислот, из–за чего, с одной стороны, загрязняются отмываемые предметы, с другой – непроизводительно расходуется мыло.
7) И постоянную и временную жесткость воды в СССР принято оценивать числом содержащихся в одном литре миллиграмм–эквивалентов двухвалентных металлов (мг–экв/л). За рубежом пользуются условными «градусами жесткости», величины которых в отдельных странах различны (1 мг–экв/л соответствует 2,8 немецким, 3,5 английским, 5 французским или 50 американским градусам). До 1952 г. в СССР обычно применялись немецкие градусы.
Сумма временной и постоянной жесткости определяет общую жесткость воды. Последняя характеризуется по этому признаку следующими наименованиями: очень мягкая (до 1,5), мягкая (1,5–3), среднежесткая (3–6), жесткая (6–9), очень жесткая (>9 мг–экв/л). Жесткость отдельных естественных вол . колеблется в весьма широких пределах. Для открытых водоемов она часто зависит от времени года и даже погоды. Наиболее «мягкой» природной водой является атмосферная (дождь, снег), почти не содержащая растворенных солей.
Так как очистка воды от растворенных солей при помощи перегонки слишком дорога, в местностях с жесткой водой для ее «умягчения» пользуются химическими методами. Временную (иначе – карбонатную) жесткость обычно устраняют, прибавляя к воде Са(ОН)2 в количестве, строго отвечающем найденному по анализу содержанию бикарбонатов. При этом по реакции
весь бикарбонат переходит в нормальный карбонат и осаждается. От постоянной (иначе, некарбонатной) жесткости чаще всего освобождаются добавлением к воде соды, которая вызывает образование осадка по реакции:
Воде дают затем отстояться и лишь после этого пользуются ею для питания котлов или в производстве. Для умягчения небольших количеств жесткой воды (в прачечных и т. п.) обычно добавляют к ней немного соды и дают отстояться. При этом двухвалентные металлы полностью осаждаются в виде карбонатов, а остающиеся в растворе соли натрия употреблению мыла не мешают.
Из изложенного следует, что содой можно пользоваться для Устранения и временной и постоянной жесткости, а гидроокисью кальция – только для устранения временной. Тем не менее в технике стараются применять именно Са (ОН)2 , что обусловлено гораздо большей дешевизной этого продукта сравнительно с содой.
Распознавание неорганических веществ
Мы знаем, что многие химические элементы добывают из минералов. Прежде чем понять, что есть в минерале, нужно это определить. К тому же, многие химические вещества похожи друг на друга, что затрудняет задачу. Оказывается, существуют реакции, идущие только с определенными элементами. Такие реакции называются качественными. В этой статье рассмотрим основные качественные реакции на ионы неорганических соединений.
Основные понятия
Качественная реакция – это реакция, обладающая определенными признаками для того или иного соединения. К таким процессам предъявляется ряд требований: низкий порог чувствительности, специфичность, селективность.
Определять можно ионы. Это заряженные частицы. Если ион заряжен положительно – это катион, если отрицательно – анион. Ионы могут быть простыми и сложными, но у каждого есть специфическая качественная реакция.
Индикаторы
Индикаторы – вещества, которые дают специфический продукт реакции (осадок, газ, соль определенного цвета) с тем или иным ионом.
Определять можно не только конкретное соединение, но и класс, к которому оно относится. Одним из первых индикаторов являются индикаторы среды: фенолфталеин, метилоранж и лакмус. Молекулы этих веществ меняют свою конфигурацию в зависимости от кислотности раствора, на чем основана их индикаторная значимость.
В лабораториях и на производстве часто используют не сам раствор, а бумажку, пропитанную им – индикаторную бумагу. Существует несколько типов таких бумаг:
- Универсальная;
- Фенолфталеиновая;
- Лакмусовая;
- Свинцовая и т.д.
Для каждого вида индикаторных бумажек есть шкала цвета, по которому можно определить значение того или иного результата.
Распознавание катионов щелочных металлов
Для некоторых ионов есть несколько способов их идентификации. Например, ионы щелочных металлов определяются сухим способом – окрашиванием пламени и реакциями в растворах.
Каждый ион щелочного металла окрашивает пламя в определенный цвет:
- натрий – ярко-желтый,
- калий – розово-фиолетовый,
- литий – карминово-красный,
- рубидий – темно-фиолетовый.
Для определения наличия катиона щелочного металла можно провести качественную реакцию. Для каждого катиона используется определенный реактив.
Таблица. Характеристика качественных реакций на ионы щелочных металлов.
Распознавание ионов щелочноземельных металлов
Щелочно-земельные металлы расположены во второй группе таблицы Менделеева. Они, так же, активны, но меньше щелочных. Их распространенность в природе намного выше. К этим металлам относятся: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba), радий (Ra).
Раньше первые два металла не относили к группе щелочно-земельных. Последние научные исследования подтвердили их принадлежность к этому ряду.
Эти металлы можно определять окрашиванием пламени, но различить правильный оттенок у некоторых из них довольно трудно:
- Be – красный;
- Mg – ярко-белый (сильное выделение тепла);
- Ca – оранжево-красный;
- Sr – карминово-красный;
- Ba – желтовато-зеленый;
- Ra – темно-красный.
Определение катионов бериллия
Бериллий имеет специфическое строение атома. Его электронная конфигурация больше свойственная инертным газам. Обычных химических реакций для определения этого катиона нет. Бериллий определяют электрометрическим титрованием. При этом, производится титрование (по каплям) бериллия фторидом аммония в кислой среде. Бериллий образует аквафторокомплексы [BeF4]2 - , удерживая до четырех молекул воды.
Еще одним инновационным способом определения бериллия является нефелометрический метод с применением гидроксида аммиака. При этом получают мутные спеси с дальнейшим определением оптической плотности.
Описанные методы основаны не на химической реакции, а на процессе образования комплексных соединений.
Определение катионов магния
Для определения магния используют сильные щелочи, карбонат аммония или гидрофосфат натрия в присутствии солей аммония.
В первых двух случаях выпадает белый аморфный осадок. Его кристаллы настолько малы, что практически не оседаю на дно, оставаясь взвешенными в водном растворе.
Во втором случае образуется, так же, белый осадок, но крупнокристаллический:
Определение катионов кальция
Для определения кальция чаще всего используют угольную или сернистую кислоту. Образующиеся соли белого цвета и не растворимы в вод. При этом, они хорошо растворимы в других кислотах:
Еще один способ – микрокристаллоскопическая реакция с серной кислотой. Образуются белые кристаллы игольчатой формы.
Определение ионов стронция
Стронций образует белые нерастворимые осадки с серной кислотой, карбонатом аммония:
Также, для индикации используют оксалат аммония. Образующийся белый осадок растворяется во всех кислотах:
Одной из самых ярких реакций на ион стронция является реакция с родизонатом натрия. При этом образуется красно-бурый осадок:
Определение катионов бария
В растворе ионы бария определяют с помощью серной кислоты или ее растворимых солей.
При реакции образуется белый нерастворимый в кислотах осадок. Это микрокристаллоскопическая реакция, можно рассмотреть форму кристаллов под микроскопом.
Определение ионов меди
Для обнаружения ионов меди в растворе соли в него добавляют концентрат аммиачного раствора.
При этом, медь образует комплексную соль ярко-синего цвета.
еще один способ - реакция с гидроксидом натрия. В результате реакции образуется синий студенистый осадок.
При его нагревании происходит разложение с образованием черного оксида меди.
Медь можно определить сухим способов в пламени горелки. Она приведет к окрашиванию пламени в зеленый цвет.
Определение ионов двух- и трехвалентного железа
Железо имеет два основных иона: Fe 2+ и Fe 3+ .
Ионы Fe 3+ можно идентифицировать с помощью трех реактивов. Первый из них – щелочь. При этом образуется красно-бурый нерастворимый осадок:
FeCl₃ + 3NaOH = Fe(OH)₃↓+ 3NaCl.
Другой вариант – желтая кровяная соль K₃[Fe(CN)₆], при взаимодействии с которой трехвалентное железо образует комплексное соединение синего цвета.
Третий вариант – роданид калия (ядовитое вещество). При реакции образуется красная густая соль. Это соединение часто использовали в кинематографе в качестве искусственной крови.
Для определения Fe 2+ используют красную кровяную соль K₄[Fe(CN)₆]. В результате образуется соединение синего цвета (берлинская лазурь).
Определение катионов аммония
Катион аммония необычен тем, что состоят из молекулы аммиака с присоединенным за счет донорно-акцепторной связи водородом. Так, ион имеет вид NH4 + . Соли аммония применяются в сельском хозяйстве, медицине.
Определить наличие этого катиона можно с помощью индикаторной бумаги. Над раствором соли аммония она синеет.
Значения цветов индикаторной бумаги
Гидроксид аммония – слабое соединение, которое распадается на аммиак и воду. Аммиак обладает характерным запахом (нашатырный спирт), по которому, так же, определяют наличие катиона аммония.
Качественная реакция на катион аммония: NH4Cl + NaOH → NaCl + NH3↑ + H2O
Другой способ индикации – с помощью реактива Несслера– K2[HgI4]. При взаимодействии с солями аммония образуется бурый цвет:
Реакция очень чувствительная. При малом содержании катионов аммония, цвет будет желтый.
Качественные реакции на анионы
Сульфат-ион и сульфит-ион
Ионы серной и сернистой кислот дают одинаковую реакцию с растворимыми солями бария – образуется белый осадок:
Различить их можно добавлением к полученному раствору азотной кислоты. Осадок сульфита бария растворится с образованием газа, а сульфата – нет.
Хлорид-, бромид-, йодид-ион
Для определения этих ионов используют один реактив – нитрат серебра. Во всех трех случаях выпадает творожистый осадок, но цвет у каждого – свой. Фторид-ион осадок с этим реактивом не дает.
Для индикации фторида используют нитрат кальция. При этом образуется белый осадок:
Карбонат-ион
Карбонат-ион определяется в две стадии. Первая – получение угольной кислоты:
Эта кислота слабая и быстро диссоциирует с образованием воды и углекислого газа.
Вторая реакция – пропускание выделяемого газа через известковую воду. Углекислый газ приводит к ее помутнению из-за образования нерастворимого карбоната кальция:
Фосфат-ион
Фосфат-ион определяется с помощью нитрата серебра. При взаимодействии образуется ярко-желтый осадок:
Цвет пламени щелочноземельных металлов
Ключевые слова конспекта: щелочноземельные металлы, элементы IIA-группы, земли, получение щелочноземельных металлов.
ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ IIA ГРУППЫ
К щёлочноземельным металлам относят кальций Са, стронций Sr, барий Ва, радий Ra – металлы IIА-группы. Название «щёлочноземельные» обусловлено тем, что гидроксиды этих металлов относятся к щелочам – растворимым в воде основаниям, а оксиды этих металлов с древних времён называли землями. Бериллий и магний к щёлочноземельным металлам не относятся.
Важнейшие параметры элементов IIA группы приведены в таблице:
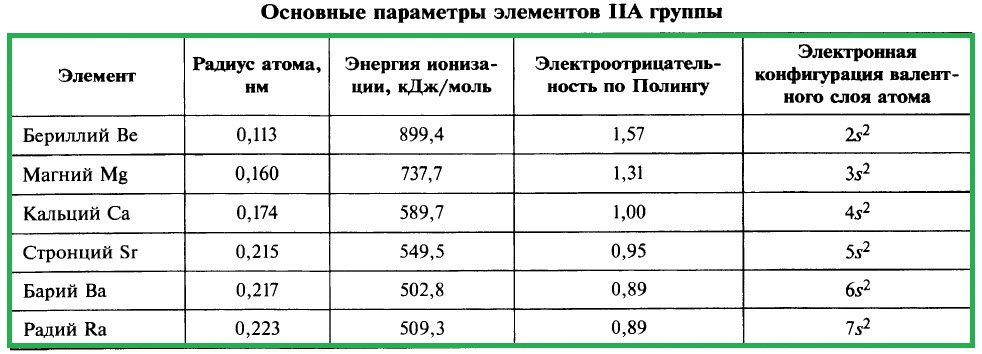
Электронная конфигурация валентного слоя атомов щёлочноземельных металлов в стационарном состоянии ns 2 . Щёлочноземельные металлы являются s-элементами. Во всех своих соединениях они имеют степень окисления +2.
Высшие оксиды щёлочноземельных металлов имеют состав МеО и проявляют основный характер. Высшие гидроксиды этих элементов Ме(ОН)2 являются типичными основаниями, их относят к щелочам, хотя их растворимость намного ниже, чем гидроксидов щелочных металлов. Водородные соединения щёлочноземельных металлов представляют собой твёрдые гидриды состава МеH2.
ЩЁЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ – ПРОСТЫЕ ВЕЩЕСТВА
При обычных условиях щёлочноземельные металлы – твёрдые вещества, имеют металлический блеск на свежем срезе (быстро покрываются желтоватой плёнкой на воздухе), лёгкие (кроме радия), при этом более твёрдые, чем щелочные металлы. Кальций не режется ножом, он довольно твёрдый, стронций и барий мягче. Барий похож по твёрдости на свинец, но в отличие от него при разрезании крошится на отдельные кристаллы.
При внесении щёлочноземельных металлов или их соединений в бесцветное пламя появляется его характерная окраска:
Щёлочноземельные металлы являются активными восстановителями. Реакции с галогенами протекают легко даже при обычных условиях: При сгорании щёлочноземельных металлов на воздухе или в кислороде образуются оксиды:При нагревании на воздухе или в кислороде кальций загорается, пламя при этом имеет красноватый цвет.
Щёлочноземельные металлы взаимодействуют с серой при нагревании. Образуются сульфиды: При нагревании щёлочноземельные металлы реагируют с азотом с образованием нитридов (Са – при температуре красного каления): При нагревании щёлочноземельные металлы взаимодействуют с водородом с образованием твёрдых гидридов: Щёлочноземельные металлы легко взаимодействуют с водой с образованием щёлочи и водорода:Кальций с холодной водой реагирует сравнительно медленно, но с горячей водой реакция идёт бурно.
Щёлочноземельные металлы активно взаимодействуют с растворами солей, но происходит, как и в случае щелочных металлов, не замещение металла, входящего в состав соли, а реакция щёлочноземельных металлов с водой раствора.
Кальций и стронций получают электролизом расплавов хлоридов:Конспект урока по химии «Щелочноземельные металлы. Элементы IIA-группы». Выберите дальнейшее действие:
Читайте также:
