Что такое переходные металлы в химии
Перехо́дные мета́ллы (перехо́дные элеме́нты) — элементы побочных подгрупп Периодической системы химических элементов Д. И. Менделеева, в атомах которых появляются электроны на d- и f-орбиталях. [1] В общем виде электронное строение переходных элементов можно представить следующим образом: " />
. На ns-орбитали содержится один или два электрона, остальные валентные электроны находятся на металлами.
Содержание
Общая характеристика переходных элементов
Все переходные элементы имеют следующие общие свойства: [2]
- Небольшие значения электроотрицательности.
- Переменные степени окисления. Почти для всех d-элементов, в атомах которых на внешнем ns-подуровне находятся 2 валентных электрона, известна степень окисления +2.
- Начиная с d-элементов III группы Периодической системы химических элементов Д. И. Менделеева, элементы в низшей степени окисления образуют соединения, которые проявляют основные свойства, в высшей — кислотные, в промежуточной — амфотерные. Например:
- Для всех переходных элементов характерно образование комплексных соединений.
Подгруппа меди
Подгруппа меди, или побочная подгруппа I группы Периодической системы химических элементов Д. И. Менделеева, включает в себя элементы: медь Cu, серебро Ag и золото Au.
Свойства металлов подгруппы меди [3]
| Атомный номер | Название, символ | Электронная конфигурация | Степени окисления | p, г/см³ | tпл, °C | tкип, °C |
|---|---|---|---|---|---|---|
| 29 | Медь Cu | [Ar] 3d 10 4s 1 | 0, +1, +2 | 8,96 [4] [5] | 1083 [4] [5] | 2543 [4] [5] |
| 47 | Серебро Ag | [Kr] 4d 10 5s 1 | 0, +1, +3 | 10,5 [6] | 960,8 [6] | 2167 [6] |
| 79 | Золото Au | [Xe] 4f 14 5d 10 6s 1 | 0, +1, +3 | 19,3 [7] | 1063,4 [7] | 2880 [7] |


В отличие от серебра и золота, медь окисляется с поверхности кислородом воздуха уже при комнатной температуре. В присутствии углекислого газа и паров воды её поверхность покрывается зелёным налётом, представляющим собой основной карбонат меди(II).
Для меди наиболее характерна степень окисления +2 [11] , однако существует целый ряд соединений, в которых она проявляет степень окисления +1.
Оксид меди(II)

Оксид меди(II) CuO — вещество чёрного цвета. Под действием восстановителей при нагревании он превращается в металлическую медь:
Растворы всех солей двухвалентной меди окрашены в голубой цвет, который им придают гидратированные ионы .
Гидроксид меди(II)
Это малорастворимое в воде вещество голубого цвета. Гидроксид меди(II) — амфотерный гидроксид с преобладанием основных свойств. При сильном нагревании или стоянии под маточным раствором он разлагается:
При добавлении аммиака Cu(OH)2 растворяется с образованием ярко-синего комплекса:
Соединения одновалентной меди
Соединения одновалентной меди крайне неустойчивы, поскольку медь стремится перейти либо в Cu 2+ , либо в Cu 0 . Стабильными являются нерастворимые соединения CuCl, CuCN, Cu2S и комплексы типаСеребро

Серебро более инертно, чем медь [14] , но при хранении на воздухе оно чернеет из-за образования сульфида серебра:
Наиболее устойчивая степень окисления серебра +1. В аналитической химии широкое применение находит растворимый нитрат серебра AgNO3, который используют как реактив для качественного определения ионов Cl − , Br − , I − :
\longrightarrow \ AgCl \downarrow>" />
При добавлении к раствору AgNO3 раствора щёлочи образуется тёмно-коричневый осадок оксида серебра Ag2O:
Многие малорастворимые соединения серебра растворяются в веществах-комплексообразователях, например, аммиаке и тиосульфате натрия:
Золото

Золото представляет собой металл, сочетающий высокую химическую инертность и красивый внешний вид, что делает его незаменимым в производстве ювелирных украшений. [15] В отличие от меди и серебра, золото крайне инертно по отношению к кислороду и сере, но реагирует с галогенами при нагревании:
Чтобы перевести золото в раствор, необходим сильный окислитель, поэтому золото растворимо в смеси концентрированных соляной и азотной кислот ("царской водке"):
Платиновые металлы
Платиновые металлы — семейство из 6 химических элементов побочной подгруппы VIII группы Периодической системы, включающее рутений Ru, родий Rh, палладий Pd, осмий Os, иридий Ir и платину Pt. Эти металлы подразделяются на две триады: лёгкие — триада палладия (Ru, Rh, Pd) и тяжёлые — триада платины (Os, Ir, Pt).
Примечания
Литература
См. также
Ссылки
- Переходные металлы
- Группы химических элементов
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Переходные металлы" в других словарях:
ПЕРЕХОДНЫЕ МЕТАЛЛЫ — химич. элементы I6 и VIIIб подгрупп периодич. системы элементов. В П. м. внутр. оболочки атомов заполнены только частично. Различают d металлы, у к рых происходит постепенное заполнение З d (от Sc до Ni), 4 d (от Y до Pd) и 5 d (от Hf до Pt)… … Физическая энциклопедия
переходные металлы — Элементы 16 и VIII6 подгруппы Периодич. системы. У атомов п. м. внутр. оболочки заполнены только частично. Различают rf ме таллы, у к рых происходит постепенное заполнение 3
переходные металлы — [transition metals] элементы Iб и VIIIб подгруппы Периодической системы. У атомов переходных металлов внутренние оболочки заполнены только частично. Различают d металлы, у которых происходит постепенное заполнение 3d (от Se до Ni), 4d (от Y до… … Энциклопедический словарь по металлургии
Металлы платиновой группы — H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr Rb Sr Y … Википедия
Переходные элементы — Переходные металлы (переходные элементы) химические элементы побочных подгрупп I VIII групп Периодической системы элементов Д.И. Менделеева (3 12 групп в длиннопериодном варианте таблицы). Переходные металлы выделяют на основании незавершённости… … Википедия
металлы — Простые вещ ва, обладающие в обычных условиях хар рными св вами: высокой электро и теплопроводностью, отрицат. темп рным коэфф. электропроводности, способностью хорошо отражать электромагн. волны, пластичностью. М. В. Ломоносов определял м. как… … Справочник технического переводчика
ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ — (переходные металлы; хим. элементы, расположенные в побочных подгруппах больших периодов периодической системы; являются d и f элементами. Назв. переходные связано с тем, что в периодах П. э. вклиниваются между s и р элементами. Всего известно 65 … Химическая энциклопедия
МЕТАЛЛЫ — (от греч. metallon, первоначально шахта, руда, копи), простые в ва, обладающие в обычных условиях характерными св вами: высокими электропроводностью и теплопроводностью, отрицательным температурным коэфф. электропроводности, способностью хорошо… … Физическая энциклопедия
ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ — (переходные металлы) химические элементы подгрупп б периодической системы Менделеева. Атомы переходных элементов имеют незавершенные внутренние электронные оболочки. Различают d элементы, у которых происходит заполнение внутренних 3d , 4d , 5d и… … Большой Энциклопедический словарь
ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ — переходные металлы, d и f элементы, хим. элементы, у к рых d и f оболочки частично заполнены электронами. К d элементам относятся металлы подгрупп меди Си, цинка Zn, скандия Sc, титана Ti, ванадия V, хрома Сr, марганца Мп, а также VIII гр.… … Большой энциклопедический политехнический словарь
Переходные элементы
Переходные металлы (переходные элементы) — химические элементы побочных подгрупп I — VIII групп Периодической системы элементов Д.И. Менделеева (3 — 12 групп в длиннопериодном варианте таблицы).
Переходные металлы выделяют на основании незавершённости внутренних электронных оболочек их атомов или ионов. Термин «переходные» связан с тем, что в периодах эти элементы располагаются между s- и р-элементами. Переходные металлы, в свою очередь, подразделяют на d-элементы, у которых происходит заполнение 3d-, 4d-, 5d- и 6d-подоболочек, и f-элементы, у которых заполняется 4f- (лантаноиды) либо 5f-подоболочка (актиноиды). Цинк, кадмий и ртуть, обычно причисляемые к переходным металлам, строго говоря, таковыми не являются, поскольку их катионы имеют завершённый d-подуровень.
Незавершённость внутренних электронных оболочек предопределяет наличие у переходных металлов ряда специфических свойств: способность к образованию координационных (комплексных) соединений, ферромагнетизм некоторых металлов, парамагнетизм многих соединений и т.д.
Смотреть что такое "Переходные элементы" в других словарях:
ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ — ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ, химические элементы, расположенные в побочных подгруппах больших периодов периодической системы; металлы. Из 109 элементов 65 переходные. Переходные элементы, кроме железа, мало распространены в природе … Современная энциклопедия
Переходные элементы — ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ, химические элементы, расположенные в побочных подгруппах больших периодов периодической системы; металлы. Из 109 элементов 65 переходные. Переходные элементы, кроме железа, мало распространены в природе. … Иллюстрированный энциклопедический словарь
ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ — ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ, металлические элементы, имеющие незаполненные внутренние электронные оболочки. Переходные элементы характеризуются переменной ВАЛЕНТНОСТЬЮ и образованием окрашенных ионов. Сюда входят элементы с атомным номером от 21 до 112.… … Научно-технический энциклопедический словарь
ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ — хим. элементыпобочных подгрупп (b подгрупп) периодической системы элементов. К ним относятся d и f элементы, т. е. элементы, у к рыхпроисходит заполнение 3d ,4d , 5d оболочки (переходныеметаллы) или 4f и 5f оболочки (лантаноиды и актиноиды… … Физическая энциклопедия
переходные элементы — (переходные металлы), химические элементы подгрупп «б» периодической системы. Атомы переходных элементов имеют незавершённые внутренние электронные оболочки. Различают d элементы, у которых происходит заполнение внутренних 3d , 4d , 5d и 6d… … Энциклопедический словарь
ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ — В соответствии с периодической классификацией элементов существует 44 элемента, образующих подгруппы А. В каждой из этих подгрупп (или семейств) на внешней (валентной) электронной оболочке число электронов равно номеру группы. При переходе от… … Энциклопедия Кольера
переходные элементы — pereinamieji elementai statusas T sritis chemija apibrėžtis d ir f elementai. atitikmenys: angl. transition elements rus. переходные элементы … Chemijos terminų aiškinamasis žodynas
ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ — (переходные металлы), хим. элементы подгрупп б периодич. системы. Атомы П. э. имеют незавершённые внутр. электронные оболочки. Различают rf элементы, у к рых происходит заполнение внутр. 3d , 4d , 5d и 6d подоболочек, и f элементы, у к рых… … Естествознание. Энциклопедический словарь
Переходный металл
Смотреть что такое "Переходный металл" в других словарях:
переходный металл — Металл, в котором доступные электронные энергетические уровни заняты таким способом, что d полоса содержит менее максимально возможного количества электронов (десять на атом), например железо, кобальт, никель и вольфрам. Отличительные свойства… … Справочник технического переводчика
Переходный металл — Transition metal Переходный металл. Металл, в котором доступные электронные энергетические уровни заняты таким способом, что d полоса содержит менее максимально возможного количества электронов (десять на атом), например железо, кобальт, никель и … Словарь металлургических терминов
переходный металл — Металл в твёрдом теле, энергия которого находится в зоне проводимости … Политехнический терминологический толковый словарь
Металл — (Metal) Определение металла, физические и химические свойства металлов Определение металла, физические и химические свойства металлов, применение металлов Содержание Содержание Определение Нахождение в природе Свойства Характерные свойства… … Энциклопедия инвестора
Драгоценные металлы — (Precious metals) Драгоценные металлы это редко встречающиеся металлы, которые отличаются блеском, красотой и стойкостью к коррозии История добычи драгоценных металлов, разновидности, свойства, применение, распространение в природе, сплавы… … Энциклопедия инвестора
Аморфные металлы — Образцы аморфных металлов … Википедия
Медь — (Copper) Металл медь, месторождения и добыча меди, получение и применение Информация о металле медь, свойства меди, месторождения и добыча металла, получение и применение меди Содержание — (лат. Cuprum), Cu, химический элемент I группы… … Энциклопедия инвестора
МЕТАЛЛИЧЕСКИЕ СТЁКЛА — (стекловидные металлы, метглассы), металлич. сплавы в стеклообразном состоянии, образующиеся при сверхбыстром охлаждении металлич. расплава (скорость охлаждения ?106 К/с). Быстрый теплоотвод достигается, если, по крайней мере, один из размеров… … Физическая энциклопедия
Палладий — У этого термина существуют и другие значения, см. Палладий (значения). 46 Родий ← Палладий → Серебро … Википедия
Переходный металл: свойства и список
Элементы в периодической таблице часто делятся на четыре категории: элементы основной группы, переходные металлы, лантаноиды и актиноиды. В основные элементы группы включают активные металлы в двух колонках по крайней левой части таблицы Менделеева и металлов, полуметаллов и неметаллов в шести колонках на крайней правой. Эти переходные металлы являются металлическими элементами, которые выступают в качестве своего рода моста или перехода между частями сторонами периодической таблицы.
Что это такое
Вам будет интересно: Эвентуальный — это какой?
Из всех групп химических элементов переходные металлы могут быть наиболее сложными для идентификации, потому что существуют различные мнения относительно того, что именно туда должно быть включено. Согласно одному из определений, к ним относят любые вещества с частично заполненной d-электронной подоболочкой (обиталью). Это описание относится к группам с 3-й по 12-ю в периодической таблице, хотя элементы f-блока (лантаноиды и актиноиды, расположенные ниже основной части периодической таблицы) также являются переходными металлами.
Их название связано с именем английского химика Чарльза Бери, который использовал его в 1921 году.

Место в периодической таблице
Переходными являются все металлы рядов, расположенных в группах от IB до VIIIB периодической таблицы:
- с 21-го (скандий) по 29-й (медь);
- с 39-го (иттрий) по 47-й (серебро);
- с 57-го (лантан) до 79-го (золото);
- с 89-го (актиний) до 112-й (коперник).
Последняя группа включает лантаноиды и актиноиды(так называемые f-элементы, которые представляют собой их особую группу, все остальные относятся к d-элементам).
Переходные металлы: список
Перечень этих элементов представлен:
- скандием;
- титаном;
- ванадием;
- хромом;
- марганцем;
- железом;
- кобальтом;
- никелем;
- медью;
- цинком;
- иттрием;
- цирконием;
- ниобием;
- молибденом;
- технецием;
- рутением;
- родием;
- палладием;
- серебром;
- кадмием;
- гафнием;
- танталом;
- вольфрамом;
- рением;
- осмием;
- иридием;
- платиной;
- золотом;
- ртутью;
- резерфодием;
- дубнием;
- сиборгием;
- борием;
- хассием;
- мейтнерием;
- дармштадтием;
- рентгением;
- унунбием.

Группа лантаноидов представлена:
- лантаном;
- церием;
- празеодимом;
- неодимом;
- прометием;
- самарием;
- европием;
- гадолинием;
- тербием;
- диспрозием;
- гольмием;
- эрбием;
- тулием;
- иттербием;
- лютецием.
- актинием;
- торием;
- протактинием;
- ураном;
- нептунием;
- плутонием;
- америцием;
- кюрием;
- берклием;
- калифорнием;
- эйнштейнием;
- фермием;
- менделевием;
- нобелием;
- лоуренсием.
Особенности
В процессе образования соединений атомы металлов могут использоваться как валентные s- и p-электроны, так и d-электроны. Поэтому d-элементы в большинстве случаев характеризуются переменной валентностью, в отличие от элементов главных подгрупп. Это свойство обуславливает их способность к образованию комплексных соединений.
Наличие определенных свойств обуславливает название этих элементов. Все переходные металлы ряда являются твердыми с высокими температурами плавления и кипения. При перемещении слева направо по периодической таблице пять d-орбиталей становятся более заполненными. Их электроны слабо связаны, что способствует высокой электропроводности и податливости переходных элементов. Им свойственна также низкая энергия ионизации (она требуется при удалении электрона от свободного атома).

Химические свойства
Переходные металлы проявляют широкий спектр состояний окисления или положительно заряженных форм. В свою очередь, они позволяют переходным элементам образовывать много различных ионных и частично ионных соединений. Образование комплексов приводит к расщеплению d-орбиталей на два энергетических подуровня, что позволяет многим из них поглощать определенные частоты света. Таким образом, образуются характерные окрашенные растворы и соединения. Эти реакции иногда усиливают относительно низкую растворимость некоторых соединений.
Переходные металлы характеризуются высокой электропроводностью и теплопроводностью. Они податливы. Обычно образуют парамагнитные соединения из-за неспаренных d-электронов. Также им свойственна высокая каталитическая активность.
Следует также отметить, что существует некоторая полемика о классификации элементов на границе между основной группой и элементами переходного металла в правой части таблицы. Этими элементами являются цинк (Zn), кадмий (Cd) и ртуть (Hg).

Проблемы систематизации
Разногласия относительно того, следует ли классифицировать их как относящиеся к основной группе или переходные металлы, свидетельствуют о том, что различия между этими категориями не ясны. Между ними есть определенное сходство: они выглядят как металлы, они податливы и пластичны, они проводят тепло и электричество и образуют положительные ионы. Тот факт, что двумя лучшими проводниками электричества являются переходный металл (медь) и элемент, относящийся к основной группе (алюминий), показывает степень, в которой физические свойства элементов двух этих групп перекрываются.

Сравнительная характеристика
Существуют также различия между основными и переходными металлами. Например, последние являются более электроотрицательными, чем представители основной группы. Поэтому они с большей вероятностью образуют ковалентные соединения.
Другое различие между металлами основной группы и переходными металлами можно увидеть в формулах соединений, которые они образуют. Первые имеют тенденцию образовывать соли (такие как NaCl, Mg 3 N 2 и CaS), в которых достаточно только отрицательных ионов, чтобы уравновесить заряд на положительных ионах. Переходные металлы образуют аналогичные соединения, такие как FeCl3, HgI2 или Cd (OH)2. Однако они чаще, чем металлы основной группы, образуют комплексы, такие как FeCl4- , HgI42- и Cd (ОН)42-, имеющие избыточное количество отрицательных ионов.
Еще одно отличие между основной группой и ионами переходных металлов заключается в легкости, с которой они образуют стабильные соединения с нейтральными молекулами, такими как вода или аммиак.
Переходные элементы: медь, хром, железо
Общая характеристика переходных элементов-металлов
К переходным элементам относятся такие, которые расположены в побочных подгруппах больших периодов периодической системы Д.И. Менделеева. К ним принадлежат d– и f–элементы. Название «переходные» связано с тем, что переходные элементы расположены между s– и р–элементами.
Мы рассмотрим три металла: железо, хром и медь.
Железо — металл VIIIB-группы четвёртого периода. Его особенностью, как и особенностью других переходных металлов, является наличие валентных электронов как на внешнем (4s), так и на предвнешнем (3d) подуровнях.
Хром — металл VIB-группы четвёртого периода. Как и железо, это d-элемент, у которого валентные электроны находятся и на внешнем слое и на предвнешнем подуровне. Помимо этого, в атоме хрома в основном состоянии происходит провал электрона.
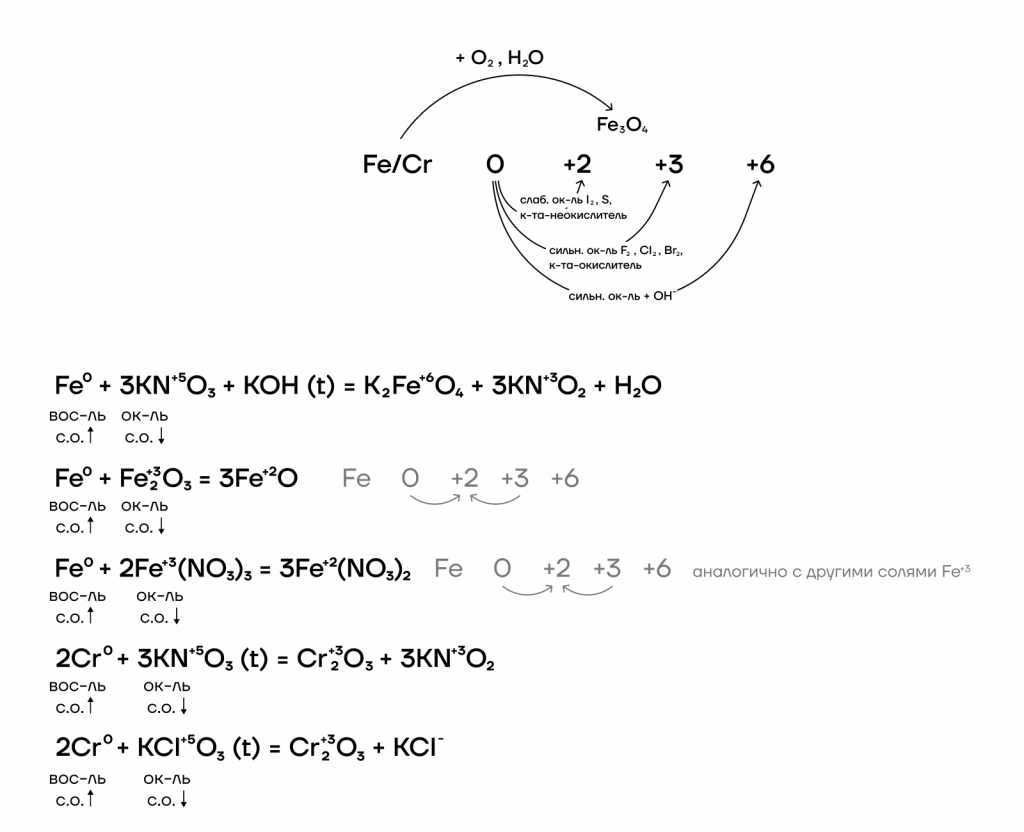
Железо и хром имеют идентичный набор степеней окисления, а также возможных оксидов и гидроксидов: 0, +2, +3, +6.
Медь — металл IB-группы четвёртого периода. Как и в случае других элементов побочных подгрупп, особенностью для неё является наличие валентных электронов как на внешнем (4s), так и на предвнешнем (3d) подуровнях. Как и у хрома, у меди в электронной конфигурации наблюдается провал электрона.
Степени окисления меди следующие:
- низшая степень окисления равна 0, как и у всех металлов;
- высшая равна +2;
- промежуточная равна +1.
Физические свойства
По физическим свойствам железо и хром — совершенно типичные металлы серебристо-белого цвета, которые не растворяются в воде, а на воздухе покрываются прочной оксидной плёнкой.
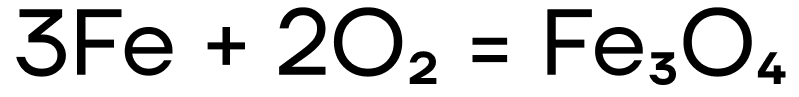
Особенностью железа является его быстрая коррозия (то есть окисление) кислородом во влажном воздухе, а особенностью хрома — высокая твёрдость: он является одним из самых твёрдых металлов.
Медь же — металл красного цвета, один из четырёх металлов, имеющих явную цветовую окраску, которая отлична от серой или серебристой.
Способы получения
Основным способом получения меди, хрома и железа является пирометаллургия, то есть различные реакции, происходящие при высоких температурах.
- Взаимодействие с простыми веществами
Как и другие металлы, железо и хром способны взаимодействовать со своими противоположностями, неметаллами, с образованием различных бинарных соединений.
При этом неметаллы, являющиеся сильными окислителями, окисляют железо и хром до +3, а неметаллы, являющиеся слабыми окислителями, — только до +2.
Железо и хром не реагируют с водородом и азотом ввиду неактивности последних. При взаимодействии с кислородом железо ржавеет: образуется смесь оксидов железа, то есть железная окалина Fe3O4.
Медь способна также окисляться до разных степеней окисления в зависимости от силы окислителя или его избытка/недостатка.
Железо и хром являются металлами, стоящими в ряду активности до водорода, поэтому они могут вытеснять его из воды с образованием оксидов и вытесненного водорода.
Так как это металлы средней активности (стоящие в промежутке от алюминия до водорода) они реагируют с водой не при нормальных условиях, а при очень высокой температуре.
При взаимодействии с водой железо ржавеет: образуется железная окалина Fe3O4, как и в случае с кислородом.

Медь же находится в ряду активности после водорода, следовательно, она “слабее” водорода и не способна вытеснить такого сильного соперника.
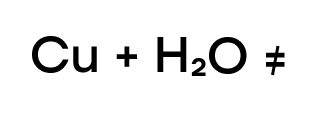
- Реакция с кислотами-неокислителями
Благодаря нахождению железа и хрома до водорода в ряду активности металлов они также способны вытеснять водород из растворов кислот-неокислителей.
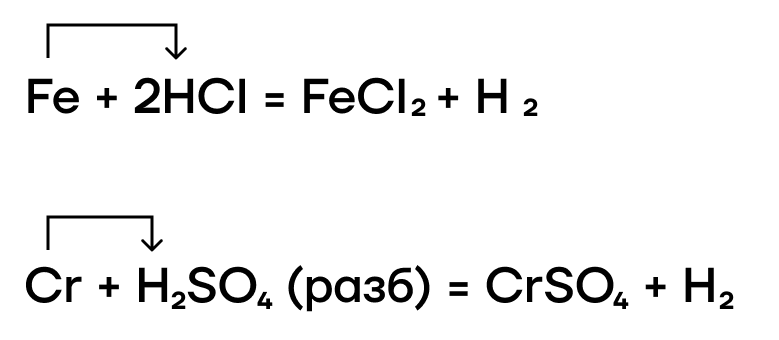
Так же, как и в случае с водой, медь не может вытеснить “качка”-водорода из таких кислот.
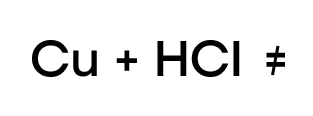
Как и прочие металлы, железо, хром и медь могут вытеснять менее активные металлы из растворов их солей.
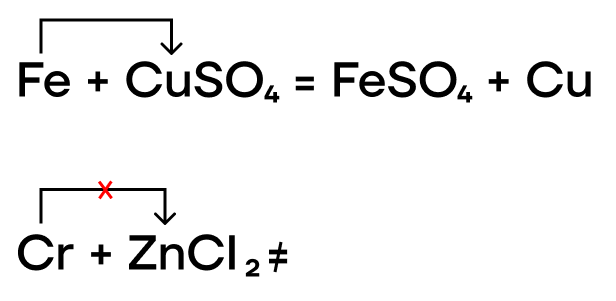
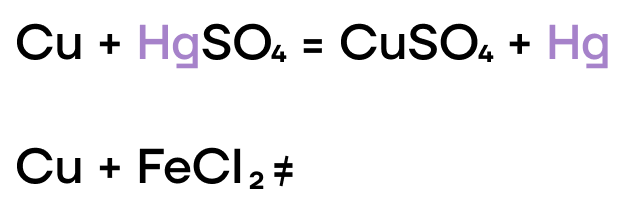
Из-за низких значений электроотрицательности, железо, хром и медь являются типичными восстановителями, а следовательно, способны реагировать с окислителями.
Ниже представлены различные способы повышения степеней окисления железа и хрома и основные реагенты, которые используются.
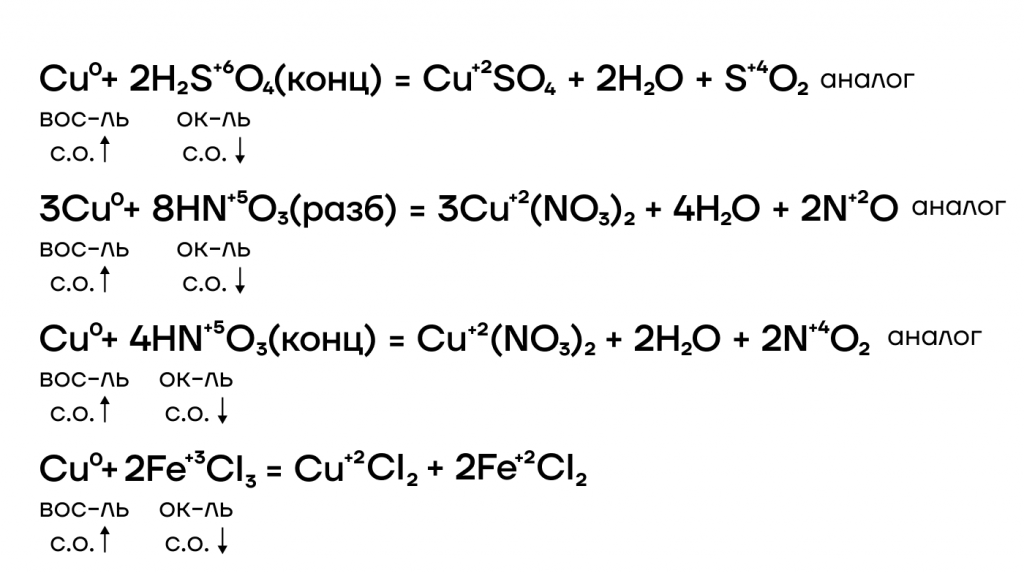
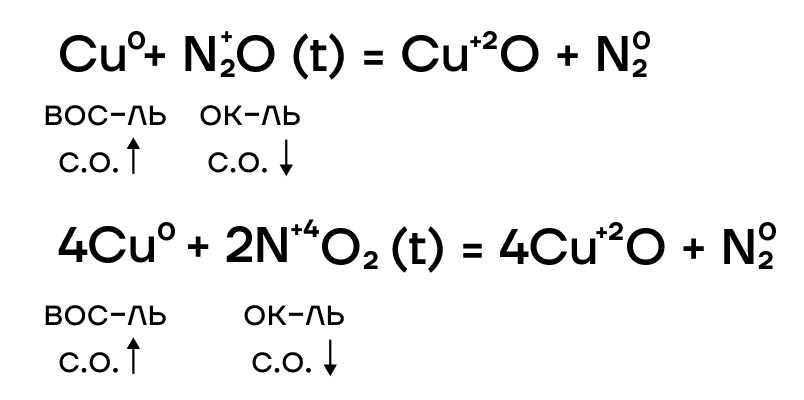
Фактчек
- Медь, железо и хром относятся к переходным металлам, то есть таким, которые расположены в побочных подгруппах больших периодов;
- Возможные степени окисления железа и хрома: 0, +2, +3, +6. Возможные степени окисления меди: 0, +1, +2.
Проверь себя
Задание 1.
У атома какого химического элемента не наблюдается «проскок» электрона?
Задание 2.
С какой солью будет реагировать медь?
- Хлорид натрия;
- Сульфат ртути(II);
- Хлорид железа(III);
- Фосфат кальция.
Задание 3.
Для какого металла характерна степень окисления +1?
Ответы: 1. — 3; 2. — 2; 3. — 4
Читайте также:

