Что такое металлический натрий
В обычных условиях натрий представляет собой серебристо-белый (в тонком слое — с фиолетовым оттенком), легкий, очень мягкий, низкоплавкий металл (относится к группе щелочных металлов) (рис. 1).
Пар натрия имеет темно-красный цвет и состоит из атомов Na (преобладают) и молекул Na2.
Весьма реакционноспособный; на воздухе покрывается оксидной пленкой (тускнеет), воспламеняется приумеренном нагревании. Устойчив в атмосфере аргона и азота. Сильный восстановитель; энергично реагирует с водой, кислотами, неметаллами.
Хорошо сохраняется под слоем бензина или керосина, легко суспендируется в кипящих инертных растворителях (толуол, ксилол, гептан, октан и др.). В инертной атмосфере расплавленный натрий быстро распределяется по поверхности некоторых твердых веществ (NaCl, Na2СО3, уголь, железо, Аl2О3, ZrO2), образуя серо-черные моноатомные покрытия. Окрашивает пламя газовой горелки в желтый цвет.

Рис. 1. Металлический натрий. Внешний вид.
Химическая формула металлического натрия
Химическое обозначение натрия – Na от латинского слова «natrium». Этот химический элемент расположен в третьем периоде в IА группе Периодической таблицы Д.И. Менделеева. Относится к элементамs-семейства. Металл. Относительная атомная масса натрия равна 22,9898 а.е.м.
Электронная формула металлического натрия
В ядре атома натрия содержится 11 протонов и 12 нейтронов (массовое число равно 23). В атоме натрия есть три энергетических уровня, на которых находятся 11 электронов (рис. 2).
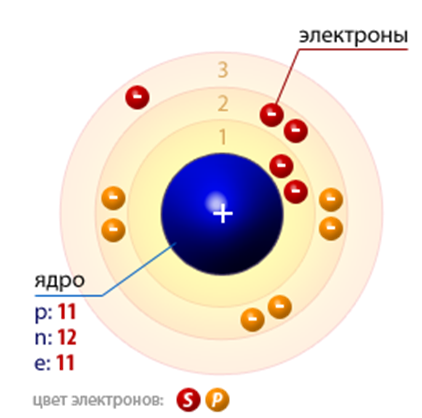
Рис. 2. Строение атома натрия.
Электронная формула атома натрия в основном состоянии имеет следующий вид:
Примеры решения задач
| Задание | Определите молекулярную формулу кальциевой селитры, в которой массовые отношения кальция, азота и кислорода равны 10:7:24. Относительная молекулярная масса кальциевой селитры 164. |
| Решение | Для того, чтобы узнать, в каких отношениях находятся химические элементы в составе молекулы необходимо найти их количество вещества. Известно, что для нахождения количества вещества следует использовать формулу: |
Найдем молярные массы кальция, азота и кислорода (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел). Известно, что M = Mr, значит M(Ca)= 40 г/моль, Ar(N)=14 г/моль, а М(O) = 32 г/моль.
Тогда, количество вещества этих элементов равно:
n (Ca) = m (Ca) / M (Ca);
n (Ca) = 10 / 40 = 0,25 моль.
n (N) = 7 / 14 = 0, 5 моль.
n (O) = 24 / 16 = 1,5 моль.
Найдем мольное отношение:
n(Ca) :n(N):n(O) = 0,25 : 0,5 : 1,5= 1 : 2 : 6,
т.е. простейшая формула соединения кальция, азота и кислорода имеет вид CaN2O6 и молярную массу 164 г/моль [M(CaN2O6) = Ar(Ca) + 2×Ar(N) + 6×Ar(O) = 40 + 2×14 + 6×16 = 40 + 28 + 96 = 164 г/моль]
Чтобы найти истинную формулу органического соединения найдем отношение полученных молярных масс:
Значит формула соединения кальция, азота и кислорода имеет вид CaN2O6или Ca(NO3)2. Это нитрат кальция.
| Задание | Установите массовую формулу вещества, содержащего 55,2% калия, 14,6% фосфора и 30,2% кислорода. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле: |
ω (Х) = n × Ar (X) / M (HX) × 100%.
Обозначим количество моль элементов, входящих в состав соединения за «х» (калий), «у» (фосфор) и «z» (кислород). Тогда, мольное отношение будет выглядеть следующим образом (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел):
x:y:z = ω(K)/Ar(K) : ω(P)/Ar(P) : ω(O)/Ar(O);
x:y:z= 55,2/39 : 14,6/31 : 30,2/16;
x:y:z= 1,4 : 0,5: 1,9 = 3 : 1: 4.
Значит формула соединения калия, фосфора и кислорода будет иметь вид K3PO4. Это фосфат калия.
Натрий – полезные свойства и опасность металла
Этот химический элемент известен каждому. На бытовом уровне натрий – это родная поваренная соль. Без нее еда не еда.

Что представляет собой
Натрий – это элемент периодической системы Дмитрия Менделеева под № 11.
Мягкое серебристо-белое вещество, относится к металлам щелочной группы.
Структура кристаллической решетки вещества – куб.
По составу вещество представляет собой два десятка изотопов, из которых только один стабилен. Большинство не «живет» дольше минуты, «долгожитель» – радиоактивный изотоп Na-22 (более года).
Официальное обозначение вещества: Na, Natrium.
История
История взаимодействия человека с натрием исчисляется тысячелетиями:
- Натуральную соду использовали еще древние египтяне и иудеи: как мыло, консервант (при бальзамировании), отбеливатель, компонент красок, эмалей, пищевую приправу. На местных рынках продавали кусковую соду.
- Вещество упоминается Ветхим Заветом.
- Натрий как металл выделил в 1807 году Гемфри Дэви. Английский химик расплавил гидроксид вещества методом электролиза.
Термин «натрий» восходит к древнеегипетскому ntr. Одно из его значений – сода. Его переняла латынь: natrium – сода.
Название предложил шведский ученый Йенс Берцелиус – автор, «окрестивший» многие химические вещества.
Формы нахождения в природе
В свободном виде вещество в природе не зафиксировано, только минералы либо соединения.
Самые известные минералы: содалит, галит («каменная соль»), полевые шпаты.
Тонна земной коры содержит в среднем 25 кг натрия, литр воды морей и океанов – 10,5 г соединений вещества.
Месторождения, добыча
Залежи натриевого сырья, особенно полевые шпаты, рассредоточены по планете.
Например, галит добывают Украина, Индия, США, Польша, ФРГ.
В России крупнейшие месторождения разрабатываются в Крыму, Красноярском и Пермском краях, Архангельской, Иркутской, Волгоградской, Астраханской областях, Оренбуржье.
Добыча ведется открытым либо шахтным способом.
Способы получения
Традиционный способ получения натрия – восстановление металла по способу Девиля. Карбонат натрия загружают в емкость с углем и нагревают до 1000°C.

Промышленное получение натрия по способу Девилля, распространённое в 19 веке. AC — железная трубка со смесью соды, угля и мела; B — холодильник Донни и Мареска; R — приёмник с нефтью
Со времен промышленной революции основным стал электролиз. Исходное вещество – расплав хлорида натрия либо едкого натра.
Физико-химические характеристики
Металлический натрий, сохраняемый в минеральном масле
Физические характеристики вещества:
- Режется ножом. По этому признаку его легко отличить от прочих металлов.
- Хорошо проводит тепло и ток. Это достоинство оценили промышленники.
- Свежесрезанная поверхность металла блестит.
- Тонкие пластины отсвечивают фиолетом.
- Под давлением серебристо-белый металл становится прозрачно-красным.
Более интересны химические свойства.
Это очень активный металл:
- На воздухе мгновенно окисляется.
- Вступает в реакцию с большинством веществ.
Взаимодействие вещества с водой подобно шоу. Кусочек натрия всплывает, нагревает воду, плавится. Наконец становится белым шариком, который хаотично плавает по водной поверхности.
| Свойства атома | |
|---|---|
| Название, символ, номер | На́трий / Natrium (Na), 11 |
| Атомная масса (молярная масса) | 22,98976928 ± 2,0E−8 а. е. м. (г/моль) |
| Электронная конфигурация | [Ne] 3s1, 1s22s22p63s1 |
| Радиус атома | 190 пм |
| Химические свойства | |
| Ковалентный радиус | 154 пм |
| Радиус иона | 97 (+1e) пм |
| Электроотрицательность | 0,93 (шкала Полинга) |
| Электродный потенциал | -2,71 В |
| Степени окисления | −1 (в алкалидах); 0; +1 (наиболее частая) |
| Энергия ионизации (первый электрон) | 495,6(5,14) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 0,971 г/см³ |
| Температура плавления | 370,96 К; 97,81 °C |
| Температура кипения | 1156,1 К; 882,95 °C |
| Уд. теплота плавления | 2,64 кДж/моль |
| Уд. теплота испарения | 97,9 кДж/моль |
| Молярная теплоёмкость | 28,23 Дж/(K·моль) |
| Молярный объём | 23,7 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая объёмноцентрированная |
| Параметры решётки | 4,2820 Å |
| Температура Дебая | 150 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 142,0 Вт/(м·К) |
| Номер CAS | 7440-23-5 |
Реакцию венчает фонтан водорода. Однако газ способен самопроизвольно загореться.
Присутствие натрия в образце обнаруживают по ярко-желтому цвету пламени.
Где используется
Человек использует натрий как чистый металл и соединения.
Промышленность
Главные потребители сырья – металлургия и химия. Здесь металл нашел применение как восстановитель.
Сферы использования, ассортимент продукции из металла:
- Качественный анализ органических веществ.
- Производство энергоемких аккумуляторов.
- Материал проводов, работающих под высоким напряжением.
- Теплоноситель для АЭС, других объектов (в сплаве с калием, цезием, рубидием).
- Основа ионных ракетных двигателей (в сплаве с калием и цезием).
- Наполнитель газоразрядных ламп для освещения больших пространств.
Металлурги с помощью соединений щелочного металла выделяют золото из руды, наносят золотое, серебряное гальванопокрытие. Обходчики – убирают растительность на железнодорожном полотне.
Другие сферы
Ученые задействуют изотопы натрия в исследованиях. С их помощью диагностируют и лечат лейкемию.
Самая известная «натриевая» формула – NaCl. Это хлорид натрия, или поваренная соль.
Вещество – один из первых консервантов и вкусовых приправ. Сегодня пищепром без него не обходится.
Речь о добавках:
- Глутамат натрия (Е621) – усилитель вкуса (особенно мясного).
- Бензоат (Е215) – консервант.
- Нитрит (Е250) – консервант.
- Цитрат (Е331) – эмульгатор, стабилизатор.
Плюс пищевая сода.
На рынке представлен ассортимент продукции из соединений натрия.
Цена определяется видом (руб./кг):
- Бихромат – 180-200.
- Сульфат – 17-25.
- Нитрит (технический) – 46-48.
Один из самых дорогих вольфрамосиликат – 7,4 тыс. руб. за кг.
Значение для человека
Натрий критично важен для жизнедеятельности человека.
Суточная потребность в микроэлементе для взрослых – до 510 мг, для детей до 18 лет – 500-900 мг, в зависимости от возраста.
Беременным требуется 500 мг. При физических, эмоциональных нагрузках, вызывающих обезвоживание, еще больше.
Чайная ложка содержит 2,3 г соли.
Питание
80% натрия человек получает из поваренной соли.
Другие источники вещества:
- Субпродукты, рыба, морепродукты (включая морскую капусту).
- Крупы – рис, гречка, перловка, овсянка, пшенка.
- «Борщевой набор» – морковь, томаты, капуста, свекла.
Металлом насыщены бобовые, куриные яйца, сельдерей, молочный ассортимент.
Биологические процессы
Натрий аккумулируется в межклеточной жидкости.
Задействован в следующих биологических процессах:
- Кислотно-щелочной баланс.
- Водно-солевой обмен.
- Выработка желудочного сока.
- Работа мышц, нервной системы.
- Регулирование кондиций крови.
В этом его почти всегда дополняет калий.
Симптомы дефицита/избытка вещества
О нехватке натрия организм сигнализирует повышенной потливостью.
Ее могут дополнять:
- Головокружение.
- Забывчивость.
- Утрата аппетита.
- Быстрая утомляемость.
- Судороги.
Возможны высыпания на коже, проблемы с ЖКТ (вздутие, тошнота, рвота, спазмы).
Избыток натрия проявляется отечностью, аллергией, неутолимой жаждой.
Предостережение
Опасен металлический натрий. На воздухе самопроизвольно воспламеняется. При контакте с водой, увлажненной поверхностью взрывается либо создает ожог.
Этими недостатками металла обусловлены условия хранения и правила работы.
Условия хранения вещества:
- Плотно закрываемая стеклянная тара.
- В ней вещество залито бензином, керосином, вазелиновым маслом.
- Тару держат в закрытом несгораемом коробе.
При работе с веществом соблюдается строгий алгоритм:
- Надеть защитные очки либо маску.
- Не брать вещество руками – только щипцами либо пинцетом. От кожной влаги оно взрывается либо оставляет сильный ожог.
- Нужное количество металла отрезать ножом на сухом стекле (не на столе).
- Остаток сразу возвратить обратно.
- С куском металла работать не откладывая.
- По окончании работы посуду и остатки материала залить крепким спиртом, затем «обезвредить» слабым раствором кислоты.
Остатки вещества нельзя выбрасывать в мусоропровод либо канализацию. В первом случае возникнет пожар, во втором – взрыв и разрушение водопровода.
Перед работой с натрием обязателен инструктаж по технике безопасности.
Это актуально для уроков химии в школе/вузе и любителей домашних химических опытов. Хотя домашние манипуляции с веществом не приветствуются.
Что такое металлический натрий
ГОСУДАРСТВЕННЫЙ СТАНДАРТ СОЮЗА ССР
НАТРИЙ МЕТАЛЛИЧЕСКИЙ ТЕХНИЧЕСКИЙ
Technical metallic sodium. Specifications
ОКП 21 1211 0100
Дата введения 1977-01-01
1. РАЗРАБОТАН И ВНЕСЕН Министерством химической промышленности СССР
Жукова Г.Г., Адаев Е.И., Карталова Г.Г., Денищенко В.Я., Фролов Н.С., Резниченко М.Ф.
2. УТВЕРЖДЕН В ВВЕДЕН В ДЕЙСТВИЕ Постановлением Государственного комитета стандартов Совета Министров СССР от 29.12.75 N 4080
4. ССЫЛОЧНЫЕ НОРМАТИВНО-ТЕХНИЧЕСКИЕ ДОКУМЕНТЫ
Обозначение НТД, на который дана ссылка
3.4.1; 3.5.1; 3.6.1; 3.7.1; 3.8.1
3.4.1; 3.6.1; 3.7.1; 3.8.1
3.4.1; 3.5.1; 3.6.1; 3.7.1
* Документ в информационных продуктах не содержится. За информацией о документе Вы можете обратиться в Службу поддержки пользователей. - Примечание изготовителя базы данных.
5. Постановлением Госстандарта СССР от 15.05.91 N 686 снято ограничение срока действия
Постановлением Государственного комитета стандартов Совета Министров СССР от 29 декабря 1975 года N 4080 срок введения установлен с 01.01.77
Настоящий стандарт распространяется на технический металлический натрий, предназначенный для химической, химико-фармацевтической, энергетической и других отраслей промышленности и экспорта.
Атомная масса (по международным атомным массам 1985 г.) - 22,99.
Требования настоящего стандарта являются обязательными.
(Измененная редакция, Изм. N 3).
1. ТЕХНИЧЕСКИЕ ТРЕБОВАНИЯ
1.1. Металлический натрий должен быть изготовлен в соответствии с требованиями настоящего стандарта по технологическому регламенту, утвержденному в установленном порядке.
1.2. По физико-химическим показателям металлический натрий должен соответствовать требованиям и нормам, указанным в таблице.
Слитки серебристо-белого цвета
2. Массовая доля щелочи в пересчете на натрий, %, не менее
3. Массовая доля калия, %, не более
4. Массовая доля железа, %, не более
5. Массовая доля кальция, %, не более
6. Содержание тяжелых металлов, осаждаемых сероводородом
Выдерживает испытание по п.3.8
1. В металлическом натрии, получаемом электролизом едкого натра, массовую долю кальция не нормируют.
2. В металлическом натрии на экспорт массовая доля кальция должна быть не более 0,1%.
(Измененная редакция, Изм. N 2).
1а. ТРЕБОВАНИЯ БЕЗОПАСНОСТИ
1a.1. Металлический натрий - пожаровзрывоопасен. При работе с металлическим натрием необходимо соблюдать правила техники безопасности, принятые при работе со щелочными металлами.
При взаимодействии металлического натрия с водой или влагой воздуха выделяется водород - легковоспламеняющийся газ, образующий с воздухом взрывчатую смесь.
Взаимодействие металлического натрия с водой, растворами кислот, галоидзамещенными органическими соединениями сопровождается воспламенением или взрывом.
При нагревании на воздухе до температуры выше 270°С металлический натрий самовоспламеняется, при горении металлического натрия образуется аэрозоль соединений натрия.
1а.2. Металлический натрий в твердом состоянии не летуч и не представляет опасности ингаляционного отравления.
При попадании на влажную кожу, слизистые оболочки металлический натрий вызывает ожоги.
Попадание металлического натрия в глаза может привести к потере зрения.
1а.3. Производственные помещения, в которых проводят работы с металлическим натрием, должны быть просторными, чистыми, сухими, оборудованными приточно-вытяжной вентиляцией и средствами пожаротушения. В помещении на видном месте должен быть вывешен знак со смысловым значением "Опасность взрыва! Осторожно" по ГОСТ 12.4.026.
Уборку производственных помещений производят сухим способом.
1а.4. Работающие с натрием должны быть обеспечены средствами индивидуальной защиты: специальной одеждой и обувью, капюшоном, резиновыми перчатками, респиратором типа "Лепесток" по ГОСТ 12.4.028, закрытыми защитными очками по ГОСТ 12.4.013 и противогазом марки БКФ по ГОСТ 12.4.121.
НАТРИЙ — соль жизни
Соединения металлов натрия-калия контролируют солевой баланс в наших организмах. Нарушения этого баланса опасно для жизни. В составе крови соединения этих металлов создают своеобразный электролит, необходимый для работы любой клетки организма.
От Библии до наших дней
История героя статьи тянется с библейских времен. Именно в Библии упомянуто вещество, которым пользовались для мытья, отбеливания хлопковых тканей. В переводе слово νίτρον (нитрон) означает мыло или щелок.

Природной содой или щелоком из золы многие века люди пользовались для домашних нужд.
Свойства натрия

Натрий (natrium) относится к щелочным металлам, в таблице Менделеева имеет атомный № 11.
- Легко режется ножом.
- Чистый натрий имеет белый серебристый цвет; на воздухе быстро покрывается слоем оксида Na2O.
- Структура кристаллической решетки объемноцентрированная, кубическая.
- Natrium легче воды; если бросить кусочек в воду, он будет плавать на ее поверхности.
Металл настолько активный, что хранят его в минеральном масле или в керосине, без доступа воздуха.
- Натрий реагирует с разбавленными кислотами, как рядовой металл.
- В реакции с концентрированными кислотами образуются продукты восстановления.
- Бурная реакция с водой идет с выделением водорода, поэтому металл загорается или взрывается.
- Как все щелочные металлы, активно реагирует со многими неметаллами.
Известен один стабильный изотоп — 23-Na.
| Свойства атома | |
|---|---|
| Название, символ, номер | На́трий / Natrium (Na), 11 |
| Атомная масса (молярная масса) | 22,98976928 ± 0,00000002 а.е.м.[1] а. е. м. (г/моль) |
| Электронная конфигурация | [Ne] 3s1, 1s22s22p63s1 |
| Радиус атома | 190 пм |
| Химические свойства | |
| Ковалентный радиус | 154 пм |
| Радиус иона | 97 (+1e) пм |
| Электроотрицательность | 0,93 (шкала Полинга) |
| Электродный потенциал | -2,71 В |
| Степени окисления | −1 (в алкалидах)[2]; 0; +1 (наиболее частая) |
| Энергия ионизации (первый электрон) | 495,6(5,14) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 0,971 г/см³ |
| Температура плавления | 370,96 К; 97,81 °C |
| Температура кипения | 1156,1 К; 882,95 °C |
| Уд. теплота плавления | 2,64 кДж/моль |
| Уд. теплота испарения | 97,9 кДж/моль |
| Молярная теплоёмкость | 28,23[3] Дж/(K·моль) |
| Молярный объём | 23,7 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая объёмноцентрированная |
| Параметры решётки | 4,2820 Å |
| Температура Дебая | 150 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 142,0 Вт/(м·К) |
| Номер CAS | 7440-23-5 |
Познавательно: у космонавтов в коже накапливается связанный белками Na. Тело так реагирует на чуждые условия существования. Почему соединение выводится из клеток — ученые пока не поняли.
Минералы, месторождения
В природе встречаются минералы:
- мирабилит (глауберова соль);
- галит (каменная соль);
- бура (формула Na2В4О7 • 10Н2О);
- криолит.

Месторождений металлического натрия на планете нет. В любом месте (даже в пустынях) найдется вода, с которой металл мгновенно прореагирует.
Добыча и переработка
Для производства натрия ведется добыча минералов во многих странах:

Промышленное получение натрия по способу Девилля, распространённое в 19 веке. AC — железная трубка со смесью соды, угля и мела; B — холодильник Донни и Мареска; R — приёмник с нефтью
Основной способ промышленного получения натрия — электролиз NaOH или NaCl.
Возможно получение с помощью термического разложения NaN3.

Качественное определение натрия с помощью пламени — ярко-жёлтый цвет эмиссионного спектра «D-линии натрия», спектральный дублет 588,9950 и 589,5924 нм
Плюсы и минусы
Достоинства соединений натрия не перечислить. Самое главное — без него невозможна биологическая жизнь на планете.
К недостаткам можно отнести дороговизну натриевых реакторов (необходимость промежуточного контора, усиленные системы безопасности). Реакторы на БН дороже, чем ВВЭР (водо-водяные).
Натрий вокруг нас
Применение металла и его соединений чрезвычайно широко:
- Металлический Na работает теплоносителем в реакторах на быстрых нейтронах (БН) и в ионных ракетных двигателях.

Познавательно: поваренной солью (NaCl) пользуются все жители планеты (даже животные с удовольствием приходят на солончаки полакомиться солью.
Купить металл
Цена металлического Natrium за килограмм у разных производителей колеблется от 900 до 1500 руб/кг.

Мне 42 года и я специалист в области минералогии. Здесь на сайте я делюсь информацией про камни и их свойства — задавайте вопросы и пишите комментарии!
Читайте также:
