Что представляет собой металлическая кристаллическая решетка

У каждого вещества есть набор физических свойств. Например, соли легко растворяются в воде и проводят электрический ток, а металлы имеют характерный блеск и ковкость. Такие характеристики зависят от строения вещества — от его кристаллической решетки. В этом материале мы расскажем о видах кристаллических решеток и о том, какие свойства придает веществу каждая из них.
О чем эта статья:
11 класс, ЕГЭ/ОГЭ
Что такое кристаллическая решетка
Как известно, все вещества состоят из частиц — атомов, которые могут располагаться хаотично или в определенном порядке. У аморфных веществ частицы расположены беспорядочно, а у кристаллических они образуют определенную структуру. Эта структура называется кристаллической решеткой. Она определяет такие характеристики вещества, как твердость, хрупкость, температура кипения и/или плавления, пластичность, растворимость, электропроводность и т. д.
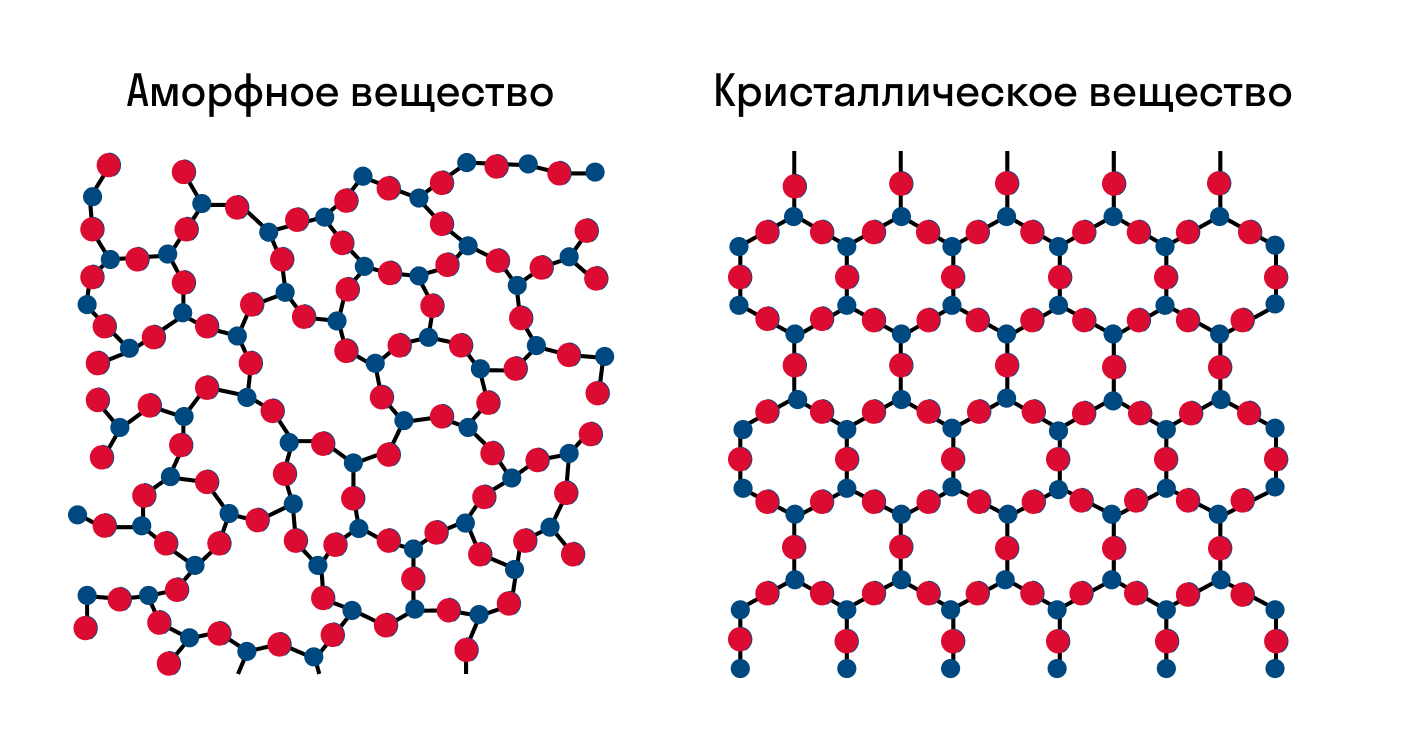
Кристаллическая решетка — это внутренняя структура кристалла, порядок взаимного расположения атомов, ионов или молекул. Точки, в которых находятся эти частицы, называются узлами решетки.
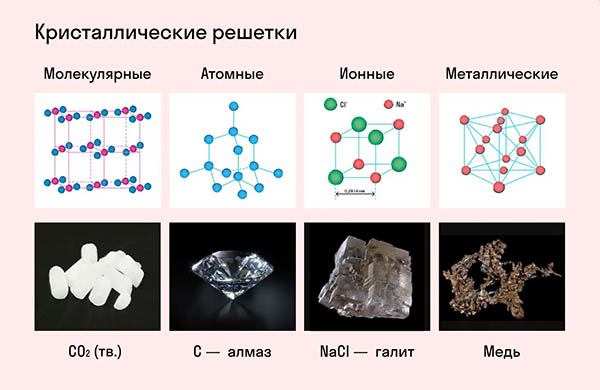
Частицы удерживаются на своих местах благодаря химическим связям между ними. В зависимости от того, какой вид связи удерживает атомы или ионы данного вещества, в химии выделяют основные типы кристаллических решеток:
атомная (ковалентные связи),
молекулярная (ковалентные связи и притяжение между молекулами),
металлическая (металлические связи),
ионная (ионные связи).
Не путайте эти два понятия — кристаллическая решетка и химическая связь. Тип решетки говорит о том, как расположены атомы/ионы в молекуле вещества, а тип связи — по какому принципу они между собой взаимодействуют.
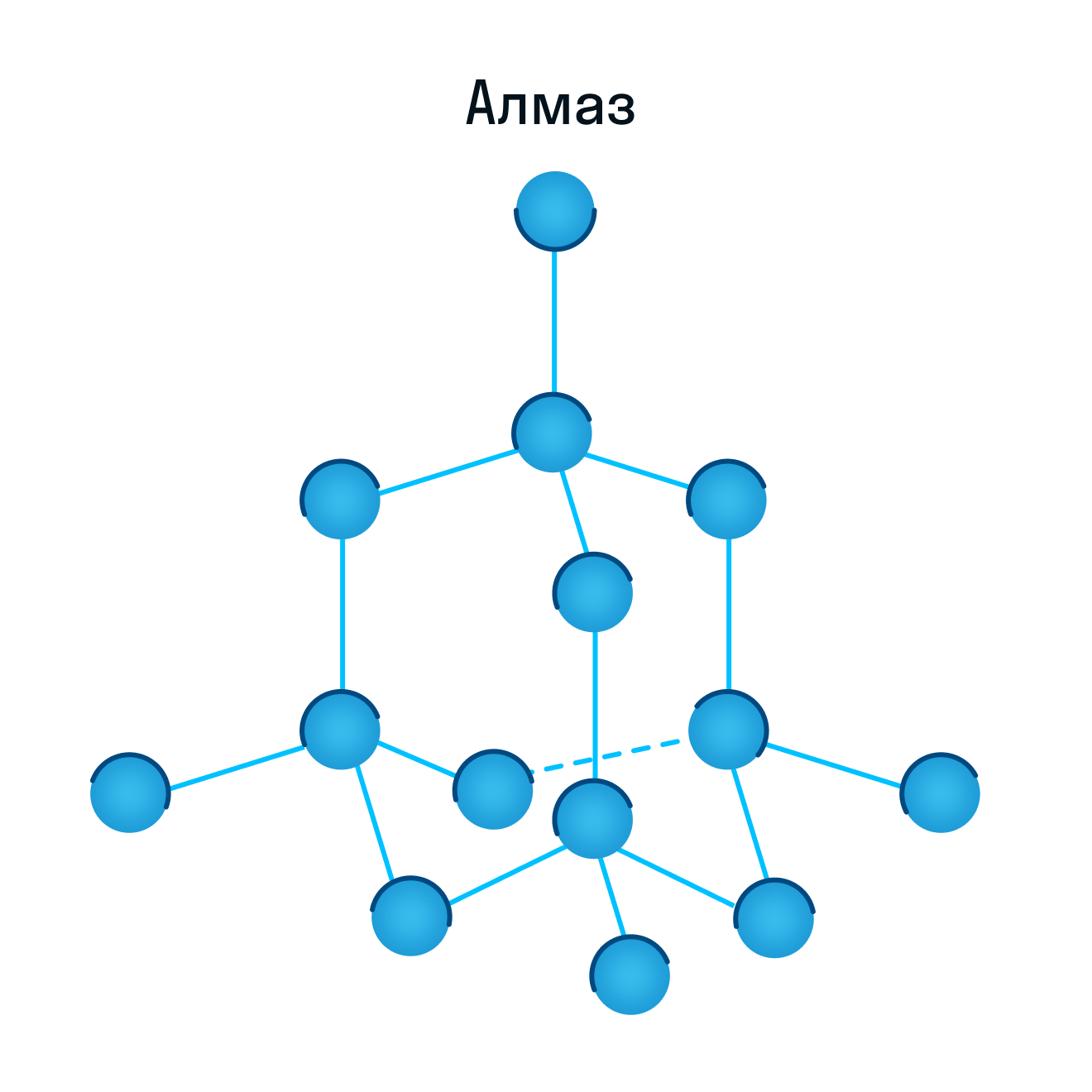
Атомная кристаллическая решетка
Согласно своему названию, атомная кристаллическая решетка — это структура, в узлах которой расположены атомы. Они взаимодействуют с помощью ковалентных связей, то есть один атом отдает другому свободный электрон или же электроны из разных атомов образуют общую пару. В кристаллах с атомной решеткой частицы прочно связаны, что обуславливает ряд физических характеристик.
Свойства веществ с атомной решеткой:
неспособность к растворению в воде,
высокая температура кипения и плавления.
К примеру, атомную кристаллическую решетку имеет алмаз — самый твердый минерал в мире.
Другие примеры: германий Ge, кремний Si, нитрид бора BN, карборунд SiC.
Если нужно рассказать о свойствах веществ с атомной кристаллической решеткой, достаточно вспомнить песок и перечислить его характеристики.
Молекулярная кристаллическая решетка
Как и в предыдущей группе, в этой находятся вещества с ковалентными связями между атомами. Но физические характеристики этих веществ совершенно иные — они легко плавятся, превращаются в жидкость, растворяются в воде. Почему так происходит? Все дело в том, что здесь кристаллы строятся не из атомов, а из молекул.
Молекулярная кристаллическая решетка — это структура, в узлах которой находятся не атомы, а молекулы.
Внутри молекул атомы имеют прочные ковалентные связи, но сами молекулы связаны между собой слабо. Поэтому кристаллы таких веществ непрочные и легко распадаются.
Молекулярная кристаллическая решетка характерна для воды. При комнатной температуре это жидкость, но стоит нагреть ее до температуры кипения (которая сравнительно низка), как она тут же начинает превращаться в пар, т. е. переходит в газообразное состояние.
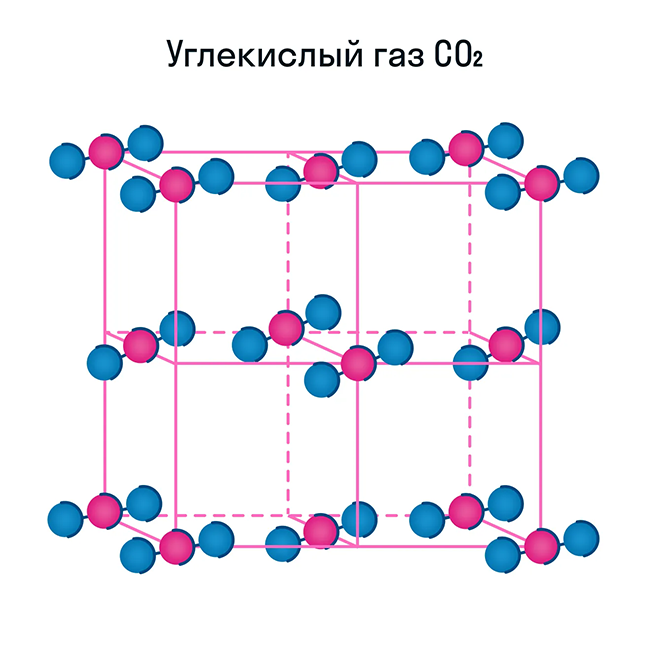
Некоторые молекулярные вещества — например, сухой лед CO2, способны преобразоваться в газ сразу из твердого состояния, минуя жидкое (данный процесс называется возгонкой).
Свойства молекулярных веществ:
у некоторых — наличие запаха.
Помимо воды к веществам с молекулярной кристаллической решеткой относятся аммиак NH3, гелий He, радон Rn, йод I, азот N2 и другие. Все благородные газы — молекулярные вещества. Также к этой группе принадлежит и большинство органических соединений (например, сахар).
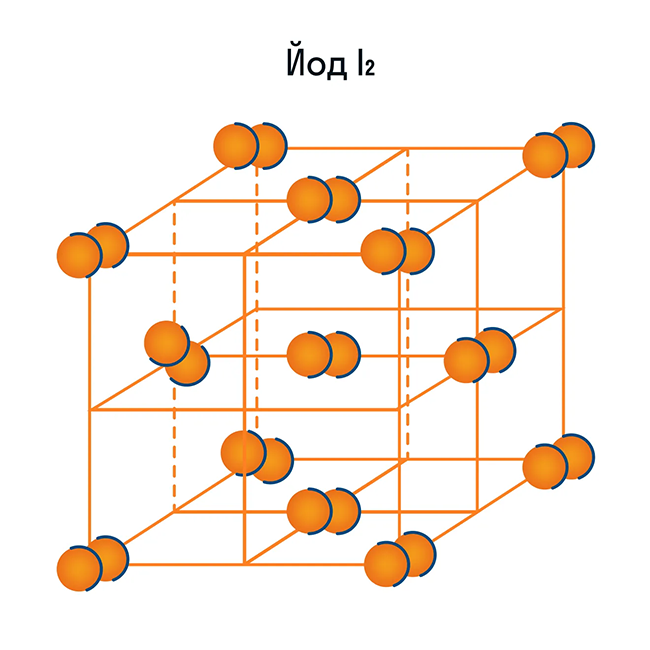
Ионная кристаллическая решетка
Как известно, при ионной химической связи один атом отдает другому ионы и приобретает положительный заряд, в то время как принимающий атом заряжается отрицательно. В итоге появляются разноименно заряженные ионы, из которых и состоит структура кристалла.
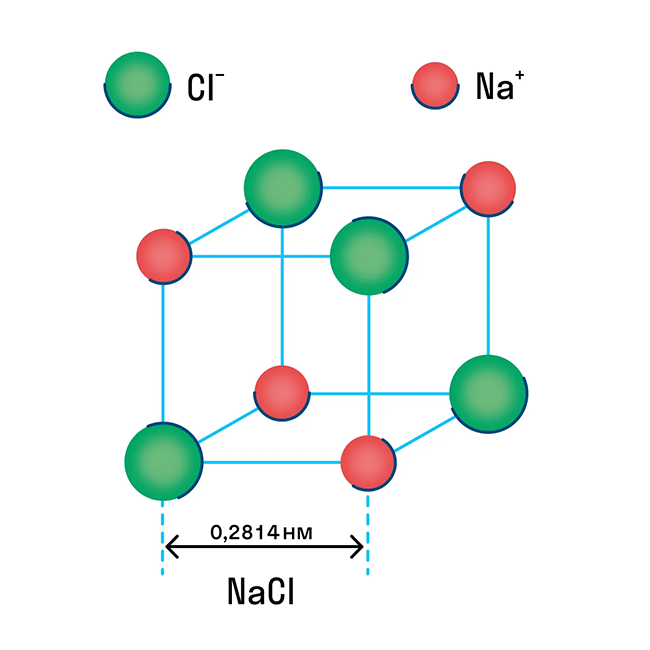
Ионная решетка — это кристаллическая структура, в узловых точках которой находятся ионы, связанные взаимным притяжением.
Ионную кристаллическую решетку имеют практически все соли, типичным представителем можно считать поваренную соль NaCl. О ней стоит вспомнить, если нужно перечислить физические характеристики этой группы. Также ионную решетку имеют щелочи и оксиды активных металлов.
Свойства веществ с ионной структурой:
способность растворяться в воде.
Примеры веществ с ионной кристаллической решеткой: оксид кальция CaO, оксид магния MgO, хлорид аммония NH4Cl, хлорид магния MgCl2, оксид лития Li2O и другие.
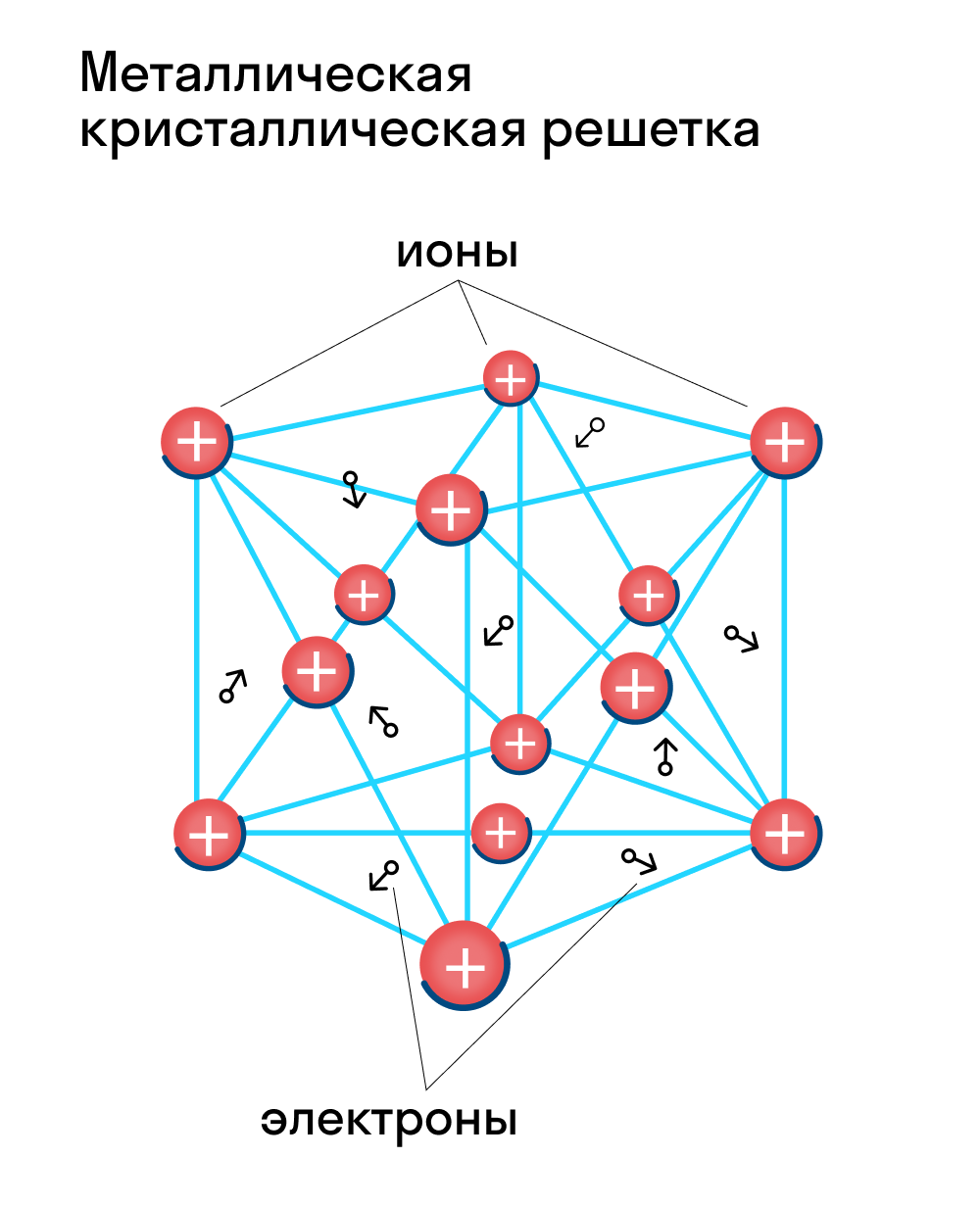
Металлическая кристаллическая решетка
Для начала вспомним, как проходит металлическая химическая связь. В молекуле металла свободные отрицательно заряженные электроны перемещаются от одного иона к другому и соединяются с некоторыми из них, а после отрываются и мигрируют дальше. В результате получается кристалл, в котором ионы превращаются в атомы и наоборот.
Металлическая кристаллическая решетка — это структура, которая состоит из ионов и атомов металла, а между ними свободно передвигаются электроны. Как несложно догадаться, она характерна лишь для металлов и сплавов.
Свободные электроны, мигрирующие между узлами решетки, образуют электронное облако, которое под воздействием электротока приходит в направленное движение. Это объясняет такое свойство металлов, как электрическая проводимость.
В химии типичным примером вещества, которое имеет металлическую кристаллическую решетку, считается медь. Она очень ковкая, пластичная, имеет высокую тепло- и электропроводность. Впрочем, все металлы ярко демонстрируют эти характеристики, поэтому назвать физические свойства данной группы несложно.
Свойства веществ с металлической кристаллической решеткой:
При этом температура плавления веществ может существенно различаться. Например, у ртути это −38,9°С, а у бериллия целых +1287°С.
Подведем итог: о характеристиках разных типов кристаллических решеток расскажет таблица.
15 главных свойств металлической кристаллической решетки
Что представляет собой металлическая кристаллическая решетка: промышленное подразделение металлов + их атомно-кристаллическое строение + понятие, классификация и свойства металлической кристаллической решетки + особенности решетки у сплавов + разбор термина в контексте сварочного процесса

Взглянув вокруг себя, вы наверняка заметите парочку вещиц с содержанием металлов. Из-за повсеместного использования данных элементов, знать базовую информацию по ним обязан каждый.
В сегодняшней статье я расскажу, что такое металлическая кристаллическая решетка + предоставлю исчерпывающую информацию в отношении кристаллической классификации металлических веществ вообще.
Понятие кристаллической решетки + классификация
Перед углублением в сложные темы по химии и физике школьной программы, я хотел бы выдать вам исчерпывающую информацию в отношении терминологии и классификации металлических элементов сквозь призму промышленности.
1) Промышленное подразделение металлов + их атомно-кристаллическое строение
Начало эры металлов началось в 20 веке. Медь, железо, серебро и прочие элементы стали неотъемлемой частью быта и промышленности населения большинства развитых стран. Базовые характеристики металлов, такие как упругость, пластичность и прочность, определяются их атомным + кристаллическим строением.

Знание этих свойств позволит умело оперировать свойствами и применять их для получения эталонных комбинаций элементов. В индустриальном плане металлы подразделяют на 5 больших коопераций . Детальнее по каждой из них я расскажу в отдельной таблице.
| Группа | Описание | Распространение (из 5 ★) |
|---|---|---|
| Черные | В категории расположилось большинство распространенных металлов планеты, такие как хром и железо. Сюда же включены и сплавы из комбинаций черных металлов по типу ферросплавов. Мировое использование черных металлов составляет 88% всей мировой потребности. | ★★★★★ |
| Цветные (легкие) | Магний, титан и прочие элементы с низким показателем плотности. По добыче дороже черных + встречаются в природе по залежам реже. Применяются в точном строительстве, и для деталей, где их применение финансово обосновано. | ★★★★ |
| Цветные (тяжелые) | Отличительная черта – повышенный удельный вес + превосходная проводимость электрического тока. Применяются в качестве реакционных катализаторов при производстве плат и прочей электронике. | ★★★ |
| Благородные | Защита от коррозии и малый удельный вес. В современном обществе, приоритетно, используются как инструмент для накопления финансов странами и украшения. Яркие представители –платина и золото. | ★★ |
| Редкоземельные | Итрий, лантан и прочие химические элементы редкоземельного типа из группы металла. Имеют весомый удельный вес и очень активны химически, что обуславливает их использование в приборостроении и смежных направлениях. | ★★★ |
Выделяют еще и щелочные металлы, но обычно их предпочитают относить в одну группу с редкоземельными, ибо по базовым характеристикам они весьма похожи между собой. Натрий, литий и прочие элементы группы при химических реакциях с водой образуют щелочи – отсюда и название группы. Используются при производстве всяческих моющих.
Обратите внимание: атомно-кристаллическое строение металлов напрямую влияет на их физические и химические свойства. Особенно важную роль в промышленности отыгрывает параметр электропроводимости.
Кристаллическое строение характерно металлическим элементам, которые пребывают в твердой фазе состояния. Атомы самостоятельно располагаются в четкой (иногда расплывчатой) геометрической фигуре объемного типа. Получаемые соединения и местоположения атомов принято называть кристаллической решеткой. С научной точки зрения термин подается практически также.

Кристаллическая решетка (КР) – сетчатый геометрический образ для исследований структуры кристаллов. Состоит из узлов, в которых могут располагаться молекулы/ионы/атомы, и соединений этих элементов.
Какие параметры используют при исследовании:
- ЕКР;
- константа КР;
- плотность упаковки;
- значение координации.
Металлическая кристаллическая решетка – это совокупность из элементарных ячеек, определяющая симметричные свойства всей структуры в целом. Признаки по структурным частям кристаллической решетки описываются за счет 3 правил Бреве.
2) Классификация кристаллических решеток
Распределение по типам кристаллических решеток производится на основании природного происхождения частиц + типам химических связей между базовыми элементами структуры. Беря в учет оговоренное, можно выделить 4 типа КР. Детальнее по 3-м из них предоставлю информацию в отдельной таблице, а что собой представляет металлическая кристаллическая решетка разберем отдельным пунктом статьи чуть ниже.
| Тип КР | Особенности |
|---|---|
| Ионная | По названию понятно, что узловыми элементами структуры являются ионы. Связываются между собой ячейки за счет электростатики, что придает ИКР электронейтральность. Отсутствие насыщенности с направленностью характеризует решетку крупными числами координации. По физике - - большая твердость, тугоплавкость и нелетучесть. Также ионные соединения характеризуются повышенной ломкостью. Даже мелкие сдвиги приводят к разрушению огромной площади КР. |
| Атомная | Ячейки КР соединяются между собой за счет связи ковалентного типа. Здесь идет подразделение на 3 категории в зависимости от структуры – каркас (алмаз), слоистость (графит) и цепочка (асбест). К базовым физическим свойствам атомных кристаллических решеток отнесу высокий запас твердости, тугоплавкость, нерастворимость в воде и отсутствие летучести. В своем большинстве, АКР характерная для сложных веществ по типу оксида алюминия или оксида кремния. |
| Молекулярная | По узлам структуры располагаются молекулы, а их соединение образуется за счет все тех же сил молекулярного типа. Их часто называют водородными или вандерваальсовскими связями. Простейшими примером веществ с молекулярной кристаллической решёткой является лед и йод. |
Кристаллическая структура характерна не только для чистых веществ, но и разнообразных соединений неорганики. Особенно это актуально для металлических соединений по типу сплавов. Учитывая распространение металлов в промышленности и бытовой сфере, разбору понятия металлической кристаллической решетки нужны уделить особое внимание. Чем я дальше и займусь.
Что такое металлическая кристаллическая решетка: обобщенная терминология и свойства
Если ранее описанные КР имели по узлам только один компонент, то металлическая кристаллическая решетка состоит из структур множественного повторения, в точках соединения которых имеется 2 типа ячеек.

Первые – ионы с положительным зарядом, а вторые – нейтральные атомы. Между узлами КР свободно передвигаются относительно свободные электроны. Со схемой металлической решетки можете ознакомиться на рисунке выше.
1) Особенности строения и классификация металлической кристаллической решетки
В зависимости от межатомного расстояния, кристаллические соединения в сплавах и чистых структурах металлов могут разбиваться на 2 подвида – изотропные и анизотропные. В первом случае расстояние между ионами и атомами в узлах структуры равно. Колебания могут составлять от 0.1% до 3%, не более. Если расстояние между узлами кристаллической решетки вдоль и вверх различается, получаемый кристалл относят к анизотропному. Четкое представление об параметрах таких КР можно получить только после изучения направления.
Важно: на практике практически нереально встретить металлы либо их сплавы, которые будут располагать четкой однородной структурой. В 95%+ случаев, металлический элемент из множества кристаллов имеет разнобойной кристаллической решетке. По данной причине была создана еще одна категория в кристаллическом строении, именуемая квазиизотропная.
Второй параметр в металлических кристаллических решетках, который дал толчок к вводу еще одной классификации, – это межатомное расстояние близлежащих элементов. Здесь используется обособленная единица измерения — ангстрем. Среднее значение для различных металлов в чистом виде составляет порядка 3-7 ангстрем.

Классификация КР по типу:
- Куб. Решетка имеет правильную форму с объемным центрированием. Число содержащихся узлов соединения – 9. Пример металла с кубической кристаллической решеткой является железо.
- Куб с центрированными гранями. Здесь уже число узлов соединения увеличено до четырнадцати. Гранецентрированная КР имеется у золота, свинца и прочих цветных + драгоценных металлах.
- Гексагональ. Кристаллическая решетка содержит уже целых 17 узлов с крайне плотным размещением друг к другу. Актуальна такая геометрия цинку, магнию и так далее.
Особенно поражает железо, ведь при нагревании выше температуры в 920 градусов по Цельсию, его кристаллическая решетка преобразуется из обычной кубической в кубическую с центрированными гранями.
2) Свойства металлической кристаллической решетки
Свойства металлов напрямую зависят от кристаллической структуры, а это значит, что большинство характеристик элементов равны параметрам КР. Как и в других направлениях, свойства металлической кристаллической решетки квалифицируются на 2 категории – физические и химические.
К общим физическим свойствам металлов я отнесу:
- ковкость;
- пластичность;
- тягучесть;
- характерный металлический отблеск;
- теплопроводимость;
- электропроводимость.
Отмечу, что физические свойства для различных чистых элементов в металлах могут иметь большую разницу. К примеру, ряд «Ag Cu Au Al Mg Zn Fe РЬ Hg» имеет меньшее значение проводимости тепла и тока. Сюда же отнесу разделение на цветные и черные металлы, а также классификацию в зависимости от плотности (легкие и тяжелые), твердости (мягкие и твердые) и температуры плавления (легкоплавкие и тугоплавкие).
К общим химических свойствам металлов отнесу:
- являются восстановителями;
- взаимодействие с кислородом и образование в результате оксидов;
- взаимодействие с галогенами;
- активные металлы могут вступать в реакцию с водородом;
- получение сульфидов при химических реакциях с серой;
- часть элементов среди металлов могут сотрудничать с азотом, выделяя нитриды;
- получение карбидов при контакте с углеродом;
- фосфиды – результат связей с фосфором;
- получение интерметаллических соединений за счет взаимодействия между металлическими компонентами.
Особенно интересным химическим взаимодействием я считаю соитие металлов при воздействии температур. В процессе нагрева элементы растворяются друг в друге, и, как результат, мы получаем металлический сплав. О них я далее также скажу пару слов.
3) Металлическая кристаллическая решетка в сплавах
Сплавом считается соединение сразу нескольких химических элементов. В большинстве случаев – это металлы, но нельзя сбрасывать со счетов и соединения, в которых имеются вкрапления неметаллов. Простейший пример сплава металла и неметалла, — это углерод.
Обратите внимание: если вкрапливаемый элемент в сплав приносит ему практическую пользу (например, улучшает коррозийную стойкость), такую присадку называют легирующей, в обратном случае получаем вредную примесь.

В металлургии имеется такое понятие как механическая смесь – это разновидность сплава, у которого кристаллические решетки компонентов не способны взаимно раствориться. Получаемое соединение мало используется в металлургии, но как явление все же существует.
Качественная взаимосвязь компонентов характерна для:
- твердых растворов. Когда атомы элемента-помощника внедряются внутрь кристаллической решетки базового компонента соединения;
- химические сплавы. Наиболее качественные метод соединения металлов. Результатом становится новая кристаллическая решетка, образованная из молекул обоих компонентов в более-менее равной мере.
В зависимости от долевого вкрапления легирующих добавок, физика и химия поведения сплавов может значительно отличаться друг от друга. Особенно чувствительны в этом плане компоновки из металлов и неметаллов.

Конечный этап процесса химического соединения металлических элементов называют первичной кристаллизацией. После нагрева элемента до нужной температуры (температура плавления), наступает этап смешивания и последующее остывание. На последней стадии происходит образование центральных элементов кристаллизации, вокруг которых и собирается полноценная кристаллическая решетка сплава из повторяющихся ячеек центра.
Центральными элементами могут быть:
- ячейки вдоль каемки литейного оборудования, где остывание происходит быстрее всего;
- неметаллические элементы, попавшие в сплав;
- легирующие элементы с высоким запасом тугоплавкости.
Рост кристаллов в 90% случаев протекает вдоль температурного градиента. Наткнувшись на препятствие, структура приобретает древовидный вид. При стыке двух таких элементов, происходит образование зерен, из которых и образуется тело поликристаллического типа. Отдельные кристаллы, которые встретили препятствие на поздних стадиях своего роста, могут вырастать до 8 000 – 11 000 микрон. Их пространственное положение не имеет четкого направления, а подается вразброс. Вся совокупность мелких + крупных зерен и составляет новое образование, именуемое сплавом.
Разбор терминологии и свойств по металлической кристаллической решетке:
Металлическая кристаллическая решетка в контексте сварки
Фактически, сварочный процесс — это ручное производство сплава, цель которого соединить независимое элементы в единое целое. Задача не из простых, особенно если приходится работать с разными типами металлов, у которых слишком большой разрыв по температуре плавления.
Проблемы возникают на этапе остывания сварочного шва. Думаю, с явлением возникновение трещин знаком каждый сварщик. Основа данного явления кроется как раз в свойствах металлической решетки металла. О классификации дефектов детальнее в таблице ниже.
| Дефект | Описание |
|---|---|
| Точечный | Изменения в структуре кристаллической решетки, которые по размерам соизмеримы с атомом. Типичными точечными дефектами является безатомные узлы, элементы вне узлов КР и замещаемые элементы неметаллов, которые становятся на место основного атома. |
| Линейный | Основная проблематика заключается в одном измерении, когда как остальные два остаются практически неизменными. Подобные дефекты принято назвать дислокационными. |
| Поверхностные | Здесь проблема уже состоит на 90% в двух измерениях. Третье измерение не затрагивается вовсе, либо проблематика является незначительной (менее 5 размеров атомов). |
| Объемные | Очевидные для сварщика проблемы – поры, трещины и прочие повреждения поверхности свариваемой области. |
Полностью избавиться от дефектов нереально физически даже самому опытному мастеру. Единственное, что может сделать сварщик – это придерживаться технологии + обращать внимание на свойства свариваемых металлов.
На этом сегодня все. Надеюсь, инфа по металлической кристаллической решетке вам пригодилась. Удачи и крепкого здоровья!
Кристаллические решетки
Кристаллической решеткой называют пространственное расположение атомов или ионов в кристалле. Точки кристаллической решетки, в которых расположены атомы или ионы, называют узлами кристаллической решетки.
Кристаллические решетки подразделяют на молекулярные, атомные, ионные и металлические.
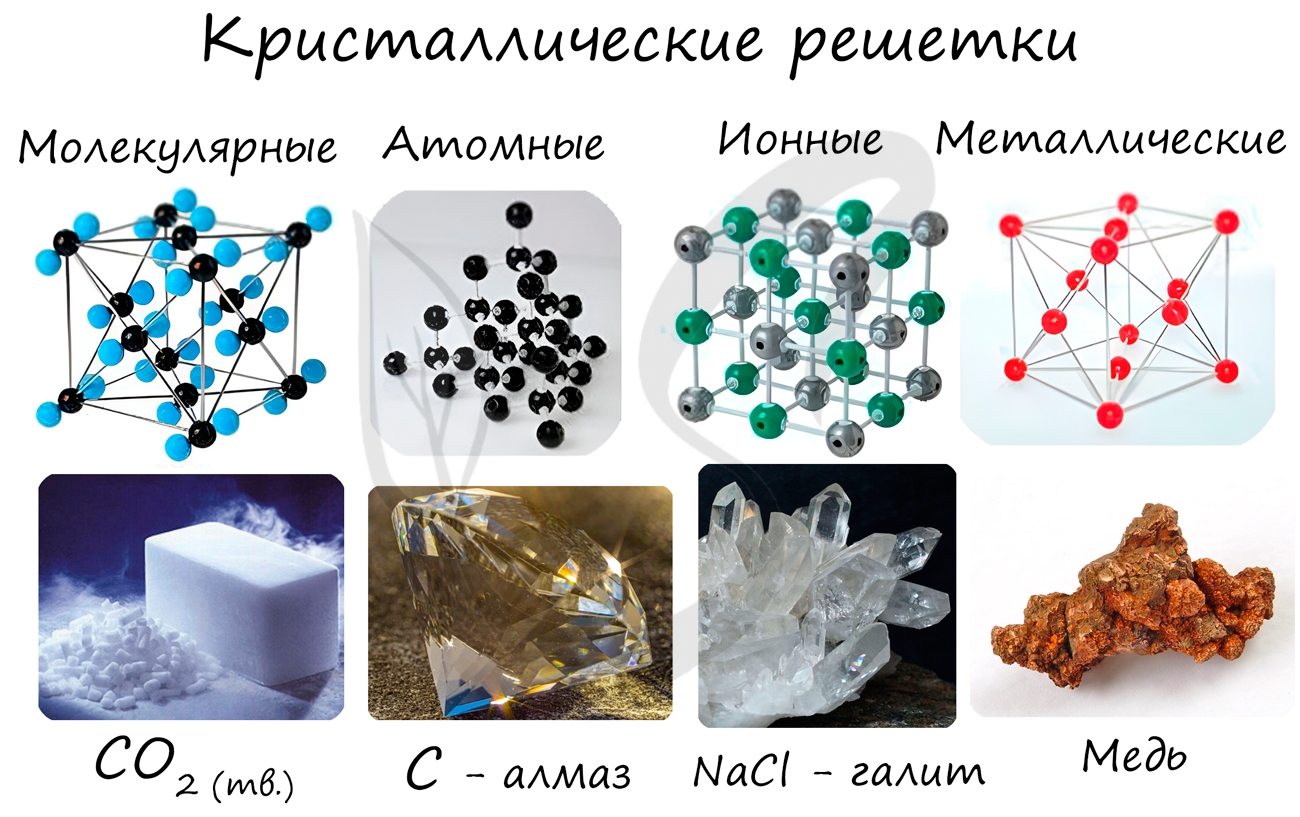
Очень важно не перепутать вид химической связи и кристаллической решетки. Помните, что кристаллические решетки отражают пространственное расположение атомов.
Молекулярная кристаллическая решетка
В узлах молекулярной решетки расположены молекулы. При обычных условиях молекулярную решетку имеют большинство газов и жидкостей. Связи чаще всего ковалентные полярные или неполярные.
Классическим примером вещества с молекулярной решеткой является вода, так что ассоциируйте свойства этих веществ с водой. Вещества с молекулярной решеткой непрочные, имеют небольшую твердость, летучие, легкоплавкие, способны к возгонке, для них характерны небольшие температуры кипения.
Примеры: NH3, H2O, Cl2, CO2, N2, Br2, H2, I2. Особо хочется отметить белый фосфор, ромбическую, пластическую и моноклинную серу, фуллерен. Эти аллотропные модификации мы подробно изучили в статье, посвященной классификации веществ.
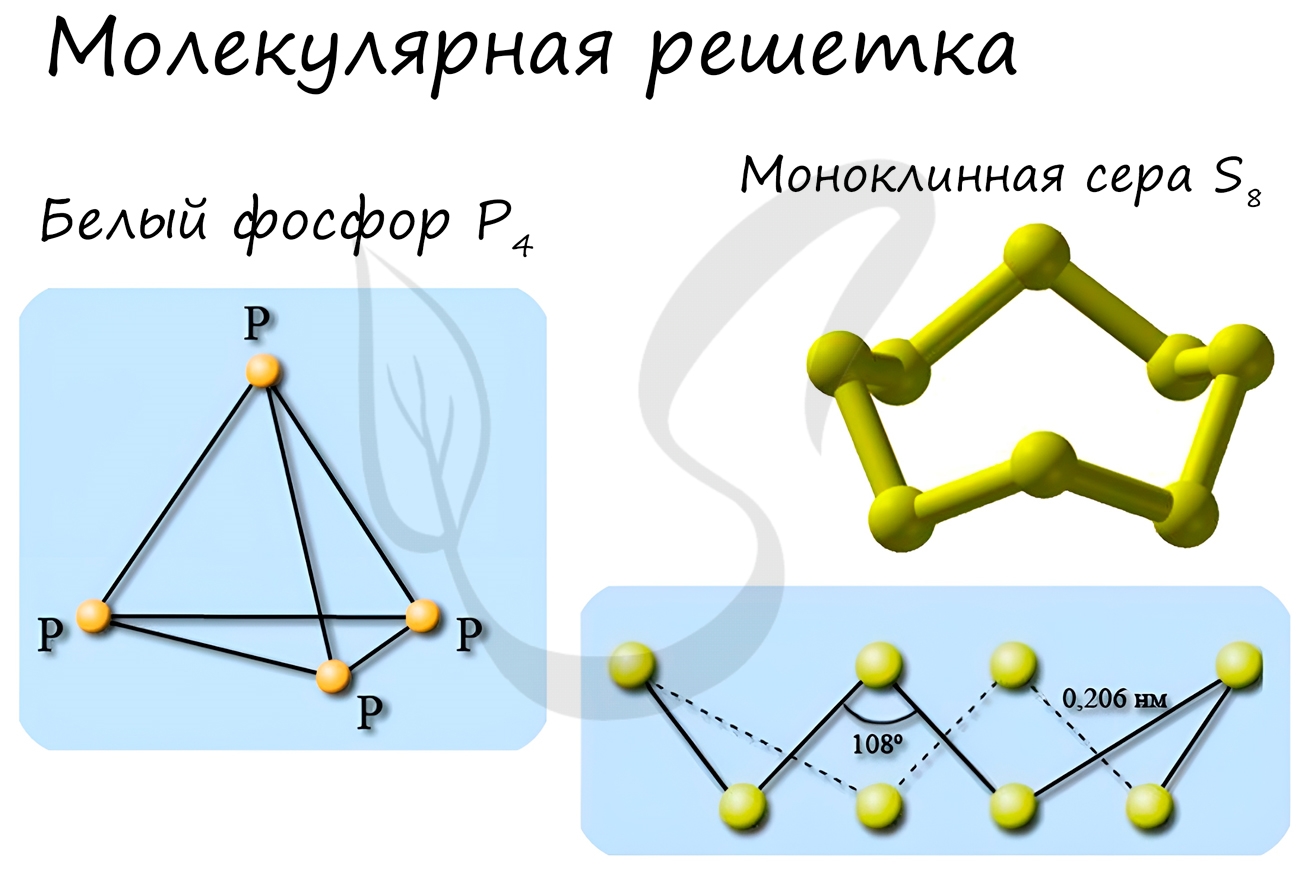
Ионная кристаллическая решетка
В узлах ионной решетки находятся атомы, связанные ионной связью. Этот тип решетки характерен для веществ, обладающих ионной связь: соли, оксиды и гидроксиды металлов.
Ассоциируйте этот ряд веществ с поваренной солью - NaCl. Веществе с ионной решеткой имеют высокие температуры плавления и кипения, легко растворимы в воде, хрупкие, твердые, их растворы и расплавы проводят электрический ток.

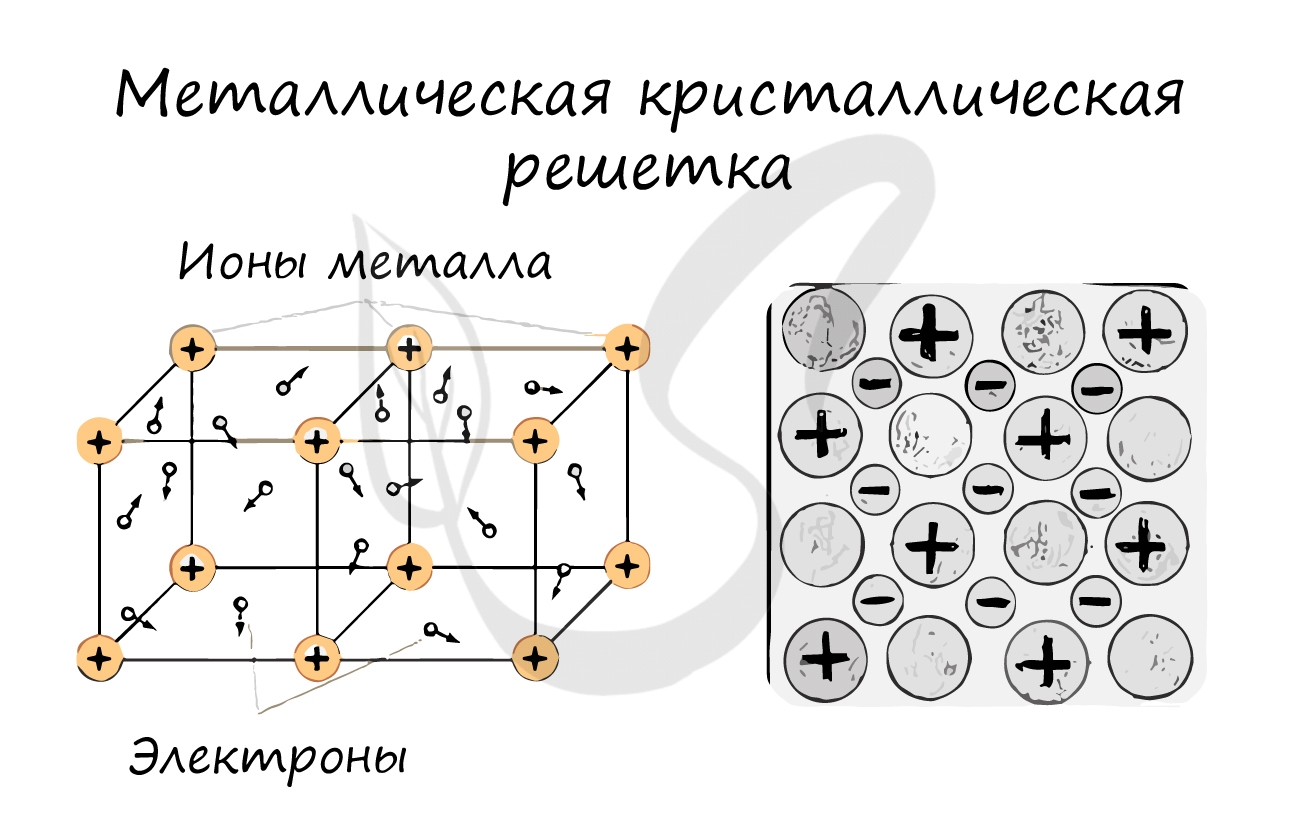
Металлическая кристаллическая решетка
В узлах металлической решетки находятся атомы металла. Этот тип решетки характерен для веществ, образованных металлической связью.
Ассоциируйте свойства этих веществ с медью. Они обладают характерным металлическим блеском, ковкие и пластичные, хорошо проводят электрический ток и тепло, имеют высокие температуры плавления и кипения.
Примеры: Cu, Fe, Zn, Al, Cr, Mn.
Атомная кристаллическая решетка
В узлах атомной решетки находятся атомы, связанные ковалентной полярной или неполярной связью.
Ассоциируйте эти вещества с песком. Они очень твердые, очень тугоплавкие (высокая температура плавления), нелетучие, прочные, нерастворимы в воде.
Примеры: SiO2, B, Ge, SiC, Al2O3. Особенно хочется выделить: алмаз и графит (C), красный и черный фосфор (P).

Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Читайте также:
