Что образуют атомы металлов в пространстве
Из всех элементов Периодической системы Д.И. Менделеева 76 составляют металлы. Все металлы имеют общие характерные свойства, отличающие их от других веществ. Это обусловлено особенностями их внутриатомного строения.
Согласно современной теории строения атомов, каждый атом представляет сложную систему, которую схематично можно представить состоящей из положительно заряженного ядра, вокруг которого на разном расстоянии от него движутся отрицательно заряженные электроны.
Притягивающее действие ядра на внешние (валентные) электроны в металлах в значительной степени скомпенсировано электронами внутренних оболочек. Поэтому валентные электроны легко отрываются и свободно перемещаются между образовавшимися положительно заряженными ионами.
Слабая связь отдельных электронов с остальной частью атома и является характерной особенностью атомов металлических веществ, обусловливающей их химические, физические и механические свойства. Общее число не связанных с определенным атомом электронов в различных металлах неодинаково. Этим объясняется довольно значительное различие в степени ”металличности” отдельных металлов. Наличием электронного газа объясняют и особый тип межатомной связи, присущей металлам.
Металлический тип связи характеризуется тем, что между решеткой из положительно заряженных ионов и окружающими их свободными валентными электронами возникает электростатическое притяжение.
Наличие в металлах металлической связи придает им ряд характерных свойств: высокую тепло- и электропроводность; повышенную способность к пластической деформации; термоэлектронную эмиссию, т. е. способность испускать электроны при нагреве; хорошую отражательную способность, т.е. обладают металлическим блеском и непрозрачны; положительный температурный коэффициент электросопротивления, т.е. с повышением температуры электросопротивление металлов увеличивается.
Последнее свойство присуще только металлам, поэтому:
Металл это вещество, имеющее металлический тип связи и положительный температурный коэффициент электросопротивления.
Сила связи в металлах определяется соотношением между силами отталкивания и притяжения между ионами и электронами. Атомы (ионы) располагаются на таком расстоянии один от другого, чтобы энергия взаимодействия была минимальной (рис. 1). Сближение атомов (ионов) на расстояние меньше R0 или удаление их на расстояние больше R0 осуществимо лишь при совершении определенной работы против сил отталкивания или притяжения.
В качестве модели такого взаимодействия (рисунок 1, б) можно принять два шара (ионы), между которыми находится пружина (сила взаимодействия). В состоянии равновесия расстояние между шарами R0. Если расстояние уменьшить и сжать пружину, то между шарами появится сила отталкивания (F), которая будет стремиться вернуть их в равновесное состояние. При увеличении расстояния появится сила притяжения (-F).
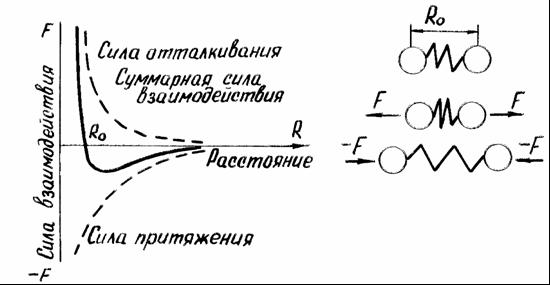
Рисунок 1 — Силы взаимодействия двух атомов в кристаллической решетке (а) и модель такого взаимодействия (б)
В связи с этим атомы в металлах располагаются закономерно на определенном расстоянии друг от друга, образуя правильную кристаллическую решетку.
Ее следует представлять как мысленно проведенные в пространстве в направлении трех осей координат прямые линии, соединяющие ближайшие атомы и проходящие через их центры, около которых они совершают колебательные движения. Проведенные линии образуют объемные фигуры правильной геометрической формы.
Наименьший объем кристалла, дающий представление об атомной структуре металла во всем объеме называется элементарной кристаллической ячейкой.
Размеры кристаллической решетки характеризуются параметрами или периодами решетки. Расстояние между центрами соседних атомов измеряется ангстремами (1 Å=10 -10 м), килоиксами (1 кХ=1,00202 Å), нанометрами
(1 нм=10 -9 м). Период решетки металлов находится в пределах 1…7 Å.
Половину наименьшего расстояния между центрами атомов называют атомным радиусом.
Плотность кристаллической решетки, объем занятого атомами, характеризуется координационным числом.
Число атомов, находящихся на равном и наименьшем расстоянии от данного атома, называется координационным числом.
Чем выше координационное число, тем больше плотность упаковки атомов. Для кубической ячейки координационное число обозначается буквой ”К”, а гексагональной — ”Г“.
Число атомов, приходящихся на одну элементарную ячейку, называется базисом.
Базис решетки обозначается буквой ”n“. Основными видами ячеек (рисунок 2), которые имеют металлы, являются: кубическая объемноцентрированная (ОЦК), кубическая гранецентрированная (ГЦК) и гексагональная плотноупакованная (ГПУ).
На одну элементарную ячейку ОЦК приходятся два атома (n=2): один в центре куба, а другой вносят атомы, располагающиеся в вершинах куба. Каждый атом в вершине куба одновременно принадлежит восьми сопряженным элементарным ячейкам, и на данную ячейку приходится лишь 1/8 часть, а на всю ячейку (1/8)х8=1 атом. Координационное число считается для центрального атома и соответствует К8.
На одну элементарную ячейку ГЦК приходится четыре атома (n=4): из них один вносят атомы в вершинах куба, а три суммарно вносят атомы, находящиеся на середине грани, так как каждый из таких атомов принадлежит одновременно двум ячейкам: (1/2)х6=3. Координационное число считается для атома, расположенного в центре грани, и соответствует К12.
На одну элементарную ячейку ГПУ приходится шесть атомов (n=6): из них три находятся внутри ячейки. Два атома в центре граней дают один атом: (1/2)х2=1, а двенадцать вершинных атомов — два атома: (1/6)х12=2. Координационное число считается для атома, расположенного внутри ячейки, и соответствует Г12.
Лекция "Особенности атомно-кристаллического строения металлов"по дисциплине "Основы материаловедения"
Материаловедение - это наука о взаимосвязи электронного строения, структуры материалов с их составом, физическими, химическими, технологическими и эксплуатационными свойствами.
Создание научных основ металловедения по праву принадлежит. Чернову Д.К., который установил критические температуры фазовых превращений в сталях и их связь с количеством углерода в сталях. Этим были заложены основы для важнейшей в металловедении диаграммы состояния железоуглеродистых сплавов.
Открытием аллотропических превращений в стали, Чернов заложил фундамент термической обработки стали. Критические точки в стали, позволили рационально выбирать температуру ее закалки, отпуска и пластической деформации в производственных условиях.
В своих работах по кристаллизации стали, и строению слитка Чернов изложил основные положения теории литья, не утратившие своего научного и практического значения в настоящее время.
Великий русский металлург Аносов П.П. впервые применил микроскоп для исследования структуры металлов. Ему принадлежит приоритет в создании легированных сталей. Разработал теорию и технологию изготовления клинков из булатной стали. Из его работ стало ясно, что так называемый булатный узор на поверхности стали, непосредственно зависит от ее внутренней структуры.
В 1873-1876 г.г Гиббс изложил основные законы фазового равновесия и, в частности, правило фаз, основываясь на законах термодинамики. Для решения практических задач знание фазового равновесия в той или иной системе необходимо, но не достаточно для определения состава и относительного количества фаз. Обязательно знать структуру сплавов, то есть атомное строение фаз, составляющих сплав, а также распределение, размер и форму кристаллов каждой фазы.
Определение атомного строения фаз стало возможным после открытия Лауэ (1912 г), показавшего, что атомы в кристалле регулярно заполняют пространство, образуя пространственную дифракционную решетку, и что рентгеновские лучи имеют волновую природу. Дифракция рентгеновских лучей на такой решетке дает возможность исследовать строение кристаллов.
В последнее время для структурного анализа, кроме рентгеновских лучей, используют электроны и нейтроны. Соответствующие методы исследования называются электронографией и нейтронографией. Электронная оптика позволила усовершенствовать микроскопию. В настоящее время на электронных микроскопах полезное максимальное увеличение доведено до 100000 раз.
В пятидесятых годах, когда началось исследование природы свойств металлических материалов, было показано, что большинство наиболее важных свойств, в том числе сопротивление пластической деформации и разрушению в различных условиях нагружения, зависит от особенностей тонкого кристаллическо строения. Этот вывод способствовал привлечению физических теорий о строении реальных металлов для объяснения многих непонятных явлений и для конструирования сплавов с заданными механическими свойствами. Благодаря теории дислокаций, удалось получить достоверные сведения об изменениях в металлах при их пластической деформации.
Особенно интенсивно развивается металловедение в последние десятилетия. Это объясняется потребностью в новых материалах для исследования космоса, развития электроники, атомной энергетики.
Основными направлениями в развитии металловедения является разработка способов производства чистых и сверхчистых металлов, свойства которых сильно отличаются от свойств металлов технической чистоты, с которыми преимущественно работают. Генеральной задачей материаловедения является создание материалов с заранее расчитаными свойствами применительно к заданным параметрам и условиям работы. Большое внимание уделяется изучению металлов в экстремальных условиях (низкие и высокие температуры и давление).
До настоящего времени основной материальной базой машиностроения служит черная металлургия, производящая стали и чугуны. Эти материалы имеют много положительных качеств и в первую очередь обеспечивают высокую конструкционную прочность деталей машин. Однако эти классические материалы имеют такие недостатки как большая плотность, низкая коррозионная стойкость. Потери от коррозии составляют 20% годового производства стали и чугуна. Поэтому, по данным научных исследований, через 20…40 лет все развитые страны перестроятся на массовое использование металлических сплавов на базе титана, магния, алюминия. Эти легкие и прочные сплавы позволяют в 2-3раза облегчить станки и машины, в 10 раз уменьшить расходы на ремонт.
По данным института имени Байкова А.Н. в нашей стране есть все условия чтобы в течении 10…15 лет машиностроение могло перейти на выпуск алюминиево-титановой подвижной техники, которая отличается легкостью, коррозионной стойкостью и большим безремонтным ресурсом.
Важное значение имеет устранение отставания нашей страны в области использования новых материалов взамен традиционных (металлических) – пластмасс, керамики, материалов порошковой металлургии, особенно композиционных материалов, что экономит дефицитные металлы, снижает затраты энергии на производство материалов, уменьшает массу изделий.
Расчетами установлено, что замена ряда металлических деталей легкового автомобиля на углепластики из эпоксидной смолы, армированной углеродными волокнами, позволит уменьшить массу машины на 40%; она станет более прочной; уменьшится расход топлива, резко возрастет стойкость против коррозии.
Металлы, особенности атомно-кристаллического строения
В огромном ряду материалов, с незапамятных времен известных человеку и широко используемых им в своей жизни и деятельности, металлы всегда занимали особое место.
Подтверждение этому: и в названиях эпох (золотой, серебряный, бронзовый, железный века), на которые греки делили историю человечества: и в археологических находках металлических изделий (кованые медные украшения, сельскохозяйственные орудия); и в повсеместном использовании металлов и сплавов в современной технике.
Причина этого - в особых свойствах металлов, выгодно отличающих их от других материалов и делающих во многих случаях незаменимыми.
Металлы – один из классов конструкционных материалов, характеризующийся определ¨нным набором свойств:
· «металлический блеск» (хорошая отражательная способность);
Данные свойства обусловлены особенностями строения металлов. Согласно теории металлического состояния, металл представляет собой вещество, состоящее из положительных ядер, вокруг которых по орбиталям вращаются электроны. На последнем уровне число электронов невелико и они слабо связаны с ядром. Эти электроны имеют возможность перемещаться по всему объ¨му металла, т.е. принадлежать целой совокупности атомов.
Таким образом, пластичность, теплопроводность и электропроводность обеспечиваются наличием «электронного газа».
Все металлы, затвердевающие в нормальных условиях, представляют собой кристаллические вещества, то есть укладка атомов в них характеризуется определ¨нным порядком – периодичностью, как по различным направлениям, так и по различным плоскостям. Этот порядок определяется понятием кристаллическая реш¨тка.
Другими словами, кристаллическая решетка это воображаемая пространственная решетка, в узлах которой располагаются частицы, образующие твердое тело.
Элементарная ячейка – элемент объ¨ма из минимального числа атомов, многократным переносом которого в пространстве можно построить весь кристалл.
Элементарная ячейка характеризует особенности строения кристалла. Основными параметрами кристалла являются:
размеры р¨бер элементарной ячейки. a, b, c – периоды реш¨тки – расстояния между центрами ближайших атомов. В одном направлении выдерживаются строго определ¨нными. ·
· углы между осями ().
координационное число (К) указывает на число атомов, расположенных на ближайшем одинаковом расстоянии от любого атома в решетке. ·
базис решетки количество атомов, приходящихся на одну элементарную ячейку решетки. ·
плотность упаковки атомов в кристаллической решетке – объем, занятый атомами, которые условно рассматриваются как жесткие шары. Ее определяют как отношение объема, занятого атомами к объему ячейки (для объемно-центрированной кубической решетки – 0,68, для гранецентрированной кубической решетки – 0,74) ·
Рис.1.1. Схема кристаллической решетки
Классификация возможных видов кристаллических решеток была проведена французским ученым О. Браве, соответственно они получили название «решетки Браве». Всего для кристаллических тел существует четырнадцать видов решеток, разбитых на четыре типа;
примитивный – узлы решетки совпадают с вершинами элементарных ячеек; ·
· базоцентрированный – атомы занимают вершины ячеек и два места в противоположных гранях;
объемно-центрированный – атомы занимают вершины ячеек и ее центр; ·
гранецентрированный – атомы занимают вершины ячейки и центры всех шести граней ·
Рис. 1.2. Основные типы кристаллических решеток: а – объемно-центрированная кубическая; б– гранецентрированная кубическая; в – гексагональная плотноупакованная
Основными типами кристаллических реш¨ток являются:
1. Объемно - центрированная кубическая (ОЦК) (см. рис.1.2а), атомы располагаются в вершинах куба и в его центре (V, W, Ti, )
2. Гранецентрированная кубическая (ГЦК) (см. рис. 1.2б), атомы рассполагаются в вершинах куба и по центру куждой из 6 граней (Ag, Au, )
3. Гексагональная, в основании которой лежит шестиугольник:
o простая – атомы располагаются в вершинах ячейки и по центру 2 оснований (углерод в виде графита);
o плотноупакованная (ГПУ) – имеется 3 дополнительных атома в средней плоскости (цинк).
Понятие об изотропии и анизотропии
Свойства тела зависят от природы атомов, из которых оно состоит, и от силы взаимодействия между этими атомами. Силы взаимодействия между атомами в значительной степени определяются расстояниями между ними. В аморфных телах с хаотическим располохением атомов в пространстве расстояния между атомами в различных направлениях равны, следовательно, свойства будут одинаковые, то есть аморфные тела изотропны
В кристаллических телах атомы правильно располагаются в пространстве, причем по разным направлениям расстояния между атомами неодинаковы, что предопределяет существенные различия в силах взаимодействия между ними и, в конечном результате, разные свойства. Зависимость свойств от направления называется анизотропией
Чтобы понять явление анизотропии необходимо выделить кристаллографические плоскости и кристаллографические направления в кристалле.
Плоскость, проходящая через узлы кристаллической решетки, называется кристаллографической плоскостью.
Прямая, проходящая через узлы кристаллической решетки, называется кристаллографическим направлением.
Д ля обозначения кристаллографических плоскостей и направлений пользуются индексами Миллера. Чтобы установить индексы Миллера, элементарную ячейку вписывают в пространственную систему координат (оси X,Y, Z – кристаллографические оси). За единицу измерения принимается период решетки.
Рис.1.3. Примеры обозначения кристаллографических плоскостей (а) и кристаллографических направлений (б)
Для определения индексов кристаллографической кристаллографической плоскости необходимо:
установить координаты точек пересечения плоскости с осями координат в единицах периода решетки; ·
взять обратные значения этих величин; ·
привести их к наименьшему целому кратному, каждому из полученных чисел. ·
Полученные значения простых целых чисел, не имеющие общего множителя, являются индексами Миллера для плоскости, указываются в круглых скобках. Примеры обозначения кристаллографических плоскостей на рис. 1.3 а.
Другими словами, индекс по оси показывает на сколько частей плоскость делит осевую единицу по данной оси. Плоскости,параллельные оси, имеют по ней индекс 0 (110)
Ориентация прямой определяется координатами двух точек. Для определения индексов кристаллографического направления необходимо:
одну точку направления совместить с началом координат; ·
установить координаты любой другой точки, лежащей на прямой, в единицах периода решетки ·
привести отношение этих координат к отношению трех наименьших целыж чисел. ·
Индексы кристаллографических направлений указываются в квадратных скобкаж [111]
В кубической решетке индексы направления, перпендикулярного плоскости (hkl) имеют теже индексы [hkl].
Аллотропия или полиморфные превращения.
Способность некоторых металлов существовать в различных кристаллических формах в зависимости от внешних условий (давление, температура) называется аллотропией или полиморфизмом.
Каждый вид решетки представляет собой аллотропическое видоизменение или модификацию.
Примером аллотропического видоизменения в зависимости от температуры является железо (Fe).
Превращение одной модификации в другую протекает при постоянной температуре и сопровождается тепловым эффектом. Видоизменения элемента обозначается буквами греческого алфавита в виде индекса у основного обозначения металла.
Примером аллотропического видоизменения, обусловленного изменением давления, является углерод: при низких давлениях образуется графит, а при высоких – алмаз.
Используя явление полиморфизма, можно упрочнять и разупрочнять сплавы при помощи термической обработки.
Магнитные превращения
Некоторые металлы намагничиваются под действием магнитного поля. После удаления магнитного поля они обладают остаточным магнетизмом. Это явление впервые обнаружено на железе и получило название ферромагнетизма. К ферромагнетикам относятся железо, кобальт, никель и некоторые другие металлы.
При нагреве ферромагнитные свойства металла уменьшаются постепенно: вначале слабо, затем резко, и при определ¨нной температуре (точка Кюри) исчезают (точка Кюри для железа – ). Выше этой температуры металлы становятся парамагнетиками. Магнитные превращения не связаны с изменением кристаллической решетки или микроструктуры, они обусловлены изменениями в характере межэлектронного взаимодействия.
Лекция по Химии на тему "Металлы"
1. Где расположены металлы в периодической системе химических элементов Д.И.Менделеева?
2. Каковы особенности строения атомов металлов?
3. В чём различие в строении внешнего энергетического уровня у металлов и неметаллов?
4. Сколько наружных электронов имеют атомы металлов главных и побочных подгрупп?
5. В каких формах могут находиться металлы в природе?
6. Как устроена кристаллическая решетка металлов?
7. Каковы физические свойства металлов?
8. Как можно получить металлы из их соединений?
9. Как ведут себя атомы металлов в химических реакциях и почему?
10. Какие свойства – окислителей или восстановителей – проявляют металлы в химических реакциях?
11. Расскажите об электрохимическом ряде напряжений металлов.
12. Перечислите реакции, в которые могут вступать металлы.
13. Каково значение металлов в жизни человека?
1. Особенности электронного строения металлов.
Металлы - это химические элементы, атомы которых отдают электроны внешнего (а иногда предвнешнего) электронного слоя, превращаясь в положительные ионы. Металлы – восстановители Ме 0 – nе = Ме n+ . Это обусловлено небольшим числом электронов внешнего слоя (в основном 1 - 3), большим радиусом атомов, вследствие чего эти электроны слабо удерживаются с ядром.
2. Положение металлов в ПСХЭ.
Легко увидеть, что большинство элементов ПСХЭ – металлы (92 из 114).
Металлы размещены в левом нижнем углу ПСХЭ. Это все элементы, расположенные ниже диагонали В – А t , даже те у которых на внешнем слое 4 электрона ( Je , Sn , Pb ), 5 электронов ( Sb , Di ), 6 электронов ( Po ), так как они отличаются большим радиусом. Среди них есть s и p -элементы – металлы главных подгрупп, а также d и f металлы, образующие побочные подгруппы.
В соответствии с местом, занимаемым в периодической системе, различают переходные (элементы побочных подгрупп) и непереходные металлы (элементы главных подгрупп). Металлы главных подгрупп характеризуются тем, что в их атомах происходит последовательное заполнение электронных s- и р-подуровней. В атомах металлов побочных подгрупп происходит достраивание d- и f-подуровней.
Закономерности в изменении свойств элементов – металлов.
Признаки сравнения
В главной подгруппе
Число электронов на внешнем слое
У элементов – металлов побочных подгрупп свойства чуть-чуть другие.
В побочных подгруппах ( Cu , Ag , Au ) – активност ь элементов – металлов падает. Эта закономерность наблюдается и у элементов второй побочной подгруппы Zn , Cd , Hg . У элементов побочных подгрупп – это элементы 4-7 периодов – с увеличением порядкового элемента радиус атомов изменятся мало, а величина заряда ядра увеличивается значительно, поэтому прочность связи валентных электронов с ядром усиливается, восстановительные свойства ослабевают.
3. Металлическая химическая связь. Кристаллические решетки.
Связь в металлах между («атом-ионами» ) посредством (большого количества не связанных с ядрами подвижных электронов) называется (металлической связью) .
Все металлы являются кристаллическими телами, имеющими определенный тип кристаллической решетки, состоящей из малоподвижных положительно заряженных ионов, между которыми движутся свободные электроны (так называемый электронный газ). Такой тип структуры называется металлической связью.
Тип решетки определяется формой элементарного геометрического тела, многократное повторение которого по трем пространственным осям образует решетку данного кристаллического тела.
Обобщим сведения о типе химической связи, образуемой атомами металлов и строение кристаллической решетки:
- сравнительно небольшое количество электронов одновременно связывают множество ядер, связь делаколизована;
- валентные электроны свободно перемещаются по всему куску металла, который в целом электронейтрален;
- металлическая связь не обладает направляемостью и насыщенностью.
4. Физические свойства металлов
В соответствие именно с таким строением металлы характеризуются общими физическими свойствами.
а) твердость – все металлы кроме ртути, при обычных условиях твердые вещества. Самые мягкие – натрий, калий. Их можно резать ножом; самый твердый хром – царапает стекло.
б) плотность. Металлы делятся на мягкие (5г/см³) и тяжелые (меньше 5г/см³).
в) плавкость. Металлы делятся на легкоплавкие и тугоплавкие.
г) электропроводность, теплопроводность металлов обусловлена их строением. Хаотически движущиеся электроны под действием электрического напряжения приобретают направленное движение, в результате чего возникает электрический ток.
При повышении температуры амплитуда движения атомов и ионов, находящихся в узлах кристаллической решетки резко возрастает, и это мешает движению электронов, и электропроводность металлов падает.
д) металлический блеск – электроны, заполняющие межатомное пространство отражают световые лучи, а не пропускают как стекло. Поэтому все металлы в кристаллическом состоянии имеют металлический блеск. Для большинства металлов в ровной степени рассеиваются все лучи видимой части спектра, поэтому они имеют серебристо-белый цвет. Только золото и медь в большой степени поглощают короткие волны и отражают длинные волны светового спектра, поэтому имеют желтый цвет. Самые блестящие металлы – ртуть, серебро, палладий. В порошке все металлы, кроме Al и Mg , теряют блеск и имеют черный или темно-серый цвет.
е) пластичность. Механическое воздействие на кристалл с металлической решеткой вызывает только смещение слоев атомов и не сопровождается разрывом связи, и поэтому металл характеризуется высокой пластичностью.
Некоторые металлы, например, железо, титан, олово и др. способны по достижении определенных температур изменять кристаллическое строение. Это явление получило название аллотропии или полиморфизма, а сами переходы от одного кристаллического строения к другому называются аллотропическими или полиморфными.
5. Химические свойства металлов
Ряд напряжений характеризует химические свойства металлов: чем меньше электродный потенциал металла, тем больше его восстановительная способность.
А) Взаимодействие с неметаллами ( в названиях полученных веществ окончание
2Mg 0 +O2 0 —>2Mg 2+ O 2- (оксид магния)
Fe 0 +S 0 —>Fe 2+ S 2- ( сульфид железа II)
Б) Взаимодействие с водой. Самые активные металлы реагируют с водой при обычных условиях, и в результате этих реакций образуются растворимые в воде основания и выделяется водород
2Na + 2HOH = 2NaOH + H2
2Li 0 +2H2 + O 2– —> 2Li + O 2- H + + H2 0
Менее активные металлы реагируют с водой при повышенной температуре с выделением водорода и образованием оксида соответствующего металла Zn + H2O = ZnO +H2
В) Взаимодействие с растворами кислот. Происходит при соблюдении ряда условий
· Металл должен находиться левее в ряду напряжений металлов;
· В результате реакции должна образовываться растворимая соль, иначе металл покроется осадком и доступ кислоты к металлу прекратиться;
· Для этих реакций не рекомендуется использовать щелочные металлы, так как они взаимодействуют с водой в растворе кислоты;
· По особому взаимодействуют с металлами концентрированные азотная и серная кислоты;
2H + Cl – +Zn0 → Zn 2+ Cl2 - +H20
Г) Взаимодействие с растворами солей. При этом соблюдаются следующие условия
· Металл должен находиться в ряду напряжений левее металла, образующего соль;
· Для этих реакций не рекомендуется использовать щелочные металлы, так как они взаимодействуют с водой в растворе соли;
Fe 0 +Cu 2+ Cl2 – →Fe 2+ Cl2 – +Cu 0
Д) Взаимодействие со щелочами (только амфотерные)
Магний и щелочноземельные металлы с щелочами не реагируют.
Е) Взаимодействие с оксидами металлов (металлотермия).
Некоторые активные металлы способны вытеснять другие металлы из их оксидов при поджигании смеси.
2Al 0 + Fe 2 O 3 = Al 2 O 3 +2 Fe 0
Ж) Коррозия (будет рассмотрена на другом занятии).
6. Способы получения металлов
Существуют несколько основных способов получения — металлов.
а) Пирометаллургия – это получение металлов из их соединений при высоких температурах с помощью различных восстановителей (C, CO, H2, Al, Mg и др.).
— из их оксидов углем или оксидом углерода (II)
ZnО + С = Zn + СО
Fе2О3 + ЗСО = 2Fе + ЗСО2
— водородом
WO3 + 3H2 =W + 3H2O
СоО + Н2 = Со + Н2О
— алюминотермия
4Аl + ЗМnО2 = 2А12О3 + ЗМn
б) Гидрометаллургия – это получение металлов, которое состоит из двух процессов: сначала природное соединение металла (оксид) растворяют в кислоте, в результате чего получают соль металла. Затем из полученного раствора необходимый металл вытесняют более активным металлом. Например:
Обжигом сульфидов металлов и последующим восстановлением образовавшихся оксидов (например, углем):
2ZnS + ЗО2 = 2ZnО + 2SО2
ZnО + С = СО + Zn
в) Электрометаллургия – это получение металлов при электролизе растворов или расплавов их соединений. Роль восстановителя при этом играет электрический ток.
СuСl2 → Сu 2 + 2Сl -
Катод (восстановление): Сu 2+ - 2е - = Сu 0
Атомно-кристаллическое строение металлов
Все тела в зависимости от расположения атомов делятся на аморфные и кристаллические. В отличие от аморфных тел, атомы в которых расположены хаотично, металлы в твердом состоянии являются телами кристаллическими. Кристаллическое строение характеризуется закономерным расположением атомов.
Атомы металлов образуют кристаллическую решетку или ячейку. Каждый металл имеет определенный тип кристаллической решетки, чаще всего встречаются три типа решеток: кубическая объемноцентрированная – ОЦК (рис. 16, а), кубическая гранецентрированная – ГЦК (рис. 16, б) и гексагональная – ГПУ (рис. 16, в).
В кубической объемноцентрированной решетке атомы расположены в узлах ячейки и один атом в центре куба. Такие решетки имеют металлы: Feα, Сг, W, Mo, Tiβ, Nb, Та, Li n др.
В кубической гранецентрированной решетке атомы расположены в узлах ячейки и в центре каждой грани. Этот тип решетки имеют металлы: Feγ, Ni, Ag, Au, Pb, Сu, Соβ и др.
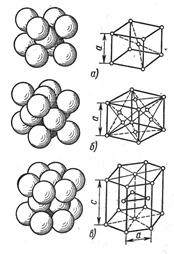
Рис. 16. Типы кристаллических решеток:
а – кубическая объемноцентрированная;
б – кубическая гранецентрированная;
В гексагональной решетке атомы расположены в узлах и центре шестигранных оснований призмы и три атома в средней плоскости призмы. Такую решетку имеют металлы: Zn, Cd, Be, Re, Coα, Tiα и др. Индексы α, β, γ обозначают, что у соответствующих металлов различные кристаллические решетки при различных температурах.
Типы кристаллических ячеек определяются при помощи рентгеноструктурного анализа.
Расстояния между центрами соседних атомов в кристаллической решетке называется периодом (а, b, с). Расстояния между атомами измеряются в ангстремах - , 1 = 1•10 -8 см.
Базис кристаллической решетки - это число атомов, принадлежащих одной элементарной кристаллической ячейке; для ОЦК базис равен 2, для ГЦК – 4, ГПУ – 6.
Плотность упаковки – это отношение объема занимаемого атомами к объему всей ячейки. Плотность упаковки для ОЦК составляет 68%, для ГЦК и ГПУ – 74%. Плотность упаковки характеризуется координационным числом, т. е. числом атомов, находящихся на равном и наименьшем расстоянии от данного атома. Координационное число для ОЦК – 8, для ГЦК и ГПУ – 12.
2.1. Полиморфизм металлов.
Полиморфизмом или аллотропией называют способность металла в твердом состоянии при изменении температуры перестраивать свою кристаллическую решетку. Полиморфные превращения сопровождаются выделением или поглощением теплоты, а также изменением свойств металла. Различные аллотропические состояния называют модификациями. Каждой модификации свойственно оставаться устойчивой лишь в пределах определенного для данного металла интервала температур. Аллотропические формы обозначаются греческими буквами α, β, γ и т. д. На кривых охлаждения и нагрева переход из одного состояния в другое характеризуется остановкой (для чистых металлов) или изменением характера кривой (для сплавов). При аллотропических превращениях кроме изменения свойств (теплопроводности, электропроводности, механических, магнитных и др.) наблюдают изменения объема металла и растворимости (например, углерода в железе). Аллотропические превращения свойственны многим металлам (железу, олову, титану и др.).
Железо известно в двух полиморфных модификациях — α и γ. На рис. 17 приведена кривая охлаждения, характеризующая его аллотропические превращения. Как видно, в интервале температур 911. 1392 °С железо имеет кубическую гранецентрированную решетку γ-железа (γFe), а в интервале от 0 до 911 °С и от 1392 до 1539 °С— объемноцентрированную решетку α-железа (αFe). Железо меняет свои магнитные свойства: выше 768 °С железо немагнитно, а ниже — магнитно.
Строение кристаллов металла
Все металлические тела кристаллические. Их атомы в кристаллах имеют определенное, закономерное расположение в пространстве. Атомы состоят из положительно заряженных ионов и отрицательно заряженных электронов. Электроны у металлов слабо связаны с ядром и могут легко переходить от одного иона к другому. Этим объясняется высокая электро- и теплопроводность металлов.
Воображаемые линии, проведенные через центры атомов (положительно заряженных ионов), образуют так называемую кристаллографическую плоскость. Многократное повторение кристаллографических плоскостей, расположенных параллельно, образует пространственную кристаллическую решетку (рис. 5). Атомы в узлах кристаллической решетки колеблются с определенными амплитудой и частотой и находятся под действием сил взаимного притяжения и отталкивания. Размеры кристаллической решетки (расстояния между центрами соседних атомов) называются параметрами и измеряются в ангстремах – Å (1Å = 1´10 -8 см) или в килоиксах – кХ (1кХ = 1,00202Å), или в нанометрах – нм (1нм = 1´10 -9 см = 0,1 Å).
Стремление атомов металлов занять места, наиболее близкие друг к другу, приводит к образованию трех типов кристаллических решеток: кубической объемно центрированной (ОЦК), кубической гранецентрированной (ГЦК) и
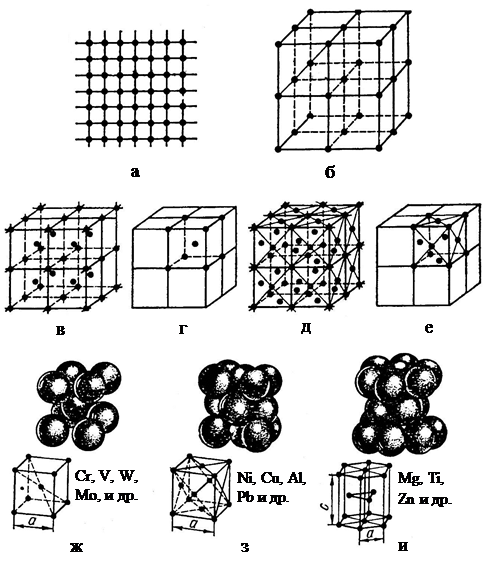 |
гексагональной плотноупакованной (ГПУ) (рис. 5).
Рис. 5. Схема расположения атомов в металле: а – в плоскости;
б – в пространстве; кубические решетки металлов: объемно
центрированный куб (в) и ячейка его кристаллической решетки (г);
гранецентрированный куб (д) и ячейка его кристаллической решетки (е);
элементарные ячейки: объемно центрированной кубической решетки (ж);
гранецентрированной кубической решетки (з); плотноупакованной
кубической решетки (и)
В ячейке решетки кубической объемно центрированной атомы расположены в вершинах и в центре куба; такую решетку имеют, например, хром, ванадий, вольфрам и др. В ячейке кубической гранецентрированной решетки атомы расположены в вершинах куба и в центре каждой грани куба; такую решетку имеют алюминий, никель, свинец и др. В решетке гексагональной плотноупакованной атомы расположены в вершинах шестиугольных оснований призмы, в центрах этих оснований и внутри призмы; такую решетку имеют магний, титан, цинк и др.
Из изложенного выше понятно, что характерные признаки металлов обусловлены их внутренним строением (структурой). Геометрическая правильность расположения атомов в кристаллической решетке придает им особенности, которых нет у аморфных тел (смола, стекло).
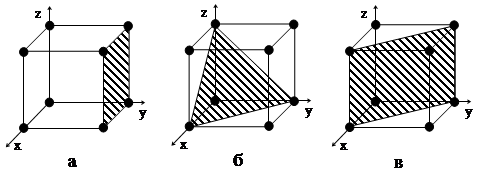 |
В плоскостях и направлениях кристаллической решетки атомы расположены с различными плотностью, расстоянием друг от друга, и потому свойства кристаллов (физические, химические, механические) в различных направлениях разные (рис. 6). Такое различие свойств называется анизотропией. Все кристаллы анизотропны. В металлах, состоящих из большого количества по-разному ориентированных мелких анизотропных кристаллов, свойства во всех направлениях одинаковы (усредненные). Если в структуре металла создается одинаковая ориентировка всех кристаллов, то появляется анизотропия всего металла.
Рис. 6. Кристаллографические плоскости и направления
в объемно центрированной кубической решетке: а – в направлении
граней (четыре атома); по диагонали: б – три, в – четыре атома
В действительности реальный кристалл в отличие от идеального представления о его кристаллической решетке имеет структурные несовершенства (дефекты): точечные, линейные, поверхностные.
Точечные несовершенства. Как указывалось, атомы находятся в колебательном движении в узлах решетки. Чем выше температура, тем больше амплитуда этих колебаний. Хотя атомы в кристаллической решетке обладают одинаковой (средней) энергией и значения их амплитуды колебаний одинаковы, всегда есть отдельные атомы, у которых и энергия, и амплитуда больше, чем у других. Такие атомы могут перемещаться из одного узла в другой, оказавшийся свободным.
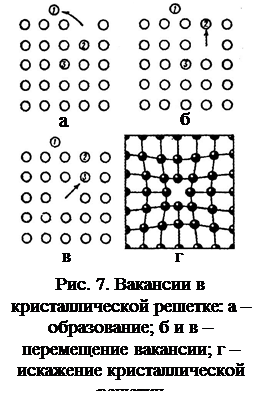
Наиболее легко перемещаются атомы поверхностного слоя кристалла (например, атом 1 на рис. 7, а). Место, где находился такой атом, оказывается свободным и называется вакансией. Через некоторое время в свободный узел перемещается другой атом (например, атом 2 на рис. 7, б). В освободившееся место перемещается следующий атом (атом 3 на рис. 7, в). Таким образом, вакансия перемещается по кристаллу. Наличие вакансий искажает атомную решетку кристалла, оказывая влияние на свойства металла (рис. 7, г).
С увеличением температуры увеличивается число вакансий и они чаще переходят из одного узла в другой. Вакансии играют определяющую роль в диффузионных процессах, протекающих в металлах и сплавах.
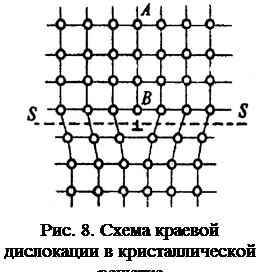
Линейные несовершенства. Наиболее распространенными являются несовершенства, имеющие протяженность только в одном направлении, или линейные дефекты. Их называют дислокациями. Дислокации образуются в результате местных смещений (сдвигов) кристаллографических плоскостей, происходящих в кристаллической решетке кристаллов. Наиболее распространены краевые дислокации (рис. 8). Краевая дислокация – это нижняя граница (край) как бы лишней, не имеющей продолжения полуплоскости АВ. Линию атомов нижней границы полуплоскости АВ и называют дислокацией (см. рис. 8).
Образование дислокаций может происходить при кристаллизации, термической обработке и при других процессах. Дислокации оказывают большое влияние на механические свойства – понижают прочность, но обеспечивают способность металла пластически деформироваться (рис. 9).
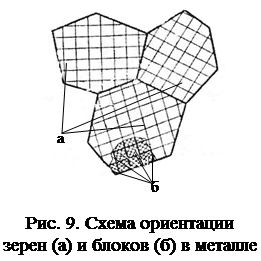
Поверхностные несовершенства – границы зерен и блоков металла. На границе между зернами (кристаллами) атомы имеют менее правильное расположение, чем в объеме зерна. Зерна разориентированы, повернуты относительно друг друга на несколько градусов. По границам зерен скапливаются дислокации и вакансии. Зерно состоит из большого количества областей, называемых блоками, границы которых представляют собой дислокации, разделяющее зерно на блоки (рис. 10).
Итак, в реальной кристаллической решетке металлов всегда есть вакансии, дислокации, атомы примесей (имеющие другие атомные размеры), искажающие форму кристаллических ячеек и их параметры. Все это оказывает влияние на реальные свойства металлов (рис. 11). Для определения свойств металлов стандартами предусматривается проведение соответствующих испытаний.
Читайте также:
