Атомы в кристаллических решетках металлов удерживаются посредством
1. Какая из перечисленных групп элементов содержит только металлы:
1) Li, Be, B; 2) K, Ca, Sr; 3) H, Li, Na; 4) Se, Te, Po .
2. Отметьте ряд, в котором находятся только металлы:
1) Mg, Gе, As 2) Li, Ве, В 3) C, Sn, Pb 4) К, Са, V
3. Металлами являются:
1) все s-элементы; 3) все p-элементы;
2) все d-элементы; 4) все элементы главных подгрупп.
4. Среди металлов нет: а) s-элементов б) р-элементов в) d-элементов г) f-элементов
1) а,б 2) в,б 3) в,г 4) есть все
5. В каком ряду приведены символы соответственно самого твердого и самого тугоплавкого металлов?
1) W, Ti; 2) Cr, Hg; 3) Cr, W; 4) W, Cr
6. Какой металл является самым распространенным на Земле:
1) алюминий 2) золото 3) железо 4) магний
7. Металл, используемый для сплавов, применяемых в самолетостроении; для восстановления металлов из оксидов: устойчивы коррозии, с малой плотностью - .
1) цинк 2) медь 3) алюминий 4) хром
8. Какой металл проявляет переменные степени окисления:
1) Fе 2) Na 3) Са 4) Al
9. Степень окисления хрома в его амфотерных соединениях равна
1) +6 2) +2 3) +3 4) +1
10. Исключите лишний элемент:
1) Na; 2) Mg; 3)Al; 4)Si.
11. Какой металл в природе встречается только в виде соединений:
1) натрий 2) золото 3) серебро 4) платина
12. Исключите "лишний" сплав:
1) сталь; 2) булат; 3) латунь; 4) чугун.
13. Атомы в кристаллических решетках металлов удерживаются посредством:
1) ионной связи 3) ковалентной полярной связи
2) водородной связи 4) металлической связи
14. Характерное свойство металлов:
1) плохая теплопроводность; 3) оксиды имеют ионный характер;
2) многие из них окислители; 4) большинство оксидов – ковалентные соединения.
15. Наибольший атомный радиус имеет:
1) Be; 2) Sr; 3) Са; 4) Ba
16. Для металлов характерны:
1) низкая теплопроводность и электропроводность
3) ковкость и пластичность
4) в обычных условиях газообразное состояние
17. В составе иона 25 Mg 2+ содержится:
1) 12 протонов, 12 электронов, 13 нейтронов 2) 10 протонов, 12 электронов, 13 нейтронов
3) 12 протонов, 10 электронов, 12 нейтронов 4) 12 протонов, 10 электронов, 13 нейтронов
18. Атомы металлов при взаимодействии с атомами неметаллов:
1) отдают валентные электроны 2) принимают электроны
3) в одних случаях принимают электроны, в других – отдают 4) являются окислителями
19. С увеличением порядкового номера металла в главной подгруппе способность отдавать электроны
1) увеличивается 3) не изменяется
2) уменьшается 4) увеличивается, а затем уменьшается
20. Атомы металлов, отдавая электроны, приобретают электронную структуру внешнего энергетического уровня:
1) щелочных металлов 2) галогенов 3) благородных газов 4) кислорода
21. В ряду натрий —магний — алюминий элементы расположены в порядке увеличения
1) атомного радиуса 2) электроотрицательности
3) металлических свойств 4) числа электронных слоев
22. Металлические свойства усиливаются в ряду элементов
1) натрий → магний → алюминий 2) литий → натрий → калий
3) барий → кальций → магний 4) калий → натрий → литий
23. Наиболее выраженные металлические свойства проявляет:
1) А1 2) Na 3) Mg 4) Fe
24. Какое свойство не является общим для всех металлов:
1) электропроводность; 2) теплопроводность;
3) твёрдое агрегатное состояние при стандартных условиях; 4) металлический блеск.
25. Металл, у которого наиболее устойчивая степень окисления +1, – это:
4) у всех перечисленных выше металлов степень окисления +1 одинаково устойчивая.
26. Верны ли следующие суждения о щелочных металлах?
А. Во всех соединениях они имеют степень окисления +1.
Б.С галогенами они образуют соединения с ионной связью.
1) верно только А; 2) верно только Б;
3) верны оба суждения; 4) оба суждения неверны.
27. На внешнем энергетическом уровне один электрон у .
1) щелочноземельных металлов 3) алюминия
2) щелочных металлов 4) железа
28. Из приведенных ниже металлов наиболее активным является
1) бериллий 2) магний 3) кальций 4) барий
29. Ряд элементов, в котором усиливаются металлические свойства.
1) Li - Be – В 2) Cs - Rb - К 3) Al, Fe, Ag 4) Ca, Sr, Ba
30. Отметьте ряд, в которых основные свойства гидроксидов металлов убывают:
31. Отметьте ряды, в которых основные свойства оксидов металлов убывают:
32. Какое утверждение по отношению к металлам являются верными:
1) большая часть химических элементов является металлами
2) гидроксиды металлов проявляют кислотные свойства
3) для металлов характерны окислительные свойства
4) металлы плохо проводят электрический ток
33. Какие утверждения для металлов неверны:
1) металлы составляют большинство элементов Периодической системы;
2) в атомах всех металлов на внешнем энергетическом уровне содержится не более двух электронов;
3) в химических реакциях для металлов характерны восстановительные свойства;
4) в каждом периоде атом щелочного металла имеет наименьший радиус.
34. Укажите справедливые утверждения:
1) все элементы d- и f-семейств являются металлами;
2) среди элементов р-семейства нет металлов;
3) гидроксиды металлов могут обладать как основными, так амфотерными и кислотными свойствами;
4) металлы не могут образовывать гидроксиды с кислотными свойствами.
35. Отметьте ряд, в котором находятся металлы, гидроксиды и оксиды которых проявляют амфотерные свойства:
1) Cs, Fr, Ва 2) Mg, Na, К 3) Al, Ве, Zn 4) Са, Sr, Cs
36. Амфотерным оксидом является .
37. В атомах каких металлов в основном состоянии на энергетическом d-подуровне содержится пять электронов?
1) титана; 2) хрома; 3) сурьмы; 4) марганца.
38. Окислительные свойства какого иона наиболее ярко выражены:
1) Сu 2+ 2) Pb 2+ 3) Sn 2+ 4)Zn 2+
39. Какой из оксидов является кислотным:
40. Отметьте формулу оксида металла с наиболее выраженными кислотными свойствами:
41. Химическая реакция возможна между
1) Cu и H2O 2) Au и H2 3) Na и Cl2 4) Fe и NaCl
42. Выберите реакцию, соответствующую схеме: Ме° - nе à Ме n +
43. Активнее других реагирует с кислородом .
1) Al 2) Ag 3) Zn 4) Ва
44. Амфотерным оксидом является .
1) СаО 2) ВаО 3) ZnO 4) CuO
45. Схеме: Me n + + ne à Me 0 соответствует реакция .
1) Mg + S = MgS 2) NaOH + HC1 = NaCl + H2O
46. Укажите символы металлов, которые можно окислить ионами Н + в водном растворе кислоты:
1) Cu; 2) Zn; 3) Fe; 4) Ag.
47. Схеме: Ме n + + nе à Ме° соответствует реакция .
48. В каких парах обе из реакций, схемы которых приведены ниже, позволяют получить металл?
1) CuO + COà и CuSO4 + Zn à 3) AgNO3 àи Cr2O3 + Al à
49. Активнее других взаимодействует с кислородом .
1) Li 2) Na 3) К 4) Pt
50. С водой только при нагревании реагируЮт:
1) натрий; 2) цинк; 3) медь; 4) железо.
51. Какой из металлов не вытесняет водород из разбавленной серной кислоты?
1) железо 2) хром 3) медь 4) цинк
52. С кислородом не взаимодействует .
l) Fe 2) Zn 3) Аl 4) Pt
53. Какой металл реагирует с водой при комнатной температуре с образованием гидроксида и водорода:
1) Fе 2) Zn 3) Na 4) Аu
54. Водород не вытесняется из кислот
1) оловом 2) свинцом 3) серебром 4) магнием
55. При комнатной температуре вытесняет водород из воды .
1) медь 2) железо 3) литий 4) цинк
56. Наиболее энергично взаимодействует с водой .
l) Mg 2) Са 3) Ва 4) Be
57. С образованием щелочи с водой взаимодействует
1) алюминий 2) цинк 3) барий 4) ртуть
58. Щелочь и водород образуются при взаимодействии с водой .
1) Fe 2) Сu 3) А1 4) Na
59. Оксид металла образуется при взаимодействии с водой .
l) Zn 2)Ва 3)Na 4) Au
60. Все металлы какого ряда реагируют с соляной кислотой:
1) Al, Аu, Hg 2) Mg, Zn, Fе 3) K, Pt, Ag 4) Zn, Ag, Ba
61. С какой кислотой металлы практически никогда не реагируют с выделением водорода:
62. Какой металл реагирует с водным раствором щелочи с образованием комплексных солей:
1) Аl 2) Са 3) К 4) Ва
63. С кислотами и щелочами взаимодействует:
64. Оксид какого металла реагирует как с кислотами, так и с основаниями:
1) Аl 2) Na 3) Са 4) Ва
65. Гидроксид какого металла реагирует как с кислотами, так и с основаниями:
1) Na 2) Zn 3) Са 4) Ва
66. С кислотами и щелочами может взаимодействовать оксид:
1) калия 2) серы 3) алюминия 4) кальция
67. Какой металл будет вытеснять олово из водных растворов его солей:
1) Рb 2) Сu 3) K 4) Mg
68. Какой металл будет вытеснять медь из водных растворов ее солей:
1) Аu 2) Mg 3) Na 4) Ag
69. Между какой парой веществ возможна химическая реакция в водном растворе:
1) Ag и CuCl2 2) Рb(NОЗ)2 и Zn 3) HCl и Cu 4) Fе и MgCl2
70. Как изменится масса цинковой пластинки через некоторое время, после того как ее опустили в раствор хлорида железа (II):
1) не изменится 2) увеличится
3) уменьшится 4) пластинка растворится
71. Никель может выступать в качестве восстановителя по отношению к ионам:
1) Сu 2+ 2) Zn 2+ 3) Аl 3+ 4) Mg 2+
72. Отметьте металл, который может окисляться ионами свинца Pb 2+ :
1) Аu 2) Сu 3) Zn 4) Ag
73. Реакция замещения происходит между .
1) Сu и FeSO4 раствор 3) А1 и AgNO3 раствор
2) Ag и А1С13 раствор 4) Fe и ZnCl2 раствор
74. Химическая реакция проходит между .
1) Mg и ZnCl2 раствор 3) Ag и АlСl3 раствор
2) Сu и FeSO4 раствор 4) Рb и Mg(NO3)2 раствор
СРОЧНО ПОМОГИТЕ ПОЖАЛУЙСТА
10-7-1.Какая из перечисленных групп элементов содержит только металлы:
1)Li, Be, B; 2)K, Ca, Sr; 3)H, Li, Na; 4) Se, Te, Po .
10-7-2. Отметьте ряд, в котором находятся только металлы:
10-7-3. Металлами являются:
1)все s-элементы; 2) все p-элементы;
3) все d-элементы; 4) все элементы главных подгрупп.
10-7-4. Среди металлов нет: а) s-элементов б) р-элементов в) d-элементов г) f-элементов
10-7-5. В каком ряду приведены символы соответственно самого твердого и самого тугоплавкого металлов?
1) W, Ti; 2) Cr, Hg; 3) Cr, W; 4) W, Cr,
10-7-6. Какой металл является самым распространенным на Земле:
10-7-7.Металл, используемый для сплавов, применяемых в самолетостроении; для восстановления металлов из оксидов: устойчивы коррозии, с малой плотностью - .
1)цинк 2) медь 3) алюминий 4)хром
10-7-8. Какие металлы проявляют переменные степени окисления:
10-7-9.Степень окисления хрома в его амфотерных соединениях равна
10-7-10.Исключите лишний элемент:
1)Na; 2)Mg; 3)Al; 4)Si.
10-7-11. Какие металлы в природе встречаются только в виде соединений:
1) натрий 2) золото 3) серебро 4) ртуть
10-7-12. Исключите "лишний" сплав:
1)сталь; 2)булат; 3)латунь; 4)чугун.
10-7-13. Атомы в кристаллических решетках металлов удерживаются посредством:
1) ионной связи 2) ковалентной полярной связи
3) водородной связи 4) металлической связи
10-7-14. Характерное свойство металлов:
1) плохая теплопроводность; 2) оксиды имеют ионный характер;
3) многие из них окислители; 4) большинство оксидов – ковалентные соединения.
10-7-15. Наибольший атомный радиус имеет:
1) Be; 2) Sr; 3) Са; 4) Ba.
10-7-16. Для металлов характерны:
1) низкая теплопроводность и электропроводность 2) летучесть
3) ковкость и пластичность 4) в обычных условиях газообразное состояние
10-7-17. В составе иона 25Mg2+ содержится:
10-7-18. Атомы металлов при взаимодействии с атомами неметаллов:
3) в одних случаях принимают электроны, в других - отдают 4) являются окислителями
10-7-19.С увеличением порядкового номера металла в главной подгруппе способность отдавать электроны .
1) увеличивается 2) не изменяется
3) уменьшается 4) увеличивается, а затем уменьшается
10-7-20. Атомы металлов, отдавая электроны, приобретают электронную структуру внешнего энергетического уровня:
1) щелочных 2) галогенов 3) благородных газов 4) кислорода
10-7-21. В ряду натрий — магний — алюминий элементы расположены в порядке увеличения
10-7-22. Металлические свойства усиливаются в ряду элементов
1) натрий — магний — алюминий 2) литий — натрий — калий
3) барий - кальций — магний 4) калий — натрий — литий
10-7-23Наиболее выраженные металлические свойства проявляет:
1)А1 2)Na 3)Mg 4) Fe
10-7-24.Какое свойство не является общим для всех металлов:
3)твёрдое агрегатное состояние при стандартных условиях; 4)металлический блеск.
10-7-25. Металл, у которого наиболее устойчивая степень окисления +1, – это:
10-7-26. Верны ли следующие суждения о щелочных металлах?
1)верно только А; 2) верно только Б;
3)верны оба суждения; 4)оба суждения неверны.
10-7-27.На внешнем энергетическом уровне один электрон у .
1) щелочно-земельных металлов 2)алюминия
3)щелочных металлов 4) железа
10-7-28. Из приведенных ниже металлов наиболее активным является
10-7-29. Ряд элементов, в котором усиливаются металлические свойства.
10-7-30. Отметьте ряд, в которых основные свойства гидроксидов металлов убывают:
1) LiOH, КОН, CsOH 2) Са(ОН)2, Mg(OH)2, Ве(ОН)2
3) Аl(ОН)3, Mg(OH)2, NaOH 4) Ва(ОН)2, CsOH, RbOH
10-7-31. Отметьте ряды, в которых основные свойства оксидов металлов убывают:
Кристаллическое строение металлов
Все металлы и металлические сплавы за редким исключением в твердом состоянии – тела кристаллические, атомы (ионы) расположены в металлах упорядоченно друг относительно друга на определенных расстояниях в зависимости от природы металла. Эти расстояния называются параметрами кристаллической решетки.
В аморфных телах атомы расположены не упорядоченно, а хаотично.
Металлы если их кристаллизуют обычным способом – поликристаллические тела, состоящие из большого числа мелких, различимых только в микроскоп зерен (10 -1 –10 -6 см), различно ориентированных по отношению друг к другу.
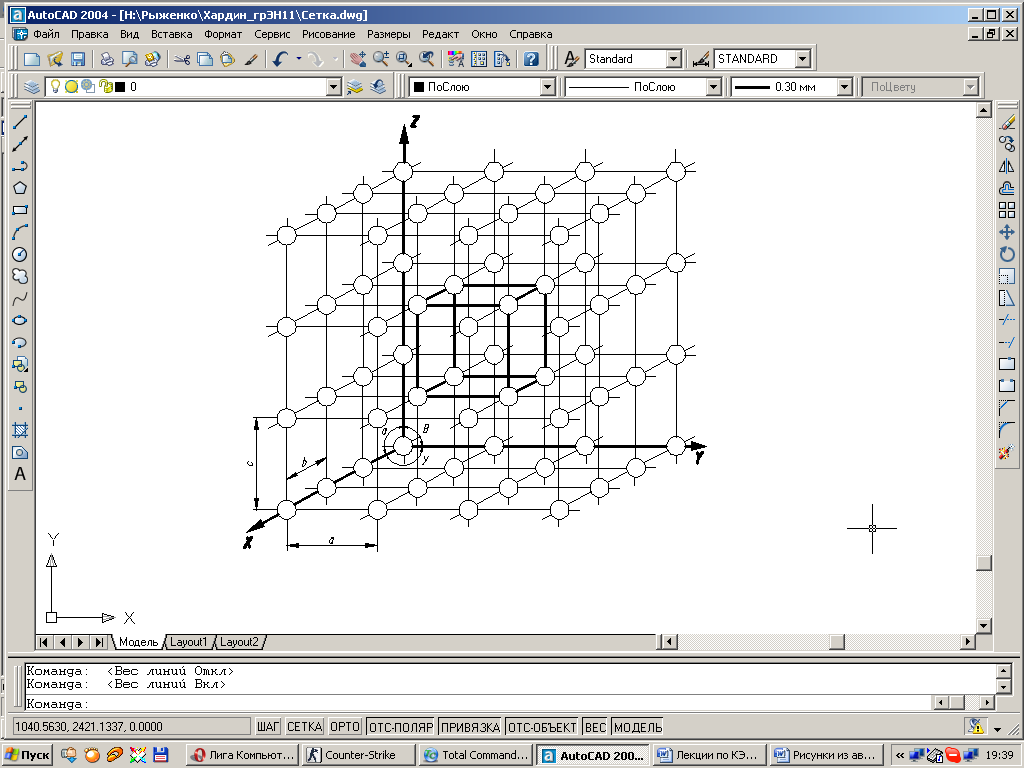
Ближайшие друг к другу атомы образуют контур какой-нибудь геометрической фигуры, например куба (рис. 1.1).
Следовательно, каждое зерно металла состоит из множества таких геометрических тел, называемых элементарными ячейками. В соседних зернах металла эти ячейки ориентированы по-другому.
| Рис. 1.1. Схема кристаллической решетки. |
Что же удерживает атомы в узлах кристаллической решетки, сохраняя природу твердого состояния материала и его прочность.
Известно, что атом любого металла состоит из окружающих его несколько электронных оболочек, несущих отрицательный заряд. Каждая оболочка заполнена строго определенным количеством сильно связанных с атомом электронов и только на последней оболочке, находятся несколько слабосвязанных электронов с атомом. Их число равно валентности металла. С помощью этих электронов атомы в металле устанавливают связи друг с другом. Связь атомов между собой с помощью валентных электронов называется металлической.
Но не все электроны внешней оболочки участвуют в образовании металлической межатомной связи. Часть электронов, покидая ядра своих атомов, уходит в межузельное пространство, образуя электронный «газ», т.е. становятся коллективизированными.
Благодаря коллективизированным электронам металлы обладают электро- и теплопроводностью, металлическим блеском, сверхпроводимостью, термоэлектронной эмиссией, пластической деформацией и другими металлическими свойствами.
Сила связи в металлах определяется силами отталкивания и притяжения между ионами и электронами. Атомы (ионы) располагаются на таком расстоянии один от другого, при котором энергия взаимодействия минимальна.
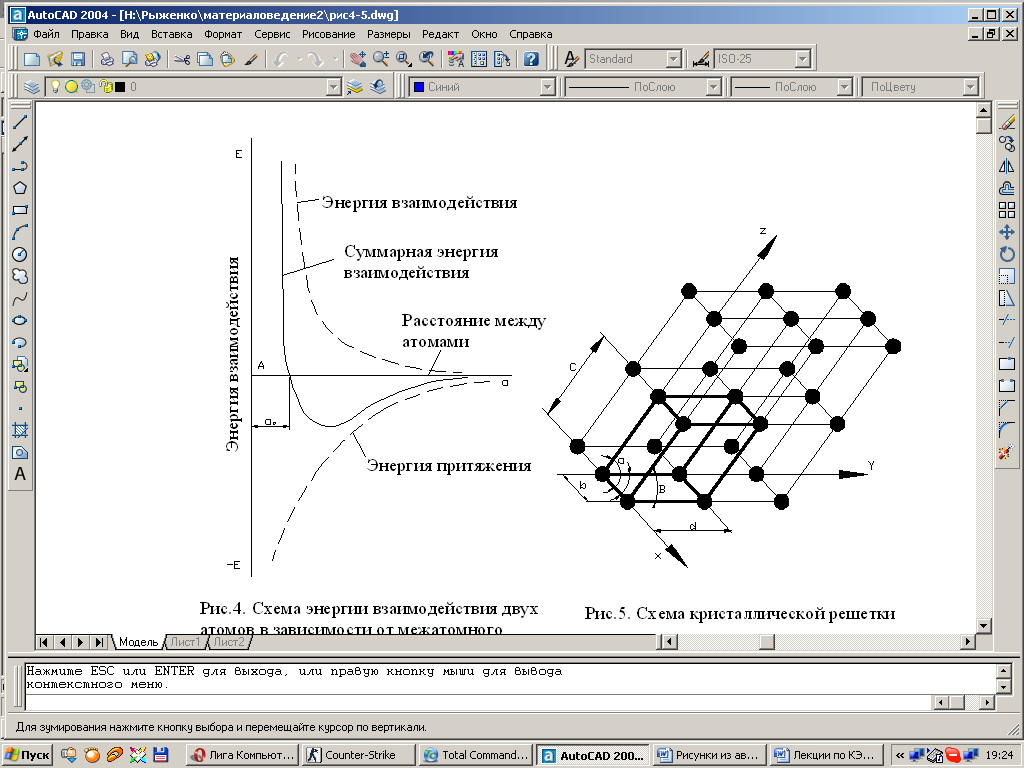
Как видно из рис. 1.2 этому положению соответствует равновесное расстояние a0. Сближение атомов или удаление их на расстояния меньше или больше a0,осуществимо лишь при осуществлении определенной работы против силы отталкивания или притяжения. Поэтому атомы в металле располагаются равномерно, образуя правильную кристаллическую решетку.
Большинство металлов образуют одну из следующих высокосимметричных решеток с
| Рис. 1.2. Схема энергии взаимодействия двух атомов в зависимости от межатомного расстояния. |
а, б) кубическую объемную центрированную (ОЦК) – решетку имеют железо при обычных температурных условиях, хром, вольфрам, ванадий, молибден, калий, натрий;
в) кубическую гранецентрированную (ГЦК) – решетку имеют никель, медь, алюминий, свинец, серебро, железо при температурах 911-1392°С и др. металлы;
г) гексагональную плотно упакованную (ГПУ) – решетку имеют магний, цинк, кобальт, цирконий и титан при комнатной температуре.
Для однозначной характеристики элементарной кристаллической решетки, т.е. её параметров, необходимо знать: три ребра (a, b и c) и
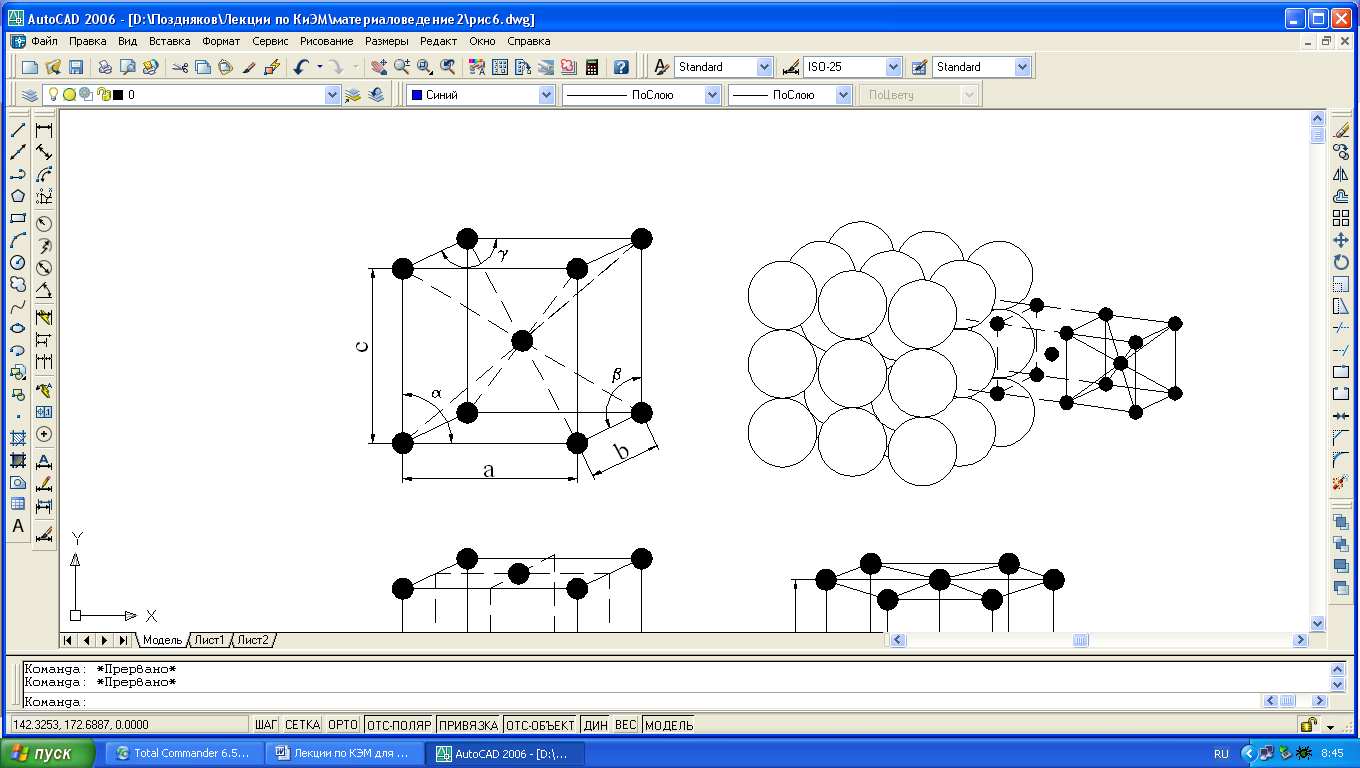
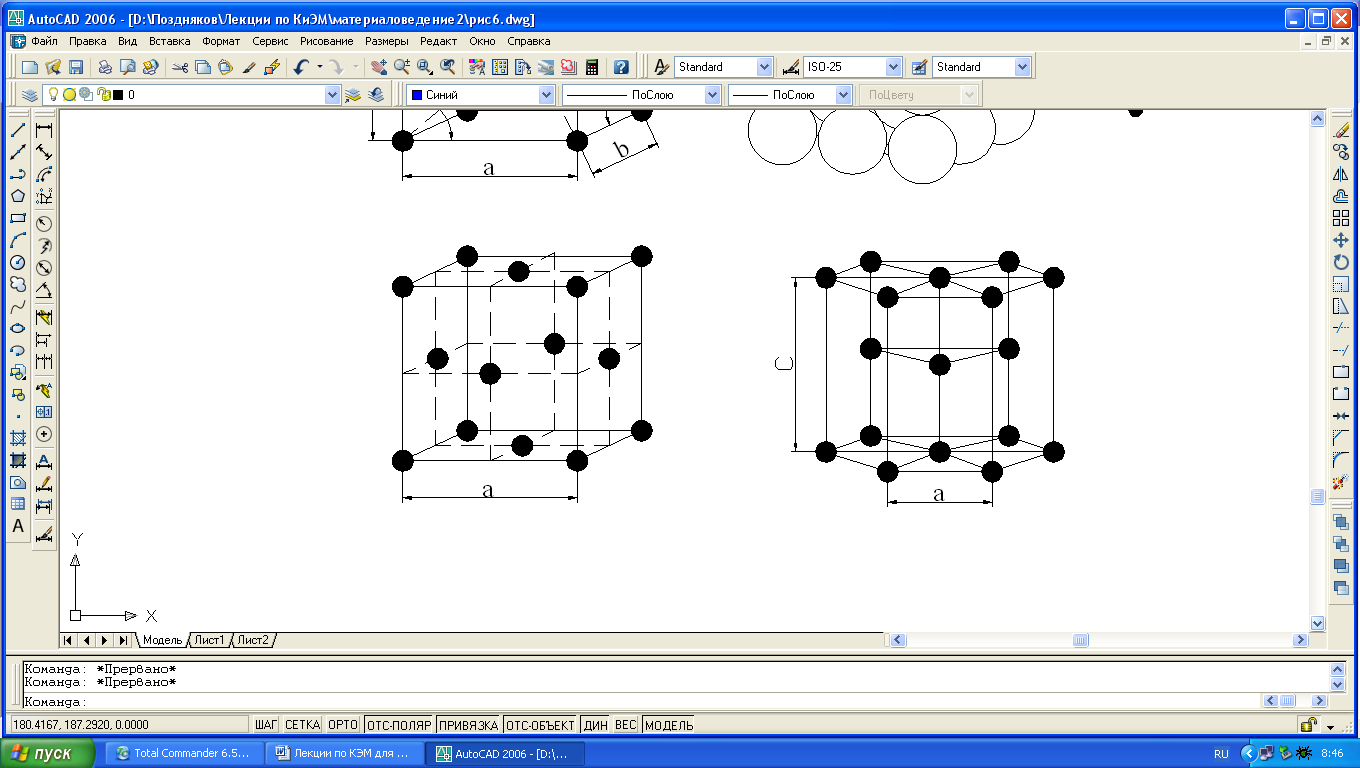
Рис. 1.3. Кристаллические решетки металлов: а и б – кубическая объемноцентрированная (ОЦК); в – кубическая гранецентрированная (ГЦК); г – гексагональная плотноупакованная.
три угла между осями (α, β и γ) (см. рис.1.1). Параметры – расстояния между центрами соседних атомов по избранному направлению и измеряются в нанометрах или Ангстремах А°, причем 1нм=10А°=10 -9 м.
Как видно, что некоторые металлы в зависимости от температурных условий существуют с различными кристаллическими решетками. Например, железо при температурах до 911°С имеет ОЦК-решетку, выше 911°С и до 1392°С имеет ГЦК-решетку и далее свыше 1392°С вплоть до температуры плавления 1539°С принимает форму ОЦК-решетки.
Способность металла изменять тип кристаллической решетки в зависимости от температуры называется аллотропией или полиморфизмом.
Полиморфные превращения имеют важные значения в технике, благодаря им, оказывается возможным производить термическую обработку сталей и других металлов.
Нетрудно видеть, что плотность атомов в кристаллической решетке по различным плоскостям неодинакова (рис. 1.4).
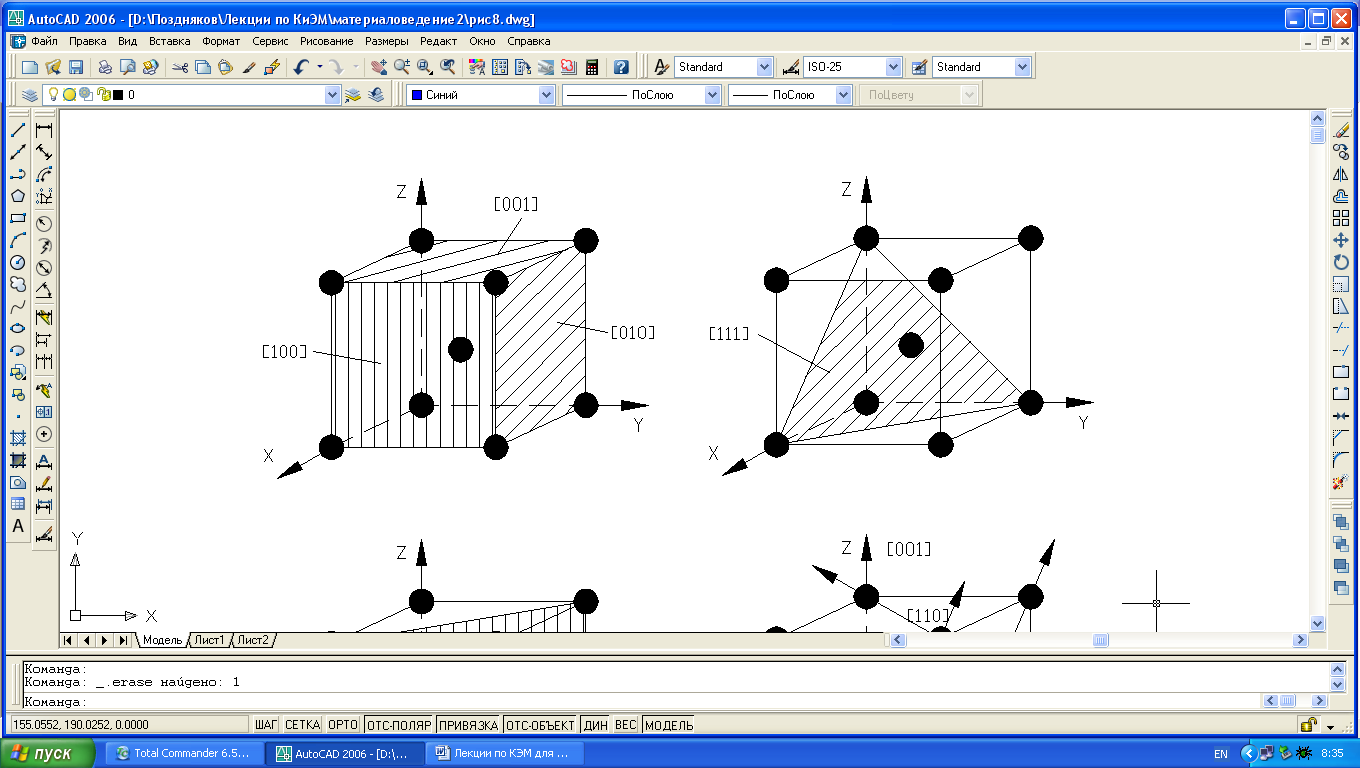
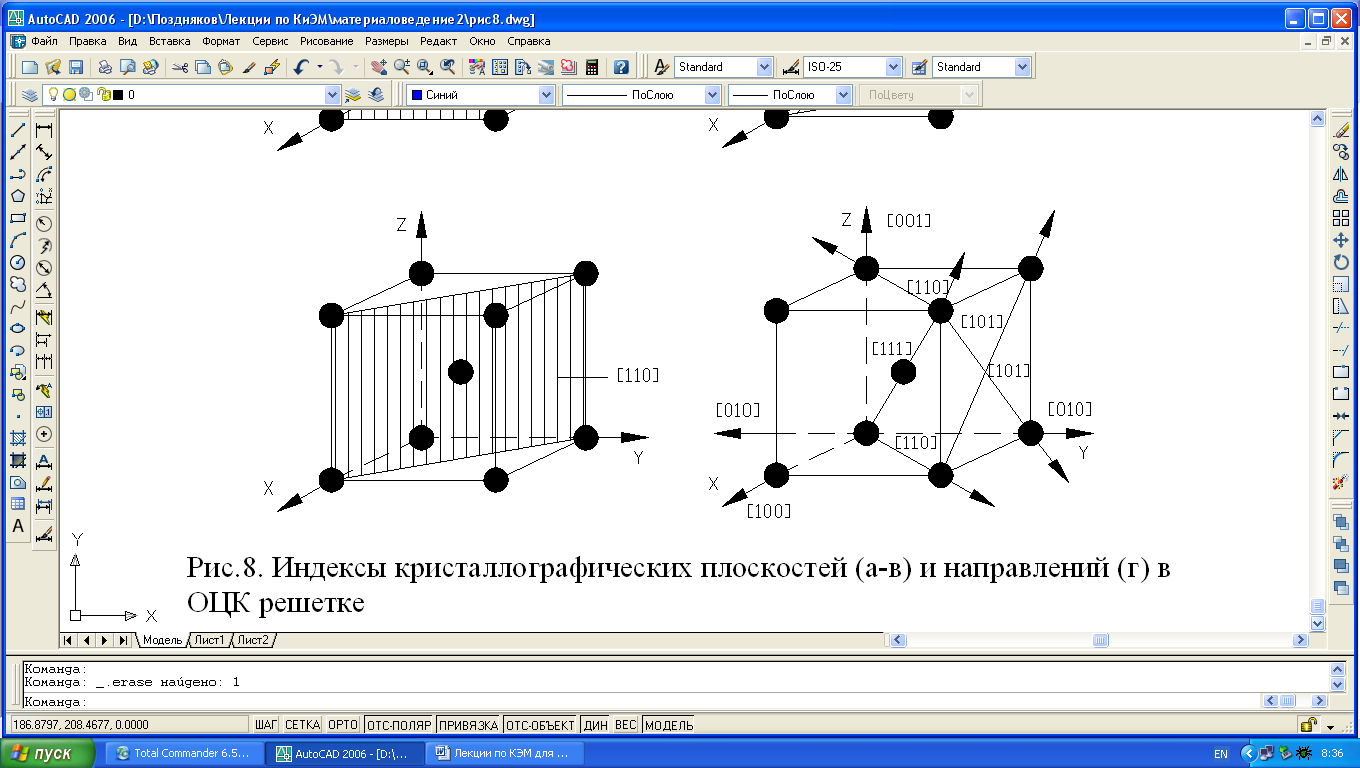
Рис. 1.4. Индексы кристаллографических плоскостей (а-в) и направлений (г) в ОЦК-решетке.
Так плоскость(100) в ОЦК-решетке принадлежит один атом (1/4х4=1), плоскости (110) – 2 атома (1/4х4+1=2), то вследствие неодинаковой плотности в различных плоскостях и направлениях решетки, свойства (химические, физические, механические) каждого монокристалла будут неодинаковы и это называется анизотропией. Следовательно кристалл – тело анизотропное.
Технические металлы – поликристаллические тела, т.е. состоят из большого числа анизотропных кристаллов, которые в большинстве случаев неупорядоченно ориентированы друг к другу. Поэтому свойства во всех направлениях более или менее одинаковы, т.е. поликристаллическое тело псевдоизотропно. Такая мнимая изотропность металла не будет наблюдаться при направленной кристаллизации и значительной холодной деформации.
1.1. Кристаллическое строение металлов.
У металлов электроны на внешних оболочках имеют слабую связь с ядром, легко отрываются и могут свободно перемещаться между положительно заряженными ядрами. Следовательно, в металле положительно заряженные ионы окружены коллективизированными электронами. Так как эти электроны подвижны аналогично частицам газа, то используется термин «электронный газ».
Металлургический тип связи характерен тем, что нет непосредственного соединения атомов друг с другом, нет между ними прямой связи. Атомы в металлах размещаются закономерно, образуя кристаллическую решетку.
Кристаллическая решетка - это мысленно проведенные в пространстве прямые линии, соединяющие ближайшие атомы и проходящие через их центры,
относительно которых они совершают колебательные движения. В итоге образуются фигуры правильной геометрической формы - кристаллическая решетка (рис. 1.1).
.files/image006.png)
Расстояния (а,b,с) между атомами , т.е. параметры кристаллической решетки, находятся в пределах 2… 6 A° (1 A°=10 -8 см). Каждый атом принадлежит 8 кристаллическим решеткам. В аморфных телах с хаотическим расположением атомов в пространстве, свойства в различных направлениях одинаковы, а в кристаллических телах расстояния между атомами в различных направлениях неодинаковы, поэтому различны и свойства. Тип кристаллической решетки (рис. 1.2) зависит от металла, температуры и давления. Это используется при термообработке металлов для упрочнения их.
Реальные металлы состоят из большого количества кристаллов, различно ориентированных в пространстве относительно друг друга. На границах зерен атомы кристаллов не имеют правильного расположения, здесь скапливаются примеси, дефекты и включения. Экспериментально установлено , что внутреннее кристаллическое строение зерен не является правильным. В решетках имеются различные дефекты ( несовершенства ), которые нарушают связь между атомами и оказывают влияние на свойства металлов .
Имеются следующие несовершенства в кристаллических решетках :
1. Точечные (рис. 1.3):
а) Наличие вакансий, т. е. мест в решетке, не занятых атомами. Это происходит из-за смещения атомов от равновесного состояния. Число вакансий увеличивается с ростом температуры.
.files/image007.png) |
б) Дислоцированные атомы, т. е. атомы вышедшие из узла решетки и занявшие место в междоузлии.
в) Примесные атомы, т.е. в основном металле имеются чужеродные примеси. Например, в чугуне основными атомами являются атомы железа, а примесными- атомы углерода, которые или занимают место основного атома, или внедряются внутрь ячейки.
2. Поверхностные несовершенства, имеющие небольшую толщину при значительных размерах в двух других направлениях.
3. Линейные несовершенства ( цепочки вакансий, дислокаций и т. д.). Линейные дефекты малы в двух направлениях и значительно большего размера в третьем.
Количество дефектов в металле оказывает существенное влияние на его прочность. На первом участке кривой (рис. 1.4) при минимуме дислокаций меньше возможностей для сдвига атомов по кристаллической решетке ,поэтому будет максимум прочности металла (теоретическая, недостижимая прочность). Путем восстановления из хлористого или бромистого железа в лабораторных условиях выращивают «усы» кристаллов железа длиной до 10 см и диаметром 0,5 … 1 мкм , имеющие относительно высокую прочность на растяжение (бb = 1200 …1300 кгс / мм 2 ). Для сравнения, высокопрочная сталь имеет прочность всего 150 …200 кгс / мм 2 , т.е. на порядок ниже, а прочность железных «усов» примерно в 100 раз выше , чем у обычного железа (минимум на кривой) .
.files/image009.png)
Повышение прочности с увеличением плотности дислокаций выше их критического значения объясняется тем , что имеются не только параллельные , но и взаимопересекающиеся ( объемные ) дислокации . Они препятствуют взаимному перемещению металла и, как результат, приводят к увеличению прочности металла.
Все современные способы упрочнения металлов (легирование, закалка, прокатка, ковка, штамповка, волочение и т.д.) – это увеличение количества дефектов в металле. Наивысшая прочность, которую можно получить путем увеличения количества дефектов в металле , составляет около 1/3 от теоретически возможной (идеальной) прочности.
.files/image011.png) |
При нагреве и охлаждении (рис. 1.5) аморфных тел ( смола, стекло, пластмассы,…) при переходе из жидкого в твердое состояние качественных изменений не происходит. В твердом состоянии атомы в аморфном теле расположены так же хаотично, как и в жидком, имеют только меньшую степень перемещения. Из рис 1. 5 видим, что температура плавления Тпл равняется температуре кристаллизации Ткр, а переход из одного состояния в другое ( из твердого в жидкое- точка Тпл ,и из жидкого в твердое- точка Ткр ) происходит скачкообразно.
По другому ведут себя металлы ( рис. 1.6). На участке 1 - 2 происходит нагрев металла ; кристаллическая решетка сохраняется, но атомы увеличивают амплитуду колебаний за счет поглощенной тепловой энергии. На горизонтальном участке 2 - 3 также подводится тепло, но температура Тпл не повышается, т.к. подводимое тепло целиком расходуется на разрушение кристаллической решетки. Атомы переходят в неупорядоченное (жидкое) состояние . После разрушения последнего участка кристаллов, после точки 3 начинается повышение температуры жидкого металла по линии 3 - 4.
При охлаждении (4- 5) на горизонтальном участке 5 - 6 происходит кристаллизация, при которой выделяется тепло, поэтому процесс проходит при постоянной температуре Ткр. Кристаллизация металла происходит не при температуре плавления Тпл , а при некотором переохлаждении Dt, величина которая зависит от природы металла, наличия примесей и от скорости охлаждения.
Кристаллизация начинается с того , что при понижении температуры до значения Ткр начинают образовываться мелкие кристаллики, называемые центрами кристаллизации ( зародышами ). При дальнейшем уменьшении энергии металла происходит рост кристаллов и в то же время в жидкости возникают новые центры кристаллизации, т.е. процесс кристаллизации состоит из двух одновременно происходящих процессов :зарождение новых центров кристаллов и роста кристаллов из ранее образованных центров.
.files/image016.png) |
Скорости кристаллизации и числа центров в зависимости от Dt изменяются по закону нормального распределения (рис.1.7).
.files/image017.png) |
При переохлаждении (б) образуется мелкое зерно, т. к кристаллы быстро образуются, но медленно растут ,а при меньших (а) значениях Dt возникает крупное зерно. Мелкокристаллический металлболее твердый и прочный, чем крупнокристаллический. Следовательно, подбором температуры переохлаждения Dt можно регулировать механические характеристики металла. Многое зависит от количества нерастворимых примесей, которые являются центрами кристаллизации. Чем больше этих частиц, тем меньше зерна металла.
Влияние степени переохлаждения Dt на процесс кристаллизации хорошо видно в структуре слитка (рис. 1.8). Полученная в конверторе или в мартене, сталь (0,5…3 тн) заливается в изложницу . Большой перепад температур (свыше 1500 °С) будет между расплавленным металлом и атмосферой по высоте и ширине слитка. В результате на поверхности слитка, т. е. там, где имеется наибольший перепад температур, будет мелкозернистая структура, а в центре слитка при минимальном перепаде температур возникнут при кристаллизации крупные , а между ними –столбчатые кристаллы .
Российские ученые и практики сделали много открытий в металловедении и технологии обработки металлов. Так, основы научной металлургии и геологии заложил еще Михаил Васильевич Ломоносов ,об этом свидетельствует написанный им в 1763 году труд «Первые основания металлургии или рудных дел».
Дмитрий Иванович Менделеев систематизировал в периодической таблице химические элементы, что способствовало развитию многих вопросов металловедения ( из известных в то время 63 химических элемента 50 были металлами). Родоначальником металлургии является и русский горный инженер Павел Петрович Аносов (1797…1851 г.), работающий в городе Златоусте на Урале. Он впервые применил световой микроскоп для изучения микроструктур металлов и нашел секрет булатной стали, заложил основы легирования стали (исследовал добавки золота, платины, хрома, марганца и других элементов к стали).
Дмитрий Константинович Чернов (1839…1921 г.) - основоположник теории и строения стального слитка. Работал на Обуховском заводе г. Санкт-Петербурга.
Читайте также:
