Атомы металлов способны только отдавать валентные электроны
В с п о м н и т е, что такое атом, из чего состоит атом, изменяется ли атом в химических реакциях.
Атом – это электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Число электронов в ходе химических процессов может изменяться, но заряд ядра всегда остается неизменным. Зная распределение электронов в атоме (строение атома), можно предсказать многие свойства данного атома, а также свойства простых и сложных веществ, в состав которых он входит.
Строение атома, т.е. состав ядра и распределение электронов вокруг ядра, несложно определить по положению элемента в периодической системе.
В периодической системе Д.И.Менделеева химические элементы располагаются в определенной последовательности. Эта последовательность тесно связана со строением атомов этих элементов. Каждому химическому элементу в системе присвоен порядковый номер, кроме того, для него можно указать номер периода, номер группы, вид подгруппы.
Зная точный «адрес» химического элемента – группу, подгруппу и номер периода, можно однозначно определить строение его атома.
Период – это горизонтальный ряд химических элементов. В современной периодической системе семь периодов. Первые три периода – малые, т.к. они содержат 2 или 8 элементов:
1-й период – Н, Не – 2 элемента;
2-й период – Li … Nе – 8 элементов;
3-й период – Na . Аr – 8 элементов.
Остальные периоды – большие. Каждый из них содержит 2–3 ряда элементов:
4-й период (2 ряда) – K . Kr – 18 элементов;
6-й период (3 ряда) – Сs . Rn – 32 элемента. В этот период входит ряд лантаноидов.
Группа – вертикальный ряд химических элементов. Всего групп восемь. Каждая группа состоит из двух подгрупп: главной подгруппы и побочной подгруппы. Например:

Главную подгруппу образуют химические элементы малых периодов (например, N, P) и больших периодов (например, As, Sb, Bi).
Побочную подгруппу образуют химические элементы только больших периодов (например, V, Nb,
Ta).
Визуально эти подгруппы различить легко. Главная подгруппа «высокая», она начинается с 1-го или 2-го периода. Побочная подгруппа – «низкая», начинается с 4-го периода.
Итак, каждый химический элемент периодической системы имеет свой адрес: период, группу, подгруппу, порядковый номер.
Например, ванадий V – это химический элемент 4-го периода, V группы, побочной подгруппы, порядковый номер 23.
Задание 3.1. Укажите период, группу и подгруппу для химических элементов с порядковыми номерами 8, 26, 31, 35, 54.
Задание 3.2. Укажите порядковый номер и название химического элемента, если известно, что он находится:
а) в 4-м периоде, VI группе, побочной подгруппе;
б) в 5-м периоде, IV группе, главной подгруппе.
Каким образом можно связать сведения о положении элемента в периодической системе со строением его атома?
Атом состоит из ядра (оно имеет положительный заряд) и электронов (они имеют отрицательный заряд). В целом атом электронейтрален.
Положительный заряд ядра атома равен порядковому номеру химического элемента.
Ядро атома – сложная частица. В ядре сосредоточена почти вся масса атома. Поскольку химический элемент – совокупность атомов с одинаковым зарядом ядра, то около символа элемента указывают следующие его координаты:

По этим данным можно определить состав ядра. Ядро состоит из протонов и нейтронов.
Протон p имеет массу 1 (1,0073 а. е. м.) и заряд +1. Нейтрон n заряда не имеет (нейтрален), а масса его приблизительно равна массе протона (1,0087 а. е. м.).
Заряд ядра определяют протоны. Причем число протонов равно (по величине) заряду ядра атома, т.е. порядковому номеру.
Число нейтронов N определяют по разности между величинами: «масса ядра» А и «порядковый номер» Z. Так, для атома алюминия:
N = А – Z = 27 –13 = 14n,

Задание 3.3. Определите состав ядер атомов, если химический элемент находится в:
а) 3-м периоде, VII группе, главной подгруппе;
б) 4-м периоде, IV группе, побочной подгруппе;
в) 5-м периоде, I группе, главной подгруппе.
Как известно, ядро атома в химических процессах не изменяется. А что изменяется? Переменным оказывается общее число электронов в атоме и распределение электронов. Общее число электронов в нейтральном атоме определить несложно – оно равно порядковому номеру, т.е. заряду ядра атома:
Электроны имеют отрицательный заряд –1, а масса их ничтожна: 1/1840 от массы протона.
Отрицательно заряженные электроны отталкиваются друг от друга и находятся на разных расстояниях от ядра. При этом электроны, имеющие приблизительно равный запас энергии, находятся на приблизительно равном расстоянии от ядра и образуют энергетический уровень.
Число энергетических уровней в атоме равно номеру периода, в котором находится химический элемент. Энергетические уровни условно обозначают так (например, для Al):

Задание 3.4. Определите число энергетических уровней в атомах кислорода, магния, кальция, свинца.
На каждом энергетическом уровне может находиться ограниченное число электронов:
• на первом – не более двух электронов;
• на втором – не более восьми электронов;
• на третьем – не более восемнадцати электронов.
Эти числа показывают, что, например, на втором энергетическом уровне может находиться 2, 5 или 7 электронов, но не может быть 9 или 12 электронов.
Важно знать, что независимо от номера энергетического уровня на внешнем уровне (последнем) не может быть больше восьми электронов. Внешний восьмиэлектронный энергетический уровень является наиболее устойчивым и называется завершенным. Такие энергетические уровни имеются у самых неактивных элементов – благородных газов.
Как определить число электронов на внешнем уровне остальных атомов? Для этого существует простое правило: число внешних электронов равно:
• для элементов главных подгрупп – номеру группы;
• для элементов побочных подгрупп оно не может быть больше двух.
Рис. 5.
Схема определения числа
внешних электронов атомов
Задание 3.5. Укажите число внешних электронов для химических элементов с порядковыми номерами 15, 25, 30, 53.
Задание 3.6. Найдите в периодической системе химические элементы, в атомах которых имеется завершенный внешний уровень.
Очень важно правильно определять число внешних электронов, т.к. именно с ними связаны важнейшие свойства атома. Так, в химических реакциях атомы стремятся приобрести устойчивый, завершенный внешний уровень (8е). Поэтому атомы, на внешнем уровне которых мало электронов, предпочитают их отдать.
Химические элементы, атомы которых способны только отдавать электроны, называют металлами. Очевидно, что на внешнем уровне атома металла должно быть мало электронов: 1, 2, 3.
Если на внешнем энергетическом уровне атома много электронов, то такие атомы стремятся принять электроны до завершения внешнего энергетического уровня, т. е. до восьми электронов. Такие элементы называют неметаллами.
В о п р о с. К металлам или неметаллам относятся химические элементы побочных подгрупп? Почему?
О т в е т. Металлы и неметаллы главных подгрупп в таблице Менделеева отделяет линия, которую можно провести от бора к астату. Выше этой линии (и на линии) располагаются неметаллы, ниже – металлы. Все элементы побочных подгрупп оказываются ниже этой линии.
Задание 3.7. Определите, к металлам или неметаллам относятся: фосфор, ванадий, кобальт, селен, висмут. Используйте положение элемента в периодической системе химических элементов и число электронов на внешнем уровне.
Для того, чтобы составить распределение электронов по остальным уровням и подуровням, следует воспользоваться следующим а л г о р и т м о м.
1. Определить общее число электронов в атоме (по порядковому номеру).
2. Определить число энергетических уровней (по номеру периода).
3. Определить число внешних электронов (по виду подгруппы и номеру группы).
4. Указать число электронов на всех уровнях, кроме предпоследнего.
5. Рассчитать число электронов на предпоследнем уровне.
Например, согласно пунктам 1–4 для атома марганца определено:

Всего 25е; распределили (2 + 8 + 2) = 12e; значит, на третьем уровне находится: 25 – 12 = 13e.
Получили распределение электронов в атоме марганца:

Задание 3.8. Отработайте алгоритм, составив схемы строения атомов для элементов № 16, 26, 33, 37. Укажите, металлы это или неметаллы. Ответ поясните.
Составляя приведенные выше схемы строения атома, мы не учитывали, что электроны в атоме занимают не только уровни, но и определенные подуровни каждого уровня. Виды подуровней обозначаются латинскими буквами: s, p, d.
Число возможных подуровней равно номеру уровня. Первый уровень состоит из одного
s-подуровня. Второй уровень состоит из двух подуровней – s и р. Третий уровень – из трех подуровней – s, p и d.
На каждом подуровне может находиться строго ограниченное число электронов:
на s-подуровне – не больше 2е;
на р-подуровне – не больше 6е;
на d-подуровне – не больше 10е.
Подуровни одного уровня заполняются в строго определенном порядке: s p d.
Таким образом, р-подуровнь не может начать заполняться, если не заполнен s-подуровень данного энергетического уровня, и т.д. Исходя из этого правила, несложно составить электронную конфигурацию атома марганца:
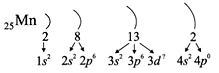
В целом электронная конфигурация атома марганца записывается так:
25Мn 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 2 .
Здесь и далее приняты следующие обозначения:

Задание 3.9. Составьте электронные конфигурации атомов для химических элементов № 16, 26, 33, 37.
Для чего необходимо составлять электронные конфигурации атомов? Для того, чтобы определять свойства этих химических элементов. Следует помнить, что в химических процессах участвуют только валентные электроны.
Валентные электроны находятся на внешнем энергетическом уровне и незавершенном
d-подуровне предвнешнего уровня.
Определим число валентных электронов для марганца:

или сокращенно: Мn … 3d 5 4s 2 .
Что можно определить по формуле электронной конфигурации атома?
1. Какой это элемент – металл или неметалл?
Марганец – металл, т.к. на внешнем (четвертом) уровне находится два электрона.
2. Какой процесс характерен для металла?
Атомы марганца в реакциях всегда только отдают электроны.
3. Какие электроны и сколько будет отдавать атом марганца?
В реакциях атом марганца отдает два внешних электрона (они дальше всех от ядра и слабее притягиваются им), а также пять предвнешних d-электронов. Общее число валентных электронов – семь (2 + 5). В этом случае на третьем уровне атома останется восемь электронов, т.е. образуется завершенный внешний уровень.
Все эти рассуждения и заключения можно отразить при помощи схемы (рис. 6):
Рис. 6.
Схема отдачи электронов атомом марганца
Полученные условные заряды атома называют степенями окисления.
Рассматривая строение атома, аналогичным способом можно показать, что типичными степенями окисления для кислорода является –2, а для водорода +1.
В о п р о с. С каким из химических элементов может образовывать соединения марганец, если учесть полученные выше степени его окисления?
О т в е т. Только с кислородом, т.к. его атом имеет противоположную по заряду степень окисления. Формулы соответствующих оксидов марганца (здесь степени окисления соответствуют валентностям этих химических элементов):
Для закрепления всех этих понятий рассмотрим строение атома теллура и некоторые его свойства:
Как неметалл, атом Te может принять 2 электрона до завершения внешнего уровня и отдать «лишние» 6 электронов:
Задание 3.10. Изобразите электронные конфигурации атомов Nа, Rb, Cl, I, Si, Sn. Определите свойства этих химических элементов, формулы их простейших соединений (с кислородом и водородом).
Практические выводы
1. В химических реакциях участвуют только валентные электроны, которые могут находиться только на двух последних уровнях.
2. Атомы металлов могут только отдавать валентные электроны (все или несколько), принимая положительные степени окисления.
3. Атомы неметаллов могут принимать электроны (недостающие – до восьми), приобретая при этом отрицательные степени окисления, и отдавать валентные электроны (все или несколько), при этом они приобретают положительные степени окисления.
Сравним теперь свойства химических элементов одной подгруппы, например натрия и рубидия:
Nа . 3s 1 и Rb . 5s 1 .
Что общего в строении атомов этих элементов? На внешнем уровне каждого атома по одному электрону – это активные металлы. Металлическая активность связана со способностью отдавать электроны: чем легче атом отдает электроны, тем сильнее выражены его металлические свойства.
Что удерживает электроны в атоме? Притяжение их к ядру. Чем ближе электроны к ядру, тем сильнее они притягиваются ядром атома, тем труднее их «оторвать».
Исходя из этого, ответим на вопрос: какой элемент – Nа или Rb – легче отдает внешний электрон? Какой из элементов является более активным металлом? Очевидно, рубидий, т.к. его валентные электроны находятся дальше от ядра (и слабее удерживаются ядром).
Вывод. В главных подгруппах сверху вниз металлические свойства усиливаются, т.к. возрастает радиус атома, и валентные электроны слабее притягиваются к ядру.
Сравним свойства химических элементов VIIa группы: Cl …3s 2 3p 5 и I …5s 2 5p 5 .
Оба химических элемента – неметаллы, т.к. до завершения внешнего уровня не хватает одного электрона. Эти атомы будут активно притягивать недостающий электрон. При этом чем сильнее притягивает атом неметалла недостающий электрон, тем сильнее проявляются его неметаллические свойства (способность принимать электроны).
За счет чего происходит притяжение электрона? За счет положительного заряда ядра атома. Кроме того, чем ближе электрон к ядру, тем сильнее их взаимное притяжение, тем активнее неметалл.
В о п р о с. У какого элемента сильнее выражены неметаллические свойства: у хлора или йода?
О т в е т. Очевидно, у хлора, т.к. его валентные электроны расположены ближе к ядру.
Вывод. Активность неметаллов в подгруппах сверху вниз убывает, т.к. возрастает радиус атома и ядру все труднее притянуть недостающие электроны.
Сравним свойства кремния и олова: Si …3s 2 3p 2 и Sn …5s 2 5p 2 .
На внешнем уровне обоих атомов по четыре электрона. Тем не менее эти элементы в периодической системе находятся по разные стороны от линии, соединяющей бор и астат. Поэтому у кремния, символ которого находится выше линии В–At, сильнее проявляются неметаллические свойства. Напротив, у олова, символ которого находится ниже линии В–At, сильнее проявляются металлические свойства. Это объясняется тем, что в атоме олова четыре валентных электрона удалены от ядра. Поэтому присоединение недостающих четырех электронов затруднено. В то же время отдача электронов с пятого энергетического уровня происходит достаточно легко. Для кремния возможны оба процесса, причем первый (прием электронов) преобладает.
Выводы по главе 3. Чем меньше внешних электронов в атоме и чем дальше они от ядра, тем сильнее проявляются металлические свойства.
Чем больше внешних электронов в атоме и чем ближе они к ядру, тем сильнее проявляются неметаллические свойства.
Основываясь на выводах, сформулированных в этой главе, для любого химического элемента периодической системы можно составить «характеристику».
Периодический закон Д.И.Менделеева: свойства химических элементов, а также свойства простых и сложных веществ, образованных ими, находятся в периодической зависимости от заряда ядер их атомов.
Физический смысл периодического закона: свойства химических элементов периодически повторяются потому, что периодически повторяются конфигурации валентных электронов (распределение электронов внешнего и предпоследнего уровней).
Так, у химических элементов одной и той же подгруппы одинаковое распределение валентных электронов и, значит, похожие свойства.
Например, у химических элементов пятой группы пять валентных электронов. При этом в атомах химических элементов главных подгрупп – все валентные электроны находятся на внешнем уровне: … ns 2 np 3 , где n – номер периода.
У атомов элементов побочных подгрупп на внешнем уровне находятся только 1 или 2 электрона, остальные – на d-подуровне предвнешнего уровня: … (n – 1)d 3 ns 2 , где n – номер периода.
Задание 3.12. Составьте краткие электронные формулы для атомов химических элементов № 35 и 42, а затем составьте распределение электронов в этих атомах по алгоритму. Убедитесь, что ваше предсказание сбылось.
Металлы
В периодах и группах периодической системы Д. И. Менделеева существуют закономерности в изменении металлических и неметаллических свойств элементов, можно достаточно определённо указать положение элементов-металлов и элементов-неметаллов в периодической системе. Если провести диагональ от элемента бора B (порядковый номер 5) до элемента астата At (порядковый номер 85), то слева от этой диагонали в периодической системе все элементы являются металлами, а справа от неё элементы побочных подгрупп являются металлами, а элементы главных подгрупп – неметаллами. Элементы расположенные вблизи диагонали (например, Al, Ti, Ge, Sb, Te, As, Nb), обладают двойственными свойствами: в некоторых своих соединениях ведут себя как металлы; в некоторых – проявляют свойства неметаллов.
Все s-элементы (кроме H и He), d-элементы (все элементы побочных подгрупп) и f-элементы (лантаноиды и актиноиды) являются металлами. Среди p-элементов есть и металлы, и неметаллы, число элементов-металлов увеличивается с увеличением номера периода.
Деление на металлы и неметаллы объясняется различием в строении атомов. Рассмотрим, например, строение атомов третьего периода:
Элементы третьего периода: Na, Mg, Al, Si, P, S, Cl, Ar (аргон).
Радиус атома: 0.19; 0.16; 0.143; 0.134; 0.130; 0.104; 0.099.
Число электронов на внешнем слое: 1, 2, 3, 4, 5, 6, 7.
Электроотрицательность: 0.9; 1.2; 1.5; 1.8; 2.1; 2.5; 3.0.
Любой гидроксид содержит гидроксидные группы – OH.
а. Радиус атомов уменьшается;
б. Заряд ядра увеличивается;
в. Электроотрицательность увеличивается;
г. Число электронов на внешнем слое увеличивается;
д. Прочность связи внешних электронов с ядром увеличивается;
е. Способность атомов отдавать электроны уменьшается.
Na, Mg, Al – металлы, а Si, P, S, Cl – неметаллы.
Атомы большинства металлов на внешнем электронном слое имеют от 1 до 3 электронов. Исключение: атомы германия Ge, олова Sn, свинца Pb на внешнем электронном слое имеют четыре электрона, атомы сурьмы Sb, висмута Bi – пять, атомы полония Po – шесть. Атомы металла имеют меньший заряд ядра и больший радиус (размер) по сравнению с атомами неметаллов данного периода. Потому прочность связи внешних электронов с ядром в атомах металлов небольшая. Атомы металлов легко отдают валентные электроны и превращаются в положительно заряженные ионы.
Простые вещества, которые образуют элементы-металлы, при обычных условиях являются твёрдыми веществами (кроме ртути). Кристаллическая решётка металлов образуется за счёт металлической связи. Имеющиеся между узлами кристаллической решётки свободные электроны могут переносить теплоту и электрический ток, что является причиной главных физических свойств металлов – высокой электро- и теплопроводности.
Металлическая связь образуется во всех металлах. Это связь, которую осуществляют относительно свободные электроны с положительными ионами металлов в кристаллической решётке. Атомы металла легко отдают валентные электроны и превращаются в положительные ионы. Относительно свободные электроны перемещаются между положительными ионами металла и между ними возникает металлическая связь, то есть электроны как бы цементируют положительные ионы металла в кристаллической решётке.
Атомы металлов более или менее легко отдают электроны, то есть окисляются.
Энергия, которая необходима для отрыва электрона от атома и превращение его в положительно заряженный ион, называется энергией ионизации. Металлы характеризуются небольшими величинами энергий ионизации.
Атомы металлов не могут присоединять электроны. Поэтому металлы во всех химических реакциях являются восстановителями и в соединениях имеют только положительные степени окисления. Восстановительная активность различных металлов не одинакова. В периодах слева направо восстановительная активность уменьшается; в главных подгруппах сверху вниз – увеличивается. Восстановительная активность металлов в химических реакциях, которые протекают в водных растворах различных веществ, характеризуется положением металлов в электрохимическом ряду напряжений металлов.
Металлы являются восстановителями и вступают в химические реакции с различными окислителями.
2. Альдегиды
Альдегиды – органические вещества, содержащую функциональную группу (альдегидную группу).
Физические свойства металлов
Более 80% известных элементов образуют простые вещества — металлы. К ним относятся s-элементы I и II групп (исключение — водород), все d- и f - элементы, а также р-элементы III группы (кроме бора), IV группы (олово, свинец), V группы cурьма, висмут) и VI группы (полоний).
Особенности строения атомов металлов:
♦ небольшое число электронов на внешнем энергетическом уровне (как правило, один-три электрона). Исключение — атомы р-элементов IV-VI групп;
♦ малые заряды ядер и большие радиусы атомов по сравнению с атомами неметаллов данного периода;
♦ сравнительно слабая связь валентных электронов с ядром;
♦ низкие значения электроотрицательности.
В связи с этим атомы металлов легко отдают валентные электроны и превращаются в положительно заряженные ионы, т. е. металлы - восстановители.
Однако способность отдавать электроны проявляется у металлов неодинаково. В периодах с увеличением зарядов ядер атомов уменьшаются их радиусы, увеличивается число электронов на внешнем уровне и усиливается связь валентных электронов с ядром. Поэтому в периодах слева направо восстановительная способностъ атомов металлов уменьшается.
В главных подгруппах с возрастанием атомных номеров элементов увеличиваются радиусы их атомов и уменьшается притяжение (валентных электронов к ядру. Поэтому в главных подгруппах сверху вниз восстановительная активность атомов металлов возрастает. Следовательно, наиболее активными восстановителями являются щелочные и щелочно-земельные металлы.
Только некоторые металлы (золото, платина) находятся в природе в виде простых веществ (в самородном состоянии). Металлы, расположенные в электрохимическом ряду напряжений между оловом и золотом, встречаются как в виде простых веществ, так и в составе соединений. Большинство же металлов находятся в природе в виде соединений — оксидов, сульфидов, карбонатов и т. д. Распространенность металлов в природе уменьшается в ряду:
Al, Fe, Ca, Na, К, Mg, Ti, Mn, Cr, Ni, Zn, Cu, Sn, Pb, W, Hg, Ag. Аu
Содержание в земной коре (массовая доля, %) уменьшается
Получение металлов из их соединений — задача металлургии. Металлургия — наука о промышленном получении металлов из природного сырья. Различают черную (производство железа и его сплавов) и цветную (производство всех остальных металлов сплавов) металлургию. Любой металлургический процесс является процессом восстановления ионов металла различными восстановителями:
Me n + + пе - = Me
В зависимости от условий проведения процесса восстановления различают несколько способов получения металлов.
Способы получения металлов
Пирометаллургия — восстановление безводных соединений при высокой температуре
Электрометаллургия – восстановление электрическим током
Гидрометаллургия – восстановление из растворов солей
Металл, входящий в состав руды, переводят в раствор, затем восстанавливают более активным металлом:
Задания для самостоятельной работы
1. Атому магния в степени окисления +2 соответствует электронная конфигурация:
а) 1s 2 2s 2 2р 6 3s 2 3р 6 ; в) 1s 2 2s 2 2р 4 ;
б) 1s 2 2s 2 2р 6 ; г) 1s 2 2s 2 2р 6 3s 2 ;
2. При частичном восстановлении водородом 30 г оксида кобальта. В получили смесь оксида и металла массой 26,8 г. Определите количество вещества водорода, вступившего в реакцию, и массовую долю кобальта в полученной смеси.
3. При электролизе раствора сульфата меди (II) в растворе образовалась кислота (около анода), на нейтрализацию которой затрачен раствор объемом 16 см (р = 1,05 г/см 3 ) с массовой долей гидроксида калия 6%. Вычислите массу меди, которая выделилась на катоде.
4. Для восстановления марганца из оксида марганца(1\/) путем алюмотермии было смешано 10,8 г алюминия и 26,2 г оксида. Определите, какое из исходных веществ осталось и какова его масса.
Физические свойства металлов
Все металлы обладают металлической кристаллической решеткой, особенности которой определяют их общие физические и механические свойства.
Общие свойства металлов:
1).Все металлы являются твердыми веществами, за исключением ртути.
2). Металлический блески непрозрачность металлов — результат отражения световых лучей.
3). Электро- и теплопроводность обусловлены наличием в металлических решетках свободных электронов.
С повышением температуры электропроводность металлов уменьшается, а с понижением температуры — увеличивается. Около абсолютного нуля для многих металлов характерно явление сверхпроводимости.
4). Металлы обладают ковкостью и пластичностью. По определению М. В. Ломоносова, «металлом называется светлое тело, которое ковать можно». Металлы легко прокатываются в листы, вытягиваются в проволоку, поддаются ковке, штамповке, прессованию.
Специфические физические свойства металлов:
1). по значению плотности металлы делят на легкие (плотность меньше 5 г/см 3 ): Na, Са, Mg, Al, Ti — и тяжелые (плотность больше 5 г/см 3 ): Zn, Cr, Sn, Mn, Ni, Сu, Ag, Pb, Hg, Аи, W, Os -самый тяжелый;
2). по значению температуры плавления — на легкоплавкие (tпл < 1000 °С): Hg, Na, Sn, Pb, Zn, Mg, Al, Ca, Ag — и тугоплавкие (tпл > 1000 °C): Au, Cu, Mn, Ni, Fe, Ti, Cr, Os, W - самый тугоплавкий;
3). из металлов самые мягкие — щелочные (их можно резать ножом), самый твердый — хром (царапает стекло).
4). по отношению к магнитным полям металлы подразделяют на три группы:
а) ферромагнитные — способны намагничиваться под действием даже слабых магнитных полей (Fe, Со, Ni);
б) парамагнитные — проявляют слабую способность к намагничиванию даже в сильных магнитных полях (Al, Cr, Ti);
в) диамагнитные — не притягиваются к магниту (Sn, Сu, Bi).
4. Химические свойства металлов
Если атомы большинства неметаллов могут как отдавать, так и присоединять электроны, проявляя окислительно-восстановительную двойственность, то атомы металлов способны только отдавать валентные электроны, проявляя восстановительные свойства: Me - пе - = Me п+ (окисление)
Как восстановители металлы взаимодействуют с неметаллами, водой, растворами щелочей, кислот и солей.
1. Общая характеристика элементов металлов
Из \(118\) известных на данный момент химических элементов \(96\) образуют простые вещества с металлическими свойствами, поэтому их называют металлическими элементами .
Металлические химические элементы в природе могут встречаться как в виде простых веществ, так и в виде соединений. То, в каком виде встречаются металлические элементы в природе, зависит от химической активности образуемых ими металлов.
Металлические элементы, образующие химически активные металлы ( Li–Mg ), в природе чаще всего встречаются в виде солей (хлоридов, фторидов, сульфатов, фосфатов и других).
Соли, образуемые этими металлами, являются главной составной частью распространённых в земной коре минералов и горных пород.


В растворённом виде соли натрия, кальция и магния содержатся в природных водах. Кроме того, соли активных металлов — важная составная часть живых организмов. Например, фосфат кальция Ca 3 ( P O 4 ) 2 является главной минеральной составной частью костной ткани.
Металлические химические элементы, образующие металлы средней активности ( Al–Pb ), в природе чаще всего встречаются в виде оксидов и сульфидов.


Металлические элементы, образующие химически неактивные металлы ( Cu–Au ), в природе чаще всего встречаются в виде простых веществ.
 |  |  |
| Рис. \(7\). Самородное золото Au | Рис. \(8\). Самородное серебро Ag | Рис. \(9\). Самородная платина Pt |
Исключение составляют медь и ртуть, которые в природе встречаются также в виде химических соединений.

В Периодической системе химических элементов металлы занимают левый нижний угол и находятся в главных (А) и побочных (Б) группах.
Рис. \(13\). Положение металлов в Периодической системе. Знаки металлических химических элементов расположены ниже ломаной линии B — Si — As — Te
В электронной оболочке атомов металлов на внешнем энергетическом уровне, как правило, содержится от \(1\) до \(3\) электронов. Исключение составляют только металлы \(IV\)А, \(V\)А и \(VI\)А группы, у которых на наружном энергетическом уровне находятся соответственно четыре, пять или шесть электронов.
В атомах металлов главных подгрупп валентные электроны располагаются на внешнем энергетическом уровне, а у металлов побочных подгрупп — ещё и на предвнешнем энергетическом уровне.
Радиусы атомов металлов больше, чем у атомов неметаллов того же периода. В силу отдалённости положительно заряженного ядра атомы металлов слабо удерживают свои валентные электроны.
Рис. \(14\). Характер изменения радиусов атомов химических элементов в периодах и в группах. Радиусы атомов металлов существенно больше, чем радиусы атомов неметаллов, находящихся в том же периоде
Главное отличительное свойство металлов — это их сравнительно невысокая электроотрицательность (ЭО) по сравнению с неметаллами.

Рис. \(15\). Величины относительных электроотрицательностей (ОЭО) некоторых химических элементов (по Л. Полингу). ОЭО металлических химических элементов уступает соответствующей величине неметаллических химических элементов
Атомы металлов, вступая в химические реакции, способны только отдавать электроны, то есть окисляться, следовательно, в ходе превращений могут проявлять себя в качестве восстановителей .
Читайте также:
