Алюминий это переходный металл
Элементы в периодической таблице часто делятся на четыре категории: элементы основной группы, переходные металлы, лантаноиды и актиноиды. В основные элементы группы включают активные металлы в двух колонках по крайней левой части таблицы Менделеева и металлов, полуметаллов и неметаллов в шести колонках на крайней правой. Эти переходные металлы являются металлическими элементами, которые выступают в качестве своего рода моста или перехода между частями сторонами периодической таблицы.
Что это такое
Вам будет интересно: Эвентуальный — это какой?
Из всех групп химических элементов переходные металлы могут быть наиболее сложными для идентификации, потому что существуют различные мнения относительно того, что именно туда должно быть включено. Согласно одному из определений, к ним относят любые вещества с частично заполненной d-электронной подоболочкой (обиталью). Это описание относится к группам с 3-й по 12-ю в периодической таблице, хотя элементы f-блока (лантаноиды и актиноиды, расположенные ниже основной части периодической таблицы) также являются переходными металлами.
Их название связано с именем английского химика Чарльза Бери, который использовал его в 1921 году.

Место в периодической таблице
Переходными являются все металлы рядов, расположенных в группах от IB до VIIIB периодической таблицы:
- с 21-го (скандий) по 29-й (медь);
- с 39-го (иттрий) по 47-й (серебро);
- с 57-го (лантан) до 79-го (золото);
- с 89-го (актиний) до 112-й (коперник).
Последняя группа включает лантаноиды и актиноиды(так называемые f-элементы, которые представляют собой их особую группу, все остальные относятся к d-элементам).
Переходные металлы: список
Перечень этих элементов представлен:
- скандием;
- титаном;
- ванадием;
- хромом;
- марганцем;
- железом;
- кобальтом;
- никелем;
- медью;
- цинком;
- иттрием;
- цирконием;
- ниобием;
- молибденом;
- технецием;
- рутением;
- родием;
- палладием;
- серебром;
- кадмием;
- гафнием;
- танталом;
- вольфрамом;
- рением;
- осмием;
- иридием;
- платиной;
- золотом;
- ртутью;
- резерфодием;
- дубнием;
- сиборгием;
- борием;
- хассием;
- мейтнерием;
- дармштадтием;
- рентгением;
- унунбием.

Группа лантаноидов представлена:
- лантаном;
- церием;
- празеодимом;
- неодимом;
- прометием;
- самарием;
- европием;
- гадолинием;
- тербием;
- диспрозием;
- гольмием;
- эрбием;
- тулием;
- иттербием;
- лютецием.
- актинием;
- торием;
- протактинием;
- ураном;
- нептунием;
- плутонием;
- америцием;
- кюрием;
- берклием;
- калифорнием;
- эйнштейнием;
- фермием;
- менделевием;
- нобелием;
- лоуренсием.
Особенности
В процессе образования соединений атомы металлов могут использоваться как валентные s- и p-электроны, так и d-электроны. Поэтому d-элементы в большинстве случаев характеризуются переменной валентностью, в отличие от элементов главных подгрупп. Это свойство обуславливает их способность к образованию комплексных соединений.
Наличие определенных свойств обуславливает название этих элементов. Все переходные металлы ряда являются твердыми с высокими температурами плавления и кипения. При перемещении слева направо по периодической таблице пять d-орбиталей становятся более заполненными. Их электроны слабо связаны, что способствует высокой электропроводности и податливости переходных элементов. Им свойственна также низкая энергия ионизации (она требуется при удалении электрона от свободного атома).

Химические свойства
Переходные металлы проявляют широкий спектр состояний окисления или положительно заряженных форм. В свою очередь, они позволяют переходным элементам образовывать много различных ионных и частично ионных соединений. Образование комплексов приводит к расщеплению d-орбиталей на два энергетических подуровня, что позволяет многим из них поглощать определенные частоты света. Таким образом, образуются характерные окрашенные растворы и соединения. Эти реакции иногда усиливают относительно низкую растворимость некоторых соединений.
Переходные металлы характеризуются высокой электропроводностью и теплопроводностью. Они податливы. Обычно образуют парамагнитные соединения из-за неспаренных d-электронов. Также им свойственна высокая каталитическая активность.
Следует также отметить, что существует некоторая полемика о классификации элементов на границе между основной группой и элементами переходного металла в правой части таблицы. Этими элементами являются цинк (Zn), кадмий (Cd) и ртуть (Hg).

Проблемы систематизации
Разногласия относительно того, следует ли классифицировать их как относящиеся к основной группе или переходные металлы, свидетельствуют о том, что различия между этими категориями не ясны. Между ними есть определенное сходство: они выглядят как металлы, они податливы и пластичны, они проводят тепло и электричество и образуют положительные ионы. Тот факт, что двумя лучшими проводниками электричества являются переходный металл (медь) и элемент, относящийся к основной группе (алюминий), показывает степень, в которой физические свойства элементов двух этих групп перекрываются.

Сравнительная характеристика
Существуют также различия между основными и переходными металлами. Например, последние являются более электроотрицательными, чем представители основной группы. Поэтому они с большей вероятностью образуют ковалентные соединения.
Другое различие между металлами основной группы и переходными металлами можно увидеть в формулах соединений, которые они образуют. Первые имеют тенденцию образовывать соли (такие как NaCl, Mg 3 N 2 и CaS), в которых достаточно только отрицательных ионов, чтобы уравновесить заряд на положительных ионах. Переходные металлы образуют аналогичные соединения, такие как FeCl3, HgI2 или Cd (OH)2. Однако они чаще, чем металлы основной группы, образуют комплексы, такие как FeCl4- , HgI42- и Cd (ОН)42-, имеющие избыточное количество отрицательных ионов.
Еще одно отличие между основной группой и ионами переходных металлов заключается в легкости, с которой они образуют стабильные соединения с нейтральными молекулами, такими как вода или аммиак.
Урок №52. Алюминий. Нахождение в природе. Свойства алюминия
Главную подгруппу III группы периодической системы составляют бор (В), алюминий (Аl), галлий (Ga), индий (In) и таллий (Тl).
Как видно из приведенных данных, все эти элементы были открыты в XIX столетии.
Хронология открытия металлов главной подгруппы III группы
В – 1806 г. Г. Люссак, Л. Тенар (Франция)
Al – 1825 г. Г. Х. Эрстед (Дания)
Ga – 1875 г. Л. де Буабодран (Франция)
In – 1863 г. Ф. Рейх, И. Рихтер (Германия)
Tl – 1861 г. У. Крукс (Англия)
Бор представляет собой неметалл. Алюминий — переходный металл, а галлий, индий и таллий — полноценные металлы. Таким образом, с ростом радиусов атомов элементов каждой группы периодической системы металлические свойства простых веществ усиливаются.
Строение атома алюминия
Элемент алюминий расположен в III группе, главной «А» подгруппе, 3 периоде периодической системы, порядковый номер №13, относительная атомная масса Ar(Al) = 27. Его соседом слева в таблице является магний – типичный металл, а справа – кремний – уже неметалл. Следовательно, алюминий должен проявлять свойства некоторого промежуточного характера и его соединения являются амфотерными.
p – элемент, проявляет в соединениях степень окисления +3:
Al 0 – 3 e - → Al +3 , - восстановитель
Физические свойства
Алюминий в свободном виде — серебристо-белый металл, обладающий высокой тепло- и электропроводностью.
Температура плавления 650 о С. Алюминий имеет невысокую плотность (2,7 г/см 3 ) — примерно втрое меньше, чем у железа или меди, и одновременно — это прочный металл.
Нахождение в природе
По распространённости в природе занимает 1-е среди металлов и 3-е место среди элементов , уступая только кислороду и кремнию. Процент содержания алюминия в земной коре по данным различных исследователей составляет от 7,45 до 8,14 % от массы земной коры.
В природе алюминий встречается только в соединениях (минералах):
Глинозёмы (смеси каолинов с песком SiO 2 , известняком CaCO 3 , магнезитом MgCO 3 )
Рубин, сапфир – редкие драгоценные разновидности - Al 2 O 3
Получение алюминия
1). Современный рентабельный способ получения алюминия был изобретен американцем Холлом и французом Эру в 1886 году. Он заключается в электролизе раствора оксида алюминия в расплавленном криолите. Расплавленный криолит Na 3 AlF 6 растворяет Al 2 O 3, как вода растворяет сахар. Электролиз “раствора” оксида алюминия в расплавленном криолите происходит так, как если бы криолит был только растворителем, а оксид алюминия - электролитом.
В английской “Энциклопедии для мальчиков и девочек” статья об алюминии начинается следующими словами: “23 февраля 1886 года в истории цивилизации начался новый металлический век - век алюминия. В этот день Чарльз Холл, 22-летний химик, явился в лабораторию своего первого учителя с дюжиной маленьких шариков серебристо-белого алюминия в руке и с новостью, что он нашел способ изготовлять этот металл дешево и в больших количествах”. Так Холл сделался основоположником американской алюминиевой промышленности и англосаксонским национальным героем, как человек, сделавшим из науки великолепный бизнес.
Химические свойства алюминия и его соединений
Алюминий легко взаимодействует с кислородом при обычных условиях и покрыт оксидной пленкой (она придает матовый вид).
Её толщина 0,00001 мм, но благодаря ней алюминий не коррозирует. Для изучения химических свойств алюминия оксидную пленку удаляют. (При помощи наждачной бумаги, или химически: сначала опуская в раствор щелочи для удаления оксидной пленки, а затем в раствор солей ртути для образования сплава алюминия со ртутью – амальгамы).
Взаимодействие с простыми веществами
Алюминий уже при комнатной температуре активно реагирует со всеми галогенами, образуя галогениды. При нагревании он взаимодействует с серой (200 °С), азотом (800 °С), фосфором (500 °С) и углеродом (2000 °С), с йодом в присутствии катализатора - воды:
2Аl + 3S = Аl 2 S 3 (сульфид алюминия),
2Аl + N 2 = 2АlN (нитрид алюминия),
Аl + Р = АlР (фосфид алюминия),
4Аl + 3С = Аl 4 С 3 (карбид алюминия).
2Аl + 3I 2 = 2AlI 3 (йодид алюминия)
Все эти соединения полностью гидролизуются с образованием гидроксида алюминия и, соответственно, сероводорода, аммиака, фосфина и метана:
В виде стружек или порошка он ярко горит на воздухе, выделяя большое количество теплоты:
Взаимодействие со сложными веществами
1. Взаимодействие с водой:
2. Взаимодействие с оксидами металлов:
Алюминий – хороший восстановитель, так как является одним из активных металлов. Стоит в ряду активности сразу после щелочноземельных металлов. Поэтому восстанавливает металлы из их оксидов . Такая реакция – алюмотермия – используется для получения чистых редких металлов, например, таких, как вольфрам, ванадий и др.
Термитная смесь Fe 3 O 4 и Al (порошок) –используется ещё и в термитной сварке.
3. Взаимодействие с кислотами
С раствором серной кислоты: 2Al + 3H 2 SO 4 = Al 2 (SO 4 ) 3 + 3H 2
С холодными концентрированными серной и азотной не реагирует (пассивирует). Поэтому азотную кислоту перевозят в алюминиевых цистернах. При нагревании алюминий способен восстанавливать эти кислоты без выделения водорода:
4. Взаимодействие со щелочами .
2Al + 2NaOH + 6H 2 O = 2Na[Al(OH) 4 ] + 3H 2
Na[Аl(ОН) 4 ] – тетрагидроксоалюминат натрия
По предложению химика А. И. Горбова, в русско-японскую войну эту реакцию использовали для получения водорода для аэростатов.
5. С растворами солей:
Если поверхность алюминия потереть солью ртути, то происходит реакция:
2Al + 3HgCl 2 = 2AlCl 3 + 3Hg
Выделившаяся ртуть растворяет алюминий, образуя амальгаму.
Применение алюминия и его соединений
Крупным потребителем алюминия является авиационная промышленность : самолет на 2/3 состоит из алюминия и его сплавов. Самолет из стали оказался бы слишком тяжелым и смог бы нести гораздо меньше пассажиров. Поэтому алюминий называют крылатым металлом. Из алюминия изготовляют кабели и провода : при одинаковой электрической проводимости их масса в 2 раза меньше, чем соответствующих изделий из меди.
Учитывая коррозионную устойчивость алюминия, из него изготовляют детали аппаратов и тару для азотной кислоты .
Порошок алюминия является основой при изготовлении серебристой краски для защиты железных изделий от коррозии, а также для отражения тепловых лучей такой краской покрывают нефтехранилища, костюмы пожарных.
Оксид алюминия используется для получения алюминия, а также как огнеупорный материал.
Гидроксид алюминия – основной компонент всем известных лекарств маалокса, альмагеля, которые понижают кислотность желудочного сок.
Соли алюминия сильно гидролизуются. Данное свойство применяют в процессе очистки воды. В очищаемую воду вводят сульфат алюминия и небольшое количество гашеной извести для нейтрализации образующейся кислоты. В результате выделяется объемный осадок гидроксида алюминия, который, оседая, уносит с собой взвешенные частицы мути и бактерии. Таким образом, сульфат алюминия является коагулянтом.
ЭТО ИНТЕРЕСНО:
Металлический алюминий первым выделил в 1825 году датский физик Ханс Кристиан Эрстед. Пропустив газообразный хлор через слой раскаленного оксида алюминия, смешанного с углем, Эрстед выделил хлорид алюминия без малейших следов влаги. Чтобы восстановить металлический алюминий, Эрстеду понадобилось обработать хлорид алюминия амальгамой калия. Через 2 года немецкий химик Фридрих Вёллер. Усовершенствовал метод, заменив амальгаму калия чистым калием.
К 1855 году французский ученый Сен- Клер Девиль разработал способ получения металлического алюминия в технических масштабах. Но способ был очень дорогостоящий. Девиль пользовался особым покровительством Наполеона III, императора Франции. В знак своей преданности и благодарности Девиль изготовил для сына Наполеона, новорожденного принца, изящно гравированную погремушку – первое «изделие ширпотреба» из алюминия. Наполеон намеревался даже снарядить своих гвардейцев алюминиевыми кирасами, но цена оказалась непомерно высокой. В то время 1 кг алюминия стоил 1000 марок, т.е. в 5 раз дороже серебра. Только после изобретения электролитического процесса алюминий по своей стоимости сравнялся с обычными металлами.
А знаете ли вы, что алюминий, поступая в организм человека, вызывает расстройство нервной системы. При его избытке нарушается обмен веществ. А защитными средствами является витамин С, соединения кальция, цинка.
При сгорании алюминия в кислороде и фторе выделяется много тепла. Поэтому его используют как присадку к ракетному топливу. Ракета "Сатурн" сжигает за время полёта 36 тонн алюминиевого порошка. Идея использования металлов в качестве компонента ракетного топлива впервые высказал Ф. А. Цандер.
Урок по химии на тему: "Алюминий - переходный элемент. Свойства алюминия. Получение и применение алюминия" (9 класс)
1. Образовательная – продолжить работу по формированию представления учащихся о переходных химических элементах на примере алюминия; выявление готовности учащихся успешно применять полученные знания на практике.
2. Развивающая – развитие самостоятельности и способности к рефлексии.
3. Воспитательная – воспитание положительной мотивации учения, правильной самооценки и чувства ответственности.
Оборудование: растворы едкого натра, соляной кислоты, сульфата алюминия, пробирки.
1. Организационный момент. Вначале урока положительно настраиваем учащихся на активную работу.
2. Повторение. Для объяснения нового материала учитель задает ребятам вопросы из курса химии 8 класса. (фронтальный опрос)
· Назовите химический элемент, имеющий порядковый номер 13 и дайте краткую характеристику элементу. (Ответ учащихся: это алюминий, металл, который находится в 3 группе главной подгруппе, в 3 периоде периодической системе Д.И. Менделеева).
· Каково строение его атома?(Ответ учащихся: заряд ядра атома алюминия +13, 13е, 13р, 14п, электронная формула 1 s 2 2 s 2 2 p 6 3 s 2 3 p 1 .
3. Изучение нового материала.
Свое название алюминий получил от латинского alumen – квасцы. Впервые он был получен в 1825г датским физиком Х.К. Эрстедом. В природе встречается в минералах.
Учитель: Сегодня у нас необычный урок. Я расскажу вам сказку. А для этого мы отправимся в Периодическое царство. (Учитель читает учащимся сказку, по окончании которой, дети в ходе обсуждения должны сформулировать физические и химические свойства алюминия. Во время прослушивания сказки дети по желанию делают для себя записи в тетради).
Итак, в Периодическом царстве, Химическом государстве жил-был красавец Алюминий. Он очень легкий, серебристо-белый металл, но характер у него был вспыльчивый, он очень быстро реагировал со старушками кислотами, щелочами и даже водой.
И страдал наш герой, потому что был очень общителен, разговорчив, он мог бы быть душой любой компании, но никто не хотел дружить с ним. И решил тогда Алюминий уйти из царства. И пошел куда глаза глядят. Долго ли, коротко ли бродил Алюминий, но встретил по дороге дом, восьмерка на доме том, а в окно выглядывает очень веселый газообразный Кислород. Кислород пригласил в гости Алюминий, но тот долго не соглашался, потом рассказал про свою беду.
- Да, страшно жить одному. Я даже не представляю, как бы я жил без своего друга Водорода и без своей сестрички Серы. Но из каждого положения есть выход. Нужна тебе необыкновенная одежда, чтобы она не растворялась ни в кислоте, ни в щелочи, а, уж, в воде и подавно. Вот тогда-то ты сможешь жить, как все другие вещества. А одежду мы с тобой вместе сошьем!
Кислород взял у Алюминия электроны, и тут же произошла реакция. Обрадовался Алюминий, примерил одежду оксидную. С тех пор Алюминий всегда покрыт оксидной пленкой. И пусть одежда не такая блестящая, как была. Но она действительно не растворяется ни в щелочи, ни в кислоте, ни в воде.
(Выслушав внимательно сказку, учащиеся пытаются сформулировать физические и химические свойства металла).
Вывод: (ученики записывают в тетрадь свойства ) .
Физические свойства : Al – серебристо-белый металл, легкий, на воздухе покрывается тонкой прочной пленкой Al 2 O 3, защищающей металл от окисления и коррозии.
Химические свойства:
· 8 Al + 3 Fe 3 O 4 = 4 Al 2 O 3 + 9 Fe (в металлургии алюминий используют для получения железа из термита Fe 3 O 4 , реакция протекает с большим выделением тепла).
2 Al + 2 NaOH = 2 NaAlO 2 + H 2 ( образование алюмината натрия).
Алюминий проявляет амфотерные свойства, является переходным элементом, т.е. его оксиды и гидроксиды реагирует и с кислотами, и с щелочами. Далее учитель проводит опыт: «Получение амфотерного гидроксида алюминия и изучение его свойств»
Опыт. В 2 пробирки с раствором сульфата алюминия добавим несколько капель раствора щелочи. Наблюдаем в результате реакции выпадение осадка гидроксида алюминия. К содержимому в одну пробирку добавим раствор соляной кислоты, в другую – раствор щелочи.
· 2 Al ( OH )3 + 6 HCl = 2 AlCl 3 + 3 H 2 O – проявляет основные свойства
· Al ( OH )3 + NaOH = NaAlO 2 + H 2 O – проявляет кислотные свойства.
Применение алюминия:
· в медицине (применяют в качестве кровоостанавливающего и прижигающего средства), в стоматологии каолин (белая глина Al 2 O 3 *2 SiO 2 *2 H 2 O )
· в электротехнике (благодаря высокой электропроводности).
4. Закрепление.
Верны ли утверждения: да(нет)
1. Встречается в свободном виде.
2. Легкий металл.
3. Реагирует только с кислотами.
4. Реагирует и с кислотами, и с щелочами.
5. Подвергается к коррозии.
6. Восстанавливает металлы из оксидов.
5. Подведем итоги урока. Алюминий является переходным элементом, его оксиды и гидроксиды проявляют кислотные и основные свойства. Имеет широкое применение. Благодаря своим физическим свойствам алюминий ценится как один из наиболее эффективных видов сырья для вторичной переработки.
6. Домашнее задание.
1) п. 16 до с.116. (учить свойства), с.117 задача 7.
2) составить текст рекламы алюминия или изделия с ним, либо подготовить вопросы для интервью у алюминия (для подготовленных учащихся).
Алюминий. Строение атома алюминия. Физические и химические свойства простого вещества.
Элементы главной подгруппы III группы периодической системы:
бор (В), алюминий (Аl), галлий (Ga), индий (In) и таллий (Тl).
Открытие металлов главной подгруппы III группы
Рассмотрим подробнее свойства алюминия.
1. Положение алюминия в таблице Д. И. Менделеева. Строение атома, проявляемые степени окисления.
Al 0 – 3 e - → Al +3 Алюминий проявляет в соединениях степень окисления +3:
2. Физические свойства алюминия
Алюминий в свободном виде — серебристо-белый металл, обладающий высокой тепло- и электропроводностью. Температура плавления 650 о С. Алюминий имеет невысокую плотность (2,7 г/см 3 ) — примерно втрое меньше, чем у железа или меди, и одновременно — это прочный металл.
3. Нахождение в природе
По распространённости в природе занимает 1-е среди металлов и 3-е место среди элементов, уступая только кислороду и кремнию. Процент содержания алюминия в земной коре по данным различных исследователей составляет от 7,45 до 8,14 % от массы земной коры.
В природе алюминий встречается только в соединениях (минералах).
Некоторые из них:
4. Химические свойства алюминия и его соединений
I. Взаимодействие с простыми веществами - неметаллами
Алюминий уже при комнатной температуре активно реагирует со всеми галогенами, образуя галогениды.
при нагревании он взаимодействует с серой (200 °С) 2Аl + 3S = Аl 2 S 3 (сульфид алюминия),
азотом (800 °С) 2Аl + N 2 = 2АlN (нитрид алюминия),
фосфором (500 °С) Аl + Р = АlР (фосфид алюминия)
углеродом (2000 °С) 4Аl + 3С = Аl 4 С 3 (карбид алюминия)
с йодом в присутствии катализатора - воды (видео) 2Аl + 3I 2 = 2 AlI 3 (йодид алюминия)
Все эти соединения полностью гидролизуются с образованием гидроксида алюминия и, соответственно, сероводорода, аммиака, фосфина и метана:
Al 2 S 3 + 6H 2 O = 2Al(OH) 3 + 3H 2 S
Al 4 C 3 + 12H 2 O = 4Al(OH) 3 + 3CH 4
4Аl + 3O 2 = 2Аl 2 О 3 + 1676 кДж.
II. Взаимодействие алюминия со сложными веществами
Взаимодействие с водой:
2Al + 6H 2 O = 2 Al(OH) 3 + 3H 2 без оксидной пленки!!
Взаимодействие с оксидами металлов:
Алюминий – хороший восстановитель, так как является одним из активных металлов. Стоит в ряду активности сразу после щелочно-земельных металлов. Поэтому восстанавливает металлы из их оксидов . Такая реакция – алюмотермия – используется для получения чистых редких металлов, например таких, как вольфрам, ваннадий и др.
3 Fe 3 O 4 + 8Al = 4Al 2 O 3 + 9Fe +Q
Термитная смесь Fe3O4 и Al (порошок) –используется ещё и в термитной сварке.
Сr 2 О 3 + 2Аl = 2Сr + Аl 2 О 3
Взаимодействие с кислотами, например с раствором серной кислоты с образованием соли и водорода:
2 Al + 3 H 2 SO 4 = Al 2 (SO 4 ) 3 + 3 H 2
Взаимодействие алюминия с щелочами (видео) .
2Al + 2NaOH + 6H 2 O = 2 Na[Al(OH) 4 ] + 3H 2
Na[Аl(ОН)4] – тетрагидроксоалюминат натрия
По предложению химика Горбова, в русско-японскую войну эту реакцию использовали для получения водорода для аэростатов.
Взаимодействие алюминия с растворами солей:
2Al + 3CuSO 4 = Al 2 (SO 4 ) 3 + 3Cu
2Al + 3HgCl 2 = 2AlCl 3 + 3Hg
5. Применение алюминия и его соединений: РИСУНОК 1 и РИСУНОК 2
Физические и химические свойства алюминия обусловили его широкое применение в технике. Крупным потребителем алюминия является авиационная промышленность: самолет на 2/3 состоит из алюминия и его сплавов. Самолет из стали оказался бы слишком тяжелым и смог бы нести гораздо меньше пассажиров. Поэтому алюминий называют крылатым металлом. Из алюминия изготовляют кабели и провода: при одинаковой электрической проводимости их масса в 2 раза меньше, чем соответствующих изделий из меди.
Учитывая коррозионную устойчивость алюминия, из него изготовляют детали аппаратов и тару для азотной кислоты. Порошок алюминия является основой при изготовлении серебристой краски для защиты железных изделий от коррозии, а также для отражения тепловых лучей такой краской покрывают нефтехранилища, костюмы пожарных.
Гидроксид алюминия – основной компонент всем известных лекарств маалокса, альмагеля, которые понижают кислотность желудочного сока.
Соли алюминия сильно гидролизуются. Данное свойство применяют в процессе очистки воды. В очищаемую воду вводят сульфат алюминия и небольшое количество гашеной извести для нейтрализации образующейся кислоты. В результате выделяется объемный осадок гидроксида алюминия, который, оседая, уносит с собой взвешенные частицы мути и бактерии.
Таким образом, сульфат алюминия является коагулянтом.
6. Получение алюминия
1) Современный рентабельный способ получения алюминия был изобретен американцем Холлом и французом Эру в 1886 году. Он заключается в электролизе раствора оксида алюминия в расплавленном криолите. Расплавленный криолит Na3AlF6 растворяет Al2O3, как вода растворяет сахар. Электролиз “раствора” оксида алюминия в расплавленном криолите происходит так, как если бы криолит был только растворителем, а оксид алюминия - электролитом.
В английской “Энциклопедии для мальчиков и девочек” статья об алюминии начинается следующими словами: “23 февраля 1886 года в истории цивилизации начался новый металлический век - век алюминия. В этот день Чарльз Холл, 22-летний химик, явился в лабораторию своего первого учителя с дюжиной маленьких шариков серебристо-белого алюминия в руке и с новостью, что он нашел способ изготовлять этот металл дешево и в больших количествах”. Так Холл сделался основоположником американской алюминиевой промышленности и англосаксонским национальным героем, как человек, сделавшим из науки великолепный бизнес.
Металлический алюминий первым выделил в 1825 году датский физик Ханс Кристиан Эрстед. Пропустив газообразный хлор через слой раскаленного оксида алюминия, смешанного с углем, Эрстед выделил хлорид алюминия без малейших следов влаги. Чтобы восстановить металлический алюминий, Эрстеду понадобилось обработать хлорид алюминия амальгамой калия. Через 2 года немецкий химик Фридрих Вёллер. Усовершенствовал метод, заменив амальгаму калия чистым калием.
К 1855 году французский ученый Сен- Клер Девиль разработал способ получения металлического алюминия в технических масштабах. Но способ был очень дорогостоящий. Девиль пользовался особым покровительством Наполеона III, императора Франции. В знак своей преданности и благодарности Девиль изготовил для сына Наполеона, новорожденного принца, изящно гравированную погремушку – первое «изделие ширпотреба» из алюминия. Наполеон намеревался даже снарядить своих гвардейцев алюминиевыми кирасами, но цена оказалась непомерно высокой. В то время 1 кг алюминия стоил 1000 марок, т.е. в 5 раз дороже серебра. Только после изобретения электролитического процесса алюминий по своей стоимости сравнялся с обычными металлами.
А знаете ли вы, что алюминий, поступая в организм человека, вызывает расстройство нервной системы. При его избытке нарушается обмен веществ. А защитными средствами является витамин С, соединения кальция, цинка.
При сгорании алюминия в кислороде и фторе выделяется много тепла. Поэтому его используют как присадку к ракетному топливу. Ракета "Сатурн" сжигает за время полёта 36 тонн алюминиевого порошка. Идея использования металлов в качестве компонента ракетного топлива впервые высказал Ф. А. Цандер.
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Для получения алюминия из хлорида алюминия в качестве восстановителя можно использовать металлический кальций. Составьте уравнение данной химической реакции, охарактеризуйте этот процесс при помощи электронного баланса.
Алюминий это металл или неметалл

Химия
Алюминий это металл или неметалл
Один из самых распространенных в строительстве и технике металлов — алюминий. Он используется не только в чистом виде, но и в составе различных сплавов. В земной коре он тоже достаточно широко распространен, занимая почетное третье место, отставая только от кремния и кислорода. Если отдельно взвесить все компоненты, составляющие земную кору, то на алюминий придется 8% от общей массы.
Найти алюминий в периодической системе элементов можно в главной подгруппе III группы, или по новой классификации — в 13 группе. Кто знаком с основами построения таблицы, то безошибочно определит, что этот элемент — металл. В чистом виде найти алюминий не получится, он находится в виде соединений с другими элементами — полевой шпат, квасцы, бокситы, слюда, корунд. Даже в рубинах и сапфирах есть атомы алюминия.
Производится алюминий в промышленных масштабах из бокситов, сначала получают оксид алюминия, сильно нагревая сырье, затем подвергают расплав гидролизу. На катоде оседает металл, на аноде выделяется кислород в виде газа. Фильтрацией или другим способом чистый алюминий получить не удается.
Как устроен атом алюминия
В периодической системе алюминию присвоен 13 номер. В ядре элемента находится 13 нейтронов и 14 протонов. Электронная конфигурация элемента имеет вид 1s 2 2s 2 2p 6 3s 2 3p 1 , а конфигурация электронного распределения — +13Al)2)8)3. Три электрона из последней орбиты легко отделяются, что определяет высокий уровень окисления +3.
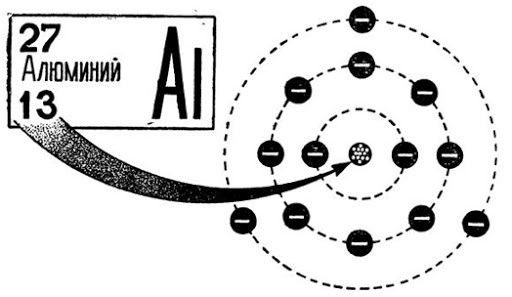
В естественном состоянии чистый алюминий существовать не может, поверхность слитка или изделия сразу же покрывается пленкой окислов, образующих герметичную оболочку. Это объясняет, почему алюминий не реагирует с водой и не поддается коррозии.
Физические и химические свойства алюминия
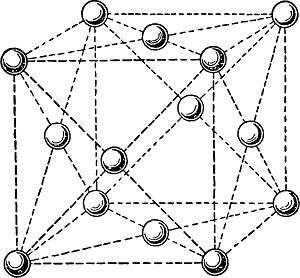
Если рассматривать физические свойства металла, то алюминий обладает небольшой массой, пластичен и хорошо проводит электричество. В нормальных условиях металл мгновенно покрывается защитной пленкой и не вступает в реакцию ни с водой, ни с кислотами. Это определяет популярность алюминиевой тары для транспортировки этих химических веществ. Кристаллическая структура определяет высокую пластичность металла.
Оксидная пленка снимается солями аммония, горячими щелочами и сплавами ртути, после чего металл вступает в реакцию со многими веществами, в частности с галогенами при комнатной температуре, а при нагревании — с фосфором, серой, азотом, углеродом. С водородом в реакцию металл не вступает. Степень окисления алюминия в соединениях всегда +3, в элементарном состоянии — 0.
Применение алюминия
Популярность металла во многом определена еще одним свойством, он не намагничивается. Это позволяет использовать его для изготовления корпусов различных машин, приборов, проводов. Отличная электропроводимость делает алюминий идеальным материалом для производства кабелей.
Алюминий плавиться при температуре 658 0 С, в расплаве легко вступает в реакцию с другими элементами, меняя свою структуру и свойства. Сплавы на основе алюминия обладают таким же небольшим весом, но значительно тверже, легче в обработке и долговечнее, чем чистый металл.
Одна из форм использования элемента в технике и быту — алюминиевая пудра. Это измельченный до мелкодисперсного состояния чистый алюминий, смешанный с 3 – 3,5 % жирных веществ. Частицы металла имеют чешуйчатую форму, при использовании пудры в качестве краски, они ложатся плоской стороной на поверхность, создают прочную антикоррозионную защиту и придают изделию декоративный вид.
Кроме чистого алюминия в порошке могут находиться железо, кремний, медь в количестве 0,01 – 0,5%. Это просто примеси, которые не вступают с алюминием в реакцию и не оказывают влияния на свойства пудры. Мелкодисперсный металл также используется при производстве взрывчатки, смесей для фейерверков, газообразующих компонентов легких бетонов.
Алюминаты
В природе часто встречаются соли ортоалюминиевой H3 AlO3 и металюминиевой кислот HAlO2. Это различные вещества, в которых алюминий полностью потерял свои металлические свойства и приобрел новые. Так алюминат натрия NaAlO2 используется в промышленности как протравочный реактив, другие соединения, как добавки для бетонов и растворов, ускоряющее отвердевание и повышающие пластичность. Металлические свойства алюминия в этих соединениях никак не проявляются. Степень окисления алюминия в метаалюминиевой кислоте и солях такой же, как и в оксидах +3.
В природе алюминаты находятся в виде минералов, не зная их химических формул сложно сказать, что в их составе находится один из самых распространенных металлов на Земле. Это минералы шпинель, ганит, герценит, хризоберилл. Сама по себе металюминиевая кислота неустойчива, а вот соли вполне самостоятельные твердые вещества с хорошо выраженными свойствами.
Читайте также:
