Алюминий это металл или неметалл в химии
Al, химический элемент III группы периодической системы Менделеева; атомный номер 13, атомная масса 26,9815; серебристо-белый лёгкий металл. Состоит из одного стабильного изотопа 27 Al.
Историческая справка. Название А. происходит от латинского alumen — так ещё за 500 лет до н. э. назывались Алюминиевые квасцы, которые применялись как протрава при крашении тканей и для дубления кожи. Датский учёный Х. К. Эрстед в 1825, действуя амальгамой калия на безводный AlCl3 и затем отгоняя ртуть, получил относительно чистый А. Первый промышленный способ производства А. предложил в 1854 французский химик А. Э. Сент-Клер Девиль: способ заключался в восстановлении двойного хлорида А. и натрия Na3AICI6 металлическим натрием. Похожий по цвету на серебро, А. на первых порах ценился очень дорого. С 1855 по 1890 было получено всего 200 т А. Современный способ получения А. электролизом криолито-глинозёмного расплава разработан в 1886 одновременно и независимо друг от друга Ч. Холлом в США и П. Эру во Франции.
Распространённость в природе. По распространённости в природе А. занимает 3-е место после кислорода и кремния и 1-е — среди металлов. Его содержание в земной коре составляет по массе 8,80%. В свободном виде А. в силу своей химической активности не встречается. Известно несколько сотен минералов А., преимущественно алюмосиликатов (См. Алюмосиликаты). Промышленное значение имеют боксит (См. Бокситы), Алунит и Нефелин. Нефелиновые породы беднее бокситов глинозёмом, но при их комплексном использовании получаются важные побочные продукты: сода, поташ, серная кислота. В СССР разработан метод комплексного использования нефелинов. Нефелиновые руды в СССР образуют, в отличие от бокситов, весьма крупные месторождения и создают практически неограниченные возможности для развития алюминиевой промышленности (См. Алюминиевая промышленность).
Физические и химические свойства. А. сочетает весьма ценный комплекс свойств: малую плотность, высокие теплопроводность и электрическую проводимость, высокую пластичность и хорошую коррозионную стойкость. Он легко поддаётся ковке, штамповке, прокатке, волочению. А. хорошо сваривается газовой, контактной и др. видами сварки. Решётка А. кубическая гранецентрированная с параметром а = 4,0413 Å. Свойства А., как и всех металлов, в значительной степени зависят от его чистоты. Свойства А. особой чистоты (99,996% ): плотность (при 20°С) 2698,9 кг/м 3 , tпл 660,24°С; tkип около 2500°С: коэффициент термического расширения (от 20° до 100°С) 23,86•10 -6 ; теплопроводность (при 190°С) 343 вт/м•К (0,82 кал/см•сек•°С), удельная теплоёмкость (при 100°С) 931,98 дж/кг К (0,2226•кал/г•°С); электропроводность по отношению к меди (при 20°С) 65,5%. А. обладает невысокой прочностью (предел прочности 50—60 Мн/м 2 ), твёрдостью (170 Мн/м 2 по Бринеллю) и высокой пластичностью (до 50% ). При холодной прокатке предел прочности А. возрастает до 115 Мн/м 2 , твёрдость — до 270 Мн/м 2 , относительное удлинение снижается до 5% (1 Мн/м 2 ≈ 0,1 кгс/мм 2 ). А. хорошо полируется, анодируется и обладает высокой отражательной способностью, близкой к серебру (он отражает до 90% падающей световой энергии). Обладая большим сродством к кислороду, А. на воздухе покрывается тонкой, но очень прочной плёнкой окиси Al2O3, защищающей металл от дальнейшего окисления и обусловливающей его высокие антикоррозионные свойства. Прочность окисной плёнки и защитное действие её сильно убывают в присутствии примесей ртути, натрия, магния, меди и др. А. стоек к действию атмосферной коррозии, морской и пресной воды, практически не взаимодействует с концентрированной или сильно разбавленной азотной кислотой,с органическими кислотами, пищевыми продуктами.
Внешняя электронная оболочка Атома А. состоит из 3 электронов и имеет строение 3s 2 3р. В обычных условиях А. в соединениях 3-валентен, но при высоких температурах может быть одновалентным, образуя т. н. субсоединения. Субгалогениды А., AIF и AlCl, устойчивые лишь в газообразном состоянии, в вакууме или в инертной атмосфере, при понижении температуры распадаются (диспропорционируют) на чистый Al и AlF3 или AlCl3 и поэтому могут быть использованы для получения сверхчистого А. При накаливании мелкоизмельчённый или порошкообразный А. энергично сгорает на воздухе. Сжиганием А. в токе кислорода достигается температура выше 3000°С. Свойством А. активно взаимодействовать с кислородом пользуются для восстановления металлов из их окислов (см. Алюминотермия). При тёмно-красном калении фтор энергично взаимодействует с А., образуя AIF3 (см. Алюминия фторид). Хлор и жидкий бром реагируют с А. при комнатной температуре, иод — при нагревании (см. Алюминия хлорид). При высокой температуре А. соединяется с азотом, углеродом и серой, образуя соответственно нитрид AIN, карбид Al4C3 и сульфид Al2S3. С водородом А. не взаимодействует; гидрид А. (AlH3)x получен косвенным путём. Большой интерес представляют двойные гидриды А. и элементов l и II групп периодической системы состава MeHn-nAlH3, т.н. алюмогидриды (см. Алюминия гидрид). А. легко растворяется в щелочах, выделяя водород и образуя Алюминаты. Большинство солей А. хорошо растворимо в воде. Растворы солей А. вследствие гидролиза показывают кислую реакцию (см. Алюминия сульфат, Алюминия нитрат).
Получение. В промышленности А. получают электролизом глинозёма Al2O3 (см. Алюминия окись), растворённого в расплавленном Криолите Na3AlF6 при температуре около 950°С. Используются электролизеры трёх основных конструкций: 1) электролизеры с непрерывными самообжигающимися анодами и боковым подводом тока, 2) то же, но с верхним подводом тока и 3) электролизеры с обожжёнными анодами. Электролитная ванна представляет собой железный кожух, футерованный внутри тепло- и электроизолирующим материалом — огнеупорным кирпичом, и выложенный угольными плитами и блоками. Рабочий объём заполняется расплавленным электролитом, состоящим из 6—8% глинозёма и 94—92% криолита (обычно с добавкой AlF6 и около 5—6% смеси фторидов калия и магния). Катодом служит подина ванны, анодом — погруженные в электролит угольные обожжённые блоки или же набивные самообжигающиеся электроды. При прохождении тока на катоде выделяется расплавленный А., который накапливается на подине, а на аноде — кислород, образующий с угольным анодом CO и CO2. К глинозёму, основному расходуемому материалу, предъявляются высокие требования по чистоте и размерам частиц. Присутствие в нём окислов более электроположительных элементов, чем А., ведёт к загрязнению А. При достаточном содержании глинозёма ванна работает нормально при электрическом напряжении порядка 4—4,5 в. Ванны присоединяют к источнику постоянного тока последовательно (сериями из 150—160 ванн). Современные электролизеры работают при силе тока до 150 ка. Из ванн А. извлекают обычно с помощью вакуум-ковша. Расплавленный А. чистотой 99,7% разливают в формы. А. высокой чистоты (99,9965%) получают электролитическим рафинированием первичного А. с помощью т. н. трёхслойного способа, снижающего содержание примесей Fe, Si и Cu. Исследования процесса электролитического рафинирования А. с применением органических электролитов показали принципиальную возможность получения А. чистотой 99,999% при относительно низком расходе энергии, но пока этот метод обладает низкой производительностью. Для глубокой очистки А. применяют зонную плавку или дистилляцию его через субфторид.
При электролитическом производстве А. возможны поражения электрическим током, высокой температурой и вредными газами. Для избежания несчастных случаев ванны надёжно изолируют, рабочие пользуются сухими валенками, соответствующей спецодеждой. Здоровая атмосфера поддерживается эффективной вентиляцией. При постоянном вдыхании пыли металлического А. и его окиси может возникнуть алюминоз лёгких (см. Пневмокониозы). У рабочих, занятых в производстве А., часты катары верхних дыхательных путей (Риниты, Фарингиты, Ларингиты). Предельно допустимая концентрация в воздухе пыли металлического А., его окиси и сплавов 2 мг/м 3 .
Применение. Сочетание физических, механических и химических свойств А. определяет его широкое применение практически во всех областях техники, особенно в виде его сплавов с др. металлами (см. Алюминиевые сплавы). В электротехнике А. успешно заменяет медь, особенно в производстве массивных проводников, например в воздушных линиях, высоковольтных кабелях, шинах распределительных устройств, трансформаторах (электрическая проводимость А. достигает 65,5% электрической проводимости меди, и он более чем в три раза легче меди; при поперечном сечении, обеспечивающем одну и ту же проводимость, масса проводов из А. вдвое меньше медных). Сверхчистый А. употребляют в производстве электрических конденсаторов и выпрямителей, действие которых основано на способности окисной плёнки А. пропускать электрический ток только в одном направлении. Сверхчистый А., очищенный зонной плавкой, применяется для синтеза полупроводниковых соединений типа AIIIBV, применяемых для производства полупроводниковых приборов. Чистый А. используют в производстве разного рода зеркал отражателей. А. высокой чистоты применяют для предохранения металлических поверхностей от действия атмосферной коррозии (плакирование, алюминиевая краска). Обладая относительно низким сечением поглощения нейтронов, А. применяется как конструкционный материал в ядерных реакторах.
В алюминиевых резервуарах большой ёмкости хранят и транспортируют жидкие газы (метан, кислород, водород и т. д.), азотную и уксусную кислоты, чистую воду, перекись водорода и пищевые масла. А. широко применяют в оборудовании и аппаратах пищевой промышленности, для упаковки пищевых продуктов (в виде фольги), для производства разного рода бытовых изделий. Резко возросло потребление А. для отделки зданий, архитектурных, транспортных и спортивных сооружений.
В металлургии А.. (помимо сплавов на его основе) — одна из самых распространённых легирующих добавок в сплавах на основе Cu, Mg, Ti, Ni, Zn и Fe. Применяют А. также для раскисления стали перед заливкой её в форму, а также в процессах получения некоторых металлов методом алюминотермии. На основе А. методом порошковой металлургии создан САП (спечённый алюминиевый порошок), обладающий при температурах выше 300°С большой жаропрочностью.
А. используют в производстве взрывчатых веществ (аммонал, алюмотол). Широко применяют различные соединения А.
Производство и потребление А. непрерывно растет, значительно опережая по темпам роста производство стали, меди, свинца, цинка.
Лит.: Беляев А. И., Вольфсон Г. Е., Лазарев Г. И..Фирсанова Л. А., Получение чистого алюминия, [М.], 1967; Беляев А. И., Рапнопорт Н.. Б., Фирсанова Л. А., Электрометаллургия алюминия, М., 1953; Беляев А. И., История алюминия, в сборнике: Труды института истории естествознания и техники, т. 20, М., 1959; Фридляндер И. Н., Алюминий и его сплавы, М., 1965.
Геохимия А. Геохимические черты А. определяются его большим сродством к кислороду (в минералах А. входит в кислородные октаэдры и тетраэдры), постоянной валентностью (3), слабой растворимостью большинства природных соединений. В эндогенных процессах при застывании магмы и формировании изверженных пород А. входит в кристаллическую решётку полевых шпатов, слюд и др. минералов — алюмосиликатов. В биосфере А. — слабый миграт, его мало в организмах и гидросфере. Во влажном климате, где разлагающиеся остатки обильной растительности образуют много органических кислот, А. мигрирует в почвах и водах в виде органо-минеральных коллоидных соединений; А. адсорбируется коллоидами и осаждается в нижней части почв. Связь А. с кремнием частично нарушается и местами в тропиках образуются минералы — гидроокислы А. — бёмит, диаспор, гидраргиллит. Большая же часть А. входит в состав алюмосиликатов — каолинита, бейделлита и др. глинистых минералов. Слабая подвижность определяет остаточное накопление А. в коре выветривания влажных тропиков. В результате образуются элювиальные бокситы. В прошлые геологические эпохи бокситы накапливались также в озёрах и прибрежной зоне морей тропических областей (например, осадочные бокситы Казахстана). В степях и пустынях, где живого вещества мало, а воды нейтральные и щелочные, А. почти не мигрирует. Наиболее энергична миграция А. в вулканических областях, где наблюдаются сильнокислые речные и подземные воды, богатые А. В местах смешения кислых вод с щелочными — морскими (в устьях рек и др.), А. осаждается с образованием бокситовых месторождений.
Алюминий в организме. А. входит в состав тканей животных и растений; в органах млекопитающих животных обнаружено от 10 -3 до 10 -5 % А. (на сырое вещество). А. накапливается в печени, поджелудочной и щитовидной железах. В растительных продуктах содержание А. колеблется от 4 мг на 1 кг сухого вещества (картофель) до 46 мг (жёлтая репа), в продуктах животного происхождения — от 4 мг (мёд) до 72 мг на 1кг сухого вещества (говядина). В суточном рационе человека содержание А. достигает 35—40 мг. Известны организмы — концентраторы А., например плауны (Lycopodiaceae), содержащие в золе до 5,3% А., моллюски (Helix и Lithorina), в золе которых 0,2—0,8% А. Образуя нерастворимые соединения с фосфатами, А. нарушает питание растений (поглощение фосфатов корнями) и животных (всасывание фосфатов в кишечнике).
Лит.: Войнар А. О., Биологическая роль микроэлементов в организме животных и человека, 2 изд., М., 1960, с. 73—77.
Большая советская энциклопедия. — М.: Советская энциклопедия . 1969—1978 .
Алюминий это металл или неметалл

Химия
Алюминий это металл или неметалл
Один из самых распространенных в строительстве и технике металлов — алюминий. Он используется не только в чистом виде, но и в составе различных сплавов. В земной коре он тоже достаточно широко распространен, занимая почетное третье место, отставая только от кремния и кислорода. Если отдельно взвесить все компоненты, составляющие земную кору, то на алюминий придется 8% от общей массы.
Найти алюминий в периодической системе элементов можно в главной подгруппе III группы, или по новой классификации — в 13 группе. Кто знаком с основами построения таблицы, то безошибочно определит, что этот элемент — металл. В чистом виде найти алюминий не получится, он находится в виде соединений с другими элементами — полевой шпат, квасцы, бокситы, слюда, корунд. Даже в рубинах и сапфирах есть атомы алюминия.
Производится алюминий в промышленных масштабах из бокситов, сначала получают оксид алюминия, сильно нагревая сырье, затем подвергают расплав гидролизу. На катоде оседает металл, на аноде выделяется кислород в виде газа. Фильтрацией или другим способом чистый алюминий получить не удается.
Как устроен атом алюминия
В периодической системе алюминию присвоен 13 номер. В ядре элемента находится 13 нейтронов и 14 протонов. Электронная конфигурация элемента имеет вид 1s 2 2s 2 2p 6 3s 2 3p 1 , а конфигурация электронного распределения — +13Al)2)8)3. Три электрона из последней орбиты легко отделяются, что определяет высокий уровень окисления +3.
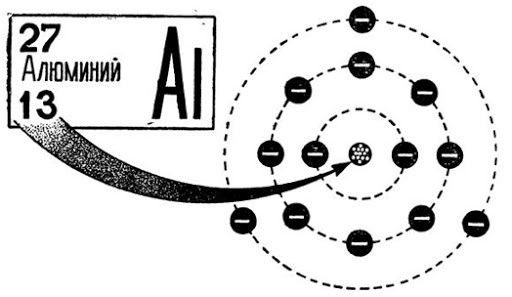
В естественном состоянии чистый алюминий существовать не может, поверхность слитка или изделия сразу же покрывается пленкой окислов, образующих герметичную оболочку. Это объясняет, почему алюминий не реагирует с водой и не поддается коррозии.
Физические и химические свойства алюминия
Если рассматривать физические свойства металла, то алюминий обладает небольшой массой, пластичен и хорошо проводит электричество. В нормальных условиях металл мгновенно покрывается защитной пленкой и не вступает в реакцию ни с водой, ни с кислотами. Это определяет популярность алюминиевой тары для транспортировки этих химических веществ. Кристаллическая структура определяет высокую пластичность металла.
Оксидная пленка снимается солями аммония, горячими щелочами и сплавами ртути, после чего металл вступает в реакцию со многими веществами, в частности с галогенами при комнатной температуре, а при нагревании — с фосфором, серой, азотом, углеродом. С водородом в реакцию металл не вступает. Степень окисления алюминия в соединениях всегда +3, в элементарном состоянии — 0.
Применение алюминия
Популярность металла во многом определена еще одним свойством, он не намагничивается. Это позволяет использовать его для изготовления корпусов различных машин, приборов, проводов. Отличная электропроводимость делает алюминий идеальным материалом для производства кабелей.
Алюминий плавиться при температуре 658 0 С, в расплаве легко вступает в реакцию с другими элементами, меняя свою структуру и свойства. Сплавы на основе алюминия обладают таким же небольшим весом, но значительно тверже, легче в обработке и долговечнее, чем чистый металл.
Одна из форм использования элемента в технике и быту — алюминиевая пудра. Это измельченный до мелкодисперсного состояния чистый алюминий, смешанный с 3 – 3,5 % жирных веществ. Частицы металла имеют чешуйчатую форму, при использовании пудры в качестве краски, они ложатся плоской стороной на поверхность, создают прочную антикоррозионную защиту и придают изделию декоративный вид.
Кроме чистого алюминия в порошке могут находиться железо, кремний, медь в количестве 0,01 – 0,5%. Это просто примеси, которые не вступают с алюминием в реакцию и не оказывают влияния на свойства пудры. Мелкодисперсный металл также используется при производстве взрывчатки, смесей для фейерверков, газообразующих компонентов легких бетонов.
Алюминаты
В природе часто встречаются соли ортоалюминиевой H3 AlO3 и металюминиевой кислот HAlO2. Это различные вещества, в которых алюминий полностью потерял свои металлические свойства и приобрел новые. Так алюминат натрия NaAlO2 используется в промышленности как протравочный реактив, другие соединения, как добавки для бетонов и растворов, ускоряющее отвердевание и повышающие пластичность. Металлические свойства алюминия в этих соединениях никак не проявляются. Степень окисления алюминия в метаалюминиевой кислоте и солях такой же, как и в оксидах +3.
В природе алюминаты находятся в виде минералов, не зная их химических формул сложно сказать, что в их составе находится один из самых распространенных металлов на Земле. Это минералы шпинель, ганит, герценит, хризоберилл. Сама по себе металюминиевая кислота неустойчива, а вот соли вполне самостоятельные твердые вещества с хорошо выраженными свойствами.
Ряд активности металлов

Что же из себя представляет ряд активности металлов давайте разбираться. Металлы — группа химических элементов, обладающих сходными свойствами. Среди них — электропроводность, пластичность, температурная зависимость сопротивления. По виду металлы можно отличить по характерному блеску, который так и назвали — металлический. Но химические свойства элементов отличаются в зависимости от строения их молекул и кристаллической решетки. Особенно ярко отличия проявляются по отношению взаимодействия с кислотами и щелочами. Всего на данный момент насчитывается 96 металлов. Общие свойства металлов показаны в таблице:
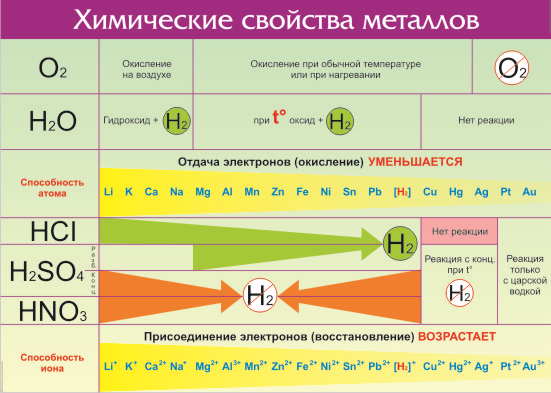
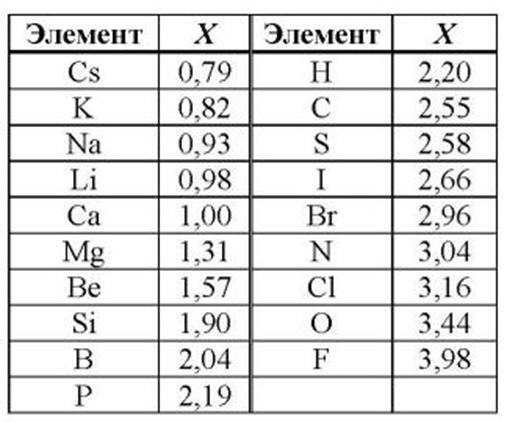
Все металлы в той или иной степени являются восстановителями, то есть, отдают электроны при течении окислительно-восстановительных реакций. Таблица электроотрицательности металлов показывает, какой металл является наиболее активным восстановителем. Если цифра напротив элемента больше 2, то это окислитель с характерными свойствами и выходит из ряда металлов, проявляя типичные свойства неметалла.
Электрохимический ряд активности металлов показывает, какие из металлов более активные, какие менее. Расположение элементов в горизонтальном ряду слева направо показывает направление снижения восстановительной способности и возрастание окислительной.
Восстановительная способность — свойство отдавать электроны в химических реакциях с водными растворами солей и щелочей.
Окислительная способность — свойство присоединять электроны в реакциях с теми же веществами.

Металлы в правой стороне более слабые восстановители, они вытесняются при реакциях с солевыми растворами металлами, расположенными левее. Пример реакции — Zn + Cu 2+ → Zn 2+ + Cu, которая протекает только в одном направлении. Цинк вытесняет медь, реагируя с водным раствором любой соли меди. Цинковая пластинка, при этом, растворяется, а медная восстанавливается.
Такую последовательность элементов еще называют ряд напряженности металлов, или ряд Бекетова. На всех вариантах записи ряда можно заметить, что последовательность металлов разделена знаком водорода (гидрогена), который металлом никак не является. Это своеобразный маркер, показывающий, что стоящие левее металлы вытесняют водород из водных растворов кислот, не обладающих окислительными свойствами. Некоторые металлы, например, литий, кальций, барий и остальные, стоящи до алюминия, вытесняют водород и при реакции с водой.
2Al +3H2SO4 = Al2(SO4)3 + 3H2↑
Fe + 2HCl = FeCl2 + H2↑
Стоящие правее знака водорода металлы с кислотами-неокислителями не взаимодействуют при нормальных условиях.
Шкала активности металлов широко используется для практических целей, например, в гальванике. Если электроды сделаны из разных металлов, то разрушаться будет тот, который стоит левее. Чем больше промежуток между металлами в ряду, тем активнее проходит процесс коррозии.
Например, метод оцинковки позволяет защитить железо именно потому, что цинк находится левее железа в ряду активности. Пока он не разрушится, то ржавчина на железе не появится. При электролизе, расположенные за водородом металлы осаживаются на катоде, а самые активные, занимающее места до алюминия, выделить из солевых растворов в не получится при нормальных температуре и давлении.
Малоактивные металлы, так называемые переходные элементы с электроотрицательностью в пределах 1,5 – 2. Это:
- Ртуть;
- Олово;
- Серебро;
- Никель;
- Рений;
- Медь;
- Марганец и еще несколько элементов.
К металлам средней активности относятся элементы с числом электроотрицательности от 1 до 1,5. В эту группу входят такие известные элементы, как магний, плутоний, неодим, кальций. Остальные элементы обладают высокой химической активностью. Лидирует в этом списке Франций, который практически не встречается в чистом виде. Из более известных можно назвать калий и натрий, которые приходится хранить в керосине, чтобы они не взаимодействовали с водой и воздухом. Если извлечь их из керосина, то металлы практически мгновенно сгорают.
Реакции кальция и натрия с водой при комнатной температуре выглядят так:
2Na + 2H2O = 2NaOH + H2↑
Сa + 2H2O = Сa(OH)2 + H2↑Стоящие в ряду электронапряжения металлов правее элементы тоже взаимодействуют с водой, но реакция протекает при более высокой температуре с образованием оксида и водорода.
3Fe + 4H2O = Fe3O4 + 4H2↑
Если вступает в реакцию металл и неметалл, то электрический ряд напряжений металлов тоже дает возможность заранее узнать, в каком направлении будет протекать реакция. Скорость реакции зависит как от восстановительной активности металла, так и от окислительных свойств неметалла. Стоящие до водорода металлы реагируют с кислородом уже при комнатной температуре, некоторые — достаточно бурно, например, литий и кальций.
4Li + O2 = 2Li2O
2Ca + O2 = 2CaO.
При таком взаимодействии образуются оксиды. Менее активные металлы, например железо, реагируют с кислородом спокойнее, а некоторые, например, золото и серебро, платина не окисляются вовсе, благодаря чему получили определение благородных.
С хлором реагируют практически все активные металлы с выделением теплоты.
2Fe + 3Cl2 = 2FeCl3
Также выделяется теплота при реакции активных металлов с серой, но начинается она при нагревании. После начала реакции нагрев не нужен — образовавшегося тепла достаточно для поддержания реакции.
2Al + 3S = Al2S3
Внимательно изучив ряд металлов, несложно определить тип реакции при контакте с другими элементами в зависимости от места в последовательности. Также легко назвать основные характеристики металла, как химического элемента, и возможность его использования на практике.
Алюминий. Химия алюминия и его соединений

Алюминий расположен в главной подгруппе III группы (или в 13 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение алюминия и свойства
Электронная конфигурация алюминия в основном состоянии :
+13Al 1s 2 2s 2 2p 6 3s 2 3p 1 1s 2pЭлектронная конфигурация алюминия в возбужденном состоянии :
+13Al * 1s 2 2s 2 2p 6 3s 1 3p 2 1s 2p 3pАлюминий проявляет парамагнитные свойства. Алюминий на воздухе быстро образует прочные оксидные плёнки, защищающие поверхность от дальнейшего взаимодействия, поэтому устойчив к коррозии.
Физические свойства
Алюминий – лёгкий металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке. Обладает высокой тепло- и электропроводностью.

Температура плавления 660 о С, температура кипения 1450 о С, плотность алюминия 2,7 г/см 3 .
Алюминий — один из наиболее ценных цветных металлов для вторичной переработки. На протяжении последних лет, цена на лом алюминия в пунктах приема непреклонно растет. По ссылке можно узнать о том, как сдать лом алюминия.
Нахождение в природе
Алюминий — самый распространенный металл в природе, и 3-й по распространенности среди всех элементов (после кислорода и кремния). Содержание в земной коре — около 8%.
В природе алюминий встречается в виде соединений:
Бокситы Al2O3 · H2O (с примесями SiO2, Fe2O3, CaCO3) — гидрат оксида алюминия.

Корунд Al2O3. Красный корунд называют рубином, синий корунд называют сапфиром.

Способы получения
Алюминий образует прочную химическую связь с кислородом. Поэтому традиционные способы получения алюминия восстановлением из оксида протекают требуют больших затрат энергии. Для промышленного получения алюминия используют процесс Холла-Эру. Для понижения температуры плавления оксид алюминия растворяют в расплавленном криолите (при температуре 960-970 о С) Na3AlF6, а затем подвергают электролизу с углеродными электродами. При растворении в расплаве криолита оксид алюминия распадается на ионы:
На катоде происходит восстановление ионов алюминия:
Катод: Al 3+ +3e → Al 0
На аноде происходит окисление алюминат-ионов:
Суммарное уравнение электролиза расплава оксида алюминия:
Лабораторный способ получения алюминия заключается в восстановлении алюминия из безводного хлорида алюминия металлическим калием:
AlCl3 + 3K → Al + 3KCl
Качественные реакции
Качественная реакция на ионы алюминия — взаимодействие избытка солей алюминия с щелочами . При этом образуется белый аморфный осадок гидроксида алюминия.
Например , хлорид алюминия взаимодействует с гидроксидом натрия:
AlCl3 + 3NaOH → Al(OH)3 + 3NaCl


При дальнейшем добавлении щелочи амфотерный гидроксид алюминия растворяется с образованием тетрагидроксоалюмината:
Обратите внимание , если мы поместим соль алюминия в избыток раствора щелочи, то белый осадок гидроксида алюминия не образуется, т.к. в избытке щелочи соединения алюминия сразу переходят в комплекс:
AlCl3 + 4NaOH = Na[Al(OH)4] + 3NaCl
Соли алюминия можно обнаружить с помощью водного раствора аммиака. При взаимодействии растворимых солей алюминия с водным раствором аммиака также в ыпадает полупрозрачный студенистый осадок гидроксида алюминия.
AlCl3 + 3NH3·H2O = Al(OH)3 ↓ + 3NH4Cl
Al 3+ + 3NH3·H2O = Al(OH)3 ↓ + 3NH4 +
Видеоопыт взаимодействия раствора хлорида алюминия с раствором аммиака можно посмотреть здесь.
Химические свойства
1. Алюминий – сильный восстановитель . Поэтому он реагирует со многими неметаллами .
1.1. Алюминий реагируют с галогенами с образованием галогенидов:
1.2. Алюминий реагирует с серой с образованием сульфидов:
1.3. Алюминий реагируют с фосфором . При этом образуются бинарные соединения — фосфиды:
Al + P → AlP
1.4. С азотом алюминий реагирует при нагревании до 1000 о С с образованием нитрида:
2Al + N2 → 2AlN
1.5. Алюминий реагирует с углеродом с образованием карбида алюминия:
1.6. Алюминий взаимодействует с кислородом с образованием оксида:
Видеоопыт взаимодействия алюминия с кислородом воздуха (горение алюминия на воздухе) можно посмотреть здесь.
2. Алюминий взаимодействует со сложными веществами:
2.1. Реагирует ли алюминий с водой? Ответ на этот вопрос вы без труда найдете, если покопаетесь немного в своей памяти. Наверняка хотя бы раз в жизни вы встречались с алюминиевыми кастрюлями или алюминиевыми столовыми приборами. Такой вопрос я любил задавать студентам на экзаменах. Что самое удивительное, ответы я получал разные — у кого-то алюминий таки реагировал с водой. И очень, очень многие сдавались после вопроса: «Может быть, алюминий реагирует с водой при нагревании?» При нагревании алюминий реагировал с водой уже у половины респондентов))
Тем не менее, несложно понять, что алюминий все-таки с водой в обычных условиях (да и при нагревании) не взаимодействует. И мы уже упоминали, почему: из-за образования оксидной пленки . А вот если алюминий очистить от оксидной пленки (например, амальгамировать), то он будет взаимодействовать с водой очень активно с образованием гидроксида алюминия и водорода:
2Al 0 + 6 H2 + O → 2 Al +3 ( OH)3 + 3 H2 0
Амальгаму алюминия можно получить, выдержав кусочки алюминия в растворе хлорида ртути ( II ):
3HgCl2 + 2Al → 2AlCl3 + 3Hg
Видеоопыт взаимодействия амальгамы алюминия с водой можно посмотреть здесь.
2.2. Алюминий взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой). При этом образуются соль и водород.
Например , алюминий бурно реагирует с соляной кислотой :
2Al + 6HCl = 2AlCl3 + 3H2↑
2.3. При обычных условиях алюминий не реагирует с концентрированной серной кислотой из-за пассивации – образования плотной оксидной пленки. При нагревании реакция идет, образуются оксид серы (IV), сульфат алюминия и вода:
2.4. Алюминий не реагирует с концентрированной азотной кислотой также из-за пассивации.
С разбавленной азотной кислотой алюминий реагирует с образованием молекулярного азота:
При взаимодействии алюминия в виде порошка с очень разбавленной азотной кислотой может образоваться нитрат аммония:
2.5. Алюминий – амфотерный металл, поэтому он взаимодействует с щелочами . При взаимодействии алюминия с раствором щелочи образуется тетрагидроксоалюминат и водород:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2 ↑
Видеоопыт взаимодействия алюминия со щелочью и водой можно посмотреть здесь.
Алюминий реагирует с расплавом щелочи с образованием алюмината и водорода:
2Al + 6NaOH → 2Na3AlO3 + 3H2 ↑
Эту же реакцию можно записать в другом виде (в ЕГЭ рекомендую записывать реакцию именно в таком виде):
2Al + 6NaOH → 2NaAlO2 + 3H2↑ + 2Na2O
2.6. Алюминий восстанавливает менее активные металлы из оксидов . Процесс восстановления металлов из оксидов называется алюмотермия .
Например , алюминий вытесняет медь из оксида меди (II). Реакция очень экзотермическая:
2Al + 3CuO → 3Cu + Al2O3
Еще пример : алюминий восстанавливает железо из железной окалины, оксида железа (II, III):
Восстановительные свойства алюминия также проявляются при взаимодействии его с сильными окислителями: пероксидом натрия, нитратами и нитритами в щелочной среде, перманганатами, соединениями хрома (VI):
Оксид алюминия
Оксид алюминия можно получить различными методами :
1. Горением алюминия на воздухе:
2. Разложением гидроксида алюминия при нагревании :
3. Оксид алюминия можно получить разложением нитрата алюминия :
Химические свойства
Оксид алюминия — типичный амфотерный оксид . Взаимодействует с кислотными и основными оксидами, кислотами, щелочами.
1. При взаимодействии оксида алюминия с основными оксидами образуются соли-алюминаты.
Например , оксид алюминия взаимодействует с оксидом натрия:
2. Оксид алюминия взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—алюминаты, а в растворе – комплексные соли . При этом оксид алюминия проявляет кислотные свойства.
Например , оксид алюминия взаимодействует с гидроксидом натрия в расплаве с образованием алюмината натрия и воды:
Оксид алюминия растворяется в избытке щелочи с образованием тетрагидроксоалюмината:
3. Оксид алюминия не взаимодействует с водой.
4. Оксид алюминия взаимодействует с кислотными оксидами (сильных кислот). При этом образуются соли алюминия. При этом оксид алюминия проявляет основные свойства.
Например , оксид алюминия взаимодействует с оксидом серы (VI) с образованием сульфата алюминия:
5. Оксид алюминия взаимодействует с растворимыми кислотами с образованием средних и кислых солей.
Например , оксид алюминия реагирует с серной кислотой:
6. Оксид алюминия проявляет слабые окислительные свойства .
Например , оксид алюминия реагирует с гидридом кальция с образованием алюминия, водорода и оксида кальция:
Электрический ток восстанавливает алюминий из оксида (производство алюминия):
7. Оксид алюминия — твердый, нелетучий. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Например , из карбоната натрия:
Гидроксид алюминия
1. Гидроксид алюминия можно получить действием раствора аммиака на соли алюминия.
Например , хлорид алюминия реагирует с водным раствором аммиака с образованием гидроксида алюминия и хлорида аммония:
2. Пропусканием углекислого газа, сернистого газа или сероводорода через раствор тетрагидроксоалюмината натрия:
Чтобы понять, как протекает эта реакция, можно использовать несложный прием: мысленно разбить сложное вещество Na[Al(OH)4] на составные части: NaOH и Al(OH)3. Далее мы определяем, как реагирует углекислый газ с каждым из этих веществ, и записываем продукты их взаимодействия. Т.к. Al(OH)3 не реагирует с СО2, то мы записываем справа Al(OH)3 без изменения.
3. Гидроксид алюминия можно получить действием недостатка щелочи на избыток соли алюминия.
Например , хлорид алюминия реагирует с недостатком гидроксида калия с образованием гидроксида алюминия и хлорида калия:
4. Также гидроксид алюминия образуется при взаимодействии растворимых солей алюминия с растворимыми карбонатами, сульфитами и сульфидами . Сульфиды, карбонаты и сульфиты алюминия необратимо гидролизуются в водном растворе.
Например: бромид алюминия реагирует с карбонатом натрия. При этом выпадает осадок гидроксида алюминия, выделяется углекислый газ и образуется бромид натрия:
Хлорид алюминия реагирует с сульфидом натрия с образованием гидроксида алюминия, сероводорода и хлорида натрия:
1. Гидроксид алюминия реагирует с растворимыми кислотами . При этом образуются средние или кислые соли, в зависимости от соотношения реагентов и типа соли.
Например , гидроксид алюминия взаимодействует с азотной кислотой с образованием нитрата алюминия:
2. Гидроксид алюминия взаимодействует с кислотными оксидами сильных кислот .
Например , гидроксид алюминия взаимодействует с оксидом серы (VI) с образованием сульфата алюминия:
3. Гидроксид алюминия взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—алюминаты, а в растворе – комплексные соли . При этом гидроксид алюминия проявляет кислотные свойства.
Например , гидроксид алюминия взаимодействует с гидроксидом калия в расплаве с образованием алюмината калия и воды:
Гидроксид алюминия растворяется в избытке щелочи с образованием тетрагидроксоалюмината:
4. Г идроксид алюминия разлагается при нагревании :
Видеоопыт взаимодействия гидроксида алюминия с соляной кислотой и щелочами (амфотерные свойства гидроксида алюминия) можно посмотреть здесь.
Соли алюминия
Нитрат и сульфат алюминия
Нитрат алюминия при нагревании разлагается на оксид алюминия, оксид азота (IV) и кислород:
Сульфат алюминия при сильном нагревании разлагается аналогично — на оксид алюминия, сернистый газ и кислород:
Комплексные соли алюминия
Для описания свойств комплексных солей алюминия — гидроксоалюминатов, удобно использоваться следующий прием: мысленно разбейте тетрагидроксоалюминат на две отдельные молекулы — гидроксид алюминия и гидроксид щелочного металла.
Например , тетрагидроксоалюминат натрия разбиваем на гидроксид алюминия и гидроксид натрия:
Na[Al(OH)4] разбиваем на NaOH и Al(OH)3
Свойства всего комплекса можно определять, как свойства этих отдельных соединений.
Таким образом, гидроксокомплексы алюминия реагируют с кислотными оксидами .
Например , гидроксокомплекс разрушается под действием избытка углекислого газа. При этом с СО2 реагирует NaOH с образованием кислой соли (при избытке СО2), а амфотерный гидроксид алюминия не реагирует с углекислым газом, следовательно, просто выпадает в осадок:
Аналогично тетрагидроксоалюминат калия реагирует с углекислым газом:
По такому же принципу тетрагидроксоалюминаты реагирует с сернистым газом SO2:
А вот под действием избытка сильной кислоты осадок не выпадает, т.к. амфотерный гидроксид алюминия реагирует с сильными кислотами.
Например , с соляной кислотой:
Правда, под действием небольшого количества ( недостатка ) сильной кислоты осадок все-таки выпадет, для растворения гидроксида алюминия кислоты не будет хватать:
Аналогично с недостатком азотной кислоты выпадает гидроксид алюминия:
Комплекс разрушается при взаимодействии с хлорной водой (водным раствором хлора) Cl2:
При этом хлор диспропорционирует.
Также комплекс может прореагировать с избытком хлорида алюминия. При этом выпадает осадок гидроксида алюминия:
Если выпарить воду из раствора комплексной соли и нагреть образующееся вещество, то останется обычная соль-алюминат:
Гидролиз солей алюминия
Растворимые соли алюминия и сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: Al 3+ + H2O = AlOH 2+ + H +
II ступень: AlOH 2+ + H2O = Al(OH )2 + + H +
Однако сульфиды, сульфиты, карбонаты алюминия и их кислые соли гидролизуются необратимо, полностью, т.е. в водном растворе не существуют, а разлагаются водой:
Более подробно про гидролиз можно прочитать в соответствующей статье.
Алюминаты
Соли, в которых алюминий является кислотным остатком (алюминаты) — образуются из оксида алюминия при сплавлении с щелочами и основными оксидами:
Для понимания свойств алюминатов их также очень удобно разбить на два отдельных вещества.
Например, алюминат натрия мы разделим мысленно на два вещества: оксид алюминия и оксид натрия.
NaAlO2 разбиваем на Na2O и Al2O3
Тогда нам станет очевидно, что алюминаты реагируют с кислотами с образованием солей алюминия :
KAlO2 + 4HCl → KCl + AlCl3 + 2H2O
NaAlO2 + 4HCl → AlCl3 + NaCl + 2H2O
Под действием избытка воды алюминаты переходят в комплексные соли:
Бинарные соединения
Сульфид алюминия под действием азотной кислоты окисляется до сульфата:
либо до серной кислоты (под действием горячей концентрированной кислоты):
Сульфид алюминия разлагается водой:
Карбид алюминия также разлагается водой при нагревании на гидроксид алюминия и метан:
Нитрид алюминия разлагается под действием минеральных кислот на соли алюминия и аммония:
Алюминий

Алюминий – это пластичный и лёгкий металл белого цвета, покрытый серебристой матовой оксидной плёнкой. В периодической системе Д. И. Менделеева этот химический элемент обозначается, как Al (Aluminium) и находится в главной подгруппе III группы, третьего периода, под атомным номером 13. Купить алюминий вы можете на нашем сайте.
История открытия
В 16 веке знаменитый Парацельс сделал первый шаг к добыче алюминия. Из квасцов он выделил «квасцовую землю», которая содержала оксид неизвестного тогда металла. В 18 веке к этому эксперименту вернулся немецкий химик Андреас Маргграф. Оксид алюминия он назвал «alumina», что на латинском языке означает «вяжущий». На тот момент металл не пользовался популярностью, так как не был найден в чистом виде.
Долгие годы выделить чистый алюминий пытались английские, датские и немецкие учёные. В 1855 году в Париже на Всемирной выставке металл алюминий произвёл фурор. Из него делали только предметы роскоши и ювелирные украшения, так как металл был достаточно дорогим. В конце 19 века появился более современный и дешёвый метод получения алюминия. В 1911 году в Дюрене выпустили первую партию дюралюминия, названного в честь города. В 1919 из этого материала был создан первый самолёт.
Физические свойства
Металл алюминий характеризуется высокой электропроводностью, теплопроводностью, стойкостью к коррозии и морозу, пластичностью. Он хорошо поддаётся штамповке, ковке, волочению, прокатке. Алюминий хорошо сваривается различными видами сварки. Важным свойством является малая плотность около 2,7 г/см³. Температура плавления составляет около 660°С.
Механические, физико-химические и технологические свойства алюминия зависят от наличия и количества примесей, которые ухудшают свойства чистого металла. Основные естественные примеси – это кремний, железо, цинк, титан и медь.
По степени очистки различают алюминий высокой и технической чистоты. Практическое различие заключается в отличии коррозионной устойчивости к некоторым средам. Чем чище металл, тем он дороже. Технический алюминий используется для изготовления сплавов, проката и кабельно-проводниковой продукции. Металл высокой чистоты применяют в специальных целях.
По показателю электропроводности алюминий уступает только золоту, серебру и меди. А сочетание малой плотности и высокой электропроводности позволяет конкурировать в сфере кабельно-проводниковой продукции с медью. Длительный отжиг улучшает электропроводность, а нагартовка ухудшает.
Теплопроводность алюминия повышается с увеличением чистоты металла. Примеси марганца, магния и меди снижают это свойство. По показателю теплопроводности алюминий проигрывает только меди и серебру. Благодаря этому свойству металл применяется в теплообменниках и радиаторах охлаждения.
Алюминий обладает высокой удельной теплоёмкостью и теплотой плавления. Эти показатели значительно больше, чем у большинства металлов. Чем выше степень чистоты алюминия, тем больше он способен отражать свет от поверхности. Металл хорошо полируется и анодируется.
Алюминий имеет большое сродство к кислороду и покрывается на воздухе тонкой прочной плёнкой оксида алюминия. Эта плёнка защищает металл от последующего окисления и обеспечивает его хорошие антикоррозионные свойства. Алюминий обладает стойкостью к атмосферной коррозии, морской и пресной воде, практически не вступает во взаимодействия с органическими кислотами, концентрированной или разбавленной азотной кислотой.
Химические свойства
Алюминий - это достаточно активный амфотерный металл. При обычных условиях прочная оксидная плёнка определяет его стойкость. Если разрушить оксидную плёнку, алюминий выступает как активный металл-восстановитель. В мелкораздробленном состоянии и при высокой температуре металл взаимодействует с кислородом. При нагревании происходят реакции с серой, фосфором, азотом, углеродом, йодом. При обычных условиях металл взаимодействует с хлором и бромом. С водородом реакции не происходит. С металлами алюминий образует сплавы, содержащие интерметаллические соединения – алюминиды.
При условии очищения от оксидной пленки, происходит энергичное взаимодействие с водой. Легко протекают реакции с разбавленными кислотами. Реакции с концентрированной азотной и серной кислотой происходят при нагревании. Алюминий легко реагирует со щелочами. Практическое применение в металлургии нашло свойство восстанавливать металлы из оксидов и солей – реакции алюминотермии.
Получение
Алюминий находится на первом месте среди металлов и на третьем среди всех элементов по распространённости в земной коре. Приблизительно 8% массы земной коры составляет именно этот металл. Алюминий содержится в тканях животных и растений в качестве микроэлемента. В природе он встречается в связанном виде в форме горных пород, минералов. Каменная оболочка земли, находящаяся в основе континентов, формируется именно алюмосиликатами и силикатами.
Алюмосиликаты – это минералы, образовавшиеся в результате вулканических процессов в соответствующих условиях высоких температур. При разрушении алюмосиликатов первичного происхождения (полевые шпаты) сформировались разнообразные вторичные породы с более высоким содержанием алюминия (алуниты, каолины, бокситы, нефелины). В состав вторичных пород алюминий входит в виде гидроокисей или гидросиликатов. Однако не каждая алюминийсодержащая порода может быть сырьём для глинозёма – продукта, из которого при помощи метода электролиза получают алюминий.
Наиболее часто алюминий получают из бокситов. Залежи этого минерала распространены в странах тропического и субтропического пояса. В России также применяются нефелиновые руды, месторождения которых располагаются в Кемеровской области и на Кольском полуострове. При добыче алюминия из нефелинов попутно также получают поташ, кальцинированную соду, цемент и удобрения.
В бокситах содержится 40-60% глинозёма. Также в составе имеются оксид железа, диоксид титана, кремнезём. Для выделения чистого глинозёма используют процесс Байера. В автоклаве руду нагревают с едким натром, охлаждают, отделяют от жидкости «красный шлам» (твёрдый осадок). После осаждают гидроокись алюминия из полученного раствора и прокаливают её для получения чистого глинозёма. Глинозём должен соответствовать высоким стандартам по чистоте и размеру частиц.
Из добытой и обогащённой руды извлекают глинозём (оксид алюминия). Затем методом электролиза глинозём превращают в алюминий. Заключительным этапом является восстановление процессом Холла-Эру. Процесс заключается в следующем: при электролизе раствора глинозёма в расплавленном криолите происходит выделение алюминия. Катодом служит дно электролизной ванны, а анодом – угольные бруски, находящиеся в криолите. Расплавленный алюминий осаждается под раствором криолита с 3-5% глинозёма. Температура процесса поднимается до 950°С, что намного превышает температуру плавления самого алюминия (660°С). Глубокую очистку алюминия проводят зонной плавкой или дистилляцией его через субфторид.
Применение
Алюминий применяется в металлургии в качестве основы для сплавов (дуралюмин, силумин) и легирующего элемента (сплавы на основе меди, железа, магния, никеля). Сплавы алюминия используются в быту, в архитектуре и строительстве, в судостроении и автомобилестроении, а также в космической и авиационной технике. Алюминий применяется при производстве взрывчатых веществ. Анодированный алюминий (покрытый окрашенными плёнками из оксида алюминия) применяют для изготовления бижутерии. Также металл используется в электротехнике.
Рассмотрим, как используют различные изделия из алюминия.
Алюминиевая лента представляет собой тонкую алюминиевую полосу толщиной 0,3-2 мм, шириной 50-1250 мм, которая поставляется в рулонах. Используется лента в пищевой, лёгкой, холодильной промышленности для изготовления охлаждающих элементов и радиаторов.
Круглая алюминиевая проволока применяется для изготовления кабелей и проводов для электротехнических целей, а прямоугольная для обмоточных проводов.
Алюминиевые трубы отличаются долговечностью и стойкостью в условиях сельских и городских промышленных районов. Применяются они в отделочных работах, дорожном строительстве, конструкции автомобилей, самолётов и судов, производстве радиаторов, трубопроводов и бензобаков, монтаже систем отопления, магистральных трубопроводов, газопроводов, водопроводов.
Алюминиевые втулки характеризуются простотой в обработке, монтаже и эксплуатации. Используются они для концевого соединения металлических тросов.
Алюминиевый круг - это сплошной профиль круглого сечения. Используется это изделие для изготовления различных конструкций.
Алюминиевый пруток применяется для изготовления гаек, болтов, валов, крепежных элементов и шпинделей.
Около 3 мг алюминия каждый день поступает в организм человека с продуктами питания. Больше всего металла в овсянке, горохе, пшенице, рисе. Учёными установлено, что он способствует процессам регенерации, стимулирует развитие и рост тканей, оказывает влияние на активность пищеварительных желёз и ферментов.
При использовании алюминиевой посуды в быту необходимо помнить, что хранить и нагревать в ней можно исключительно нейтральные жидкости. Если же в такой посуде готовить, к примеру, кислые щи, то алюминий поступит в еду, и она будет иметь неприятный «металлический» привкус.
Алюминий входит в состав лекарственных препаратов, используемых при заболеваниях почек и желудочно-кишечного тракта.
Читайте также:
